É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Um dispositivo para executar a migração celular / cicatrização de feridas em uma placa de 96 poços
Neste Artigo
Resumo
Aqui, nós apresentamos um protocolo para realizar um ensaio de migração de células semi-elevado rendimento sobre uma placa de cultura celular de 96 poços. Este protocolo é um método rápido, simples e econômica para criar feridas scratch consistentes sobre a monocamada de células.
Resumo
A migração de células / ferindo ensaio é um método vulgarmente utilizado para estudar a migração celular e outros processos biológicos, tais como angiogénese e metástase do tumor. Neste ensaio, as células são cultivadas para formar uma monocamada confluente e um ferimento mecânico é criado por raspagem com um dispositivo. Em seguida, a taxa de migração das células em relação à área desnudada pode ser monitorizada por meio de imagens. O nosso wounder mecânica de 8 canais foi concebida para resolver a maior parte dos problemas associados com o ensaio de migração celular. Em primeiro lugar, o nosso wounder pode ser facilmente esterilizados por autoclave ou com desinfectantes comuns. Em segundo lugar, os pinos individuais ajustáveis permitem mesmo contacte com a placa de cultura celular de modo a que as feridas afiadas e reprodutíveis pode ser criado. Em terceiro lugar, as barras de orientadores em ambos os lados da posição de ferimento wounder assegurar consistente em cada poço. O uso de descartáveis de plástico dicas de pipeta para ferindo pode fornecer mais melhor manuseio do wounder, bem como para minimizar cross-de contaminantesíon. Em conclusão, a wounder célula pode proporcionar aos investigadores um dispositivo reprodutível e amigável do utilizador para realizar o ensaio de migração de células usando a placa de cultura de 96-poços padrão.
Introdução
A migração celular desempenha um papel importante nos processos celulares, tais como a embriogénese, neurogénese, a angiogénese, a cura de feridas, a reparação da mucosa,-epiteliais mesenquimais-transições em desenvolvimento normal e uma situação de doença. É um processo complicado que envolve a coordenação de numerosos eventos inter e intra-celulares, incluindo as interacções molécula de sinalização, célula de polarização, a reorganização do citoesqueleto, remodelação da matriz, protrusão membrana e célula-célula dinâmica de modulação da adesão 2. Ao estudar a migração celular, pode ser determinada a descoberta e validação de produtos químicos ou biomoléculas que conduzem a movimentação das células e dos seus percursos bioquímicos relacionados. Este processo fundamental pode ser usado beneficamente como um proxy para diversas aplicações, tais como o tratamento de doença e drogas segmentação.
O ensaio ferindo é um dos ensaios de migração de células 3. Aqui, umamostra individual de células irá ser parcialmente removido por meios mecânicos para produzir uma área desnudada onde as células vão migrar para cobrir a área. A percentagem de recuperação em um ponto de tempo em particular irá ser monitorizada. Ao manusear grande número de amostras, questões como o custo experimental e contaminação cruzada dentro de amostras pode ser problemático. Apesar de muitas ferramentas comerciais e ensaios estão disponíveis para estudar a migração de células 4, 5, 6, muitos deles necessários equipamentos caros e sofisticados e melhorias ainda são necessários. Por estas razões, uma célula wounder mecânica de 8 canais (Figura 1) é desenvolvido.
O nosso wounder célula mecânica de 8 canais incorporou várias características únicas em resolver os problemas acima mencionados. Ele proporciona a flexibilidade para efectuar a migração de células / ferindo ensaios em formato de placa de cultura de 96 poços. A gu ajustávelbar design Iding assegura que a área de zero é colocada na posição central de cada poço. Além disso, a altura das barras de orientação pode ser ajustada de modo que o wounder é aplicável para vários tipos de placas de cultura. Finalmente, o desenho ferimento pin ajustável permite que um mesmo contato das pontas de pipeta com a superfície da placa de cultura para alcançar simultânea e reprodutível ferimento 7, 8.
Access restricted. Please log in or start a trial to view this content.
Protocolo
1. Introdução às Partes do wounder (Figura 1)
- Prepare o suporte do pino, fixando os pinos ferindo pelo distâncias iguais. Segure as pontas de pipeta e ajustar a altura da ponta, movendo os pinos ferindo ajustáveis para cima e para baixo.
- Montar o guiamento-barra ajustável em diferentes tipos de placas de cultura de 96 poços e garantir que a área da ferida está numa posição fixa.
- Fixe o pino de ferimento ajustável apertando o parafuso de hex. Fixar a barra-guia na posição apertando as tampas sextavados em ambas as extremidades.
2. Definir a largura da caixa Pin (Figura 2)
- Solte as tampas sextavados com a chave sextavada M5.
- Inserir um número adequado de ajuste anéis de ambos os lados do suporte de pino de modo a que as barras de orientação encaixar perfeitamente com a largura da placa de cultura de 96 poços.
NOTA: Corning e placas de Iwaki requer um par de anéis grandes e 1 par de anéis pequenos. Falcon e Nunc plates precisa de 1 par de anéis grandes. - Aperte o de cabeça hexagonal tampões para fixar a barra de guia.
3. Ajustar as Guias de (Figura 3)
- Encaixe os pinos ferindo com estéreis de 10 ul pontas de pipeta de plástico.
- Solte as tampas sextavados com a chave sextavada M5.
- Segurar o wounder e mergulhar os pinos ferindo em uma coluna de uma placa de cultura de 96 poços.
- Ajustar a altura das barras de orientação até que todas as pontas quase tocar no fundo dos poços.
- Aperte as tampas sextavados. Certifique-se de que o wounder agora se encaixa perfeitamente sobre a placa de cultura e que os pinos estão bem posicionados no meio dos poços.
4. A calibração dos pinos
- Segure o wounder perpendicular a uma superfície plana estéril (ou seja, uma placa de Petri) e solte todos os parafusos sextavados com a chave sextavada M3.
- Toque no wounder até que todas as dicas uniformemente toque na superfície estéril plana.
- Apertar os parafusos sextavados novamente para bloquear os pinos na posição.
- Verifique a regularidade de cada ponta tocando no wounder suavemente na superfície estéril plana.
5. Coçar celular monocamada (Figura 4)
- Semear as células endoteliais vasculares umbilicais humanas em uma placa de 96 poços de cultura de células revestidas com gelatina a 0,1%. células de cultura em meio 199 suplementado com 20% de soro inactivado por calor fetal de bovino, 1% de penicilina / estreptomicina e 0,09 g / L de heparina. Manter as células numa incubadora humidificada com dióxido de carbono a 5% a 37 ºC durante a noite antes de ser utilizada. As células devem chegar a 100% de confluência antes ferindo.
- Coloque as pontas ferir-se no mais à esquerda (ou o mais à direita) do lado de cada cavidade dentro de uma mesma coluna da placa de cultura. Deslize a wounder para o outro lado do poço; garantir que as pontas são ferindo tocar no fundo do poço.
- Repita a coçar (Passo 5.2) para todas as colunas.
- Depois de ferir, descarte tele meio em cada poço e substituir com compostos de teste de meio fresco contendo.
6. Aquisição de Dados e Análise de Imagem
- Imagem inteira, o poço com a ferida mecânica sobre a monocamada de células utilizando um microscópio de baixa potência com a câmara digital (por exemplo objectiva 10X) imediatamente após o ferimento (t = 0 h).
- Adicionar os compostos de teste, se desejado e incubar durante o período de tempo desejado. Toda a imagem bem com a área da ferida novamente após o tempo de incubação desejado (t = ÔH).
- Usando imagem software de análise tais como ImageJ ( https://imagej.nih.gov/ij/ ), medir a área ferido na imagem usando a ferramenta à mão livre.
- Calcula-se a percentagem de fecho de feridas:
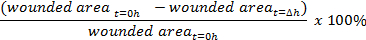
Access restricted. Please log in or start a trial to view this content.
Resultados
Este wounder mecânica 8-canal é construído para arranhar uma monocamada de células, a fim de realizar o ensaio de migração celular. É um dispositivo fácil de usar que pode realizar ensaios coçando de células em placas de 96 poços em menos de um minuto, sem treinamento especial. Este wounder pode introduzir áreas feridas em monocamadas de células com uma largura uniforme de cerca de 600 mm e com bordas afiadas (Figuras 5 e 6). A largura das f...
Access restricted. Please log in or start a trial to view this content.
Discussão
Nossa wounder célula tem várias características únicas em resolver os problemas dos ensaios de migração celular tradicionais. A célula wounder mecânica 8-canal é feita de aço inoxidável de alto grau (Aço 304) com uma longa vida útil que pode ser esterilizado em autoclave. Quase todas as marcas comerciais de placas de 96 poços de cultura disponíveis no mercado podem ser usadas com esta wounder célula mecânica por causa da barra de orientação ajustável. O desenho da barra de orientação ajustável tam...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Os autores declaram que não têm interesses financeiros concorrentes.
Agradecimentos
Os autores gostariam de agradecer ao Sr. Tam Po Leung, o Sr. Wong Chi Kin e do pessoal técnico da Faculdade Science Workshop, Hong Kong Baptist University, por suas habilidades técnicas e conselhos para tornar o protótipo desta wounder.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 96-well cell culture plate | Nunc | 167008 | Other brands of 96-well cell culture plate can also be used |
| P10 pipette tips | Axygen | 301-03-051 | Short P10 pipette tip is more easy to create a clear wound |
| Wounder | R&P Technology Limited | ||
| Medium 199 | Sigma | M2520-1L | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Fetal bovine serum | Gibco | 26140079 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Penicillin/Streptomycin | Gibco | 15140122 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Heparin sodium salt from porcine intestinal mucosa | Sigma | H3393 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
| Gelatin from bovine skin | Sigma | G9391 | For cell culture of human umbilical vein endothelial cells. Use appropirate culture medium and condition for other type of cells. |
Referências
- Friedl, P., Wolf, K. Tumour-cell invasion and migration: diversity and escape mechanisms. Nat Rev Cancer. 3 (5), 362-374 (2003).
- Friedl, P. Prespecification and plasticity: shifting mechanisms of cell migration. Curr Opin Cell Biol. 16 (1), 14-23 (2004).
- Lampugnani, M. G. Cell migration into a wounded area in vitro. Methods Mol Biol. 96, 177-182 (1999).
- Sholley, M. M., Gimbrone, M. A. Jr, Cotran, R. S. Cellular migration and replication in endothelial regeneration: a study using irradiated endothelial cultures. Lab Invest. 36 (1), 18-25 (1977).
- Gotlieb, A. I., Spector, W. Migration into an in vitro experimental wound: a comparison of porcine aortic endothelial and smooth muscle cells and the effect of culture irradiation. Am J Pathol. 103 (2), 271-282 (1981).
- Chen, Y. C., et al. Single-cell migration chip for chemotaxis-based microfluidic selection of heterogeneous cell populations. Sci Rep. 18 (5), 9980(2015).
- Yarrow, J. C., Periman, Z. E., Westwood, N. J., Mitchison, T. J. A high-throughput cell migration assay using scratch wound healing, a comparsion of image-based readout methods. BMC Biotechnol. 4, 21(2004).
- Lauder, H., Frost, E. E., Hiley, C. R., Fan, T. P. Quantification of the repair process involved in the repair of a cell monolayer using an in vitro model of mechanical injury. Angiogenesis. 2 (1), 67-80 (1998).
- Yue, P. Y. K., Leung, E. P. Y., Mak, N. K., Wong, R. N. S. A simplified method for quantifying cell migration/ wound healing in 96-well plates. J. Biomol Screen. 15 (4), 427-433 (2010).
- Yue, P. Y., et al. Elucidation of the mechanisms underlying the angiogenic effects of ginsenoside Rg(1) in vivo and in vitro. Angiogenesis. 8 (3), 205-216 (2005).
- Kwok, H. H., Chan, L. S., Poon, P. Y., Yue, P. Y., Wong, R. N. Ginsenoside-Rg1 induces angiogenesis by the inverse regulation of MET tyrosine kinase receptor expression through miR-23a. Toxicol Appl Pharmacol. 287 (3), 276-283 (2015).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados