Method Article
Discrimination et caractérisation des populations hétéro-cellulaires à l'aide de techniques d'imagerie quantitative
Dans cet article
Résumé
Nous avons développé un nouveau protocole pour étudier la dynamique de la population hétéro-cellulaire en réponse à des perturbations. Ce manuscrit décrit une plate-forme basée sur l'imagerie qui produit des jeux de données quantitatifs pour la caractérisation simultanée de multiples phénotypes cellulaires de populations hétéro-cellulaires de manière robuste.
Résumé
Les processus cellulaires sont complexes et résultent de l'interaction entre plusieurs types de cellules et leur environnement. Les techniques existantes de biologie cellulaire ne permettent souvent pas une interprétation précise de cette interaction. En utilisant une approche quantitative basée sur l'imagerie, nous présentons un protocole de contenu élevé pour caractériser les réponses phénotypiques dynamiques ( c'est-à-dire les changements de morphologie, la prolifération, l'apoptose) des populations de cellules hétérogènes aux changements dans les stimuli environnementaux. Nous mettons en évidence notre capacité à distinguer les types de cellules en fonction de l'intensité de fluorescence ou des caractéristiques morphologiques inhérentes selon l'application. Cette plate-forme permet une caractérisation plus complète de la réponse de la sous-population à la perturbation tout en utilisant un temps plus court, de plus petites quantités de réactifs et une plus faible probabilité d'erreur que les tests traditionnels de biologie cellulaire. Cependant, dans certains cas, les populations de cellules peuvent être difficiles à identifier et à quantifier en fonction de cellules complexesEt nécessite un dépannage supplémentaire; Nous mettons en évidence certaines de ces circonstances dans le protocole. Nous démontrons cette application en utilisant une réponse au médicament dans un modèle de cancer; Cependant, il peut être facilement appliqué plus largement à d'autres processus physiologiques. Ce protocole permet d'identifier les sous-populations dans un système de co-culture et de caractériser la réponse particulière de chacun aux stimuli externes.
Introduction
Les tests basés sur les cellules ont été un travail de travail dans la recherche fondamentale et les paramètres de développement de médicaments. Cependant, les limites de ces tests standard sont de plus en plus apparentes avec la discordance entre les données in vitro et cliniques et l'échec de la plupart des médicaments à recevoir l'approbation de la FDA. Ici, nous présentons une nouvelle méthode pour utiliser l'imagerie quantitative pour analyser simultanément les phénotypes hétocellulaires en réponse à des stimuli environnementaux pertinents et coexistant.
Les tests traditionnels basés sur les cellules qui sont utilisés pour mesurer la viabilité cellulaire comprennent: les analyses d'exclusion de trypan bleu, les MTT / MTS et la coloration par cytométrie de flux V-FITC d'annexine. Les essais d'exclusion de Trypan Blue, bien que simples et peu coûteux, nécessitent un grand nombre de cellules, prennent beaucoup de temps et sont souvent influencés par le biais de l'utilisateur 1 . Les analyses MTT et MTS mesurent indirectement la viabilité cellulaire grâce à des mesures du taux métabolique mitochondrial. Cependant, l'activité métaboliqueLes cellules peuvent être affectées par différentes conditions de culture (telles que les médias ou la concentration en oxygène), ce qui conduit à des résultats inexacts et empêche la standardisation à travers les types de cellules et les conditions 2 , 3 . Un autre inconvénient majeur de ces techniques est leur incapacité à distinguer les multiples types de cellules - la plupart des systèmes biologiques sont hétéro-cellulaires. Bien que les méthodes de cytométrie en flux aient la possibilité de distinguer entre les populations de cellules multiples, les étiquettes des cellules sont requises, l'échantillonnage dynamique est difficile et, lors de l'utilisation de cellules adhérentes, cette application devient de plus en plus longue et présente des erreurs.
D'autres phénotypes cellulaires importants, y compris les changements morphologiques, se produisent en réponse à des stimuli environnementaux mais ne sont pas pris en compte par des essais traditionnels basés sur des cellules. Le profil des états cellulaires grâce à la caractérisation morphologique et à la cartographie des similitudes entre les échantillons est un outil puissant et impartial avec le aAfin de fournir de nouvelles connaissances sur de nombreux aspects de la recherche fondamentale et translationnelle, y compris la biologie cellulaire de base et la découverte de médicaments 4 . En outre, la morphologie des cellules tumorales s'est avérée être en corrélation avec les sous-types de tumeur 5 et l'agressivité 6 . Par conséquent, il est très intéressant d'étudier ces caractéristiques cellulaires et leur lien avec des perturbations environnementales spécifiques. En outre, on peut utiliser des différences dans les caractéristiques morphologiques pour discriminer les sous-populations dans les systèmes de co-culture. L'étiquetage fluorescent des cellules a des chutes ( c'est-à-dire une modification des propriétés cellulaires inhérentes, prend beaucoup de temps) et, par conséquent, des méthodes supplémentaires pour classer les types de cellules sont avantageuses.
L'imagerie à base de microscopie est une méthode alternative pour le profilage des phénotypes cellulaires de manière multiplexée, quantitative et robuste. Dans ce manuscrit, nous appliquons notre pipeline d'imagerie quantitative pour mettre en évidence l'évolutionUne dynamique de populations de cellules hétérogènes dans une tumeur. Nous nous concentrons sur l'interaction entre les cellules de cancer du poumon non à cellules petites (CPNPC) et les fibroblastes associés au cancer (CAF), le type de cellules stromales les plus répandues dans les tumeurs. Les CAF ont été impliqués dans l'initiation, la progression et la réponse thérapeutique de la tumeur; Par conséquent, effectuer des tests phénotypiques sur les cellules tumorales en l'absence de CAF peut tromper 7 , 8 , 9 . Plus précisément, nous avons évalué les effets des CAF sur les cellules tumorales en réponse à l'erlotinib, une petite molécule ciblant le récepteur du facteur de croissance épidermique (EGFR) qui est souvent utilisé dans le traitement clinique du CPNPC. Nous avons utilisé une plate-forme de dépistage de contenu élevé et son logiciel d'analyse d'image qui l'accompagne pour l'évaluation; Cependant, dans le but de rendre cette méthodologie accessible à d'autres chercheurs, nous avons également développé un protocole en aval comparable à l'aide du logiciel open source:CellProfiler 10 et CellProfiler Analyst 11 . La plupart des tests de dépistage à haute teneur en image sont analysés avec un logiciel commercialisé spécifique à un modèle d'instrument donné. Les résultats sont difficiles à reproduire dans d'autres laboratoires avec des logiciels différents car les algorithmes sous-jacents sont souvent exclusifs. À l'aide de ce pipeline basé sur l'image, on a mesuré la prolifération cellulaire, la mort et la morphologie de chaque sous-population d'une culture hétéro-cellulaire en réponse au traitement médicamenteux à l'aide de la classification à base de fluorescence et de morphologie. Le protocole suivant fournit une méthodologie robuste pour sondage de processus cellulaires complexes.
Protocole
1. Culture cellulaire
NOTE: Ici, les réponses phénotypiques des cellules NSCLC (H3255) à l'agent de ciblage EGFR, l'erlotinib, lors de la co-culture avec des fibroblastes pulmonaires (CCD-19Lu GFP) ont été étudiés. Pour le même ensemble de données, on a effectué une classification basée sur la fluorescence et la morphologie des deux populations de cellules (H3255 et CCD-19Lu GFP) pour illustrer leur concordance. Cependant, une seule méthode de classification doit être utilisée et devrait être choisie en fonction de l'application.
- Préparez 500 ml de RPMI-1640 complété par 10% de FBS inactivé par la chaleur et 1% de pénicilline / streptomycine.
REMARQUE: Le milieu de croissance et les suppléments peuvent être remplacés comme requis pour d'autres types de cellules. - Cellules de culture dans des plaques de 10 cm 3 en tant que populations pures dans 5% de CO 2 à 37 ° C et passage au rapport approprié tous les 3-4 jours.
2. Préparation des cellules
- Pour préparer une suspension cellulaire, enlever cEll Media et les cellules de lavage avec 5 ml de solution saline tamponnée au phosphate 1X (PBS).
- Aspirer le PBS, ajouter 1 mL de trypsine à 0,05% réchauffé à 37 ° C et incuber pendant 5 minutes (ou jusqu'à ce que les cellules ne soient plus collées à la plaque) à 37 ° C.
- Pour neutraliser la trypsine, ajouter 4 mL de RPMI aux plaques H3255 et CCD-19Lu GFP et pipeter les solutions cellulaires dans des tubes coniques de 15 mL.
- Centrifuger les cellules à 150 xg pendant 5 min à la température ambiante.
- Aspirer le surnageant et ressusciver les pastilles cellulaires dans 10 mL de milieu RPMI dans des tubes coniques pour préparer l'ensemencement.
3. Plaquage cellulaire
- Comptez les cellules pour normaliser l'ensemencement.
- Inverser les tubes pour mélanger les cellules en solution. Pipettez 10 μL de chaque suspension cellulaire dans un tube de microcentrifugeuse et ajoutez 10 μL de bleu trypan.
- Pipettez 10 μL de cette solution dans une glissière de comptage de cellules et insérez-la dans un compteur de cellules automatisé.
REMARQUE: D'autres méthodes de comptage cellulaire ( c.-à-d.. Hémocytomètre) peuvent être utilisés. - Répétez le nombre de cellules au moins trois fois, ou jusqu'à ce que les chiffres obtenus soient cohérents.
- Cellules à graines sur une plaque multi-puits
REMARQUE: Le nombre de plaques à semer dépend du nombre de points temporels qui seront imagés. Alternativement, une plaque peut être ré-imagée au fil du temps si les cellules sont transduites avec de l'histone-2B-GFP (ou d'autres taches nucléaires lentivirales stables qui fournissent une segmentation nucléaire adéquate).- Semer un total de 1 500 cellules / puits dans 100 μL de RPMI. Préparez trois suspensions de cellules pour la plaque de trois populations de cellules: H3255, CCD-19Lu GFP et 50% de H3255 + 50% de CCD-19Lu GFP. Effectuez chacun en trois exemplaires avec des configurations de plaques identiques pour chaque point de temps.
REMARQUE: Les densités initiales d'ensemencement devraient être optimisées pour chaque ligne cellulaire et la taille de la plaque. - Cellules de graines dans des plaques de 3 x 96 puits à l'aide d'une pipette multicanaux. Incuber les cellules O / N à 37 ° C, 5% de CO 2 .
- Semer un total de 1 500 cellules / puits dans 100 μL de RPMI. Préparez trois suspensions de cellules pour la plaque de trois populations de cellules: H3255, CCD-19Lu GFP et 50% de H3255 + 50% de CCD-19Lu GFP. Effectuez chacun en trois exemplaires avec des configurations de plaques identiques pour chaque point de temps.
4. Dosage du médicament
- Ajouter DMSO à la poudre d'erlotinib pour obtenir une solution mère d'erlotinib finale de 10 mM de concentration.
NOTE: Le médicament peut être remplacé comme vous le souhaitez. - Diluer le médicament avec un milieu de culture cellulaire à 2 fois la concentration finale avec la concentration finale la plus élevée à 10 μM et diluer en série quatre fois à un ratio 1:10, pour un total de cinq concentrations de médicament et un contrôle médicamenteux.
REMARQUE: si la concentration de DMSO est égale ou supérieure à 0,1% v / v à la plus haute dose de médicament, le contrôle antidrogue devrait contenir une quantité équivalente de DMSO pour s'assurer que les effets observés observés ne sont pas dus à la toxicité du DMSO. - Pipetter 100 μL de solution de médicament dans le puits approprié pour une concentration finale de médicament de 1x diluée dans un milieu.
5. Acquisition d'image
NOTE: Les images ont été acquises aux jours 0, 2 et 3. Selon les types de cellules et les processus cellulaires étudiés, oLes points de temps désirés peuvent être étudiés.
- Tacher les cellules pour se préparer à l'imagerie.
- Compléter la solution de colorant aux concentrations finales suivantes.
- Pour la classification à base de fluorescence, préparer une tache nucléaire de 5 μg / mL et une tache de cellules mortes de 5 μM dans PBS (voir le tableau des matériaux ).
- Pour la classification basée sur la morphologie, préparer une tache nucléaire de 5 μg / mL, une tache de cellules mortes 5 μM et une tache cellulaire 5 μM dans PBS (voir le tableau des matériaux ).
- Ajouter 20 μL de solution de colorant à chaque puits. Incuber pendant 30 min à 37 ° C protégé de la lumière.
- Compléter la solution de colorant aux concentrations finales suivantes.
- Optimiser et acquérir des images.
- Retirez la plaque de puits de l'incubateur, essuyez le fond de la plaque avec 70% d'EtOH et placez la plaque dans la chambre d'imagerie.
- Dans l'onglet "Configuration", cliquez sur le bouton '+' sous 'Sélection du canal' pour ajouter les canaux appropriés àImage (couleur lumineuse, tache nucléaire, tache de cellules mortes, GFP et RFP).
- Cliquez sur «Sélection de la mise en page» et prenez des images de test empilées z toutes les 2 μm à partir de 0 μm et se terminant par 20 μm pour identifier le plan de mise au point. Entrez cette distance pour chaque canal sous 'Hauteur'.
- Cliquez sur 'Instantané' sous chaque canal pour évaluer les intensités et optimiser les temps d'exposition. Entrez les valeurs supérieures ou inférieures sous «Temps» au besoin.
- Sur le côté droit de l'écran, mettez en évidence les puits appropriés (à imaginer) sur le schéma de la plaque. Dans le schéma des puits ci-dessous, mettez en évidence les vingt-cinq champs à imaginer d'une manière similaire.
- Sous 'Run Experiment', identifiez la plaque dans 'Plate Name' sur l'onglet gauche, et cliquez sur le bouton 'Start' (en dessous) pour exécuter le protocole d'acquisition d'image avec un objectif 10X pour générer des images TIFF à échelle de gris dans les canaux précités.
REMARQUE: étape par étapeLes ructions pour le protocole d'imagerie peuvent différer d'un instrument, mais les valeurs des paramètres doivent encore être optimisées. - Répétez l'image aux jours deux et trois.
6. Analyse d'image
REMARQUE: toute analyse d'image a été effectuée à l'aide d'un logiciel propriétaire. Cependant, étant donné que ce n'est pas une publication publique, des analyses comparables ont également été conçues sur CellProfiler 2.2 et CellProfiler Analyst 2.0, avec un bref protocole répertorié ci-dessous et un protocole détaillé fourni comme matériel supplémentaire (les images de test sont déjà chargées dans les pipelines pour tester le flux de travail). Les images de cette expérience ont été regroupées en fonction de chaque puits afin que chaque puits puisse être chargé individuellement. Les pipelines CellProfiler ci-dessous contiennent une expression régulière qui analyse les informations de métadonnées de chaque nom de fichier d'image et permet de regrouper les images par canal.
- Téléchargez et installez le logiciel open source: 'CellProfiler9; Et 'CellProfiler Analyst'. Acceptez toutes les options par défaut et les modules complémentaires pendant l'installation.
- Classer les cultures hétérocycliques en sous-populations.
- Ouvrez le logiciel 'CellProfiler', cliquez sur 'Fichier' | 'Importation de pipeline' | 'From File', et sélectionnez le fichier approprié ("Fluorescence_Classification.cppipe" pour la classification basée sur la fluorescence , ou "Morphology_Classification.cppipe" pour la classification fondée sur la morphologie).
REMARQUE: ces fichiers contiennent des protocoles pour le traitement d'image de base et la segmentation des noyaux / cellules. En raison de la tache Hoechst inégale présente à travers ces cellules, les noyaux ont été segmentés et agrandis, puis utilisés pour masquer l'image pour permettre la segmentation des noyaux avec des intensités plus faibles.- Sélectionnez la pipeline de classification à base de fluorescence pour classer les cellules comme H3255 ou CCD-19Lu en fonction de l'intensité eGFP et pour calculer les caractéristiques morphologiques.
REMARQUE: CCDLes cellules -19Lu ont été transduites avec GFP. - Sélectionnez la pipeline de classification basée sur la morphologie pour segmenter les noyaux et les cellules, et pour calculer les caractéristiques morphologiques.
REMARQUE: Une analyse ultérieure en aval dans 'CellProfiler Analyst' est nécessaire pour la classification. Les cellules mortes sont classées selon une classification à base de fluorescence.
- Sélectionnez la pipeline de classification à base de fluorescence pour classer les cellules comme H3255 ou CCD-19Lu en fonction de l'intensité eGFP et pour calculer les caractéristiques morphologiques.
- Cliquez sur 'Afficher les paramètres de sortie' en bas à gauche de l'écran. Sélectionnez l'emplacement des fichiers d'image pour l'analyse ('Dossier d'entrée par défaut') et la destination pour les données extraites ('Dossier de sortie par défaut').
- Cliquez sur 'Analyser les images' pour commencer l'analyse. Une fois l'analyse terminée, cliquez sur «OK» et accédez au «dossier de sortie par défaut» pour afficher les données calculées.
REMARQUE: Des exemples de valeurs de paramètres et d'images sont disponibles dans Supplemental File 1-CellProfilerProtocol.pdf . - Pour la classification basée sur la morphologie (uniquement), procédez comme suit.
- Ouvrez le logiciel 'CellProfiler Analyst', sélectionnez le fichier de propriétés de la base de données généré dans CellProfiler et cliquez sur 'Ouvrir'.
- Cliquez sur l'onglet «Classificateur» en haut à gauche de l'écran. Pour appeler des images de cellules aléatoires de l'expérience, cliquez sur "Rechercher"; Les images apparaîtront dans la fenêtre non classifiée.
- Classer manuellement les cellules comme positives (H3255) ou négatives (CCD-19Lu) en sélectionnant et en faisant glisser des cellules vers un bac approprié (voir Fichier supplémentaire 2-Pipeline.pdf : figure B ). Après avoir classé au moins 50 cellules par sous-population, cliquez sur 'Train Classifier', puis cliquez sur 'Vérifier le progrès'.
NOTE: Les cellules sont classées par l'intermédiaire d'un algorithme d'apprentissage de la machine forestière aléatoire supervisé par l'utilisateur 12 . Si la précision n'est pas supérieure au seuil approuvé (> 90%), il peut être nécessaire de reculer et d'optimiser la segmentation cellulaire sur 'CellProfiler', ou les cellules peuvent ne pas être idéales pour les classiPar morphologie. - Cliquez sur 'Score All' pour générer une table avec un nombre de cellules pour chaque sous-population.
- Ouvrez le logiciel 'CellProfiler', cliquez sur 'Fichier' | 'Importation de pipeline' | 'From File', et sélectionnez le fichier approprié ("Fluorescence_Classification.cppipe" pour la classification basée sur la fluorescence , ou "Morphology_Classification.cppipe" pour la classification fondée sur la morphologie).
Résultats
Nous avons généré un ensemble d'images composé de 25 champs / puits, 54 puits / plaque (3 populations de cellules x 6 concentrations de médicament x 3 répétitions), sur trois plaques pour un total de 4,050 images individuelles. Les ensembles d'images générés au cours de l'expérience ont été analysés à l'aide d'un logiciel propriétaire (voir tableau de matériaux) pour extraire diverses propriétés quantitatives des cellules (morphologie, fluorescence) qui pourraient alors être utilisées pour classer les sous-populations cellulaires. Cependant, comme le logiciel commercial utilisé a un accès limité, des pipelines en aval comparables dans CellProfiler et CellProfiler Analyst ont été créés.
Classification hétéocellulaire dans les sous-populations
Les noyaux ont été identifiés et segmentés en fonction de la tache d'ADN (Hoechst) et les populations de cellules ont été classées en fonction de la fluorescence ou du moRphologie ( figure 1 ). Pour la classification basée sur la fluorescence, les fibroblastes (CCD-19Lu) ont été précédemment transduits avec GFP-lentivirus. Les niveaux d'intensité GFP ont été mesurés pour chaque noyau et ceux qui ont été calculés au-dessus du seuil accepté (basé sur le signal de fond) ont été classés comme CCD-19Lu tandis que ceux ci-dessous ont été identifiés comme cellules tumorales (H3255). Pour la classification basée sur la morphologie, les cellules ont été précédemment colorées avec une tache cellulaire non toxique (voir le tableau des matériaux) et cela a été utilisé pour identifier et segmenter le cytoplasme. Un algorithme d'apprentissage machine a été formé avec ~ 50 à 100 cellules de chaque population. Les caractéristiques morphologiques ont été identifiées de manière significativement différente entre les populations, qui ont ensuite été utilisées pour concevoir un classificateur linéaire pour distinguer les cellules CCD-19Lu et H3255. Les protocoles de classification de la fluorescence et de la morphologie étaient de 97,4% (n = 1403) concordants pour distinguer les deux populations de cellulesDans des conditions non traitées et 92,5% (n = 916) concordant dans les conditions traitées par le médicament (erlotinib 1 uM) ( figure 2 ).
Analyses phénotypiques des sous-populations
En plus de discriminer les types de cellules, nous avons cherché à caractériser les propriétés phénotypiques de chaque sous-population. Les tests de multiplexage permettent d'économiser du temps et des réactifs, ajoutent de la cohérence et fournissent des informations supplémentaires concernant le système étudié. Il existe de nombreuses sorties phénotypiques potentielles et on devrait les choisir en fonction des questions d'intérêt. Ici, des changements dans la morphologie cellulaire et le statut de viabilité en réponse au traitement par erlotinib ont été étudiés. Après trois jours de traitement médicamenteux, une diminution de la zone nucléaire et une augmentation de la surface cellulaire des cellules H3255 ( figure 3A ) ont été observées. La différence significative dans la zone nucléaire entreLes populations traitées «sans médicament» et «médicament» ont été jugées statistiquement significatives par une t- test à double face de type 2 (variance égale) ( p = 7,92 x 10 -16 ). Nous faisons l'hypothèse que cette observation est une réponse cellulaire au stress imposé par le traitement médicamenteux.
Il est également intéressant d'étudier si un médicament a un effet cytotoxique ( c.-à-d. Augmentation du nombre de cellules mortes au fil du temps) ou cytostatique ( c.-à-d. Diminution du nombre d'accouchements cellulaires au fil du temps) sur les cellules, car cela a un impact clinique profond. Par exemple, un effet de drogue cytostatique induit un arrêt de la croissance mais n'élimine pas les cellules de la tumeur, il existe donc le potentiel pour les cellules cancéreuses de réinitialiser la prolifération cellulaire une fois que le médicament est enlevé. Les effets des médicaments peuvent souvent être le contexte, la concentration et le type de cellule dépendant. Nous avons précédemment observé erlotinib provoquant une réponse cytotoxique dans un type de cellule, tout en montrant acRéponse ytostatique dans un autre 13 .
Les tests de viabilité traditionnelle produisent un nombre de cellules relatives et, par conséquent, ne font pas de discrimination entre les arrestations de la croissance et la mort cellulaire. Dans ce cas, les cellules mortes ont été identifiées en fonction de la tache d'iodure de propidium ( figure 3B ). Les effets cytotoxiques et cytostatiques de l'erlotinib sur les cellules H3255 ont été observés, avec une augmentation du nombre de décès et une diminution du nombre de naissances suite au traitement médicamenteux ( figure 3C ). Il convient de noter que le nombre de cellules mortes diminue après le jour 1, probablement en raison de la clairance cellulaire. Les cellules CCD-19Lu n'ont pas été affectées par le médicament. Un avantage supplémentaire de cette plate-forme est la génération de données quantitatives. Par exemple, dans notre expérience de co-culture, une première sous-population de 1 118 (75,8%) des cellules H3255 était de 2,817 (87,9%) ou 396 (57,2%) après trois jours sans ou avec erlotineTraitement ib, respectivement ( figure 4 ). Parce que nous pouvons générer des chiffres réels de cellules au lieu du pourcentage relatif (comme pour les méthodes de cytométrie de flux), nous concluons que le changement de composition au cours du traitement médicamenteux est dû à une diminution des cellules H3255 et non à une augmentation du CCD-19Lu. Il ne vaut rien que les taux de mortalité puissent être sous-estimés en raison de l'élimination des cellules, ce qui est difficile à évaluer expérimentalement et diffère probablement selon les types de cellules.
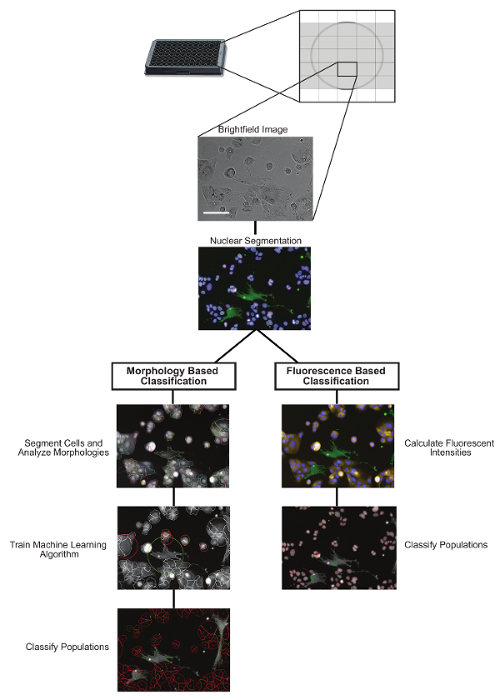
Figure 1: Vue d'ensemble du Protocole d'analyse d'image. Deux pipelines potentiels d'analyse d'image en aval pour classer les populations hétérocycliques en utilisant soit une classification basée sur la morphologie, soit une classification basée sur la fluorescence. Barres d'échelle = 100 μm. S'il vous plaît cliquez sur elleE pour voir une version plus grande de ce chiffre.

Figure 2: Concordance entre la morphologie et la classification basée sur la fluorescence. ( A ) Placage de concordance affichant le chevauchement des deux protocoles de classification. Les mêmes cellules ont été classées comme H3255 à l'aide d'une classification à base de morphologie et de fluorescence. Les deux protocoles étaient d'accord, avec une classification de 97,4% (n = 1403) des cellules non traitées et de 92,5% (n = 916) des cellules traitées avec erlotinib (Note: la zone blanche est trop petite pour être visualisée). ( B ) images 10X illustrant des exemples de bonne et mauvaise concordance entre la classification basée sur la fluorescence et la morphologie. Les flèches blanches indiquent les cellules qui ont été classées de manière incohérente entre les plates-formes. Entrée image: bleu - noyaux (Hoechst); Vert - CCD19Lu (GFP). ClassiImages de fication: Rouge - H3255; Vert - CCD-19Lu. Barre d'échelle = 100 μm. Cliquez ici pour voir une version plus grande de ce chiffre.
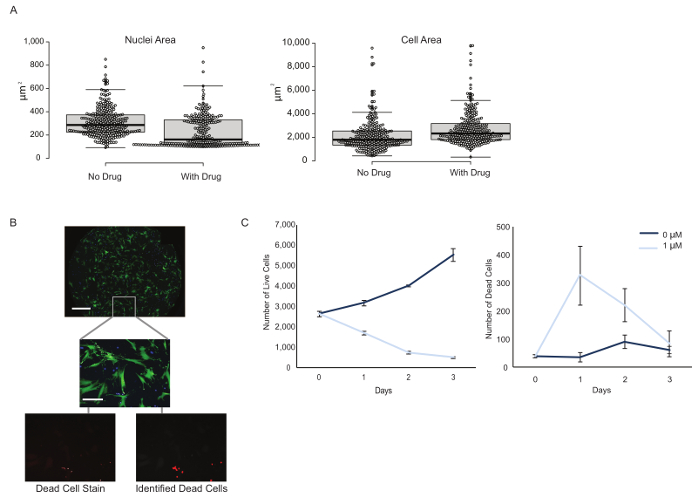
Figure 3: Mesures phénotypiques multiplexées à partir d'une configuration expérimentale unique. ( A ) Les caractéristiques morphologiques, telles que les noyaux et la surface cellulaire, ont été calculées sur le niveau cellulaire unique en présence et en l'absence de médicament. Note: Les zones cellulaires mesurant moins de 100 μm 2 ont été considérées comme des débris et exclues des analyses. L'encadré représente la médiane avec les première et troisième quartiles et 95% des barres d'erreur d'intervalle de confiance. ( B ) Les cellules H3255 (bleu) et CCD-19Lu (vert) ont été co-cultivées et les cellules mortes ont été identifiées en fonction de l'intensité du propidiumIum iodide stain (rouge) et imagé à l'aide d'un objectif 10X. Barre d'échelle = 1 mm (panneau supérieur); 100 μm (images du bas). ( C ) Le nombre total de cellules vivantes et mortes a été calculé sur trois jours avec ou sans traitement médicamenteux, avec une diminution évidente du nombre de cellules vivantes et une augmentation des cellules mortes avec addition d'erlotinib. Les barres d'erreur représentent une erreur standard de la moyenne basée sur trois répliques. Cliquez ici pour voir une version plus grande de ce chiffre.
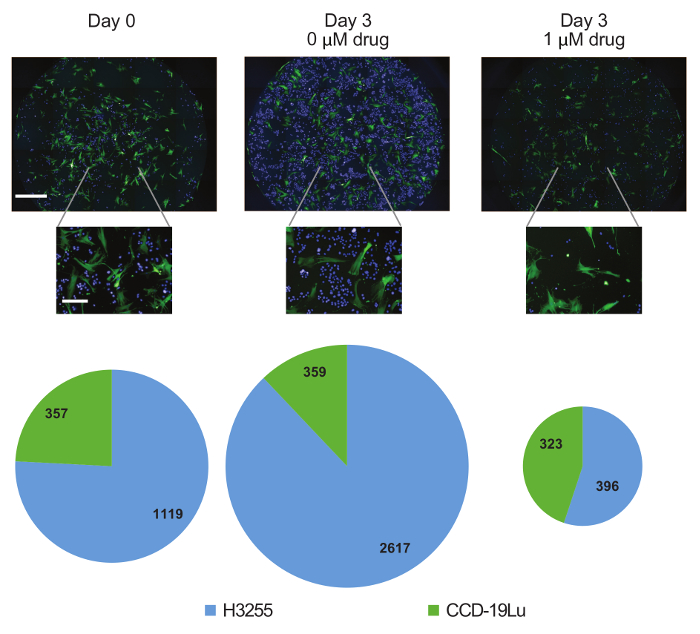
Figure 4: Dynamique de la sous-population au fil du temps. Des images 10X représentatives de puits contenant H3255 (bleu) et CCD-19Lu (vert) le jour 0 ou le jour 3 avec et sans médicament. Les cellules appartenant à chaque sous-population ont été comptées et les diagrammes circulaires proportionnels montrent le aChangement ciblant la composition de la population à travers les échantillons. Barres d'échelle = 1 mm (panneaux du milieu, coupe-corps, panneau éteint), 1 mm (image supérieure), 100 μm (images du bas). Cliquez ici pour voir une version plus grande de ce chiffre.
Discussion
The protocol described above improves upon current cell biology assays by providing more comprehensive insights into phenotypic dynamics of multiple cell types in response to environmental perturbations while using reduced reagents and time. A major advantage of this experimental design is the ability to analyze multiple phenotypes with a single setup and generate quantitative data characterizing these phenotypes on a single cell level. One technical advantage to this platform is the ease of initial troubleshooting compared to other assays. Because this method is image-based, one is able to visualize the wells for apparent over/under seeding. It is advisable to have cells in the exponential growth phase for the duration of the experiment and not be limited by nutrient or spatial constraints or confounded by senescence due to scarce seeding. Otherwise, birth and death rates may not be reproducible between experiments. For reference, CellPD is a publicly available program for computation of birth and death rates14. Additionally, one can visualize whether adequate concentrations of dyes were added to each well. Pipetting issues in an individual well could result in missegmentation and skewed data, but can easily be detected with the aforementioned protocol.
Unfortunately, not all cell types may be amenable to this application. It is important to be able to accurately segment the nuclei and cells, therefore analysis of cells that organize in more sphere-like or clumped structures may not be suitable. For some cells, it also may be advantageous to use a cell strainer prior to seeding to ensure initial seeding of single cells. In addition, the linear classifier technique is only applicable to cell types that can be readily distinguished based on morphology features.
For the success of the protocol, it is important to first optimize the imaging conditions, as the validity of downstream analyses is dependent on the quality of the images. While here we performed experiments using a high-content screening platform, image acquisition can also be performed using any fluorescent microscope (although an automated imaging platform is ideal for high-throughput approaches). Test images should be taken prior to each imaging time point to ensure that there are no problems with the microscope or protocol. The signal to noise ratio should be high, especially for the channels that will be used for segmentation (i.e. nuclei, cell stains). Additionally, it is important to image in the optimal plane of focus. If the images are out of focus, segmentation becomes much more difficult and the calculated morphological features will likely be inaccurate. Illumination differences between fields can cause problems with image segmentation as well. Large differences in brightness make the automated selection of threshold values difficult. Additionally, if there are heterogeneous fluorescence intensities between cells, a single threshold value may not sufficiently segment all the cells in an image. In this analysis, these problems were overcome by creating masks around brighter and dimmer cell populations and segmenting each population separately.
While the phenotypes under investigation in this protocol are limited to live, dead, and morphological characterization, they can easily be expanded to investigate other features. For example, functional genetic studies can be added with RNAi, overexpression, or other chemical perturbations.
In this paper, the capabilities of the protocol to measure the response of non-small cell lung cancer cells to erlotinib in the presence and absence of CAFs was demonstrated. However, this is merely one example of the many cell types and microenvironmental parameters that can be tested. We have extended this protocol to be used with other cell types and drug studies, including primary cells isolated from patient tumors13,15.
Déclarations de divulgation
Les auteurs n'ont rien à dévoiler.
Remerciements
Ce travail a été financé par les Subventions U54CA143798 et U54CA143907 de l'Institut national du cancer (NCI) pour établir des centres de sciences et d'sciences de la physique (PS-OC) au Dana-Farber Cancer Institute et University of Southern California, respectivement. SM Mumenthaler a reçu un prix PS-OC transnetwork qui a soutenu certains de ces travaux.
Nous souhaitons exprimer notre plus grand gratitude à nos partisans philanthropiques, en particulier à la famille Stephenson, Emmet, Toni et Tessa, pour leur don de la plate-forme Operetta HCS. Nous remercions également J. Foo pour l'orientation et les membres de l'équipe Centre for Applied Molecular Medicine: D. Agus pour l'orientation clinique et le mentorat, K. Patsch pour des discussions significatives avec le design expérimental, R. Rawat pour l'aide aux protocoles d'analyse d'image , J. Katz pour une assistance technique avec l'Opérette, et P. Macklin et D. Ruderman pour des discussions et des commentaires utiles.
matériels
| Name | Company | Catalog Number | Comments |
| RPMI-1640 | Corning | 10-040-CV | cell culture medium |
| Fetal Bovine Serum (FBS) | Gemini | 100-106 | medium supplement |
| Penicillin/streptomycin | Gibco | 15-140-122 | medium supplement |
| TC20 | Biorad | 1450102 | cell counter |
| TC20 slides with trypan blue | Biorad | 1450003 | cell counter slides |
| 96-well plates | Corning | 3904 | clear bottom black plates |
| Erlotinib | LC Laboratories | E-4007 | |
| DMSO | VWR | 317275-100ML | solution to resuspend drug |
| Hoechst | Invitrogen | H21491 | nuclear dye |
| Propidium Iodide (PI) | Invitrogen | P1304MP | dead cell stain |
| Cell Tracker Orange CMRA | Life Technologies | C34551 | whole cell stain |
| Operetta high content imaging system | Perkin Elmer | ||
| CellProfiler | Broad Institue | version 2.2.0 (rev 9969f42) | http://cellprofiler.org/releases/ |
| Cell culture incubator | Any cell culture incubator will be suitable - cells were cultured under 37 ºC at 5% CO2. | ||
| 15 mL Falcon conical tubes | Falcon | 14-959-53A | |
| 10 cm2 cell culture plates | TPP | 93040 |
Références
- Kanemura, Y., et al. Evaluation of in vitro proliferative activity of human fetal neural stem/progenitor cells using indirect measurements of viable cells based on cellular metabolic activity. J Neurosci Res. 69 (6), 869-879 (2002).
- Plumb, J. A., Milroy, R., Kaye, S. B. Effects of the pH dependence of 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide-formazan absorption on chemosensitivity determined by a novel tetrazolium-based assay. Cancer Res. 49 (16), 4435-4440 (1989).
- Hsu, S., et al. Green tea polyphenols induce differentiation and proliferation in epidermal keratinocytes. J Pharmacol Exp Ther. 306 (1), 29-34 (2003).
- Caicedo, J. C., Singh, S., Carpenter, A. E. Applications in image-based profiling of perturbations. Curr Opin Biotechnol. 39, 134-142 (2016).
- Sero, J. E., et al. Cell shape and the microenvironment regulate nuclear translocation of NF-kappaB in breast epithelial and tumor cells. Mol Syst Biol. 11 (3), 790 (2015).
- Chen, J. F., et al. Subclassification of prostate cancer circulating tumor cells by nuclear size reveals very small nuclear circulating tumor cells in patients with visceral metastases. Cancer. 121 (18), 3240-3251 (2015).
- Ohlund, D., Elyada, E., Tuveson, D. Fibroblast heterogeneity in the cancer wound. J Exp Med. 211 (8), 1503-1523 (2014).
- Paraiso, K. H., Smalley, K. S. Fibroblast-mediated drug resistance in cancer. Biochem Pharmacol. 85 (8), 1033-1041 (2013).
- Kalluri, R. The biology and function of fibroblasts in cancer. Nat Rev Cancer. 16 (9), 582-598 (2016).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Jones, T. R., et al. CellProfiler Analyst: data exploration and analysis software for complex image-based screens. BMC Bioinformatics. 9, 482 (2008).
- Dao, D., et al. CellProfiler Analyst: interactive data exploration, analysis and classification of large biological image sets. Bioinformatics. 32 (20), 3210-3212 (2016).
- Garvey, C. M., et al. A high-content image-based method for quantitatively studying context-dependent cell population dynamics. Sci Rep. 6, 29752 (2016).
- Juarez, E. F., et al. Quantifying differences in cell line population dynamics using CellPD. BMC Syst Biol. 10 (1), 92 (2016).
- Mumenthaler, S. M., et al. The Impact of Microenvironmental Heterogeneity on the Evolution of Drug Resistance in Cancer Cells. Cancer Inform. 14, 19-31 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon