Method Article
Дискриминация и характеристика гетеросекулярных групп населения с использованием методов количественной визуализации
В этой статье
Резюме
Мы разработали новый протокол для изучения динамики гетероклеточной популяции в ответ на возмущения. В этой рукописи описывается платформа, основанная на изображениях, которая создает количественные наборы данных для одновременной характеристики множественных клеточных фенотипов гетероклеточных групп населения.
Аннотация
Сотовые процессы сложны и являются результатом взаимодействия между несколькими типами ячеек и их средой. Существующие методы клеточной биологии часто не позволяют точно интерпретировать это взаимодействие. Используя количественный подход на основе изображений, мы представляем протокол с высоким содержанием для характеристики динамических фенотипических реакций ( т. Е. Изменений морфологии, пролиферации, апоптоза) гетерогенной популяции клеток с изменениями экологических стимулов. Мы подчеркиваем нашу способность различать типы клеток, основанные на интенсивности флуоресценции или присущих морфологии, в зависимости от приложения. Эта платформа позволяет более всестороннюю характеристику субпопуляционного ответа на возмущение при использовании более короткого времени, меньших количеств реагентов и меньшей вероятности ошибки, чем традиционные анализы клеточной биологии. Однако в некоторых случаях клеточные популяции могут быть трудно идентифицировать и количественно, основываясь на комплексной клеткеLar и потребует дополнительного устранения неполадок; Мы выделяем некоторые из этих обстоятельств в протоколе. Мы демонстрируем это применение, используя ответ на препарат в модели рака; Однако его можно легко применить более широко к другим физиологическим процессам. Этот протокол позволяет идентифицировать субпопуляции в рамках системы совместной культуры и характеризовать конкретный ответ каждого на внешние раздражители.
Введение
Клеточные анализы были рабочей лошадкой в фундаментальных исследованиях и разработке лекарств. Тем не менее, ограничения этих стандартных анализов становятся все более очевидными с несоответствием между in vitro и клиническими данными и неспособностью большинства лекарств получать одобрение FDA. Здесь мы представляем новый метод использования количественной визуализации для одновременного анализа гетероклеточных фенотипов в ответ на соответствующие совместно происходящие экологические стимулы.
Традиционные клеточные анализы, которые используются для оценки жизнеспособности клеток, включают в себя: анализы исключения трипанового синего, MTT / MTS и окрашивание проточной цитометрии приложением V-FITC. Тесты исключения Trypan blue, простые и недорогие, требуют большого количества ячеек, занимают много времени и часто зависят от смещения пользователя 1 . Анализы MTT и MTS косвенно измеряют жизнеспособность клеток посредством измерения скорости метаболизма митохондрий. Однако метаболическая активностьНа клетки могут влиять различные условия культивирования (такие как концентрация меди или кислорода), что приводит к неточным результатам и предотвращает стандартизацию по типам и условиям клеток 2 , 3 . Другим серьезным недостатком этих методов является их неспособность различать несколько типов клеток - большинство биологических систем являются гетероклеточными. В то время как методы проточной цитометрии обладают способностью различать несколько популяций клеток, требуются клеточные метки, динамическая выборка является сложной задачей, и при использовании присоединяемых ячеек это приложение становится трудоемким и подверженным ошибкам.
Другие важные фенотипы клеток, включая морфологические изменения, происходят в ответ на экологические стимулы, но не захватываются традиционными клеточными анализами. Профилирование состояний ячеек через морфологическую характеристику и сопоставление изображений по выборкам является мощным, непредвзятым инструментом с aВозможность дать новые сведения о многих аспектах базовых и трансляционных исследований, включая базовую клеточную биологию и открытие лекарств 4 . Кроме того, морфология опухолевых клеток, как было показано, коррелирует с подтипами опухолей 5 и агрессивностью 6 . Следовательно, представляет большой интерес изучение этих клеточных признаков и их взаимосвязей с конкретными возмущениями окружающей среды. Кроме того, можно использовать различия в морфологических признаках, чтобы различать субпопуляции в системах совместной культуры. Флюоресцентно маркирующие клетки имеют падений ( т.е. изменяют присущие свойства клеток, отнимают много времени), и поэтому предпочтительными являются дополнительные методы классификации типов клеток.
Микроскопическая визуализация является альтернативным методом для профилирования клеточных фенотипов мультиплексированным, количественным и надежным способом. В этой рукописи мы применяем наш количественный контур формирования изображения, чтобы подчеркнуть эволюциюNary динамика гетерогенных клеточных популяций в опухоли. Мы фокусируемся на взаимодействии между клетками немелкоклеточного рака легкого (NSCLC) и связанными с раком фибробластами (CAFs), наиболее распространенным стромальным типом клеток, обнаруженным в опухолях. CAFs участвуют в инициировании опухоли, прогрессировании и терапевтическом ответе; Поэтому проведение фенотипических анализов на опухолевые клетки в отсутствие CAF может вводить в заблуждение 7 , 8 , 9 . В частности, мы оценивали влияние CAF на опухолевые клетки в ответ на эрлотиниб, небольшую молекулу, нацеленную на рецептор эпидермального фактора роста (EGFR), который часто используется при клиническом лечении НМРЛ. Для оценки мы использовали платформу для скрининга с высоким содержанием контента и ее сопутствующее программное обеспечение для анализа изображений; Однако, пытаясь сделать эту методологию доступной для других исследователей, мы также разработали сопоставимый протокол ниже по потоку с использованием программного обеспечения с открытым исходным кодом:CellProfiler 10 и аналитик CellProfiler 11 . Большинство анализов высокого содержания на основе изображений анализируются коммерческим программным обеспечением, специфичным для данной модели прибора. Результаты трудно тиражировать в других лабораториях с помощью другого программного обеспечения, поскольку основные алгоритмы часто являются собственностью. Измеряли использование этого контура на основе изображений, клеточной пролиферации, смерти и морфологии каждой субпопуляции гетероклеточной культуры в ответ на лекарственную терапию с использованием как флуоресцентной, так и морфологической классификации. Следующий протокол обеспечивает надежную методологию для зондирования сложных клеточных процессов.
протокол
1. Культура клеток
ПРИМЕЧАНИЕ. Здесь были исследованы фенотипические ответы клеток NSCLC (H3255) на EGFR-нацеливающий агент, эрлотиниб при совместном культивировании с фибробластами легких (CCD-19Lu GFP). Для того же набора данных была выполнена классификация на основе флуоресценции и морфологии двух клеточных популяций (H3255 и CCD-19Lu GFP) для иллюстрации их соответствия. Однако необходимо использовать только один метод классификации, который следует выбирать на основе приложения.
- Подготовьте 500 мл RPMI-1640, дополненного 10% -ным инактивированным нагреванием FBS и 1% пенициллином / стрептомицином.
ПРИМЕЧАНИЕ. Средство роста и добавки можно заменить, как требуется для других типов клеток. - Культуральные клетки в 10 см 3 планшетах в виде чистых популяций в 5% СО 2 при 37 ° С и прохождение при соответствующем соотношении каждые 3-4 дня.
2. Подготовка клеток
- Для приготовления суспензии клеток удалите cEll и промывают клетки 5 мл 1X фосфатно-буферным раствором (PBS).
- Аспирируйте из PBS, добавьте 1 мл 0,05% трипсина, нагретого до 37 ° С, и инкубируйте в течение 5 минут (или пока клетки больше не прилипают к тарелке) при 37 ° C.
- Чтобы нейтрализовать трипсин, добавьте 4 мл пластин RPMI в H3255 и CCD-19Lu GFP и проведите растворы клеток в 15 мл конических пробирках.
- Центрифужные клетки при 150 мкг в течение 5 мин при комнатной температуре.
- Отсасывают супернатант и ресуспендируют клеточные гранулы в 10 мл среды RPMI в конических пробирках для подготовки к посеву.
3. Покрытие ячеек
- Подсчитайте ячейки для стандартизации посева.
- Инвертируйте трубки для смешивания клеток в растворе. Внесите 10 мкл каждой клеточной суспензии в микроцентрифужную пробирку и добавьте 10 мкл трипанового синего.
- Внесите 10 мкл этого раствора в сотовый подсчет и вставьте в автоматический счетчик клеток.
ПРИМЕЧАНИЕ. Другие методы подсчета ячеек ( т. Е., Гемоцитометр). - Повторите подсчет клеток как минимум три раза, или пока полученные подсчеты не будут согласованы.
- Семенные клетки на пластину с несколькими лунками
ПРИМЕЧАНИЕ. Количество пластин для посева зависит от количества точек времени, которые будут отображаться. Альтернативно, одна пластина может быть повторно отображена со временем, если клетки трансдуцированы гистон-2B-GFP (или другими стабильными лентивирующими ядерными пятнами, которые обеспечивают адекватную ядерную сегментацию).- Высевают в общей сложности 1500 клеток / лунку в 100 мкл RPMI. Подготовьте три клеточных суспензии для посева трех клеток: H3255, CCD-19Lu GFP и 50% H3255 + 50% CCD-19Lu GFP. Выполняйте каждый в трех повторениях с одинаковыми настройками пластины для каждой временной точки.
ПРИМЕЧАНИЕ. Первоначальные плотности посева должны быть оптимизированы для каждой клеточной линии и размера пластины. - Семена клеток в 3 х 96-луночные планшеты с использованием многоканальной пипетки. Инкубируйте клетки O / N при 37 ° C, 5% CO 2 .
- Высевают в общей сложности 1500 клеток / лунку в 100 мкл RPMI. Подготовьте три клеточных суспензии для посева трех клеток: H3255, CCD-19Lu GFP и 50% H3255 + 50% CCD-19Lu GFP. Выполняйте каждый в трех повторениях с одинаковыми настройками пластины для каждой временной точки.
4. Дозировка препарата
- Добавьте ДМСО в порошок эрлотиниба, чтобы получить конечный раствор эрлотиниба в концентрации 10 мМ.
ПРИМЕЧАНИЕ. Препарат можно заменить по желанию. - Разбавьте лекарство культуральной средой для клеток до 2х конечной концентрации с наивысшей конечной концентрацией при 10 мкМ и серийно разбавьте четыре раза при соотношении 1:10, в общей сложности пять концентраций препарата и отсутствие контроля над препаратом.
ПРИМЕЧАНИЕ. Если концентрация ДМСО равна или превышает 0,1% об. / Об. При самой высокой дозе препарата, контроль над препаратом не должен содержать эквивалентное количество ДМСО, чтобы гарантировать наблюдаемые наблюдаемые эффекты не из-за токсичности ДМСО. - Внесите 100 мкл раствора лекарственного средства в соответствующую лунку для конечной концентрации лекарственного средства в 1 раз, разбавленной в средах.
5. Приобретение изображения
ПРИМЕЧАНИЕ. Изображения были получены в дни 0, 2 и 3. В зависимости от типов клеток и изучаемых клеточных процессов oЖелательные моменты времени могут быть изучены.
- Пятновыводители для подготовки к визуализации.
- Составьте раствор красителя в следующих конечных концентрациях.
- Для классификации на основе флуоресценции, подготовьте 5 мкг / мл ядерного пятна и 5 мкМ мертвого клеточного пятна в PBS (см. Таблицу материалов ).
- Для классификации на основе морфологии, подготовить 5 мкг / мл ядерного пятна, 5 мкМ мертвого клеточного пятна и 5 мкМ клеточного окрашивания в PBS (см. Таблицу материалов ).
- Добавить 20 мкл раствора красителя в каждую лунку. Инкубируйте в течение 30 мин при температуре 37 ° C, защищенной от света.
- Составьте раствор красителя в следующих конечных концентрациях.
- Оптимизация и получение изображений.
- Удалите планшет из инкубатора, протрите нижнюю часть пластины 70% EtOH и поместите пластину в камеру формирования изображения.
- На вкладке «Настройка» нажмите кнопку «+» в разделе «Выбор канала», чтобы добавить соответствующие каналы вИзображение ( т.е. яркое поле, ядерное пятно, пятно мертвых клеток, сигналы GFP и RFP).
- Нажмите «Выбор макета» и возьмите тестовые изображения z-stacked каждые 2 мкм, начиная с 0 мкм и заканчивая 20 мкм, чтобы идентифицировать плоскость фокуса. Введите это расстояние для каждого канала в разделе «Высота».
- Нажмите «Снимок» под каждым каналом, чтобы оценить интенсивность и оптимизировать время экспозиции. Введите более высокие или более низкие значения под «Время» по мере необходимости.
- В правой части экрана выделите соответствующие колодцы (чтобы они были отображены) на схеме пластин. В схеме скважин, приведенной ниже, выделите двадцать пять полей, которые будут отображаться аналогичным образом.
- В разделе «Запустить эксперимент» определите табличку в «Название пластины» на левой вкладке и нажмите кнопку «Пуск» (внизу), чтобы запустить протокол получения изображений с целью 10X, чтобы генерировать изображения TIFF с серой шкалой в вышеупомянутых каналах.
ПРИМЕЧАНИЕ: шаг за шагом instRuctions для протокола обработки изображений могут различаться между инструментами, но значения параметров все равно должны быть оптимизированы. - Повторите визуализацию на два-три дня.
6. Анализ изображений
ПРИМЕЧАНИЕ. Все анализы изображений выполнялись с использованием проприетарного программного обеспечения. Однако, поскольку это не является общедоступным, сопоставимые анализы также были разработаны на CellProfiler 2.2 и CellProfiler Analyst 2.0 с кратким протоколом, указанным ниже, и подробным протоколом, предоставленным в качестве дополнительного материала (тестовые изображения уже загружены в конвейеры для тестирования рабочего процесса). Изображения этого эксперимента были сгруппированы на основе каждой скважины, так что каждая лунка могла быть загружена индивидуально. Конвейеры CellProfiler ниже содержат регулярное выражение, которое анализирует информацию метаданных из каждого имени файла изображения и позволяет сгруппировать по каналам изображения по каналу.
- Загрузите и установите программное обеспечение с открытым исходным кодом: «CellProfiler9; И «Аналитик CellProfiler». Примите все параметры по умолчанию и надстройки во время установки.
- Классифицировать гетероклеточные культуры в субпопуляции.
- Откройте «CellProfiler», нажмите «Файл» | «Импортный трубопровод» | «Из файла» и выберите соответствующий файл («Fluorescence_Classification.cppipe» для классификации на основе флуоресценции или «Morphology_Classification.cppipe» для классификации на основе морфологии).
ПРИМЕЧАНИЕ. Эти файлы содержат протоколы для базовой обработки изображений и сегментации ядер / клеток. Из-за неравномерного пятна Hoechst, присутствующего на этих клетках, ядра были сегментированы и увеличены, а затем использованы для маскировки изображения, чтобы обеспечить сегментацию ядер с меньшей интенсивностью.- Выберите трубопровод классификации на основе флуоресценции для классификации ячеек как H3255 или CCD-19Lu на основе интенсивности eGFP, так и для расчета особенностей морфологии.
ПРИМЕЧАНИЕ: CCD-19Lu трансдуцировали GFP. - Выберите контур классификации, основанный на морфологии, для сегментации ядер и клеток, а также для расчета характеристик морфологии.
ПРИМЕЧАНИЕ. Для классификации необходим дальнейший анализ в анализе CellProfiler Analyst. Мертвые клетки классифицируются по классификации на основе флуоресценции.
- Выберите трубопровод классификации на основе флуоресценции для классификации ячеек как H3255 или CCD-19Lu на основе интенсивности eGFP, так и для расчета особенностей морфологии.
- Нажмите «Просмотреть настройки вывода» в левом нижнем углу экрана. Выберите местоположение файлов изображений для анализа («Default Input Folder») и пункт назначения для извлеченных данных («Выходная папка по умолчанию»).
- Нажмите «Анализ изображений», чтобы начать анализ. Когда анализ завершен, нажмите «ОК» и перейдите в «Выходную папку по умолчанию», чтобы просмотреть вычисленные данные.
ПРИМЕЧАНИЕ. Пример значений параметров и изображений доступны в дополнительном файле 1-CellProfilerProtocol.pdf . - Для классификации на основе морфологии (только) выполните следующее.
- Откройте программное обеспечение CellProfiler Analyst, выберите файл свойств базы данных, сгенерированный в CellProfiler, и нажмите «Открыть».
- Перейдите на вкладку «Классификатор» в верхнем левом углу экрана. Чтобы вызвать случайные изображения клеток из эксперимента, нажмите «Fetch»; Изображения будут отображаться в неклассифицированном окне.
- Вручную классифицируйте ячейки как положительные (H3255) или отрицательные (CCD-19Lu), выбирая и перетаскивая ячейки в соответствующий бит (см. Дополнительный файл 2-Pipeline.pdf : Рисунок B ). После классификации по меньшей мере 50 ячеек на субпопуляцию, нажмите «Поезд классификатора», а затем нажмите «Проверить прогресс».
ПРИМЕЧАНИЕ. Ячейки классифицируются с помощью алгоритма обучения случайным левым машинам, контролируемого пользователем. 12 . Если точность не превышает установленный порог (> 90%), может потребоваться вернуться и оптимизировать сегментацию ячеек на «CellProfiler», или ячейки могут быть не идеальными для classiБорясь с морфологией. - Нажмите «Оценка всех», чтобы создать таблицу с подсчетом клеток для каждой субпопуляции.
- Откройте «CellProfiler», нажмите «Файл» | «Импортный трубопровод» | «Из файла» и выберите соответствующий файл («Fluorescence_Classification.cppipe» для классификации на основе флуоресценции или «Morphology_Classification.cppipe» для классификации на основе морфологии).
Результаты
Мы создали набор изображений, состоящий из 25 полей / лунки, 54 лунок / пластинок (популяции 3 клеток х 6 концентраций лекарств х 3 репликации), через три пластины для общего количества 4050 отдельных изображений. Наборы изображений, сгенерированные в ходе эксперимента, анализировались с использованием проприетарного программного обеспечения (см. Таблицу материалов) для извлечения различных количественных свойств клеток ( например, морфологии, флуоресценции), которые затем можно было использовать для классификации субпопуляций клеток. Однако, поскольку коммерческое программное обеспечение имеет ограниченный доступ, были созданы сопоставимые нисходящие конвейеры в CellProfiler и CellProfiler Analyst.
Гетероклеточная классификация в субпопуляции
Ядра были идентифицированы и сегментированы на основе ДНК-пятен (здесь Hoechst), а популяции клеток классифицировали либо на основе флуоресценции, либоRphology ( рисунок 1 ). Для классификации на основе флуоресценции фибробласты (CCD-19Lu) ранее были трансдуцированы GFP-лентивирусом. Уровни интенсивности GFP измерялись для каждого ядра, а те, которые были рассчитаны выше принятого порога (на основе фонового сигнала), были классифицированы как CCD-19Lu, тогда как те, которые ниже были идентифицированы как опухолевые клетки (H3255). Для классификации на основе морфологии клетки ранее окрашивали нетоксичным клеточным пятном (см. Таблицу материалов), и это использовалось для идентификации и сегментации цитоплазмы. Алгоритм машинного обучения был подготовлен с ~ 50-100 клетками от каждой популяции. Были идентифицированы морфологические особенности, которые значительно отличались между популяциями, которые затем использовались для создания линейного классификатора для различения клеток CCD-19Lu и H3255. Протоколы классификации флуоресценции и морфологии составляли 97,4% (n = 1403) согласных при разграничении между двумя клеточными популяциямиВ условиях отсутствия лечения и 92,5% (n = 916) согласных в условиях лечения наркотиками (1 мкМ эрлотиниба) ( рисунок 2 ).
Фенотипический анализ субпопуляций
Помимо различения типов клеток, мы стремились характеризовать фенотипические свойства каждой субпопуляции. Анализы мультиплексирования экономят время и реагенты, добавляют согласованность и предоставляют дополнительную информацию об исследуемой системе. Существует много потенциальных фенотипических результатов, и их следует выбирать на основе интересующих вопросов. Здесь были исследованы изменения морфологии и жизнеспособности клеток в ответ на лечение эрлотинибом. После трех дней лечения наркотиками наблюдалось снижение ядерной площади и увеличение клеточной площади клеток H3255 ( рис. 3A ). Средняя разница в ядерной области междуБыло обнаружено, что популяции «без лекарств» и «лекарственное средство» статистически значимы с помощью t- критерия двухстороннего типа 2 (равная дисперсия) ( p = 7,92 × 10 -16 ). Мы выдвигаем гипотезу, что это наблюдение является клеточным ответом на стресс, налагаемый лечением наркотиками.
Интересно также выяснить, оказывает ли препарат цитотоксическое ( то есть увеличение количества мертвых клеток с течением времени) или цитостатическое ( т.е. уменьшение числа клеточных рождений с течением времени) на клетки, поскольку это оказывает глубокое клиническое воздействие. Например, эффект цитостатического лекарственного средства вызывает остановку роста, но не исключает клетки из опухоли, таким образом, существует вероятность того, что раковые клетки вновь начинают клеточную пролиферацию после удаления лекарственного средства. Наркотические эффекты часто могут быть контекстом, концентрацией и зависимым от типа клеток. Ранее мы наблюдали эрлотиниб, вызывающий цитотоксический ответ в одном типе клеток, показывая acYtostatic ответ в другом 13 .
Традиционные анализы жизнеспособности выводят относительный номер клетки и, следовательно, не проводят различия между арестами роста и гибелью клеток. Здесь мертвые клетки были идентифицированы на основе пятна пропидиум-йодида ( фиг. 3В ). Наблюдалось как цитотоксическое, так и цитостатическое действие эрлотиниба на клетки H3255 с увеличением числа смертей и снижением числа родов после лечения наркотиками ( рис. 3C ). Стоит отметить, что количество мертвых клеток падает после 1-го дня, вероятно, из-за клеточного клиренса. Клетки CCD-19Lu не были подвержены воздействию препарата. Дополнительным преимуществом этой платформы является генерация количественных данных. Например, в нашем эксперименте по совместной культуре начальная субпопуляция 1,118 (75,8%) клеток H3255 оказалась равной 2817 (87,9%) или 396 (57,2%) через три дня без или с эрлотиномIb, соответственно ( рисунок 4 ). Поскольку мы можем генерировать фактические подсчеты клеток вместо относительного процента (как и методы проточной цитометрии), мы заключаем, что изменение состава при лечении наркотиками связано с уменьшением клеток H3255, а не с увеличением CCD-19Lu. Не стоит ничего, что смертность может быть недооценена из-за клеточного клиренса, который трудно оценить экспериментально и, вероятно, будет различаться по типам клеток.
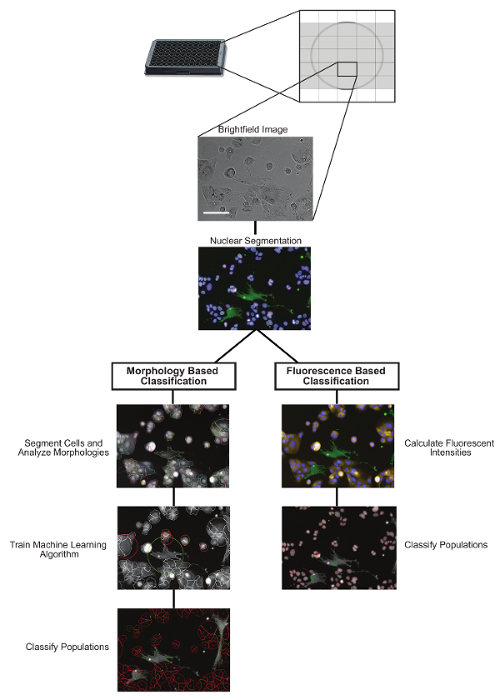
Рисунок 1: Обзор протокола анализа изображений. Два потенциальных нижестоящих анализатора изображений для классификации гетероселективных популяций с использованием либо классификации на основе морфологии, либо классификации на основе флуоресценции. Шкала шкалы = 100 мкм. Пожалуйста, нажмите на нееE, чтобы просмотреть большую версию этого рисунка.

Рисунок 2: Согласование между морфологией и классификацией на основе флуоресценции. ( A ) Контракторный график, отображающий перекрытие двух протоколов классификации. Эти же клетки классифицировали как H3255 с использованием как морфологической, так и флуоресцентной классификации. Эти два протокола согласуются с классификацией для нелеченных клеток 97,4% (n = 1403) и 92,5% (n = 916) клеток, обработанных эрлотинибом (примечание: белая область слишком мала для визуализации). ( B ) 10X изображений, изображающих примеры хорошего и плохого соответствия между классифицированием на основе флуоресценции и морфологии. Белые стрелки указывают на ячейки, которые были непоследовательно классифицированы между платформами. Входное изображение: синие - ядра (Hoechst); Зеленый - CCD19Lu (GFP). ClassiФиктивные изображения: красный - H3255; Зеленый - CCD-19Lu. Шкала шкалы = 100 мкм. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
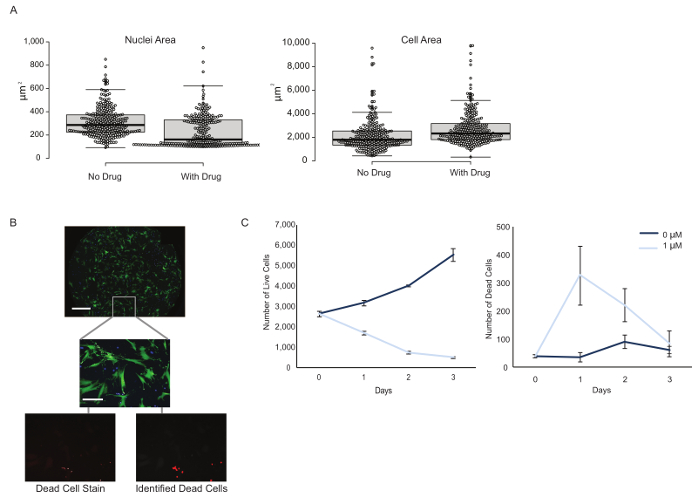
Рисунок 3: Мультиплексные фенотипические измерения из одной экспериментальной установки. ( A ) Морфологические особенности, такие как ядра и клеточная область, были рассчитаны на уровне одиночных клеток в присутствии и отсутствии лекарственного средства. Примечание. Площадь ячеек размером менее 100 мкм 2 считалась мусором и исключалась из анализа. График коробки изображает медианную область с первым и третьим рядами квартилей и 95% доверительными интервалами. ( B ) H3255 (синие) и CCD-19Lu (зеленые) клетки были совместно культивированы, а мертвые клетки были идентифицированы в зависимости от интенсивностиIum iodide (красный) и визуализируется с использованием объектива 10X. Шкала шкалы = 1 мм (верхняя панель); 100 мкм (нижние изображения). ( C ) Общее количество живых и мертвых клеток было рассчитано в течение трех дней с или без лечения наркотиками с очевидным уменьшением числа живых клеток и увеличением количества мертвых клеток с добавлением эрлотиниба. Полосы ошибок представляют собой стандартную ошибку среднего значения на основе трех повторов. Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
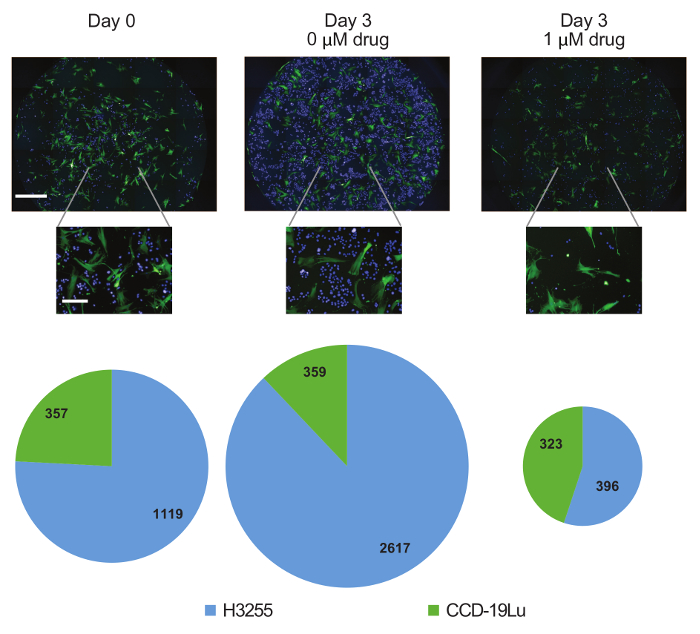
Рисунок 4: Динамика субпопуляции по времени. Представительные 10X изображения колодцев, содержащих H3255 (синий) и CCD-19Lu (зеленый) в день 0 или день 3 с и без лекарственного средства. Клетки, принадлежащие каждой подгруппе, были подсчитаны, а пропорциональные круговые диаграммы показывают aИзменение состава популяции по выборкам. Шкала шкалы = 1 мм (средние панели, верхняя панель, верхняя панель), 1 мм (верхнее изображение), 100 мкм (нижние изображения). Нажмите здесь, чтобы просмотреть увеличенную версию этого рисунка.
Обсуждение
The protocol described above improves upon current cell biology assays by providing more comprehensive insights into phenotypic dynamics of multiple cell types in response to environmental perturbations while using reduced reagents and time. A major advantage of this experimental design is the ability to analyze multiple phenotypes with a single setup and generate quantitative data characterizing these phenotypes on a single cell level. One technical advantage to this platform is the ease of initial troubleshooting compared to other assays. Because this method is image-based, one is able to visualize the wells for apparent over/under seeding. It is advisable to have cells in the exponential growth phase for the duration of the experiment and not be limited by nutrient or spatial constraints or confounded by senescence due to scarce seeding. Otherwise, birth and death rates may not be reproducible between experiments. For reference, CellPD is a publicly available program for computation of birth and death rates14. Additionally, one can visualize whether adequate concentrations of dyes were added to each well. Pipetting issues in an individual well could result in missegmentation and skewed data, but can easily be detected with the aforementioned protocol.
Unfortunately, not all cell types may be amenable to this application. It is important to be able to accurately segment the nuclei and cells, therefore analysis of cells that organize in more sphere-like or clumped structures may not be suitable. For some cells, it also may be advantageous to use a cell strainer prior to seeding to ensure initial seeding of single cells. In addition, the linear classifier technique is only applicable to cell types that can be readily distinguished based on morphology features.
For the success of the protocol, it is important to first optimize the imaging conditions, as the validity of downstream analyses is dependent on the quality of the images. While here we performed experiments using a high-content screening platform, image acquisition can also be performed using any fluorescent microscope (although an automated imaging platform is ideal for high-throughput approaches). Test images should be taken prior to each imaging time point to ensure that there are no problems with the microscope or protocol. The signal to noise ratio should be high, especially for the channels that will be used for segmentation (i.e. nuclei, cell stains). Additionally, it is important to image in the optimal plane of focus. If the images are out of focus, segmentation becomes much more difficult and the calculated morphological features will likely be inaccurate. Illumination differences between fields can cause problems with image segmentation as well. Large differences in brightness make the automated selection of threshold values difficult. Additionally, if there are heterogeneous fluorescence intensities between cells, a single threshold value may not sufficiently segment all the cells in an image. In this analysis, these problems were overcome by creating masks around brighter and dimmer cell populations and segmenting each population separately.
While the phenotypes under investigation in this protocol are limited to live, dead, and morphological characterization, they can easily be expanded to investigate other features. For example, functional genetic studies can be added with RNAi, overexpression, or other chemical perturbations.
In this paper, the capabilities of the protocol to measure the response of non-small cell lung cancer cells to erlotinib in the presence and absence of CAFs was demonstrated. However, this is merely one example of the many cell types and microenvironmental parameters that can be tested. We have extended this protocol to be used with other cell types and drug studies, including primary cells isolated from patient tumors13,15.
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Эта работа была профинансирована Национальным институтом рака (NCI) грантов U54CA143798 и U54CA143907 для создания центров физических наук-онкологии (PS-OC) в Институте рака Дана-Фарбера и Университете Южной Калифорнии, соответственно. SM Mumenthaler получил награду трансляций PS-OC, которая поддерживала некоторые из этих работ.
Мы хотели бы выразить нашу глубокую благодарность нашим благотворительным сторонникам, в частности семье Стивенсона, Эммету, Тони и Тессе за их пожертвование платформы Оперетты HCS. Мы также хотели бы поблагодарить Дж. Фу за руководство и членов группы специалистов прикладной молекулярной медицины: D. Agus за клиническое руководство и наставничество, К. Патча за конструктивные обсуждения с экспериментальным дизайном, Р. Рават за помощь в протоколах анализа изображений , Дж. Кац за техническую помощь с Опереттой, П. Маклин и Д. Рудерман за полезные обсуждения и отзывы.
Материалы
| Name | Company | Catalog Number | Comments |
| RPMI-1640 | Corning | 10-040-CV | cell culture medium |
| Fetal Bovine Serum (FBS) | Gemini | 100-106 | medium supplement |
| Penicillin/streptomycin | Gibco | 15-140-122 | medium supplement |
| TC20 | Biorad | 1450102 | cell counter |
| TC20 slides with trypan blue | Biorad | 1450003 | cell counter slides |
| 96-well plates | Corning | 3904 | clear bottom black plates |
| Erlotinib | LC Laboratories | E-4007 | |
| DMSO | VWR | 317275-100ML | solution to resuspend drug |
| Hoechst | Invitrogen | H21491 | nuclear dye |
| Propidium Iodide (PI) | Invitrogen | P1304MP | dead cell stain |
| Cell Tracker Orange CMRA | Life Technologies | C34551 | whole cell stain |
| Operetta high content imaging system | Perkin Elmer | ||
| CellProfiler | Broad Institue | version 2.2.0 (rev 9969f42) | http://cellprofiler.org/releases/ |
| Cell culture incubator | Any cell culture incubator will be suitable - cells were cultured under 37 ºC at 5% CO2. | ||
| 15 mL Falcon conical tubes | Falcon | 14-959-53A | |
| 10 cm2 cell culture plates | TPP | 93040 |
Ссылки
- Kanemura, Y., et al. Evaluation of in vitro proliferative activity of human fetal neural stem/progenitor cells using indirect measurements of viable cells based on cellular metabolic activity. J Neurosci Res. 69 (6), 869-879 (2002).
- Plumb, J. A., Milroy, R., Kaye, S. B. Effects of the pH dependence of 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyl-tetrazolium bromide-formazan absorption on chemosensitivity determined by a novel tetrazolium-based assay. Cancer Res. 49 (16), 4435-4440 (1989).
- Hsu, S., et al. Green tea polyphenols induce differentiation and proliferation in epidermal keratinocytes. J Pharmacol Exp Ther. 306 (1), 29-34 (2003).
- Caicedo, J. C., Singh, S., Carpenter, A. E. Applications in image-based profiling of perturbations. Curr Opin Biotechnol. 39, 134-142 (2016).
- Sero, J. E., et al. Cell shape and the microenvironment regulate nuclear translocation of NF-kappaB in breast epithelial and tumor cells. Mol Syst Biol. 11 (3), 790 (2015).
- Chen, J. F., et al. Subclassification of prostate cancer circulating tumor cells by nuclear size reveals very small nuclear circulating tumor cells in patients with visceral metastases. Cancer. 121 (18), 3240-3251 (2015).
- Ohlund, D., Elyada, E., Tuveson, D. Fibroblast heterogeneity in the cancer wound. J Exp Med. 211 (8), 1503-1523 (2014).
- Paraiso, K. H., Smalley, K. S. Fibroblast-mediated drug resistance in cancer. Biochem Pharmacol. 85 (8), 1033-1041 (2013).
- Kalluri, R. The biology and function of fibroblasts in cancer. Nat Rev Cancer. 16 (9), 582-598 (2016).
- Carpenter, A. E., et al. CellProfiler: image analysis software for identifying and quantifying cell phenotypes. Genome Biol. 7 (10), R100 (2006).
- Jones, T. R., et al. CellProfiler Analyst: data exploration and analysis software for complex image-based screens. BMC Bioinformatics. 9, 482 (2008).
- Dao, D., et al. CellProfiler Analyst: interactive data exploration, analysis and classification of large biological image sets. Bioinformatics. 32 (20), 3210-3212 (2016).
- Garvey, C. M., et al. A high-content image-based method for quantitatively studying context-dependent cell population dynamics. Sci Rep. 6, 29752 (2016).
- Juarez, E. F., et al. Quantifying differences in cell line population dynamics using CellPD. BMC Syst Biol. 10 (1), 92 (2016).
- Mumenthaler, S. M., et al. The Impact of Microenvironmental Heterogeneity on the Evolution of Drug Resistance in Cancer Cells. Cancer Inform. 14, 19-31 (2015).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены