Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Application et la méthodologie de la Technique de RMN Non destructifs 19F domaine temporel pour mesurer le contenu dans les produits contenant du fluor
Dans cet article
Résumé
Une technique simple et non destructive qui mesure la teneur moyenne des substances médicamenteuses dans les produits formulés contenant du fluor à l’aide de champ faible fluor-19 (19F) domaine temporel (TD) résonance magnétique (RMN) est présentée ici. La technique peut être appliquée pour le développement et la fabrication de médicaments dans l’industrie pharmaceutique.
Résumé
Nous décrivons ici un protocole développé par notre groupe qui utilise le champ faible fluor-19 (19F) domaine temporel (TD) résonance magnétique (RMN) pour mesurer la teneur moyenne de médicaments fluorés dans leurs formes de produit formulé drogue : des comprimés ou capsules. Cette méthode est spécifique aux médicaments fluorés car il détecte uniquement le contenu du fluor, évitant les interférences provenant d’excipients qui manquent de fluor. Les avantages de mesurer le contenu actif des médicaments fluorés à l’aide de champ faible 19F TD-NMR versus haut champ 19septies à l’état solide (SS) NMR sont la simplicité de la méthode ; le faible coût ; et la nature non destructive de la technique, avec tous les échantillons récupérables sous forme intacte (p. ex., poudres, comprimés et gélules), rendant cette technique abordable pour n’importe quel laboratoire.
Nous avons testé la méthode avec trois fluoré médicaments disponibles sur le marché - cinacalcet, lansoprazole et ciprofloxacine - avec des doses allant de 15 à 500 mg. Les résultats des analyses, mesurés en champ faible 19F TD-RMN, soutiennent les revendications d’étiquette signalés pour la teneur moyenne de drogue.
Basé sur la simplicité et la reproductibilité de l’analyse, nous envisageons cette méthodologie appliquée dans n’importe quel laboratoire, y compris les usines de fabrication, comme un outil (PAT) de technologie d’analyse de processus dans l’industrie pharmaceutique.
Introduction
Dans l’industrie pharmaceutique, le contenu des substances médicamenteuses dans leurs unité-de-dosages (p. ex., comprimés et gélules) doit être portée sur l’étiquette pour satisfaire le contrôle de la qualité et les directives d’exécution. Chromatographie en phase liquide à haute performance (HPLC) est la technique analytique classique utilisée pour mesurer l’uniformité du contenu de la drogue dans leurs formes formulés. Toutefois, la méthode est longue et destructrice, qui exige la dissolution de la drogue dans sa forme formulé en utilisant les solvants appropriés avant l’analyse. Même avec l’automation, le processus peut prendre 1-3 h par exemple, selon le développement de la méthode analytique appropriée1,2,3. En plus de l’HPLC, proche infrarouge (NIR) a été utilisé aux mêmes fins et comme un outil de PAT, avec l’inconvénient de nécessiter la chimiométrie l’analyse des données, rendant sa mise en œuvre longue et plus complexe4. Les deux techniques sont destructeurs, avec la drogue formulée après analyse.
Dans ce manuscrit, les auteurs décrivent le protocole étape par étape d’une méthodologie précédemment publié par notre groupe5 pour mesurer la teneur moyenne de médicaments fluorés dans leurs formes posologiques (p. ex., comprimés et gélules) à l’aide de champ faible 19septies RMN. Au cours des années, le pourcentage de médicaments fluorés sur le marché approuvé par les organismes de réglementation dans le monde entier comme médicaments formulés a augmenté de 2 % en 1970 à 25 % en 2013,6. Par conséquent, nous pensons qu’il existe une demande pour élaborer une méthode plus simple mais plus précise que les méthodes actuellement disponibles pour le contrôle de la qualité du contenu de médicaments fluorés dans leurs formes formulés.
Les médicaments contenant du fluor-19 (19septies) dans leurs structures ont l’avantage d’être facilement détecté par 19F RMN en raison de sa sensibilité d’abondance et de 83 % de 100 % par rapport aux protons7. Mesure directe par 1H RMN-TD n’est pas utile parce que les excipients et les API ont des protons, et le signal total proton provient de tous les composants du médicament, rendant impossible de mesurer la teneur de l’API dans les produits à l’aide de 1 RMN-H TD. Par conséquent, mesurer le contenu de la drogue de médicaments fluorés à l’aide de 19F TD-NMR a l’avantage d’aucune interférence avec les excipients en raison du manque de fluor. Pour illustrer notre méthodologie de mesure de la teneur moyenne drogue des médicaments fluorés, nous avons sélectionné trois médicaments commercialement formulés contenant du fluor dans les gammes de dose différente. La figure 1 illustre les structures des médicaments choisis, où deux d'entre eux - cinacalcet HCl8 et lansoprazole9-ont un groupe trifluorométhyle (CF3) dans leurs structures, avec des doses allant de 15 à 90 mg et la troisième un - ciprofloxacin HCl monohydrate10 - contient un atome de fluor, attaché à un noyau aromatique, avec une dose de 500 mg.
Ici, nous démontrons la méthodologie que nous avons mis au point5 pour quantifier la teneur en drogues moyen des médicaments fluorés en utilisant un instrument de TD-NMR de benchtop de champ faible (23,4 MHz pour 1H et 22,0 MHz pour 19septies). Nous comparons également deux progiciels (logiciel de Calibration de RI et Mnova) qui peuvent être utilisés pour signaler les résultats.
Protocole
attention : veuillez consulter toutes les fiches signalétiques (FS) avant d’utiliser tout produit chimique. Substances médicamenteuses en général sont toxiques et doivent être manipulées avec l’équipement de protection individuelle approprié (EPI ; par exemple, gants, lunettes, blouse de laboratoire, pantalons longs et chaussures fermées), avec une attention particulière lorsqu’ils soupèsent les matériaux en poudre. Il est recommandé d’utiliser une balance placée dans une hotte avec une bonne circulation d’air pour réduire la poudre de matériaux solides diffusion hors de la zone qui entoure le solde.
Remarque : les instructions du logiciel sont spécifiques pour l’étalonnage de la RINMR, RI et Mnova. Pour d’autres instruments de TD-NMR du vendeur et les progiciels, les instructions varieront.
1. préparation des échantillons avant le 19 F TD-NMR mesure
- peser les échantillons pour l’étalonnage (substance médicamenteuse de poudre ou d’ingrédients pharmaceutiques actifs (API)) dans les tubes de NMR appropriés (2,5, 3, 5, 10, 18- et tubes de 25 mm OD NMR) jusqu'à la ligne de marquage (hauteur de la bobine pour la sonde NMR), ou environ 30 mm de hauteur. Avis que la hauteur peut dépendre de la sonde.
Remarque : Le Cinacalcet HCl est un exemple d’une API à utiliser pour l’étalonnage pour déterminer le contenu de la drogue sous forme de comprimés commerciaux cinacalcet. Le poids dépend de la densité de la poudre. Dans le cas de cinacalcet HCl, les poids de l’API sont autour de 7,2, 3.5, 1.0, 0,3, 0,1 et 0,07 g lors du remplissage de la hauteur de la bobine pour le 25, 18, 10-, 5-, 3-et tubes de NMR de 2,5 mm, respectivement. - Peser les échantillons de produit formulé médicaments (comprimés ou capsules) dans les tubes de NMR appropriées jusqu'à la ligne de marquage (hauteur de la bobine pour la sonde NMR) ou environ 30 mm de hauteur, comme indiqué plus haut.
NOTE : 25 – ou 18 mm tubes sont appropriées pour grosses comprimés/capsules ou lorsque suffisamment de produit formulé des drogues est disponible. Pour les plus petits comprimés/capsules ou alors pas assez produit de formulation pharmaceutique est disponible mais le rapport signal sur bruit peut être toujours suffisant pour la mesure, utiliser des tubes de 10 mm. Mesurer les comprimés directement, ou écraser si vous le souhaitez. Aucune observation des variations dans leurs Mensurations n’ont été observées ici, tel que mentionné dans la Discussion.- Lors de la préparation commerciales comprimés de cinacalcet, peser une quinzaine mg 90 comprimés dans le tube de NMR de 25 mm (environ 9,2 g), 50 comprimés de 30 mg dans le tube de NMR de 25 mm (environ 9,6 g), vingt-deux 30 mg comprimés dans la RMN 18 mm tube (environ 4,2 g) et vingt-trois mg 60 comprimés dans le tube de NMR de 25 mm (environ 8,8 g).
2. Préparation de l’Instrument RMN pour la mesure
instrument- accordant l’instrument NMR à 19 F
- porter sur toutes les mesures à la température de l’aimant permanent dans la RMN. Utiliser ici, 40 ° C ; aucun contrôle de la température n’est disponible pour la 26 mm 19 F RMN sonde utilisée ici. Effectuer toutes les mesures à une fréquence de 22,0 MHz pour 19 F à l’aide de l’instrument de NMR 23 MHz (pour 1 H).
- Placer l’échantillon standard de téflon à l’intérieur d’un tube de 25 ou 26 mm-NMR et placez-le dans la sonde à l’intérieur de l’aimant. Permettre l’équilibration pour environ 5-10 min et accorder l’instrument à 19 F. Select " Auto O1 " sous la " commandes " menu du logiciel RINMR. Recommencez la mesure au moins 3 fois et prendre la dernière valeur du paramètre O 1 (décalage de fréquence).
- Calibration de l’impulsion de 90 degrés F 19
- calibrer le pouls de 90 degrés pour F-19 avec l’échantillon de Teflon standard à l’aide de la séquence de calibrage automatique standard disponible dans l’instrument. Sélectionnez " Auto P90 " sous la " commandes " menu du logiciel RINMR.
Remarque : Normalement, l’impulsion de 90 degrés n’a pas besoin de mesurer fréquemment à moins que l’instrument ne fonctionne pas ou la sonde n’a pas été utilisée pendant un certain temps. La valeur de 90 degrés obtenue pour Teflon avec la sonde RMN F de 26 mm 19 utilisée ici était 7,05 µs.
- calibrer le pouls de 90 degrés pour F-19 avec l’échantillon de Teflon standard à l’aide de la séquence de calibrage automatique standard disponible dans l’instrument. Sélectionnez " Auto P90 " sous la " commandes " menu du logiciel RINMR.
3. Mesure du temps de Relaxation longitudinale ou T 1 pour Pure des exemples de l’API Standard
- pour un meilleur rapport signal-bruit, faire passer l’échantillon API préparé dans le tube de NMR de 25 mm à l’intérieur de la sonde de F-19 installé dans l’aimant et laissez-le équilibrer pendant au moins 10 min.
- Mesure du temps de relaxation de T 1, suivant les instructions du manuel instrument, pour chaque échantillon d’API utilisant une expérience standard pour inversion-récupération à partir du logiciel RINMR.
Remarque : Les paramètres expérimentaux recommandées sont 16 analyses recueillies avec un temps de pause-0,1 µs ; points de 8 données ; une impulsion de 90 degrés, comme mentionné plus haut ; et un temps mort de 10 µs pour la sonde de 26 mm F-19. Un tableau des retards de 100 µs à 8 s (par exemple, 100 µs, 500 µs, 10 ms, 100 ms, 300 ms, ms 700, 1 s, 2 s, 5 s et 8 s) médicaments CF 3 et des retards de 100 µs à 20 s (par exemple 100 µs, 500 µs, 1 ms, ms 100, 500 ms, 1 s, 5 s, 10 s, 15 s et 20 s) pour les médicaments avec un groupe de fluor, attaché à l’anneau aromatique sont recommandés. Logiciel- in the RINMR, charge la " invrec.exe " séquence d’impulsions en sélectionnant " charger " sous " séquence " et en cliquant sur " ouvert. " vérifier que les paramètres fondamentaux sont les valeurs correctes en cliquant sur " A " ou en sélectionnant " Acquisition " sous la " paramètres " menu.
- Select " Scripts " sous la " outils " menu ; une fenêtre pop up. Sélectionnez le " T1.ris " onglet et cliquez sur la flèche verte ; une fenêtre s’ouvrira. Sélectionnez le fichier de liste de retard avec des retards appropriés ou de créer la liste après avoir cliqué sur " ouvert. " une fois que la liste de retard est satisfaisante, cliquez " OK. "
NOTE : une fenêtre affiche une invite de commandes pour la création d’un fichier pour tous les spectres qui est rassemblée dans afin de calculer la valeur T 1. L’emplacement et le nom des dossiers et fichiers est jusqu'à l’utilisateur. - Cliquez sur " enregistrer " l’instrument devait commencer à acquérir les données et enregistrer automatiquement les fichiers pour les retards dans le dossier sélectionné.
Remarque : Le logiciel RIMNR créer les courbes de relaxation T 1 et calculer les temps de relaxation de T 1 pour chaque cas. Une fenêtre s’ouvrira avec la courbe de détente T 1 et la constante de temps ou la valeur de T 1 . Ici, la valeur de T1 pour cinacalcet HCl était de 2,4 s.
4. Mesure d’échantillons d’étalonnage avec API pur
- mesurant l’API samples pour construire la courbe d’étalonnage
- Place un échantillon de calibrage dans l’aimant pour une API particulière. Equilibrer les échantillons pendant au moins 5 min pour les plus petits tubes et 10 min pour les plus gros tubes.
- Acquérir une décroissance de l’induction libre (FID) ou expérience solide (90 x-90y FID) avec les paramètres appropriés, suivant les instructions dans le manuel de l’instrument. Dans le logiciel RINMR, chargez le " solid.exe " (ou " fid.exe ") séquence d’impulsions en sélectionnant " charger " sous " séquence " et en cliquant sur " ouvert. "
Remarque : l’expérience recommandée est solide pour matériaux solides qui sont rapide-détente avec court T 2 s (temps de relaxation transversal). Les paramètres expérimentaux recommandées sont recueillis, avec un temps de pause 0,1 µs, points de données 1 024, une impulsion de 90 degrés (7,05 µs dans ce cas, calibr 128 scansétabli à l’aide de téflon) et un temps mort de 10 µs pour la sonde de 26 mm 19 F. Un retard de recycler de 7,5 s pour médicaments avec le groupe 3 et 20 s pour médicaments avec le groupe F, attaché à un aromatique (due à plus longs temps de relaxation de T 1) ont été utilisés pour les cas présentés ici, basé sur leurs T 1 mesures. - Mesurer tous les échantillons préparés pour chaque API après que qu’ils soient équilibrés à la température de l’aimant pour 5-10 min pour générer les courbes d’étalonnage de chaque échantillon d’API. Enregistrer les données dans un dossier, en donnant un nom différent à chaque course expérimentale.
- Calculer le pourcentage en poids des échantillons basée sur la quantité dans chaque tube et compte tenu de la pureté de l’échantillon de l’API dans le plus grand tube.
5. Échantillons de mesure d’un médicament sous forme de comprimés
- Place les déjà préparé formulé les échantillons de produits pharmaceutiques (comprimés ou capsules) en l’aimant pour les mesurer un à la fois. Equilibrer l’échantillon pendant 5 min pour les petits tubes de NMR ou pendant 10 min pour les échantillons dans les plus grands tubes de NMR.
- Acquérir la même NMR expérience (c'est-à-dire, solide) avec les mêmes conditions que les échantillons calibrés pour chaque API particulière.
6. Génération de l’étalonnage courbes avec purs exemples de l’API et ajouter les données d’échantillons de produits pharmaceutiques sous forme de comprimés dans les courbes d’étalonnage
- dans ce cas, sélectionnez la région du solide expérience de 5 à 300 points pour créer les courbes d’étalonnage. Les données peuvent être analysées de trois façons différentes, comme nous l’expliquons.
- Ouvrir le logiciel de Calibration de RI. Rappeler toutes les données solides en cliquant sur le symbole de clip pour ouvrir le FID ou fichiers solides d’une API particulière. Pour tous les échantillons mesurés, entrez les coefficients de pondération en vertu de la “ Conc ” colonne et les poids sous le “ masse ” colonne. Sélectionner la région appropriée (5-300 points) à l’aide de la méthode de la moyenne pour construire la courbe d’étalonnage (Ouvrez l’icône de “ affichage RMN ” pour sélectionner la plage de points pour le calcul). Enregistrer la courbe d’étalonnage.
Remarque : La colonne Cal fournira le pourcentage de drogue dans les échantillons mesurés. - Dans le RI étalonnage du logiciel avec la même région sélectionnée (5-300 points), utilisez la méthode fit construire la courbe d’étalonnage. Enregistrer la courbe d’étalonnage. Suivez les mêmes instructions qu’à l’étape 4.2.2.
- Ouvrez le logiciel (p. ex., Mnova). Faites glisser toutes les données solides d’une API particulière et entrez les coefficients de pondération des échantillons témoins ; Manuel d’instructions peut être trouvé en cliquant “ Content ” sous le “ aide ” menu. Dans le “ avancé ” menu, sélectionnez “ Time Domain ”, puis “ quantification ; ” une fenêtre pop up. Cliquez sur le signe plus bleu pour sélectionner la zone d’intégration. Intégrer la région appropriée (5-300 points) en utilisant le mode de l’ampleur pour construire la courbe d’étalonnage.
- Enregistrer la courbe d’étalonnage. Dans le tableau, entrez les pourcentages de la drogue par exemple que pour les normes en vertu de la “ Concentration (x) ” colonne et les poids de tous les échantillons en vertu de le “ masse (m) ” colonne ; échantillons d’étalonnage doivent être en rouge (vérifié). S’assurer que le “ fonction de Signal ” est “ y = s/m ” (de normaliser à signal/masse).
- Pour mesurer la reproductibilité et la répétabilité, chaque échantillon 3 fois à des jours différents et construire la courbe d’étalonnage dans les deux paquets de logiciels. Enregistrer l’étalonnage courbe.
7. Calcul de la drogue fluorés API poids dans l’utilisation de produit des médicaments formulés les courbes d’étalonnage
- calcul de la quantité de dosage poids pourcentage et moyenne par comprimé ou capsule de fluorés API de drogue dans la drogue formulée produit méthode
- utiliser le fichier pour la courbe d’étalonnage du logiciel de Calibration de RI et la moyenne. Lire les données de la RMN la mesurée comprimés (ou capsules) et entrer leurs poids pour déterminer le pourcentage en poids de fluorés API formulés comprimés ou gélules à partir de la courbe d’étalonnage.
Remarque : La “ Cal ” colonne fournira le pourcentage de drogue dans les échantillons mesurés (étalonnage et comprimés commerciaux ou inconnues). Notez que le paramètre O1 doit être la même pour les échantillons d’étalonnage et les comprimés ou capsules pour le logiciel de Calibration de RI. - Utiliser le fichier pour la courbe d’étalonnage du logiciel d’étalonnage RI avec la méthode d’ajustement. Lire les données de la RMN des comprimés (ou capsules) mesuré et saisir leurs poids pour déterminer le pourcentage en poids de fluorés API formulés comprimés ou gélules à partir de la courbe d’étalonnage. Suivez les mêmes instructions comme au point 5.2.1. Notez que le paramètre de 1 O doit être la même pour les échantillons d’étalonnage et les comprimés ou capsules pour le logiciel de Calibration de RI.
- Utiliser le fichier Mnova et faites glisser les données acquises de la RMN pour l’API formulée (ou mesurer le même jour). Suivez les instructions à l’étape 4.2.4. Entrez les poids pour déterminer le pourcentage en poids de la fluorés API formulés comprimés ou gélules à partir de la courbe d’étalonnage.
Remarque : Dans le tableau, les échantillons d’étalonnage sera en rouge (vérifié) et les comprimés/capsules inconnues ou commerciales en bleu (non coché). La “ Concentration (x) ” colonne affiche les valeurs calculées pour les tablettes commerciales d’échantillons inconnus en bleu selon les valeurs des échantillons d’étalonnage en rouge. Avis que le logiciel ne nécessite pas l’utilisation du même paramètre O1 pour calculer le pourcentage en poids. - Calculer la quantité de médicaments fluorés par comprimé ou une gélule comme la valeur moyenne de l’équation suivante (D = dose d’API pour mg, W NMR = le pourcentage en poids des API obtenue par la courbe d’étalonnage, w = poids total de formulé le produit du poids de la drogue formulée provenant des mesurée comprimés ou capsules et N = nombre de comprimés formulés ou capsules utilisées pour la mesure) et comparer avec les valeurs calculées par le logiciel basé sur la courbes d’étalonnage :
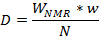
- utiliser le fichier pour la courbe d’étalonnage du logiciel de Calibration de RI et la moyenne. Lire les données de la RMN la mesurée comprimés (ou capsules) et entrer leurs poids pour déterminer le pourcentage en poids de fluorés API formulés comprimés ou gélules à partir de la courbe d’étalonnage.
Résultats
Nous avons testé le champ faible 19F TD-NMR avec trois médicaments commerciaux (cinacalcet, lansoprazole et ciprofloxacine) pour mesurer la teneur moyenne de drogue de médicaments fluorés. La figure 1 illustre les structures des médicaments testés, montrant les emplacements des atomes de fluor.
Nous avons testé plusieurs lots et formes posologiques (c'est-à-dire, 30, 60 e...
Discussion
Comme plus de médicaments fluorés sont désormais disponibles sur le marché, nous avons développé une méthodologie spécifique et simple pour mesurer la teneur moyenne de drogue de médicaments fluorés à l’aide de champ faible 19F TD-NMR5. Nous avons testé cette méthode sur les trois médicaments commerciaux : comprimés contenant cinacalcet HCl, lansoprazole en gélule et comprimés contenant du monohydrate de chlorhydrate de ciprofloxacine. Les avantages de cette méthode...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce manuscrit est basé sur un article déjà publié5. Tiré5, droit d’auteur à 2015, avec la permission de John Wiley & Sons.
Nous sommes reconnaissants à notre gestion, Dr. Janet Cheetham, Dr. Francisco Alvarez, Dr Arwinder Nagi et Dr David Semin, pour leur soutien, intérêt et des encouragements à réaliser ce projet de recherche et au Dr Minhui Ma et M. Robert Munger, qui nous avec Cinacalcet HCl, ses comprimés formulés et information sur le médicament. Nous voulons aussi remercier Dr Michael Bernstein, Dr Manuel Perez et Dr Santiago Dominguez pour leur soutien constructif et les discussions sur l’élaboration de la version actuellement commerciale du logiciel Mnova car elle s’applique à la quantification des données TD-RMN. En outre, un merci spécial à M. L. Regnar F.N.P. de Madarang pour nous avoir fourni cipro générique comprimés pour conduire nos études.
matériels
| Name | Company | Catalog Number | Comments |
| MQC-23 | Oxford Instruments | 52-AM4044 | 23.4 MHz for 1H and 22.0 MHz for 19F |
| 26 mm Probe (19F) | Oxford Instruments | 52-AM4061 | 19F NMR probe |
| Cinacalcet HCl | Amgen | Lot 005002 M | Purity 99.8% |
| Cinacalcet commercial tablets | Amgen | Lot 0010021308 | 30 mg tablets |
| Cinacalcet commercial tablets | Amgen | Lot D1026396 | 30 mg tablets |
| Cinacalcet commercial tablets | Amgen | Lot D118714 | 30 mg tablets |
| Cinacalcet commercial tablets | Amgen | Lot D061829 | 60 mg tablets |
| Cinacalcet commercial tablets | Amgen | Lot 00100213 | 90 mg tablets |
| Cinacalcet commercial tablets | Amgen | Lot D064074 | 90 mg tablets |
| Cinacalcet commercial tablets | Amgen | Lot 1026356 | 90 mg tablets |
| Lansoprazole | Fluka | Lot LRAA1897 | Purity 99.7% |
| Brand name Lansoprazole | Novartis | Lot DV1891 | 15 mg capsules |
| Lansoprazole generic | SUPERVALUE INC | Lot 2GE2027 | 15 mg capsules |
| Ciprofloxacin free base | Fluka | Lot BCBM7969V | 99.9% purity |
| Ciprofloxacin HCl monohydrate | Fluka | Lot P500044 | 94% purity as HCl salt |
| Cipro generic | Pack Pharmaceuticals | Lot PUB3033 | 500 mg tablets |
| 25 mm NMR tube | New Era Enterprises | NE-25TD-200-FB | |
| 18 mm NMR tube | New Era Enterprises | NE-18TD-200-FB | |
| 10 mm NMR tube | New Era Enterprises | NE-10TD-200-FB | |
| 5 mm NMR tube | New Era Enterprises | NE-HL5-7 | |
| 3 mm NMR tube | New Era Enterprises | NE-H3-7 | |
| 2.5 mm NMR tube | New Era Enterprises | NE-H5/2.5 |
Références
- El-Yazigi, A., Wahab, F. A., Afrane, B. Stability Study and Content Uniformity of Prochloroperazine in Pharmaceutical Preparations by Liquid Chromatography. J Chromatogr A. 690, 71-76 (1995).
- Takeuchi, Y., Yoshida, M., Ito, A., Sunada, H. Uniformity of Drug Content During Pharmaceutical Dry Granulation by Roller Compaction and Tableting Processes. J Drug Del Sci Tech. 19 (2), 119-124 (2009).
- Toro, I., Dulsat, J. F., Fábregas, J. L., Claramunt, J. Development and Validation of a Fully Automated method of the Chromatographic Determination of Content Uniformity of Drug Tablets. J Pharm Biomed Anal. 36, 57-63 (2004).
- Shi, Z., Hermiller, J. G., Gunter, T. Z., Zhang, X., Reed, D. E. A Novel Sample Selection Strategy by Near-Infrared Spectroscopy-Based High Throughput Tablet Tester for Content Uniformity in Early-Phae Pharmaceutical Product Development. J Pharm Sci. 101 (7), 2502-2511 (2012).
- Silva Elipe, M. V., et al. Applications of 19F Time-Domain NMR to Measure Content in Fluorine-Containing Drug Products. Magn Reson Chem. 54 (6), 531-538 (2015).
- Wang, J., et al. Fluorine in Pharmaceutical Industry: Fluorine-Containing Drugs Introduced to the Market in the Last Decade (2001-2011). Chem Rev. 114, 2432-2506 (2014).
- Dolbier, W. R. . Guide to Fluorine NMR for Organic Chemists. , (2009).
- Barman, J. A., Scott, L. J. Cinacalcet Hydrochloride. Drugs. 65 (2), 271-282 (2005).
- Horn, J. The Proton-Pump Inhibitors: Similarities and Differences. Clin Ther. 22 (3), 266-280 (2000).
- LeBel, M. Ciprofloxacin: Chemistry, Mechanism of Action, Resistance, Antimicrobial Spectrum, Pharmacokinetics, Clinical Trials, and Adverse Reactions. Pharmacotherapy. 8 (1), 3-30 (1988).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon