Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
À l’aide de l’imagerie rétinienne pour étudier la démence
Dans cet article
Résumé
La rétine des similitudes importantes avec le cerveau et représente donc une fenêtre unique pour étudier la vascularisation et la structure neuronale dans le cerveau non invasive. Ce protocole décrit une méthode pour étudier la démence à l’aide de techniques d’imagerie rétiniennes. Cette méthode peut potentiellement aider au diagnostic et évaluation des risques de démence.
Résumé
La rétine offre un « guichet » unique pour étudier les processus physiopathologiques de démence dans le cerveau, car c’est une extension du système nerveux central (CNS) et partage des similitudes avec le cerveau en ce qui concerne l’origine embryologique, caractéristiques anatomiques et propriétés physiologiques. La structure neuronale et vasculaire de la rétine peut maintenant être rétinienne facilement visualisée et non invasive utilisant techniques d’imagerie, y compris la photographie du fond de œil et la tomographie par cohérence optique (OCT) et quantifié semi-automatiquement programmes d’analyse assistée par ordinateur. Étudier les associations entre les modifications vasculaires et neurones dans la rétine et la démence puisse améliorer notre compréhension de la démence et potentiellement, l’aide au diagnostic et évaluation des risques. Ce protocole vise à décrire une méthode de quantification et analyse de la vascularisation rétinienne et structure neuronale, qui sont potentiellement associés à la démence. Ce protocole a également fournit des exemples de modifications rétiniennes chez les sujets atteints de démence et traite de questions techniques et les limites actuelles de l’imagerie rétinienne.
Introduction
En raison de l’augmentation de l’espérance de vie, démence est devenue un problème médical majeur, contribuant à sociale importante et santé économique charge globalement1,2,3,4,5. Aujourd'hui, une personne aux Etats-Unis développe la maladie d’Alzheimer (ma), la forme la plus courante de démence, chaque 66 s6. On estime que d’ici à 2050, 115 millions de personnes seront touchés par AD7.
La rétine offre un « guichet » unique pour étudier la démence due à ses propriétés anatomiques et physiologiques similaires avec le cerveau. En ce qui concerne le système vasculaire, la rétiniens artérioles et les veinules, mesurant 100 à 300 µm de diamètre, partagent des caractéristiques similaires avec des vaisseaux cérébraux petits, tels que les artérioles fin sans anastomoses, fonction de barrière et autorégulation8, 9. en termes de structure neuronale, les cellules ganglionnaires rétiniennes (CGR) ont des propriétés typiques avec les neurones dans le système nerveux central (CNS) 10. Les CGR sont connectés en bonne place avec le cerveau car ils forment les nerf optique et projet signaux visuels de la rétine pour le noyau géniculé latéral et le colliculus supérieur. Le nerf optique, similaire aux nombreuses fibres neuronales dans le SNC, est myélinisés par les oligodendrocytes et entourées en couches méningés. Notamment, une insulte pour le nerf optique peut entraîner dans des réponses similaires observées dans les autres axones CNS, comme rétrograde et la dégénérescence de l’axone, la formation de cicatrices, destruction de la myéline, dégénérescence secondaire et un niveau anormal de neurotrophiques antérograde facteurs et les neurotransmetteurs11,12,13,14. L’apparition de symptômes visuels chez certains patients AD peut aussi s’expliquer par les associations robustes entre la rétine et le cerveau15,16. En conséquence, il a été suggéré que la rétine peut refléter les processus pathologiques de démence dans le cerveau et l’imagerie rétinienne peut être utilisé pour étudier la démence.
Le système vasculaire rétinien et la structure neuronale peuvent maintenant être visualisées non invasive à l’aide de techniques d’imagerie rétiniennes. Par exemple, les photographies du fond d’oeil rétine peuvent être capturées à l’aide de caméras du fond de œil, et caractéristiques de la vascularisation rétinienne (par exemple, selon la dimension fractale, tortuosité et calibre de navire) peuvent ensuite être quantifiés en utilisant l’analyse assistée par ordinateur programmes. En outre, les paramètres de la structure neuronale rétinienne (tels que l’épaisseur de la couche plexiforme de cellule-inner ganglion [GC-IPL] et de la couche des fibres nerveuses rétiniennes [CFNR]) peuvent également être mesurées à l’aide de la tomographie en cohérence optique (OCT) et quantifiées à l’aide de la fonction intégrée algorithmes d’analyse.
Compte tenu de l’importance de l’imagerie rétinienne à l’étude de démence, ce protocole vise à décrire une méthode d’imagerie et d’analyse de système vasculaire rétinien et structure neuronale in vivo à l’aide de techniques d’imagerie rétiniennes. Ce protocole a également fournit des exemples de modifications rétiniennes chez les sujets atteints de démence et traite de questions techniques et les limites actuelles de l’imagerie rétinienne.
Protocole
toutes les méthodes décrites ici ont été approuvés par un Comité d’éthique de la recherche clinique locale à Hong Kong.
Remarque : pour plus de simplicité, les équipements énumérés dans la Table des matières sont utilisé pour illustrer les procédures d’imagerie rétinienne et l’analyse ultérieure. Mesure des paramètres vasculaires rétiniennes est illustrée à l’aide de l’évaluation du navire à Singapour I programme (SIVA) 17 (Version 4.0, National University of Singapore, Singapour). Toutefois, il convient de noter qu’un autre ensemble d’équipement pourra être adopté comme principes fondamentaux demeurent semblables.
1. préparer les sujets d’imagerie rétinienne
- dilater les sujets ’ élèves à l’aide d’un agent mydriatique. Attendez au moins 15 min établir la dilatation de la pupille suffisantes.
2. Mesurer les paramètres vasculaires rétiniennes de Fundus photographies utilisant un programme d’analyse assistée par ordinateur
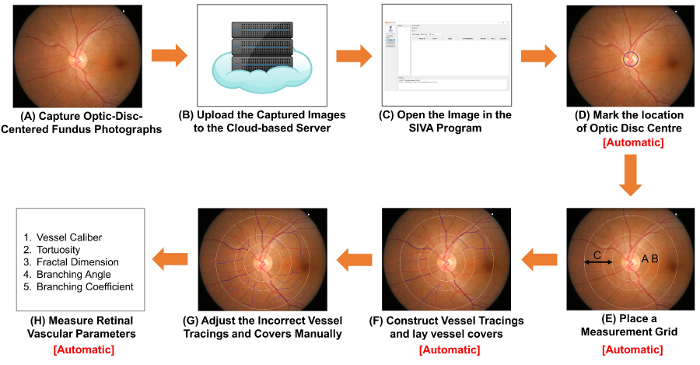
Figure 1 : Schéma montrant les procédures de mesure des paramètres vasculaires rétiniennes. Photos de fond d’oeil optic-disque-centré (A) obtenir à l’aide d’une caméra de fond d’oeil. figure 1 a et 2 a de la Figure sont deux photographies du fond de œil avec une qualité optimale. (B) télécharger les photographies du fond de œil sur le serveur basé sur un nuage et entrer dans le détail de l’étude pertinente, y compris le facteur de conversion de l’image (ICF). Autres programmes d’analyse assistée par ordinateur peuvent utiliser des méthodes non-nuage d’organiser et de stocker les images. (C) ouvrir la photographie du fond de œil dans le programme d’analyse assistée par ordinateur. (D) marque l’emplacement du centre du disque optique et (E) invite le logiciel automatiquement détecter le bord du disque optique et placer une grille de mesure. (F) construction tracés navire basé sur les chemins du navire et poser le navire couvre afin d’estimer le diamètre des vaisseaux. Adjust (G) les tracés de navire incorrect et navire couvre manuellement. (H) mesure un spectre des paramètres vasculaires rétiniennes, y compris les calibres de navire, tortuosité, dimension fractale et la bifurcation. Étape (D) à étapes (F) et (H) peut être réalisée automatiquement par des programmes d’analyse assistée par ordinateur. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Capturer des photographies du fond de œil à l’aide d’une caméra de fond d’oeil.
Programme
- tournant sur la caméra de fond d’oeil et le lancement de la capture d’image sur l’ordinateur. Reposer le menton du sujet correctement sur la mentonnière avec le front contre le bandeau. Déplacer le levier de commande pour aligner le faisceau correctement à la question ’ élève de s.
- Aligner les points d’éclairage jusqu'à ce que les deux apparaissent plus petits des deux côtés dans le viseur. Déplacer la cible de fixation externe pour guider le sujet ’ s les yeux jusqu'à ce que le disque optique est au centre du viseur et les régions d’intérêt (ROI) sont bien en deçà des limites. Réglez le bouton de mise au point de se concentrer sur la rétine.
- Ont le sujet fermement regarder la cible de la fixation externe et s’assurer que le sujet ’ s yeux n’est pas remplis de larmes.
- Appuyer sur le déclencheur pour capturer une image ( Figure 1 a).
- Vérifier la qualité de la photographie du fond de œil capturée, à l’aide de la Figure 2 a en tant que norme. Jeter l’image et répétez le processus d’acquisition image (c.-à-d. l’étape 2.1.1 à 2.1.4) si l’élève est mal dilatés ( Figure 2 b), le disque optique n’est pas au centre de l’image ( Figure 2), ou le l’image est floue ( Figure 2D).
- Enregistrer l’image au format TIFF avec résolution gradable (c'est-à-dire environ 3 000 pixels x 2,000 pixelsà, plus de 150 dpi).
Remarque : Le protocole peut être suspendu ici. - Répéter étapes 2.1.1 à 2.1.6 d’acquérir des photographies du fond de œil pour les autres sujets.
- Sélectionner un échantillon de 10 % des images au hasard et mesurer la hauteur des disques optiques dans ces images ( Figure 3). Calculer le facteur de conversion d’image (ICF) à l’aide de la formule :
ICF = 1 800 µm / (moyenne en hauteur en pixels des disques optiques des images échantillonnées). - Télécharger les photographies du fond de œil capturés sur le serveur basé sur un nuage et entrer dans les détails pertinents, y compris le facteur de conversion de l’image (ICF) ( Figure 1 b).
Remarque : Le protocole peut être suspendu ici. Autres programmes d’analyse assistée par ordinateur peuvent utiliser d’autres méthodes non-basée sur un nuage pour organiser les images et enregistrer le fichier ICF.
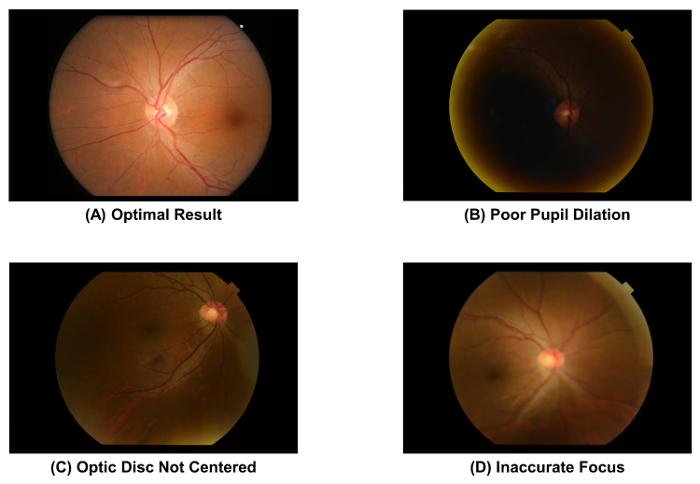
figure 2 : photographies du fond de œil avec une qualité optimale et sous-optimaux. La qualité de l’image d’une photographie du fond de œil doit être vérifiée immédiatement après l’acquisition d’images, comme la qualité de l’image affecte directement la mesure subséquente des paramètres vasculaires rétiniennes. L’image devrait être rejetée si l’un de ces objets est observé. Ces images ont été capturées à l’aide d’une caméra de fond d’oeil de 50°. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
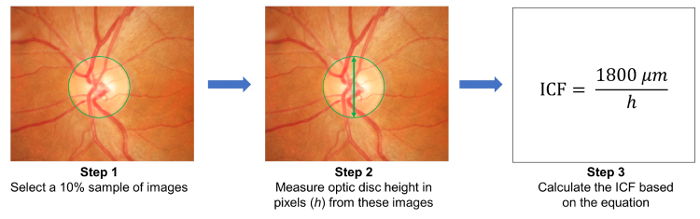
figure 3 : calculer le facteur de conversion de l’image (ICF). Pour calculer l’ICF, sélectionner au hasard un échantillon de 10 % d’images de l’étude (étape 1). Ensuite, mesurer la hauteur des disques optiques (en pixels) à partir des images échantillonnées (étape 2). Calculer le pare-feu de connexion Internet en utilisant la formule : ICF = 1800 µm / (hauteur en pixels des disques optiques des images échantillonnées en moyenne), où 1800 µm est approximativement la hauteur d’un disque optique normale (étape 3). Résolution image et de l’effet de grossissement sont différentes de la caméra à la caméra, il est nécessaire de calculer un CIF précis pour chaque caméra utilisée. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- ouvre la photographie du fond de œil dans un programme d’analyse assistée par ordinateur. Construire des tracés de navire et poser les housses de bateau pour la vascularisation rétinienne.
Remarque : Dans cette section, le programme de SIVA est utilisé pour illustrer les procédures. Toutefois, le programme de SIVA peut être remplacé par d’autres programmes disponibles analyse assistée par ordinateur. En outre, les étapes 2.2.2 à 2.2.3 sont exécutées automatiquement par une analyse assistée par ordinateur programmes lorsqu’une photographie du fond de œil est ouvrent (c'est-à-dire étape 2.2.1).- Ouvrir la photographie du fond de œil avec le programme d’analyse assistée par ordinateur ( Figure 1).
- Marquer l’emplacement du centre de disque optique ( Figure 1).
- Cliquez le “ OD Centre ” bouton sur le panneau de gauche fonction ; le curseur de la souris sera remplacé par un cercle vert.
- Déplacer le cercle vert au centre du disque optique (OD) et faites un clic gauche pour fixer le cercle.
- Invite le logiciel automatiquement placer une grille de mesure, construire la et sous-champs de navirenavire y couvre ( Figure 1E et 1F).
Remarque : Housses de bateau sont des lignes de mesure qui permettent d’estimer la largeur approximative des lumières du internes des vaisseaux.- Cliquez le “ trouver OD ” bouton pour inviter le logiciel pour détecter la jante OD et placez les quatre cercles concentriques dans une grille de mesure, basée sur la position du pôle OD.
- Cliquez sur le “ processus de ” le bouton pour lancer le processus de traçage automatique bateau.
- Tracés de navire incorrect de régler manuellement. Commencer l’inspection des 12 o ’ horloge de poste, de façon à s’assurer que tous les tracés du navire sont vérifiés dans le sens horaire.
- Vérifiez que le disque optique est correctement détecté et la grille de mesure est correctement placée. Ajuster la grille de mesure manuellement suivant étapes à 2.2.2 2.2.3, si le cercle intime décrivent pas avec précision la jante disque optique ( Figure 4 a). Clic gauche
- tracing(s) navire étiquetés avec le type de navire incorrect (artérioles et veinules) puis cliquez sur le “ ype de navire (T) ” le bouton pour changer le type de navire.
Remarque : Artérioles sont marqués en rouge et les veinules sont marqués en bleu. Artérioles se distingués les veinules basés sur leurs différences physiologiques. Par exemple, les veinules sont généralement de couleur plus foncée et plus large que les artérioles. Navires avec le même type de navire habituellement ne croisent pas l’autre.
Tracés - Extend navire incomplet suivant étapes 2.3.3.1 à 2.3.3.2 ( Figure 4 b).
- Utiliser le curseur de cliquer à l’extrémité distale de la vectorisation de navire incomplète. Faites un clic gauche à points le long du sentier de navire d’étendre le traçage de navire.
- Arrêter le processus de traçage lorsque l’extrémité distale du navire est atteint. Arrêter le traçage sur le cercle blanc ultrapériphérique si la partie distale du navire se situe en dehors de la grille de mesure (voir Figure 4 b).
- Ajuster les tracés du navire si les chemins du navire ne sont pas suivis correctement sur le site de crossover ( Figure 4).
- Cliquez le “ sélectionnez ” bouton et puis cliquez sur au point incorrect de la localisation du navire. Cliquez sur le “ Brea(k) Seg ” bouton pour déconnecter le traçage du navire au point sélectionné. Sélectionnez le segment déconnecté, puis cliquez sur le “ (Del) Seg ” bouton supprimer it.
- Re-construire un nouveau tracé de navire procédant 2.3.3.1 et 2.3.3.2.
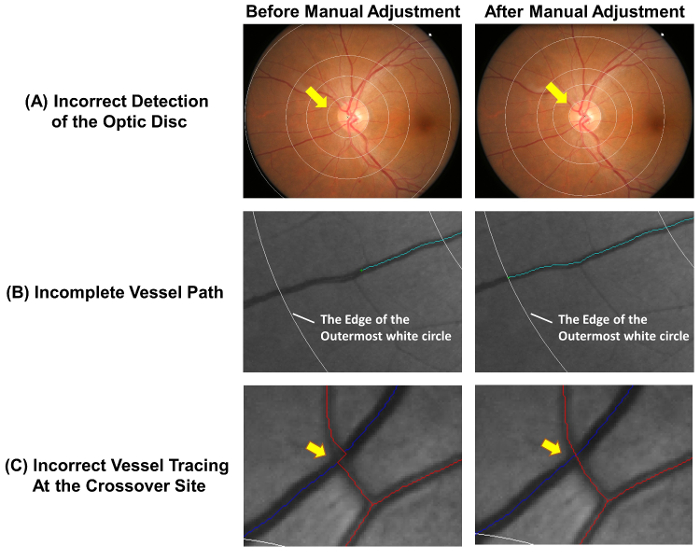
figure 4 : erreurs courantes de l’auto-traçage. Le traçage automatique bateau n’est pas tout à fait exact et ajustements manuels sont nécessaires pour assurer la précision de mesure. Cette figure montre les erreurs courantes de l’auto-traçage et démontre des résultats optimaux après ajustements manuels. (A), le centre du disque optique est incorrectement marqué et cela a conduit à l’écart de la grille de mesure, susceptible d’affecter les mesures ultérieures. Idéalement, le cercle intérieur de la grille de mesure devrait décrire la jante disque optique. Traçage de navire incomplète (B) pourrait conduire à des mesures erronées de dimension fractale, tortuosité, etc., que le chemin d’accès du navire doit être tracé jusqu'à la fin du navire. Si la partie distale du navire se situe en dehors de la grille de mesure, le traçage peut être arrêté sur le cercle blanc ultrapériphérique. (C) navire tracés sur les sites de liaison sont soumis à une tendance plue d’erreur et nécessitent donc une attention particulière. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- coucher housses de bateau sur tous les segments vasculaires et désactiver manuellement la fonction les couvertures incorrectes.
- Cliquez le “ trouver couvre ” bouton pour poser les housses de bateau sur tous les segments vasculaires automatiquement.
- Vérifier si toutes les couvertures de navire sont bien placées. Clic gauche et faites glisser le curseur pour désactiver le navire couvre si les couvertures ne sont pas posées perpendiculairement aux parois des vaisseaux ( Figure 5 a), le chemin d’accès du navire est masqué par un autre bateau ( Figure 5 b), ou le housses de surestimer ou sous-estimer la largeur de la lumière du vaisseau ( Figure 5).
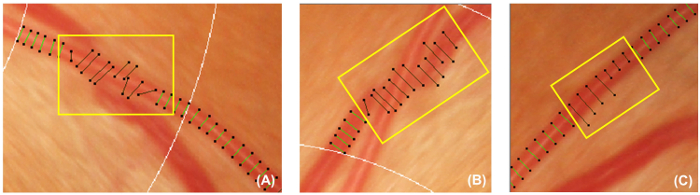
figure 5 : navire Incorrect couvre. Cette figure montre des exemples de couvertures de navire incorrect qui devraient être désactivés et exclus de la mesure. Housses de bateau doivent être désactivées si elles ne sont pas perpendiculaires aux navires (A). En outre, housses de bateau doivent également être désactivés si le bateau que vous souhaitez repérer est caché sous un autre vaisseau (B), ou les couvertures de navire ne peut pas représenter la largeur approximative du navire (C). s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- de mesurer des paramètres vasculaires rétiniennes les tracés de navire et les couvertures de navire
Remarque : étape 2.5 est effectué automatiquement par un programme d’analyse assistée par ordinateur.- Label le disque zone 0,5 à 1,0 diamètres loin de la marge de disque optique en zone B et les diamètres de disque zone 0,5 et 2,0 loin de la marge de disque optique comme zone C 18 ( Figure 6 a), conformément à la mis à jour le protocole du risque de l’athérosclérose dans les communautés (ARIC) étudier 19.
- Calibre vasculaire rétinienne de mesure à la fois zone B et zone C, en utilisant une méthode largement adoptée qui est modifiée par rapport à l’ARIC étudier 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 ( figure 6 b).
- Mesurer les longueurs de navire couvre dans les artérioles de plus grands six et les veinules plus six pour estimer les calibres des vaisseaux rétiniens.
- Résumer la rétine des artérioles et veinules calibres comme l’artère rétinienne centrale équivalent (CRAE) et la rétine centrale veine équivalent (CRVE) respectivement 17, à l’aide de la Knudtson révisé – formule Parr-Hubbard 18 , 19.
- identifier tous les navires dans la zone C avec un largeur > 40 µm. calculer la tortuosité des artérioles et veinules rétinienne de l’intégrale de la courbure totale au carré le long des tracés de navire et normaliser la valeur avec la longueur de l’arc total, s’inclinant et points d’inflexion 27 ,, 28.
- Calculer le total, des artérioles, et veinules fractal dimensions de la zone C, en utilisant l’établi “ méthode de boîte-compteur ” 29 , 30 , 31.
- Diviser l’image en une série de même tailles carrés.
- Compter le nombre de boîtes contenant un article des tracés de navire.
- Répéter le processus à l’aide d’une série de carrés de même tailles avec différentes tailles.
- Tracer le logarithme du nombre de boîtes contenant les tracés de navire contre le logarithme de la taille des cases et calculer la pente de la droite qui en résultent ; il s’agit de la dimension fractale.
- Navires s’identifient à la première bifurcation dans la zone C et calculer les angles (θ) sous-tendait un angle optique entre la première deux fille navires 32 ( Figure 6). Calculer la valeur moyenne pour obtenir l’angle moyen de ramification.
- Calculer le coefficient de ramification de la zone C en utilisant la formule :
(d 1 2 + d 2 2) /d 0 2, où d 0 est le calibre du tronc moyen et d 1 et d 2 sont les calibres de branche moyenne ( Figure 6).
- Fermer la fenêtre de classement. Cliquez sur “ envoyez ” dans la boîte de dialogue pop-up de télécharger l’image classé sur le serveur basé sur un nuage et d’enregistrer les paramètres vasculaires rétiniennes automatiquement mesurés.
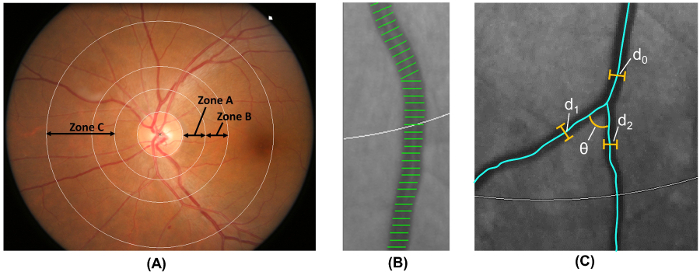
figure 6 : Quantification du système vasculaire rétinien. (A) Zone B (défini comme 0,5 à 1,0 diamètres loin de la marge de disque de disque) est utilisé pour mesurer les calibres de navire de la zone B selon le risque de l’athérosclérose dans l’étude des communautés. Zone C (défini comme 0,5 et 2,0 diamètres loin de la marge de disque de disque) est utilisé pour mesurer les calibres de navire de zone C et un éventail de paramètres de réseau vasculaire rétinienne (par exemple, tortuosité, dimension fractale et bifurcation). (B) housses de bateau sont des lignes de mesure utilisées pour estimer les calibres des vaisseaux rétiniens (ou diamètres). Housses de bateau incorrect exclure manuellement de la mesure. (C) pour tous les navires qui ont leur première bifurcation au sein de la zone C, le programme automatiquement les mesures des angles de ramification (θ) de la première bifurcation. En outre, le coefficient de ramification est également calculé selon la formule suivante : coefficient de branchement = (d 1 2 + d 2 2) /d 0 2, où d 0 est le calibre du tronc et d 1 et d 2 sont les calibres de branche. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
3. évaluer l’épaisseur du GC-IPL et CFNR
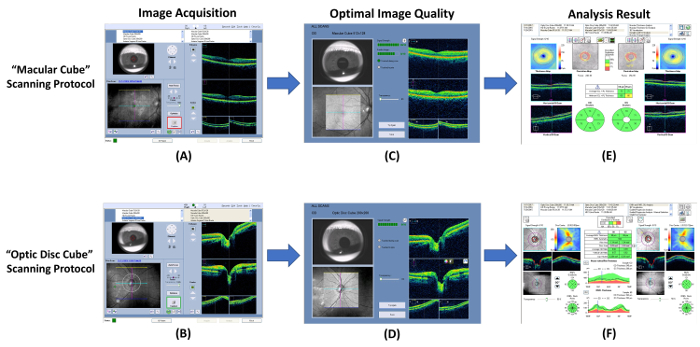
figure 7 : Schéma montrant les procédures de mesure épaisseur CFNR et GC-IPL. Tomographie par cohérence optique (OCT) peut être utilisé pour mesurer les épaisseurs de la couche plexiforme de la cellule-intérieur de ganglion (GC-IPL) et la couche des fibres nerveuses rétiniennes (CFNR). (A, B) Mesurer les épaisseurs de GC-IPL et CFNR à l’aide de la fonction intégrée “ maculaire cube ” et “ cube disque optique ” respectivement, des protocoles d’analyse. (C, D) Vérifier la qualité de l’image immédiatement après l’acquisition d’images. Jeter l’image et répétez l’analyse si le signal est inférieur à 6, ou artefacts de mouvement sont détectés. (E, F) Puis, invite le programme d’analyse intégré pour analyser le résultat du scan et générer un rapport d’interprétation automatiquement. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- Effectuez l’acquisition d’images à l’aide de la tomographie par cohérence optique (OCT).
- , Ouvrez le programme OCT et sélectionnez la “ maculaire Cube ” analyse de protocole pour démarrer un nouveau scan maculaire ( Figure 7 a).
- Localiser la pupille dans la fenêtre d’iris en ajustant la mentonnière. Baisser l’éclairage si la taille de la pupille est trop petite.
- Cliquez sur le “ Auto Focus ” bouton, puis le “ Optimize ” bouton pour améliorer la qualité de l’image.
- Charger l’objet clignote plusieurs fois immédiatement avant de commencer l’analyse.
- Cliquez le “ Capture ” bouton pour démarrer le scan quand la bordure entourant le bouton devient verte. Instruire le sujet à se concentrer sur la cible de fixation visuelle au cours de l’acquisition d’images pour éviter les artefacts de mouvement.
- Examiner la qualité de la numérisation à l’aide de la Figure 7 en tant que norme. Jeter le résultat d’analyse et de répéter l’analyse si le signal est plus petit que 6 ( Figure 8 a), ou artefacts de mouvement sont détectés (indiqué par la discontinuité des vaisseaux sanguins) ( Figure 8 b).
- Enregistrer le résultat de l’analyse.
- Répéter étapes 3.1.1 à 3.1.7 pour un autre oeil.
- Effectue une recherche tête du nerf optique avec le “ optique disque Cube ” balayage suivant protocole étapes 3.1.2 à 3.1.9 ( Figures 7 b et 7 D).

figure 8 : résultats sous-optimaux de tomographie par cohérence optique. Résultats sous-optimaux communs de la tomographie à cohérence optique (OCT) incluent la puissance du signal faible (A) (valeur de la puissance < 6) et des artefacts de mouvement (B). La qualité de la numérisation devrait être examinée immédiatement après l’acquisition d’images et l’analyse doit être répété si ces objets sont rencontrées. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
- génèrent une impression d’analyse de l’épaisseur de GC-IPL maculaire.
- Sélectionner la “ maculaire Cube ” analyser les dossiers des deux yeux dans l’interface d’analyse.
- Cliquez le “ Ganglion Cell OU analyse ” pour lancer l’algorithme d’analyse automatique afin d’évaluer l’épaisseur de la GC-IPL de la numérisation ( Figure 7E).
Remarque : Étape 3.2.2 est automatiquement établie par l’algorithme d’analyse.- Génèrent une 14,13 mm 2 axés sur la fovéa elliptique annulus qui a les rayons intérieurs et extérieurs horizontaux de 0,6 mm et 2,4 mm, respectivement et les rayons intérieurs et extérieurs verticaux de 0,5 et 2,0 mm, respectivement.
Remarque : La taille et la forme de l’anneau elliptique conforment étroitement à l’anatomie maculaire et correspondent donc à la zone où les CGR sont plus épaisses dans les yeux normaux 33 ,, 34. La zone au sein de l’anneau intérieur de l’espace annulaire n’est pas mesurée, comme le GC-IPL dans ce domaine est très mince. - Segment de la frontière extérieure de la CFNR et la limite extérieure de la couche plexiforme interne (IPL) pour localiser le GC-IPL ( Figure 9).
- Mesurer la moyenne, minimale et six sectorielles (supérieure, superotemporal, superonasal, inferonasal, temporal inférieur,) épaisseurs de GC-IPL maculaire dans la fovéa-cenenregistré anneau elliptique.
- Comparer les épaisseurs mesurées de GC-IPL au dispositif ’ s interne normative appariés selon l’âge des bases de données et générer une carte de la déviation et une carte d’importance
- Rapport sur les résultats de mesure sur un imprimé analyse.
- Génèrent une 14,13 mm 2 axés sur la fovéa elliptique annulus qui a les rayons intérieurs et extérieurs horizontaux de 0,6 mm et 2,4 mm, respectivement et les rayons intérieurs et extérieurs verticaux de 0,5 et 2,0 mm, respectivement.
- Enregistrer l’imprimé de l’analyse au format .pdf.
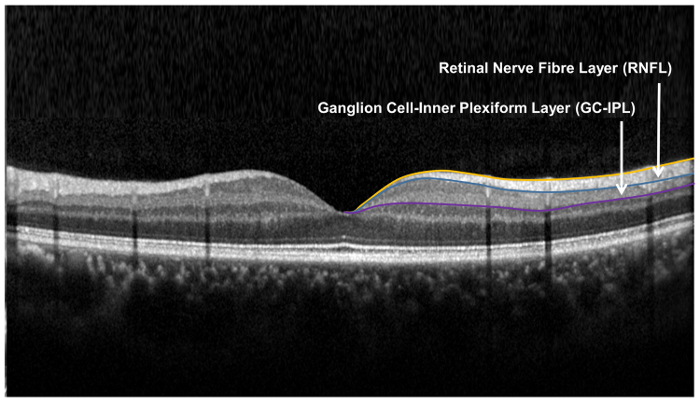
figure 9 : couches rétiniennes utilisées pour la évaluation de la structure neuronale rétinienne. La couche des fibres nerveuses rétiniennes (CFNR) est mesurée à l’aide de l’algorithme (ONH) tête de nerf optique, tandis que la couche plexiforme de ganglion cell-interne est mesurée à l’aide de l’algorithme d’analyse (GCA) de cellules ganglionnaires. L’algorithme ONH des segments de la frontière intérieure et extérieure de la CFNR pour mesurer l’épaisseur de la CFNR. L’algorithme de GCA détecte la frontière extérieure de la couche des fibres nerveuses rétiniennes (CFNR) et la couche plexiforme interne (IPL) pour obtenir l’épaisseur combinée de la couche des cellules ganglionnaires (GCL) et l’IPL. Les épaisseurs de GCL et l’IPL sont mesurées ensemble, comme la limite entre GCL et IPL est anatomiquement indistincte. Cependant, l’épaisseur combinée de GCL et IPL (c.-à-d. GC-IPL) est toujours révélateur de la santé des CGR. s’il vous plaît cliquez ici pour visionner une version agrandie de cette Figure.
- générer l’imprimé de l’analyse de l’épaisseur de la CFNR ( Figure 7F).
- Sélectionnez le “ optique disque Cube ” analyser les dossiers des deux yeux dans l’interface d’analyse.
- Cliquez le “ ONH et CFNR OU analyse ” pour lancer l’algorithme d’analyse automatique afin d’évaluer l’épaisseur de la CFNR de la numérisation.
Remarque : 3.3.2.1 à 3.3.2.6 des mesures peuvent être complétées automatiquement par l’algorithme d’analyse.- Mesurer l’épaisseur de la CFNR à chaque point d’analyse et de générer une carte d’épaisseur CFNR.
- Identification du disque optique en détectant une tache sombre près du centre de l’analyse qui a une taille et une forme compatible avec la gamme d’un disque optique
- Placer une grille de mesure de 3,46 mm de diamètre autour du disque optique sur le plan d’épaisseur CFNR.
- Mesure et calculer les mondiaux, quatre-quadrants (temporelles, supérieurs, nasales et inférieurs) et des épaisseurs de CFNR parapapillary horloge-douze heures de la grille de mesure.
- Comparer les épaisseurs mesurées de CFNR au dispositif ’ s interne normative appariés selon l’âge des bases de données et générer une carte de la déviation et une carte d’importance.
- Rapport sur les résultats de mesure sur un imprimé analyse.
- Enregistrer l’imprimé de l’analyse au format .pdf.
Résultats
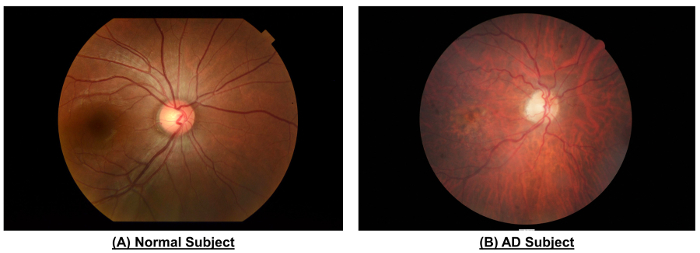
Figure 10 : Un exemple pour montrer les différences dans le système vasculaire rétinien entre un sujet normal et un sujet AD. Par rapport à ce qui est normal, photographie du fond de œil du sujet AD a montré des calibres de navire plus étroits (CRAE de Zone B, 116,4 µm vs 156,4 µm ; CRVE de la Zone B, 186,9 µm contre 207,5 µm?...
Discussion
Ce protocole décrit les procédures de quantification des modifications neuronales et vasculaires dans la rétine en vivo. Comme la rétine partage semblables origines embryologiques, anatomiques caractéristiques et propriétés physiologiques avec le cerveau, ces modifications rétiniennes peuvent refléter des changements similaires de vascularisation et de la structure neuronale dans le cerveau.
Comme le montre la Figure 10 et tableau 1
Déclarations de divulgation
Nous tenons à exprimer notre reconnaissance à l’école d’informatique, Université nationale de Singapour pour le support technique.
Remerciements
Au sujet d’éventuels liens financiers, l’auteur Tien Y. Wong est le co-inventeur du programme Singapore I navire évaluation (SIVA) utilisé dans cet article.
matériels
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
Références
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon