È necessario avere un abbonamento a JoVE per visualizzare questo. Accedi o inizia la tua prova gratuita.
Method Article
Usando la formazione immagine retinica per studiare la demenza
In questo articolo
Riepilogo
La retina condivide importanti somiglianze con il cervello e rappresenta quindi una finestra unica per studiare il sistema vascolare e struttura di un neurone nel cervello non invadente. Questo protocollo descrive un metodo per studiare demenza usando tecniche di imaging retinici. Questo metodo può potenzialmente aiutare nella diagnosi e valutazione del rischio di demenza.
Abstract
La retina offre una straordinaria "vetrina" per studiare processi patofisiologici di demenza nel cervello, in quanto è un'estensione del sistema nervoso centrale (SNC) e condivide con il cervello in termini di origine embriologica, caratteristiche anatomiche importanti somiglianze e Proprietà fisiologiche. La struttura vascolare e neuronale nella retina può ora essere retinico facilmente visualizzato e non invadente usando tecniche di formazione immagine, compreso fotographia e tomografia a coerenza ottica (OCT) e quantificati da semi-automaticamente programmi di analisi assistita da computer. Studiare le associazioni fra i cambiamenti vascolari e neuronali nella retina e demenza potrebbe migliorare la nostra comprensione della demenza e, potenzialmente, aiutare nella diagnosi e valutazione del rischio. Questo protocollo mira a descrivere un metodo di quantificazione e l'analisi di sistema vascolare retinico e struttura di un neurone, che sono potenzialmente associati a demenza. Questo protocollo anche vengono forniti esempi dei cambiamenti retinici in soggetti con demenza e discute questioni tecniche ed attuali limiti dell'imaging retinico.
Introduzione
Per effetto dei rincari dell'aspettativa di vita, demenza è diventato un grave problema medico, contribuendo alla significativa sociale e salute economica a livello globale grava1,2,3,4,5. Oggi, una persona negli Stati Uniti si sviluppa il morbo di Alzheimer (annuncio), la forma più comune di demenza, ogni 66 s6. È stato stimato che entro il 2050, 115 milioni di persone ne risentiranno di AD7.
La retina offre una straordinaria "vetrina" per studiare demenza dovuto le relative proprietà anatomiche e fisiologiche simili con il cervello. In termini di sistema vascolare, retiniche arteriole e venule, misura 100-300 µm di diametro, condividono caratteristiche simili con piccoli vasi cerebrali, come arteriole fine senza anastomosi, funzione di barriera e di auto-regolazione8, 9. in termini di struttura di un neurone, le cellule gangliari della retina (RGCs) condividono proprietà tipiche con neuroni nel sistema nervoso centrale (SNC) 10. Il RGCs prominente sono collegati con il cervello come formano i nervo ottico e progetto segnali visivi dalla retina per i nuclei genicolati laterali e il collicolo superiore. Il nervo ottico, simile a molte fibre neuronali nel SNC, è myelinated di oligodendrociti ed è ensheathed in strati meningei. In particolare, può risultare un insulto al nervo ottico in simili risposte osservate in altri assoni CNS, come retrograda e anterograda degenerazione dell'assone, formazione della cicatrice, distruzione della mielina, degenerazione secondaria e un livello anormale di neurotrophic fattori e neurotrasmettitori11,12,13,14. La comparsa di sintomi visivi in alcuni pazienti dell'annuncio può essere spiegata anche dalle associazioni robuste tra la retina e il cervello15,16. Di conseguenza, è stato suggerito che la retina può riflettere i processi patologici di demenza nel cervello e imaging retinico può essere usato per studiare la demenza.
Il vasculature retinico e la struttura di un neurone possono essere visualizzati in questo momento non invadente usando tecniche di imaging retinici. Per esempio, le fotografie del fondo retinico possono essere catturate utilizzando macchine fotografiche del fondo, e caratteristiche del vasculature retinico (ad es., la nave calibro, tortuosità e fractal dimensione) quindi possono essere quantificate utilizzando analisi assistita da computer programmi. Inoltre, i parametri della struttura neuronale retinica (ad esempio lo spessore di strato plessiforme interno cella di ganglio [GC-IPL] e strato delle fibre nervose retiniche [RNFL]) possono anche essere misurati utilizzando la tomografia a coerenza ottica (OCT) e quantificato utilizzando il built-in algoritmi di analisi.
Data l'importanza dell'imaging retinico nello studio di demenza, questo protocollo si propone di descrivere un metodo di imaging e l'analisi di sistema vascolare retinico e struttura neuronale in vivo usando tecniche di imaging retinici. Questo protocollo anche vengono forniti esempi dei cambiamenti retinici in soggetti con demenza e discute questioni tecniche ed attuali limiti dell'imaging retinico.
Protocollo
tutti i metodi descritti qui sono stati approvati da un comitato etico di ricerca clinica locale in Hong Kong.
Nota: per semplicità, l'equipaggiamento elencato nella Tabella materiali viene utilizzato per illustrare le procedure di formazione immagine retinica e la successiva analisi. Misurazione di parametri vascolari retinici è illustrato utilizzando il programma (SIVA) di Singapore I Vessel, valutazione 17 (versione 4.0, National University of Singapore, Singapore). Tuttavia, dovrebbe essere notato che un diverso insieme di apparecchiature può essere adottato come i principi sottostanti rimangono simili.
1. preparare i soggetti per Imaging retinico
- dilatare i soggetti ’ alunni utilizzando un agente mydriatic. Aspettare almeno 15 minuti stabilire sufficiente dilatazione della pupilla.
2. Misurare i parametri vascolari retiniche da Fundus fotografie utilizzando un programma di analisi Computer-assistita
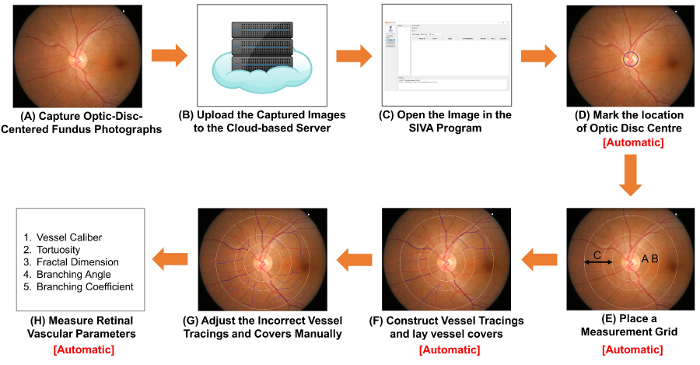
Figura 1: Diagramma schematico che mostra la procedure di misurazione dei parametri vascolari retinici. (A) ottenere fotografie di ottica-disco-centrato del fondo utilizzando una macchina fotografica del fondo. Figura 1A e 2A figura sono due fotografie del fondo con una qualità ottimale. (B) caricare le fotografie del fondo sul server basato su cloud e immettere i dettagli di studio pertinenti, tra cui il fattore di conversione di immagine (ICF). Altri programmi di analisi computerizzata possono utilizzare metodi non basati su cloud per organizzare e archiviare le immagini. (C) Apri la fotografia del fondo nel programma di analisi assistita da computer. Mark (D) la posizione del centro del disco ottico e (E) richiedere il software automaticamente rilevare il bordo del disco ottico e posizionare una griglia di misurazione. (F) costrutto ricalchi la nave base ai percorsi di nave e laici nave copre per stimare i diametri dei vasi. (G) regola i tracciati non corretto nave e nave copre manualmente. (H) misura un spettro di parametri vascolari retinici, tra cui nave calibri, tortuosità, dimensione frattale e biforcazione. Passaggio (D) al punto (F) e passo (H) può essere eseguita automaticamente da alcuni programmi di analisi assistita da computer. Clicca qui per visualizzare una versione più grande di questa figura.
- Catturare fotografie del fondo utilizzando una macchina fotografica del fondo.
Programma
- Disabilita sulla macchina fotografica del fondo e il lancio la cattura delle immagini sul computer. Appoggiare il mento del soggetto correttamente su chinrest con la fronte contro il nastro per la testa. Spostare la leva di comando per allineare il fascio di luce correttamente al soggetto ’ allievo di s.
- L'allineamento dei punti di illuminazione fino a quando entrambi appaiono più piccoli su entrambi i lati nel mirino. Spostare l'obiettivo di fissazione esterna per guidare il soggetto ’ s occhi fino a quando il disco ottico è al centro del mirino e le regioni di interesse (ROI) sono ben all'interno dei confini. Regolare la manopola di messa a fuoco a fuoco sulla retina.
- Avere il soggetto saldamente guardare l'obiettivo di fissazione esterna e garantire il soggetto ’ gli occhi non sono pieni di lacrime.
- Premere il pulsante di scatto per catturare un'immagine ( Figura 1A).
- Verifica la qualità della fotografia del fondo catturata, usando Figura 2A come standard. Eliminare l'immagine e ripetere il processo di acquisizione di immagine (cioè, passo 2.1.1-2.1.4) se la pupilla è scarsamente dilatate ( Figura 2B), il disco ottico non è al centro dell'immagine ( Figura 2), o il immagine è fuori fuoco ( Figura 2D).
- Salvare l'immagine in formato TIFF con risoluzione Sfumabilità (vale a dire, circa 3.000 pixel x 2,000 pixel, a più di 150 dpi).
Nota: Il protocollo può essere messo in pausa qui. - Ripetere i punti 2.1.1 a 2.1.6 per acquisire fotografie del fondo per altri soggetti.
- Selezionare un campione di 10% delle immagini in modo casuale e misurare l'altezza dei dischi ottici in queste immagini ( Figura 3). Calcolare il fattore di conversione di immagine (ICF) utilizzando la formula:
ICF = 1.800 µm / (media altezza in pixel di dischi ottici delle immagini campionate). - Caricare le fotografie del fondo acquisito sul server basato su cloud e immettere i dettagli di studio pertinenti, tra cui il fattore di conversione di immagine (ICF) ( Figura 1B).
Nota: Il protocollo può essere messo in pausa qui. Altri programmi di analisi computerizzata possono utilizzare altri metodi non basati su cloud per organizzare le immagini e registrare l'ICF.
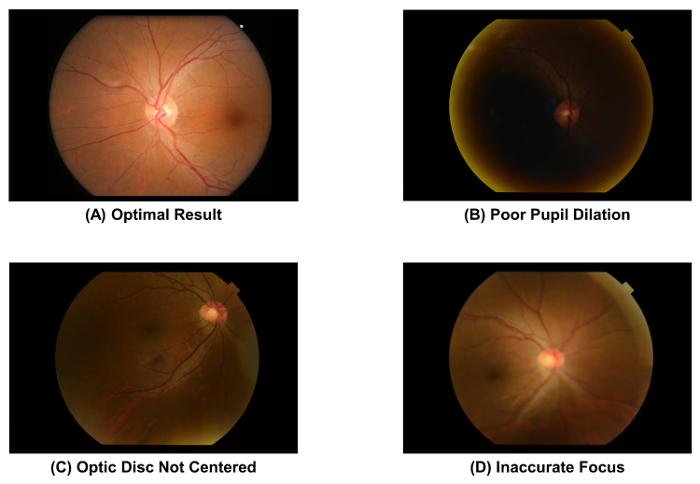
Figura 2: le fotografie del fondo con una qualità ottimale e suboptimale. La qualità dell'immagine di una fotografia del fondo dovrà essere controllata immediatamente dopo acquisizione immagine, la qualità dell'immagine colpisce direttamente la successiva valutazione di parametri vascolari retiniche. L'immagine deve essere eliminata se uno di questi manufatti è osservato. Queste immagini sono state catturate utilizzando una macchina fotografica del fondo di 50°. Clicca qui per visualizzare una versione più grande di questa figura.
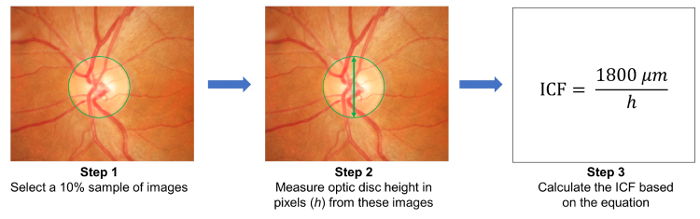
Figura 3: calcolo del fattore di conversione immagine (ICF). Per calcolare l'ICF, selezionare in modo casuale un campione di 10% delle immagini dallo studio (passaggio 1). Quindi, misurare l'altezza di dischi ottici (in pixel) dalle immagini campionate (passaggio 2). Calcolare l'ICF utilizzando la formula: ICF = 1800 µm / (altezza in pixel di dischi ottici delle immagini campionate in media), dove 1800 µm è circa l'altezza di un normale disco ottico (passaggio 3). Come risoluzione di immagine e di effetto di ingrandimento differiscono da una telecamera a altra, è necessario calcolare un accurato ICF per ogni fotocamera utilizzata. Clicca qui per visualizzare una versione più grande di questa figura.
- aprire la fotografia del fondo in un programma di analisi assistita da computer. Costruire i tracciati di nave e laici nave copertine per sistema vascolare retinico.
Nota: In questa sezione, il programma di SIVA è utilizzato per illustrare le procedure. Tuttavia, il programma di SIVA può essere sostituito da altri programmi di analisi assistita da computer disponibile. Inoltre, passaggi 2.2.2-2.2.3 vengono automaticamente eseguiti da alcune analisi assistita da computer programmi quando una fotografia del fondo è aperto (cioè punto 2.2.1).- Aprire la fotografia del fondo con il programma di analisi assistita da computer ( Figura 1).
- Segnare la posizione del centro del disco ottico ( Figura 1).
- Scegliere la “ centro OD ” pulsante sul pannello di sinistra funzione; il cursore del mouse verrà sostituito da un cerchio verde.
- Spostare il cerchio verde al centro della papilla ottica (OD) e sinistro del mouse per fissare il cerchio.
- Richiedere il software automaticamente posizionare una griglia di misurazione, costruire la e tracciamenti di navela nave y copre ( Figura 1E e 1F).
Nota: La nave coperture sono linee di misura che stimano la larghezza approssimativa dei lumen interni dei vasi.- Scegliere la “ trovare OD ” pulsante per richiedere il software per rilevare il bordo di OD e inserire quattro cerchi concentrici in una griglia di misurazione, basata sulla posizione del centro OD.
- Scegliere la “ processo ” pulsante per avviare il processo di tracciatura automatica nave.
- Tracciati di nave non corretto di regolare manualmente. Iniziare l'ispezione dal 12 o ’ posizione in senso orario per garantire che siano verificati tutti i tracciati di nave.
- Controllare che il disco ottico è accuratamente rilevato e la griglia di misurazione è posizionata correttamente. Regolare la griglia di misurazione manualmente come segue 2.2.2 a 2.2.3, se il cerchio più interno non vengono descritti con precisione il bordo del disco ottico ( Figura 4A).
- Click sinistro per selezionare la nave tracing(s) etichettato con il tipo di imbarcazione non corretto (arteriole e venule) e scegliere la “ nave (T) IPO ” pulsante per cambiare il tipo di imbarcazione.
Nota: Arteriole sono etichettati in rosso e venule sono etichettate in blu. Arteriole possono distinguere dalle venule basate sulle loro differenze fisiologiche. Ad esempio, venule sono generalmente di colore più scuro e più ampio di arteriole. Vasi con lo stesso tipo di nave solitamente non incrociano. - Estendi i tracciati nave incompleta come segue 2.3.3.1 per 2.3.3.2 ( Figura 4B).
- Usate il cursore, fare clic su all'estremità distale del ricalco nave incompleta. Click sinistro in punti lungo il percorso della nave per estendere il tracciato di nave.
- Interrompere il processo di analisi quando viene raggiunta la fine distale del vaso. Interrompere la traccia al cerchio più esterno bianco se la parte distale della nave cade all'esterno della griglia di misurazione (Vedi Figura 4B).
- Regolare i tracciati nave se i percorsi di nave non sono tracciati correttamente al sito crossover ( Figura 4).
- Clic la “ selezionare ” pulsante e quindi fare clic su nel punto errato del ricalco nave. Fare clic il “ Brea(k) Seg ” pulsante per disconnettere il tracciamento di nave al punto selezionato. Selezionare il segmento disconnesso e fare clic sul “ (Del) Seg ” pulsante per cancellare it.
- Ri-costruire una nuova traccia di nave tramite passaggi 2.3.3.1 e 2.3.3.2.
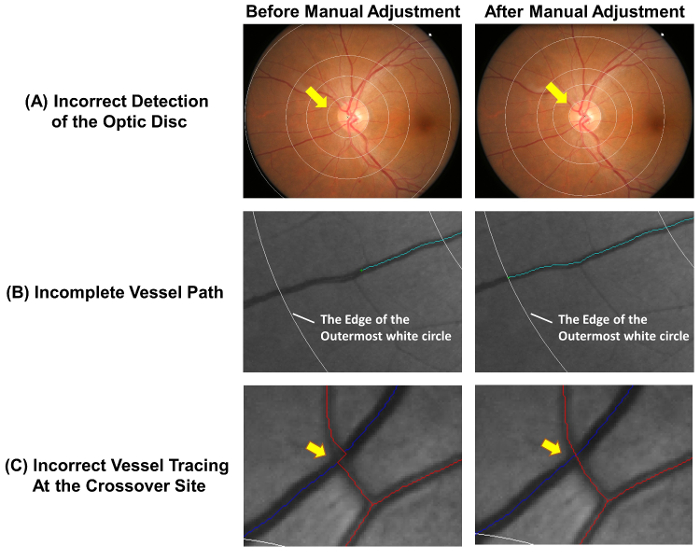
Figura 4: l'auto-analisi di errori comuni. Il tracciamento automatico nave non è completamente accurato e regolazioni manuali sono tenute a garantire l'accuratezza della misura. Questa figura mostra la traccia automatica di errori comuni e dimostra risultati ottimali dopo regolazioni manuali. (A), il centro del disco ottico è contrassegnato in modo non corretto e ciò ha portato alla deviazione della griglia di misurazione, che può riguardare le misure successive. Idealmente, il cerchio più interno della griglia di misurazione dovrebbe delineare il bordo del disco ottico. (B) l'analisi di nave incompleta potrebbe portare alla misura errata della dimensione frattale, tortuosità, ecc che dovrebbe essere tracciato il percorso della nave fino alla fine della nave. Se la parte distale della nave cade all'esterno della griglia di misurazione, l'analisi può essere interrotta in bianco cerchio più esterno. (C) la nave tracciamenti presso i siti di crossover sono soggetti a una maggiore tendenza di errore e quindi richiedono particolare attenzione. Clicca qui per visualizzare una versione più grande di questa figura.
- laici nave copre tutti i segmenti vascolari e disattivare manualmente le copertine non corrette.
- Scegliere la “ trovare copre ” pulsante per disporre automaticamente nave copertine su tutti i segmenti vascolari.
- Verifica se tutte le nave coperture siano posizionate correttamente. Tasto sinistro del mouse e trascinare il cursore per disattivare la nave copre se le coperture non sono esposte perpendicolare alle pareti del vaso ( Figura 5A), il percorso della nave è oscurato da un'altra nave ( figura 5B), o il copertine sopravvalutare o sottovalutare la larghezza del lume del vaso ( Figura 5).
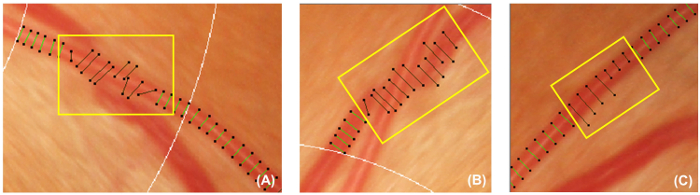
Figura 5: vaso errato copre. Questa figura mostra esempi di copertine di nave non corretto che dovrebbero essere disattivati ed esclusa dalla misurazione successiva. Copre la nave devono essere disattivati se non sono perpendicolari ai vasi (A). Inoltre, copre la nave devono essere disattivati anche se la nave tracciata è nascosto sotto un altro vaso (B), o le coperture di nave non possono rappresentare la larghezza approssimativa della nave (C). Clicca qui per visualizzare una versione più grande di questa figura.
- misurare i parametri vascolari retinici dai tracciati di nave e le copertine di nave
Nota: passo 2.5 viene eseguita automaticamente da un programma computerizzato di analisi.- Etichetta disco zona 0.5-1.0 diametri dal margine del disco ottico come zona B e i diametri del disco zona 0.5-2.0 dal margine del disco ottico come zona C 18 ( Figura 6A), secondo la protocollo modificato di rischio di aterosclerosi nelle comunità (ARIC) studiare 19.
- Calibro vascolare retinico di misura dalla zona B e zona C, usando un metodo ampiamente adottato che è stato modificato dal ARIC studiare 19 , 20 , 21 , 22 , 23 , 24 , 25 , 26 ( Figura 6B).
- Misurare la lunghezza dei coperchi di vaso in sei più grande arteriole e le venule più grande sei per stimare calibri vaso retinico.
- Riassumere arteriolare retinico e delle venule calibri come arteria retinica centrale equivalente (CRAE) e retinica centrale della vena equivalente (CRVE) rispettivamente 17, utilizzando la riveduta Knudtson – formula Parr-Hubbard 18 , 19.
- identificare tutte le navi nella zona C con un larghezza > 40 µm. calcolare la tortuosità arteriolare e delle venule retiniche dall'integrale della curvatura totale quadrata lungo i tracciati di nave e normalizzare il valore con la lunghezza totale dell'arco, inchinandosi e punti di inflessione 27 , 28.
- Calcolare il totale, arteriolare, e delle venule frattale dimensioni dalla zona C, utilizzando la consolidata “ metodo di misura delle celle ” 29 , 30 , 31.
- Dividere l'immagine in una serie di altrettanto dimensioni piazze.
- Contare il numero di scatole che contengono una sezione dei tracciati nave.
- Ripetere il processo utilizzando una serie di piazze dimensioni ugualmente con differenti formati.
- Plot il logaritmo del numero di scatole contenenti i tracciati di nave contro il logaritmo della dimensione delle caselle e calcolare la pendenza della linea risultante; questa è la dimensione frattale.
- Identificare vasi con prima biforcazione nella zona C e calcolare gli angoli (θ) sottesi tra la prima due figlia navi 32 ( Figura 6). Calcolare il valore medio per ottenere l'angolo di ramificazione media.
- Calcolare il coefficiente di ramificazione da zona C utilizzando la formula:
(d 1 2 + d 2 2) /d 0 2, dove d 0 è il calibro medio tronco e d 1 e d 2 sono i calibri medi ramo ( Figura 6).
- Chiudere la finestra di classificazione. Fare clic su “ inviare ” nella finestra di dialogo pop-up per caricare l'immagine graduata al server basato su cloud e registrare i parametri vascolari retinici automaticamente misurati.
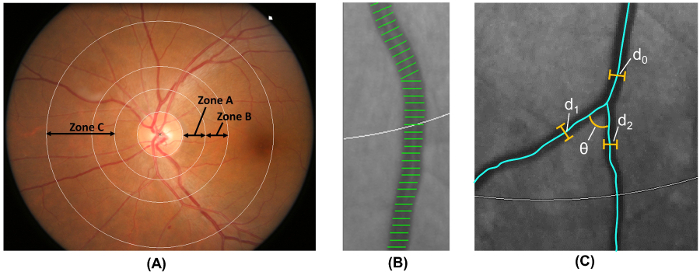
Figura 6: quantificazione del sistema vascolare retinico. (A) zona B (definito come 0.5-1.0 disco diametri allontanandole dal margine del disco) è utilizzato per misurare i calibri di nave della zona B secondo il rischio di aterosclerosi nello studio delle Comunità. Zona C (definito come 0.5-2.0 diametri allontanandole dal margine del disco a disco) viene utilizzato per misurare i calibri di nave di zona C e uno spettro di parametri di rete vascolare retinica (quali la tortuosità, dimensione frattale e biforcazione). (B) nave copertine sono linee di misura utilizzate per stimare i calibri vaso retinico (o diametri). Copertine di nave non corretto dovrebbero escludersi manualmente dalla misurazione. (C) per tutte le navi che hanno la loro prima biforcazione all'interno zona C, il programma automaticamente misura gli angoli di ramificazioni (θ) della prima biforcazione. Inoltre, il coefficiente di ramificazione è anche calcolato utilizzando la formula: coefficiente di ramificazione = (d 1 2 + d 2 2) /d 0 2, dove d 0 è il calibro del tronco e d 1 e d 2 sono i calibri di ramo. Clicca qui per visualizzare una versione più grande di questa figura.
3. valutare lo spessore del GC-IPL e RNFL
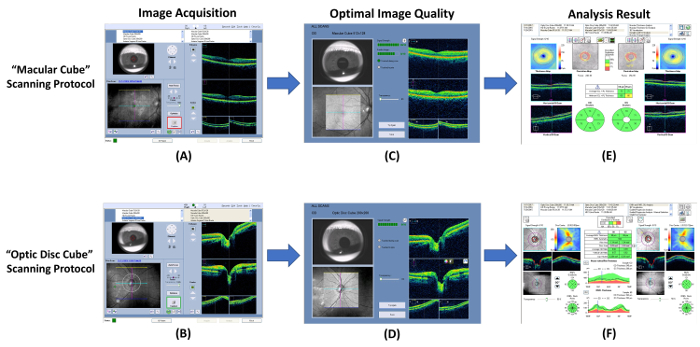
Figura 7: diagramma schematico che mostra le procedure di misurazione spessore RNFL e GC-IPL. Tomografia a coerenza ottica (OCT) può essere utilizzata per misurare spessori di strato plexiform di cella-interno del ganglio (GC-IPL) e lo strato di fibre nervose retiniche (RNFL). (A, B) Misurare gli spessori di GC-IPL e RNFL utilizzando il built-in “ maculare cubo ” e “ cubo di disco ottico ” scansione protocolli rispettivamente. (C, D) Controllare la qualità di immagine immediatamente dopo l'acquisizione di immagini. Eliminare l'immagine e ripetere la scansione se la potenza del segnale è inferiore a 6, o artefatti di movimento vengono rilevati. (E, F) Quindi, richiedere il programma di analisi integrato automaticamente analizzare il risultato della scansione e generare un rapporto per l'interpretazione. Clicca qui per visualizzare una versione più grande di questa figura.
- Eseguire l'acquisizione di immagini mediante tomografia a coerenza ottica (OCT).
- Aprire il programma di OCT e selezionare il “ maculare cubo ” scansione protocollo per avviare una nuova scansione maculare ( figura 7A).
- Individuare la pupilla nel viewport iris regolando la mentoniera. Ridurre l'illuminazione, se la dimensione della pupilla è troppo piccola.
- Scegliere la “ messa a fuoco automatica ” pulsante e poi la “ ottimizza ” pulsante per migliorare la qualità dell'immagine.
- Indicare il soggetto a lampeggiare un paio di volte subito prima di iniziare la scansione.
- Clic la “ cattura ” pulsante per avviare la scansione quando il bordo che circonda il pulsante diventa verde. Istruire il soggetto a fuoco il target di fissazione visiva durante l'acquisizione delle immagini per evitare artefatti da movimento.
- Esaminare la qualità della scansione usando Figura 7 come standard. Scartare il risultato della scansione e ripetere la scansione se la potenza del segnale è inferiore a 6 ( Figura 8A), o artefatti di movimento vengono rilevati (indicato dalla discontinuità dei vasi sanguigni) ( Figura 8B).
- Salvare il risultato della scansione.
- Ripetere i punti 3.1.1 a 3.1.7 per un altro occhio.
- Eseguire un'esplorazione della testa del nervo ottico con il “ ottica disco cubo ” seguente protocollo di scansione passi 3.1.2 a 3.1.9 ( figure 7B e 7D).

Figura 8: sub-ottimali risultati di tomografia a coerenza ottica. Risultati comuni sub-ottimali della tomografia a coerenza ottica (OCT) includono (A) segnale debole forza (valore di forza < 6) e gli artefatti di movimento (B). La qualità di scansione dovrebbe essere rivisti immediatamente dopo l'acquisizione di immagini e la scansione dovrebbe essere ripetuto se vengono rilevati questi manufatti. Clicca qui per visualizzare una versione più grande di questa figura.
- generare una stampa di analisi dello spessore maculare GC-IPL.
- Selezionare il “ maculare cubo ” scansione record di entrambi gli occhi nell'interfaccia analisi.
- Clic la “ analisi di OU di cellule del ganglio ” per avviare l'algoritmo di analisi automatica per valutare lo spessore di GC-IPL della scansione ( Figura 7E).
Nota: Passaggio 3.2.2 è completato automaticamente dall'algoritmo di analisi.- Generare un 14,13 mm 2 fovea-centrato ellittica anulus che ha raggi orizzontali interne ed esterne di 0,6 mm e 2.4 mm, rispettivamente e raggi verticali interni ed esterni di 0,5 mm e 2,0 mm, rispettivamente.
Nota: La dimensione e la forma dell'anulus ellittica si conformano strettamente all'anatomia maculare e così corrispondono alla zona dove il RGCs sono più spessa in occhi normali 33 , 34. L'area all'interno dell'anello interno dell'anulus non è misurata, come la GC-IPL in quest'area è molto sottile. - Segmento il contorno esterno del RNFL e il contorno esterno di strato plessiforme interno (IPL) per individuare il GC-IPL ( Figura 9).
- Misurare la media, minimo e sei settoriali (superior, superotemporal, superonasal, inferonasal, inferior, inferotemporal) spessori di GC-IPL maculare entro la fovea-centered ellittica anulus.
- Confrontare gli spessori di GC-IPL misurati al dispositivo ’ s interna pari età normativi del database e generare una mappa di deviazione e una mappa di significato
- Segnalare i risultati di misurazione su una stampa analisi.
- Generare un 14,13 mm 2 fovea-centrato ellittica anulus che ha raggi orizzontali interne ed esterne di 0,6 mm e 2.4 mm, rispettivamente e raggi verticali interni ed esterni di 0,5 mm e 2,0 mm, rispettivamente.
- Salvare la stampa di analisi in formato. pdf.
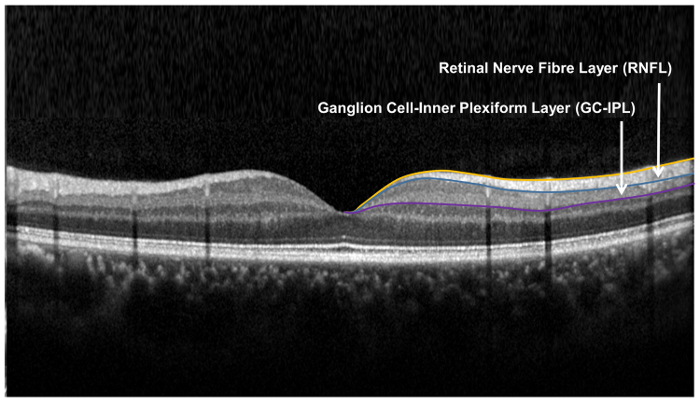
Figura 9: strati retinici utilizzati per la valutazione della struttura di un neurone retinica. Lo strato di fibre nervose retiniche (RNFL) è misurato utilizzando l'algoritmo (ONH) testa del nervo ottico, mentre lo strato di plexiform delle cellule-interno del ganglio è misurato utilizzando l'algoritmo di analisi (GCA) delle cellule del ganglio. L'algoritmo ONH segmenti il contorno interno ed esterno di RNFL per misurare lo spessore del RNFL. L'algoritmo di GCA rileva il contorno esterno dello strato di fibre nervose retiniche (RNFL) e strato plessiforme interno (IPL) per produrre il combinato spessore dello strato delle cellule del ganglio (GCL) e IPL. Gli spessori di GCL e IPL sono misurati insieme, come il confine tra GCL e IPL è anatomicamente indistinto. Tuttavia, lo spessore combinato di GCL e IPL (cioè GC-IPL) è comunque indicativo della salute del RGCs. Clicca qui per visualizzare una versione più grande di questo figura.
- generare la stampa analisi dello spessore del RNFL ( Figura 7F).
- Selezionare il “ ottica disco cubo ” scansione record di entrambi gli occhi nell'interfaccia analisi.
- Clic la “ ONH e RNFL OU analisi ” per avviare l'algoritmo di analisi automatica per valutare lo spessore RNFL della scansione.
Nota: Passaggi 3.3.2.1 a 3.3.2.6 possono essere completati automaticamente dall'algoritmo di analisi.- Misurare lo spessore RNFL in ciascun punto di scansione e di generare una mappa di spessore RNFL.
- Identificare il disco ottico rilevando una macchia scura vicino al centro della scansione che ha una dimensione e una forma coerenza con la gamma di un disco ottico.
- Posizionare una griglia di misurazione di 3,46 mm di diametro intorno al disco ottico sulla mappa spessore RNFL.
- Misura e calcolare i globali, quattro-quadranti (temporali, superiori, nasali e inferiori) e dodici-orologio-ora parapapillary RNFL spessori della griglia misura.
- Confrontare gli spessori RNFL misurati al dispositivo ’ s interna pari età normativi del database e generare una mappa di deviazione e mappa significato.
- Segnalare i risultati di misurazione su una stampa analisi.
- Salvare la stampa di analisi in formato. pdf.
Risultati
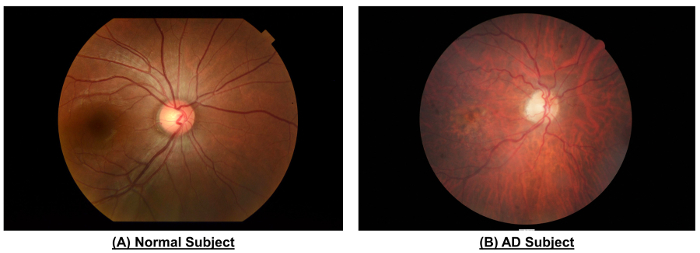
Figura 10: Un esempio per mostrare le differenze nel sistema vascolare retinico tra un soggetto normale e soggetto AD. Rispetto al soggetto normale, la fotografia del fondo del soggetto AD ha mostrato calibri di nave più stretti (CRAE della zona B, 116,4 µm vs 156,4 µm; CRVE della zona B, 186,9 µm vs 207,5 µm; CRAE della zona C, 138,5...
Discussione
Questo protocollo descrive le procedure di quantificare i cambiamenti vascolari e neuronali in retina in vivo. Come la retina condivide simili origini embriologiche, caratteristiche anatomiche e fisiologiche proprietà con il cervello, questi cambiamenti retinici possono riflettere i cambiamenti simili del sistema vascolare e struttura di un neurone nel cervello.
Come mostrato in Figura 10 e tabella 1, il soggetto AD ha mostrato calibri d...
Divulgazioni
Vorremmo esprimere il nostro apprezzamento per la School of Computing, Università nazionale di Singapore per il supporto tecnico.
Riconoscimenti
Per quanto riguarda potenziali legami finanziari, l'autore Tien Y. Wong è un co-inventore del programma Singapore I nave valutazione (SIVA) utilizzato in questo articolo.
Materiali
| Name | Company | Catalog Number | Comments |
| Non-mydriatic Retinal Camera | Topcon, Inc, Tokyo, Japan | TRC 50DX | N/A |
| Singapore I Vessel Assessment Program | National University of Singapore | Version 4.0 | N/A |
| CIRRUS HD-OCT | Carl Zeiss Meditec, Inc, Dublin, CA | Model 4000 | N/A |
| Mydriatic Agents | N/A | N/A | Prepared from 1% tropicamide and 2.5% phenylephrine hydrochloride |
Riferimenti
- Alzheimer's Disease International. The prevalence of dementia worldwide. Alzheimer's Dis. Int. (December), 1-2 (2008).
- Wimo, A., Winblad, B., &Jönsson, L. The worldwide societal costs of dementia: Estimates for 2009. Alzheimer's Dement. 6 (2), 98-103 (2010).
- Comas-Herrera, A., Northey, S., Wittenberg, R., Knapp, M., Bhattacharyya, S., Burns, A. Future costs of dementia-related long-term care: exploring future scenarios. Int. Psychogeriatr. 23 (1), 20-30 (2011).
- Alzheimer's Association. Alzheimer's disease facts and figures. Alzheimer's Dement. 10 (2), e47-e92 (2014).
- Prince, M., Bryce, R., Albanese, E., Wimo, A., Ribeiro, W., Ferri, C. P. The global prevalence of dementia: a systematic review and metaanalysis. Alzheimers. Dement. 9 (1), 63-75 (2013).
- Alzheimer's Association. 2016 Alzheimer's disease facts and figures. Alzheimer's Dement. 12 (4), 459-509 (2016).
- Asih, P. R., Chatterjee, P., Verdile, G., Gupta, V. B., Trengove, R. D., Martins, R. N. Clearing the amyloid in Alzheimer's: progress towards earlier diagnosis and effective treatments - an update for clinicians. Neurodegener. Dis. Manag. 4 (5), 363-378 (2014).
- Cheung, C. Y., Ikram, M. K., Chen, C., Wong, T. Y. Imaging retina to study dementia and stroke. Prog. Retin. Eye Res. , (2017).
- Patton, N., Aslam, T., Macgillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: a rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- London, A., Benhar, I., Schwartz, M. The retina as a window to the brain-from eye research to CNS disorders. Nat. Rev. Neurol. 9 (1), 44-53 (2013).
- Crowe, M. J., Bresnahan, J. C., Shuman, S. L., Masters, J. N., Beattie, M. S. Apoptosis and delayed degeneration after spinal cord injury in rats and monkeys. Nat Med. 3 (1), 73-76 (1997).
- Levkovitch-Verbin, H., Quigley, H. A., Kerrigan-Baumrind, L. A., D'Anna, S. A., Kerrigan, D., Pease, M. E. Optic nerve transection in monkeys may result in secondary degeneration of retinal ganglion cells. Investig. Ophthalmol. Vis. Sci. 42 (5), 975-982 (2001).
- Levkovitch-Verbin, H., Quigley, H. A., Martin, K. R., Zack, D. J., Pease, M. E., Valenta, D. F. A model to study differences between primary and secondary degeneration of retinal ganglion cells in rats by partial optic nerve transection. Invest Ophthalmol Vis Sci. 44 (8), 3388-3393 (2003).
- Yoles, E., Schwartz, M. Degeneration of spared axons following partial white matter lesion: implications for optic nerve neuropathies. Exp Neurol. 153 (1), 1-7 (1998).
- Sadun, A. A., Borchert, M., DeVita, E., Hinton, D. R., Bassi, C. J. Assessment of Visual Impairment in Patients With Alzheimer's Disease. Am. J. Ophthalmol. 104 (2), 113-120 (1987).
- Schlotterer, G., Moscovitch, M., Crapper-Mclachlan, D. Visual processing deficits as assessed by spatial frequency contrast sensitivity and backward masking in normal ageing and alzheimer's. Brain. 107 (1), 309-324 (1984).
- Cheung, C. Y. L., et al. A new method to measure peripheral retinal vascular caliber over an extended area. Microcirculation. 17 (7), 495-503 (2010).
- Knudtson, M. D., Lee, K. E., Hubbard, L. D., Wong, T. Y., Klein, R., Klein, B. E. K. Revised formulas for summarizing retinal vessel diameters. Curr. Eye Res. 27 (3), 143-149 (2003).
- Hubbard, L. D., et al. Methods for evaluation of retinal microvascular abnormalities associated with hypertension/sclerosis in the Atherosclerosis Risk in Communities Study. Ophthalmology. 106 (12), 2269-2280 (1999).
- Patton, N., et al. The association between retinal vascular network geometry and cognitive ability in an elderly population. Investig. Ophthalmol. Vis. Sci. 48 (5), 1995-2000 (2007).
- VanHecke, M. V., et al. Are retinal microvascular abnormalities associated with large artery endothelial dysfunction and intima-media thickness? The Hoorn Study. Clin. Sci. London Engl. 110 (5), 597-604 (2006).
- Tien, Y. W., et al. Retinal vascular caliber, cardiovascular risk factors, and inflammation: The Multi-Ethnic Study of Atherosclerosis (MESA). Investig. Ophthalmol. Vis. Sci. 47 (6), 2341-2350 (2006).
- Leung, H., et al. Relationships between age, blood pressure, and retinal vessel diameters in an older population. Investig. Ophthalmol. Vis. Sci. 44 (7), 2900-2904 (2003).
- Wong, T. Y., et al. The prevalence and risk factors of retinal microvascular abnormalities in older persons: The cardiovascular health study. Ophthalmology. 110 (4), 658-666 (2003).
- Ikram, M. K., et al. Retinal vessel diameters and risk of stroke: The Rotterdam Study. Neurology. 66 (9), 1339-1343 (2006).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: Methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Sasongko, M. B., et al. Alterations in retinal microvascular geometry in young type 1 diabetes. Diabetes Care. 33 (6), 1331-1336 (2010).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Mainster, M. a The fractal properties of retinal vessels: embryological and clinical implications. Eye. 4 ( Pt 1) (1), 235-241 (1990).
- Liew, G., et al. The Retinal Vasculature as a Fractal: Methodology, Reliability, and Relationship to Blood Pressure. Ophthalmology. 115 (11), (2008).
- Stosic, T., Stosic, B. D. Multifractal analysis of human retinal vessels. IEEE Trans. Med. Imaging. 25 (8), 1101-1107 (2006).
- Zamir, M., Medeiros, J. A., Cunningham, T. K. &. a. m. p. ;. M., Zamir, J. A., Medeiros, T. K. C. Arterial bifurcations in the human retina. J. Gen. Physiol. 74 (4), 537-548 (1979).
- Mwanza, J. C., Oakley, J. D., Budenz, D. L., Chang, R. T., Knight, O. J., Feuer, W. J. Macular ganglion cell-inner plexiform layer: Automated detection and thickness reproducibility with spectral domain-optical coherence tomography in glaucoma. Investig. Ophthalmol. Vis. Sci. 52 (11), 8323-8329 (2011).
- Bendschneider, D., et al. Retinal nerve fiber layer thickness in normals measured by spectral domain OCT. J. Glaucoma. 19 (7), 475-482 (2010).
- Cheung, C. Y., Ong, Y. T., Ikram, M. K., Chen, C., Wong, T. Y. Retinal Microvasculature in Alzheimer's Disease. J. Alzheimer's Dis. 42 (s4), S339-S352 (2014).
- Murray, C. D. THE PHYSIOLOGICAL PRINCIPLE OF MINIMUM WORK APPLIED TO THE ANGLE OF BRANCHING OF ARTERIES. J. Gen. Physiol. (4), 835-841 (1926).
- Ding, J., et al. Early retinal arteriolar changes and peripheral neuropathy in diabetes. Diabetes Care. 35 (5), 1098-1104 (2012).
- Yim, C., et al. Retinal Ganglion Cell Analysis Using High-Definition Optical Coherence Tomography in Patients with Mild Cognitive Impairment and Alzheimer's Disease. J. Alzheimer's Dis. Retin. Ganglion Cell Anal. MCI AD. 45 (1), 45-56 (2015).
- Stein, D. M., Wollstein, G., Ishikawa, H., Hertzmark, E., Noecker, R. J., Schuman, J. S. Effect of Corneal Drying on Optical Coherence Tomography. Ophthalmology. 113 (6), 985-991 (2006).
- Mwanza, J. C., et al. Effect of Cataract and its Removal on Signal Strength and Peripapillary Retinal Nerve Fiber Layer Optical Coherence Tomography Measurements. J. Glaucoma. 20 (1), 37-43 (2011).
- Garcia-Martin, E., et al. Influence of cataract surgery on optical coherence tomography and neurophysiology measurements in patients with retinitis pigmentosa. Am. J. Ophthalmol. 156 (2), (2013).
- Kok, P. H. B., et al. The relationship between the optical density of cataract and its influence on retinal nerve fibre layer thickness measured with spectral domain optical coherence tomography. Acta Ophthalmol. , (2012).
- Kim, N. R., et al. Influence of cataract on time domain and spectral domain optical coherence tomography retinal nerve fiber layer measurements. J. Glaucoma. 21 (2), 116-122 (2012).
- Hwang, Y. H., Kim, Y. Y. Effect of Peripapillary Vitreous Opacity on Retinal Nerve Fiber Layer Thickness Measurement Using Optical Coherence Tomography. Arch. Ophthalmol. 130 (6), 789-792 (2012).
- Schwartz, S. G., Flynn, H. W., Fisher, Y. L. "Floater scotoma" demonstrated on spectral-domain optical coherence tomography and caused by vitreous opacification. Ophthalmic Surg. Lasers Imaging Retina. 44 (4), 415-418 (2013).
- Frost, S., et al. Retinal vascular biomarkers for early detection and monitoring of Alzheimer's disease. Transl. Psychiatry. 3 (2), e233 (2013).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- DeJong, F. J., et al. Retinal vascular caliber and risk of dementia: The Rotterdam Study. Neurology. 76 (9), 816-821 (2011).
- Cheung, C. Y., et al. Quantitative and qualitative retinal microvascular characteristics and blood pressure. J. Hypertens. 29 (7), 1380-1391 (2011).
- Cheung, C. Y., et al. Retinal vascular fractal dimension and its relationship with cardiovascular and ocular risk factors. Am. J. Ophthalmol. 154 (4), 663-674 (2012).
- Cheung, C. Y. L., et al. Retinal vascular tortuosity, blood pressure, and cardiovascular risk factors. Ophthalmology. 118 (5), 812-818 (2011).
- Grinton, M. E., et al. The association between retinal vessel morphology and retinal nerve fiber layer thickness in an elderly population. Ophthalmic Surg. Lasers Imaging. 43 (6 Suppl), S61-S66 (2012).
- Hughes, A. D., et al. Quantification of topological changes in retinal vascular architecture in essential and malignant hypertension. J. Hypertens. 24 (5), 889-894 (2006).
- Hughes, A. D., et al. Determinants of retinal microvascular architecture in normal subjects. Microcirculation. 16 (2), 159-166 (2009).
- Lau, Q. P., Lee, M. L., Hsu, W., Wong, T. Y. The Singapore Eye Vessel Assessment System. Image Anal. Model. Ophthalmol. , 143-160 (2014).
- Thomas, G. N., et al. Measurement of Macular Fractal Dimension Using a Computer-Assisted Program. Investig. Opthalmology Vis. Sci. 55 (4), 2237 (2014).
- Murray, C. D. The physiological principle of minimal work. I. The vascular system and the cost of blood volume. Proc. Natl. Acad. Sci. 12, 207-214 (1926).
- Cheung, C., Chen, C., Wong, T. Ocular Fundus Photography as a Tool to Study Stroke and Dementia. Semin. Neurol. 35 (5), 481-490 (2015).
- Williams, M. A., et al. Retinal microvascular network attenuation in Alzheimer's disease. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 1 (2), 229-235 (2015).
- Cheung, C. Y., et al. Retinal Vascular Fractal Dimension Is Associated with Cognitive Dysfunction. J. Stroke Cerebrovasc. Dis. 23 (1), 43-50 (2014).
- Hammes, H. P., et al. Diabetic retinopathy: targeting vasoregression. Diabetes. 60 (1), 9-16 (2011).
- Cheung, C. Y., et al. Microvascular network alterations in the retina of patients with Alzheimer's disease. Alzheimer's Dement. 10 (2), 135-142 (2014).
- Frame, M. D., Sarelius, I. H. Arteriolar bifurcation angles vary with position and when flow is changed. Microvasc Res. 46 (2), 190-205 (1993).
- Djonov, V., Baum, O., Burri, P. H. Vascular remodeling by intussusceptive angiogenesis. Cell Tissue Res. 314 (1), 107-117 (2003).
- Griffith, T. M., Edwards, D. H. Basal EDRF activity helps to keep the geometrical configuration of arterial bifurcations close to the Murray optimum. J. Theor. Biol. 146 (4), 545-573 (1990).
- Griffith, T. M., Edwards, D. H., Randall, M. D. Blood flow and optimal vascular topography: role of the endothelium. Basic Res. Cardiol. 86 Suppl 2, 89-96 (1991).
- Chapman, N., Haimes, G., Stanton, A. V., Thom, S. A. M., Hughes, A. D. Acute effects of oxygen and carbon dioxide on retinal vascular network geometry in hypertensive and normotensive subjects. Clin. Sci. 99 (6), 483-488 (2000).
- Heringa, S. M., Bouvy, W. H., van denBerg, E., Moll, A. C., Jaap Kappelle, L., Jan Biessels, G. Associations between retinal microvascular changes and dementia, cognitive functioning, and brain imaging abnormalities: a systematic review. J. Cereb. blood flow Metab. 33 (7), 983-995 (2013).
- Ding, J., et al. Diabetic retinopathy and cognitive decline in older people with type 2 diabetes: The Edinburgh type 2 diabetes study. Diabetes. 59 (11), 2883-2889 (2010).
- Parisi, V., Restuccia, R., Fattapposta, F., Mina, C., Bucci, M. G., Pierelli, F. Morphological and functional retinal impairment in Alzheimer's disease patients. Clin. Neurophysiol. 112 (10), 1860-1867 (2001).
- Paquet, C., Boissonnot, M., Roger, F., Dighiero, P., Gil, R., Hugon, J. Abnormal retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Neurosci. Lett. 420 (2), 97-99 (2007).
- Moschos, M. M., et al. Structural and functional impairment of the retina and optic nerve in Alzheimer's disease. Curr. Alzheimer Res. 9 (7), 782-788 (2012).
- Lu, Y., et al. Retinal nerve fiber layer structure abnormalities in early Alzheimer's disease: Evidence in optical coherence tomography. Neurosci. Lett. 480 (1), 69-72 (2010).
- Kesler, A., Vakhapova, V., Korczyn, A. D., Naftaliev, E., Neudorfer, M. Retinal thickness in patients with mild cognitive impairment and Alzheimer's disease. Clin. Neurol. Neurosurg. 113 (7), 523-526 (2011).
- Ascaso, F. J., et al. Retinal alterations in mild cognitive impairment and Alzheimer's disease: An optical coherence tomography study. J. Neurol. 261 (8), 1522-1530 (2014).
- Berisha, F., Feke, G. T., Trempe, C. L., McMeel, J. W., Schepens, C. L. Retinal abnormalities in early Alzheimer's disease. Investig. Ophthalmol. Vis. Sci. 48 (5), 2285-2289 (2007).
- Iseri, P. K., Altinaş, O., Tokay, T., Yüksel, N. Relationship between Cognitive Impairment and Retinal Morphological and Visual Functional Abnormalities in Alzheimer Disease. J. Neuro-Ophthalmology. 26 (1), 18-24 (2006).
- Garcia-Martin, E. S., et al. Macular thickness as a potential biomarker of mild Alzheimer's disease. Ophthalmology. 121 (5), 1149-1151 (2014).
- Ko, F., et al. Retinal Nerve Fiber Layer Thinning Associated With Poor Cognitive Function Among A Large Cohort, The Uk Biobank. Alzheimer's Dement. 12 (7), P317-P318 (2016).
- Moreno-Ramos, T., Benito-Leon, J., Villarejo, A., Bermejo-Pareja, F. Retinal nerve fiber layer thinning in dementia associated with Parkinson's disease, dementia with Lewy bodies, and Alzheimer's disease. J. Alzheimers. Dis. 34 (3), 659-664 (2013).
- Moschos, M. M., et al. Morphologic changes and functional retinal impairment in patients with Parkinson disease without visual loss. Eur. J. Ophthalmol. 21 (1), 24-29 (2011).
- Garcia-Martin, E., et al. Ability and reproducibility of Fourier-domain optical coherence tomography to detect retinal nerve fiber layer atrophy in Parkinson's disease. Ophthalmology. 119 (10), 2161-2167 (2012).
- Yip, W., et al. Comparison of Common Retinal Vessel Caliber Measurement Software and a Conversion Algorithm. Transl. Vis. Sci. Technol. 5 (5), 11 (2016).
- Gorelick, P. B., et al. Vascular contributions to cognitive impairment and dementia: a statement for healthcare professionals from the american heart association/american stroke association. Stroke. 42 (9), 2672-2713 (2011).
- Brown, W. R., Thore, C. R. Review: Cerebral microvascular pathology in ageing and neurodegeneration. Neuropathol. Appl. Neurobiol. 37 (1), 56-74 (2011).
- DeSilva, T. M., Faraci, F. M. Microvascular Dysfunction and Cognitive Impairment. Cell. Mol. Neurobiol. 36 (2), 241-258 (2016).
- Kalaria, R. N., Akinyemi, R., Ihara, M. Does vascular pathology contribute to Alzheimer changes?. J. Neurol. Sci. 322 (1-2), 141-147 (2012).
- Kling, M. A., Trojanowski, J. Q., Wolk, D. A., Lee, V. M. Y., Arnold, S. E. Vascular disease and dementias: paradigm shifts to drive research in new directions. Alzheimers. Dement. 9 (1), 76-92 (2013).
- O'Brien, J. T., et al. Vascular cognitive impairment. Lancet Neurol. 2 (2), 89-98 (2003).
- Chen, C., et al. Alzheimer's disease with cerebrovascular disease: current status in the Asia-Pacific region. J. Intern. Med. 280 (4), 359-374 (2016).
- Pérez, M. A., Bruce, B. B., Newman, N. J., Biousse, V. The use of retinal photography in nonophthalmic settings and its potential for neurology. Neurologist. 18 (6), 350-355 (2012).
- Boppart, S. A. Optical coherence tomography: Technology and applications for neuroimaging. Psychophysiology. 40 (4), 529-541 (2003).
- Hee, M. R., et al. Optical coherence tomography of the human retina. Arch. Ophthalmol. 113 (3), 325-332 (1995).
- Huang, D., et al. Optical coherence tomography. Science (80-.). 254 (5035), 1178-1181 (1991).
- vanVelthoven, M. E. J., Verbraak, F. D., Yannuzzi, L., Rosen, R. B., Podoleanu, A. G. H., deSmet, M. D. Imaging the retina by en face optical coherence tomography. Retina. 26 (2), 129-136 (2006).
- Costa, R. A., et al. Retinal assessment using optical coherence tomography. Prog. Retin. Eye Res. 25 (3), 325-353 (2006).
- DeBuc, D. C., Somfai, G. M., Ranganathan, S., Tátrai, E., Ferencz, M., Puliafito, C. A. Reliability and reproducibility of macular segmentation using a custom-built optical coherence tomography retinal image analysis software. J. Biomed. Opt. 14 (6), 64023 (2009).
- Budenz, D. L., et al. Determinants of Normal Retinal Nerve Fiber Layer Thickness Measured by Stratus OCT. Ophthalmology. 114 (6), 1046-1052 (2007).
- Leung, C. K. S., et al. Retinal Nerve Fiber Layer Imaging with Spectral-Domain Optical Coherence Tomography: A Prospective Analysis of Age-Related Loss. Ophthalmology. 119 (4), 731-737 (2012).
- Cettomai, D., et al. Reproducibility of optical coherence tomography in multiple sclerosis. Arch. Neurol. 65 (9), 1218-1222 (2008).
- Garcia-Martin, E., Pinilla, I., Idoipe, M., Fuertes, I., Pueyo, V. Intra and interoperator reproducibility of retinal nerve fibre and macular thickness measurements using Cirrus Fourier-domain OCT. Acta Ophthalmol. 89 (1), (2011).
- Garcia-Martin, E., Pueyo, V., Pinilla, I., Ara, J. R., Martin, J., Fernandez, J. Fourier-domain OCT in multiple sclerosis patients: reproducibility and ability to detect retinal nerve fiber layer atrophy. Invest. Ophthalmol. Vis. Sci. 52 (7), 4124-4131 (2011).
- Menke, M. N., Knecht, P., Sturm, V., Dabov, S., Funk, J. Reproducibility of nerve fiber layer thickness measurements using 3D fourier-domain OCT. Invest. Ophthalmol. Vis. Sci. 49 (12), 5386-5391 (2008).
- Mwanza, J. C., et al. Reproducibility of peripapillary retinal nerve fiber layer thickness and optic nerve head parameters measured with cirrus HD-OCT in glaucomatous eyes. Investig. Ophthalmol. Vis. Sci. 51 (11), 5724-5730 (2010).
- Syc, S. B., et al. Reproducibility of high-resolution optical coherence tomography in multiple sclerosis. Mult Scler. 16 (7), 829-839 (2010).
- Ikram, M. K., Cheung, C. Y., Wong, T. Y., Chen, C. P. L. H. Retinal pathology as biomarker for cognitive impairment and Alzheimer's disease. J. Neurol. Neurosurg. Psychiatry. 83 (9), 917-922 (2012).
- MacGillivray, T. J., Trucco, E., Cameron, J. R., Dhillon, B., Houston, J. G., vanBeek, E. J. R. Retinal imaging as a source of biomarkers for diagnosis, characterization and prognosis of chronic illness or long-term conditions. Br. J. Radiol. 87 (1040), 20130832 (2014).
- Patton, N., et al. Retinal image analysis: Concepts, applications and potential. Prog. Retin. Eye Res. 25 (1), 99-127 (2006).
- McGrory, S., et al. The application of retinal fundus camera imaging in dementia: A systematic review. Alzheimer's Dement. Diagnosis, Assess. Dis. Monit. 6, 91-107 (2017).
- Wong, T. Y., Knudtson, M. D., Klein, R., Klein, B. E. K., Meuer, S. M., Hubbard, L. D. Computer-assisted measurement of retinal vessel diameters in the Beaver Dam Eye Study: methodology, correlation between eyes, and effect of refractive errors. Ophthalmology. 111 (6), 1183-1190 (2004).
- Hardin, J. S., Taibbi, G., Nelson, S. C., Chao, D., Vizzeri, G. Factors Affecting Cirrus-HD OCT Optic Disc Scan Quality: A Review with Case Examples. J. Ophthalmol. 2015, 1-16 (2015).
- Kim, N. R., et al. Influence of Cataract on Time Domain and Spectral Domain Optical Coherence Tomography Retinal Nerve Fiber Layer Measurements. J. Glaucoma. 1, (2010).
- Li, H., et al. Lens opacity and refractive influences on the measurement of retinal vascular fractal dimension. Acta Ophthalmol. 88 (6), e234-e240 (2010).
- Maberley, D., Morris, A., Hay, D., Chang, A., Hall, L., Mandava, N. A comparison of digital retinal image quality among photographers with different levels of training using a non-mydriatic fundus camera. Ophthalmic Epidemiol. 11 (3), 191-197 (2004).
- Rochtchina, E., Wang, J. J., Taylor, B., Wong, T. Y., Mitchell, P. Ethnic variability in retinal vessel caliber: A potential source of measurement error from ocular pigmentation?-The Sydney childhood eye study. Investig. Ophthalmol. Vis. Sci. 49 (4), 1362-1366 (2008).
- Wainwright, A., et al. Effect of image quality, color, and format on the measurement of retinal vascular fractal dimension. Investig. Ophthalmol. Vis. Sci. 51 (11), 5525-5529 (2010).
- Nguyen, T. T., Wong, T. Y. Retinal vascular manifestations of metabolic disorders. Trends Endocrinol. Metab. 17 (7), 262-268 (2006).
- Ding, J., et al. Retinal vascular caliber and the development of hypertension: a meta-analysis of individual participant data. J. Hypertens. 32 (2), 207-215 (2014).
- Nguyen, T. T., Wong, T. Y. Retinal vascular changes and diabetic retinopathy. Curr. Diab. Rep. 9 (4), 277-283 (2009).
- Leung, C. K. S., Ye, C., Weinreb, R. N., Yu, M., Lai, G., Lam, D. S. Impact of Age-related Change of Retinal Nerve Fiber Layer and Macular Thicknesses on Evaluation of Glaucoma Progression. Ophthalmology. 120 (12), 2485-2492 (2013).
- Sherry, L. M., et al. Reliability of computer-assisted retinal vessel measurement in a population. Clin. Experiment. Ophthalmol. 30 (3), 179-182 (2002).
- Wardlaw, J. M., et al. Neuroimaging standards for research into small vessel disease and its contribution to ageing and neurodegeneration. Lancet Neurol. 12 (8), 822-838 (2013).
- Patton, N., Aslam, T., MacGillivray, T., Pattie, A., Deary, I. J., Dhillon, B. Retinal vascular image analysis as a potential screening tool for cerebrovascular disease: A rationale based on homology between cerebral and retinal microvasculatures. J. Anat. 206 (4), 319-348 (2005).
- Ferri, C. P., et al. Global prevalence of dementia: A Delphi consensus study. Lancet. 366 (9503), 2112-2117 (2005).
- Sahadevan, S., et al. Ethnic differences in Singapore's dementia prevalence: The stroke, Parkinson's disease, epilepsy, and dementia in Singapore study. J. Am. Geriatr. Soc. 56 (11), 2061-2068 (2008).
- Kernt, M., et al. Assessment of diabetic retinopathy using nonmydriatic ultra-widefield scanning laser ophthalmoscopy (Optomap) compared with ETDRS 7-field stereo photography. Diabetes Care. 35 (12), 2459-2463 (2012).
- Manivannan, A., Plskova, J., Farrow, A., Mckay, S., Sharp, P. F., Forrester, J. V. Ultra-wide-field fluorescein angiography of the ocular fundus. Am. J. Ophthalmol. 140 (3), 525-527 (2005).
- Pellegrini, E., et al. Blood vessel segmentation and width estimation in ultra-wide field scanning laser ophthalmoscopy. Biomed. Opt. Express. 5 (12), 4329 (2014).
- Estrada, R., Tomasi, C., Schmidler, S. C., Farsiu, S. Tree topology estimation. IEEE Trans. Pattern Anal. Mach. Intell. 37 (8), 1688-1701 (2015).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon