Method Article
Sondes de projection optique de nouvelles bactéries spécifiques sur les tissus pulmonaires humains Ex Vivo par endomicroscopie confocale par Laser
Dans cet article
Résumé
Cette technique décrit un processus efficace de dépistage pour l’évaluation des bactéries spécifiques des agents d’imagerie optiques intérieur ex vivo des tissus pulmonaires humains, microscopie à fluorescence confocale fibré pour l’identification rapide des petites molécules chimiques sonde-candidats à potentiel traduisible.
Résumé
Améliorer la vitesse et la précision de détection bactérienne est importante pour stratification patiente et d’assurer l’utilisation appropriée des agents antimicrobiens. Pour atteindre cet objectif, le développement des techniques de diagnostic de reconnaître la présence bactérienne en temps réel à la point-of-care est requis. Imagerie optique pour une identification directe de bactéries au sein de l’hôte est une approche intéressante. Plusieurs tentatives de sonde chimique conception et validation ont été étudiés, cependant aucun ont encore été avec succès traduits dans la clinique. Nous décrivons ici une méthode ex vivo la validation des sondes de bactéries spécifiques pour l’identification des bactéries dans le poumon distal, photographié par microscopie à fluorescence confocale fibré (FCFM). Notre modèle utilisé ex vivo des tissus pulmonaires humains et une plate-forme d’endomicroscopie (CLE) laser confocal cliniquement approuvé au roman écran bactéries spécifiques d’imagerie composés, étroitement simulant des conditions d’imagerie censé être rencontrés avec les patients. Criblage de composés par cette technique offre donc confiance de traçabilité clinique potentielle.
Introduction
Cette technique décrit un processus de dépistage rapide d’évaluation axée sur les bactéries agents d’imagerie optiques intérieur ex vivo des tissus pulmonaires humaines par CLE utilisant FCFM pour l’identification rapide des composés avec une utilité clinique potentielle de visualisation bactéries dans le poumon distal in situ.
Il y a un besoin urgent et global de rationner prescrire des antimicrobiens dans l’ère de l’augmentation de la résistance aux antimicrobiens1. À cette fin, le développement de méthodes de diagnostic qui agissent pour identifier une infection bactérienne avec une grande spécificité, sensibilité et en temps réel sont hautement recherché2. Techniques actuelles pour confirmer un diagnostic de la pneumonie chez les patients gravement malade, tels que ceux au sein d’unités de soins intensifs (USI), reposent souvent sur l’interprétation non spécifique des caractéristiques cliniques ou radiologiques parallèlement à des techniques de culture bactérienne de aspiration des fluides/tissus, ce qui peut prendre jusqu'à 3 jours pour produire des résultats. En outre, culture bactérienne de fluide instillée dans le poumon distal et récupérée est sujette à la contamination de plus proximale airways3 et est souvent la culture négative due à une antibiothérapie concomitante ou de techniques d’échantillonnage pauvres. En outre, les techniques moléculaires tels que de la réaction en chaîne de polymérase sont trop sensibles lorsqu’il est utilisé sur les liquides aspirés, risque de surtraitement des patients. Une nouvelle approche diagnostique est l’imagerie optique moléculaire, faire in situ la pathologie moléculaire des tissus une possibilité ; Toutefois, le développement et la validation des composés d’imagerie optiques est requis. Néanmoins, une visualisation directe de bactéries, par l’intermédiaire de sondes optiques activables est potentiellement une méthode très puissante pour permettre l’étude de la présence et l’évolution de la pneumonie chez le patient et ce qui est important, pourrait servir à étudier les interactions hôte-pathogène chez réponse aux traitements en temps réel in situ.
CLE est une procédure d’enquête établie dans plusieurs maladies4, y compris dans les domaines de la gastroentérologie5, oncologie6,7et d’interrogation des voies respiratoires et des sacs alvéolaires8, 9. il permet point-of-care imagerie structurelle des tissus malades à l’aide d’une fibre bundle, qui passe par le canal d’un endoscope clinique d’imagerie et de formulaires directement en contact avec la surface du tissu pour être photographié par microscopie confocale. Toutefois, une limitation qui reste est la nécessité pour les agents de contraste générique. Donc, l’utilisation de sondes spécifiques de la maladie, tels que les agents bactériens spécifiques, pourrait élargir considérablement l’utilité de cette modalité en visualisant directement sur le site de suspicion d’infection, les bactéries. Optiques agents offrent de nombreux avantages par rapport aux autres techniques en permettant l’imagerie haute résolution en temps réel avec potentiel diagnostique. En outre, sondes optiques offrent la perspective de multiplexage pour interroger des cibles multiples, tous obtenus à un coût relativement faible. Un certain nombre d’agents optiques est en cours d’élaboration à cette fin, mais aucun n’ont encore été appliquées avec succès au sein de la clinique10. Nous avons synthétisé une bibliothèque des sondes chimiques de petites molécules avec spécificité envers les bactéries et développé un pipeline rapid et efficace pour l’évaluation de la fonction de la sonde de détection de la pneumonie bactérienne sur place11.
Pour identifier les candidats appropriés de sonde, les conditions préalables suivantes devaient être remplies avant l’interrogatoire de la sonde sur ex vivo des tissus pulmonaires humains par FCFM : i) solubilité, ii) spécificité et sélectivité pour l’étiquetage rapide cliniquement bactéries, iii) un rapport signal sur bruit élevé et iv) résistent à la dégradation dans l’environnement de poumon. Ce dernier a été évalué par lavage bronchoalvéolaire (LLBA) de patients atteints de syndrome de détresse respiratoire aiguë (SDRA), qui est une affection qui se caractérise par des environnements protéolytiques et inflammatoires dans les poumons en réanimation. En outre, les sondes devaient avoir un fluorophore approprié pour la détection par un appareil d’imagerie cliniquement approuvé optique CLE dans les tissus alvéolaires pulmonaires humaines.
Le pipeline d’interroger chacun de ces conditions préalables était les suivantes (à chaque étape, seulement les sondes qui ont été reportés à l’autre) : (1) a été synthétisée une bibliothèque des sondes pour être l’objet d’une enquête ; (2) chaque sonde a été ajouté à un groupe de bactéries vivantes pour confocal laser scanning microscopy (CLSM) afin d’assurer un étiquetage bactérienne ; (3) la sélectivité de l’étiquetage bactérienne sur des cellules de mammifères en co-cultures avec des neutrophiles humains primaires a été créée par CLSM ; (4) stabilité et étiquetage réussie de bactéries en présence du patient SDRA BALF a été déterminée par CLSM et Matrix Assisted Laser désorption/ionisation-temps de spectrométrie de masse (MALDI-TOF) de vol ; (5) concentration optimale des candidats a été déterminée par CLSM, assurer la sélectivité pour les bactéries sur les cellules de mammifères a été maintenue ; 6 ex vivo humaine alvéolaire tissu pulmonaire afin d’assurer la stabilité et que le signal-bruit était adéquat pour la détection et candidats ont été photographiés par FCFM en suspension. Étape 6 est décrite en détail dans le présent protocole. Méthodologie pour les étapes 1 à 5 a été précédemment rapporté11.
Protocole
Tous les tissus pulmonaires humains a été obtenue suite à un consentement éclairé et l’étude a été approuvée par le Comité régional d’éthique.
1. préparation des échantillons biologiques
-
Préparation des sondes
- Constituent une solution mère de 1 mM de chaque sonde (p. ex., calcéine AM, UBI-3, UBI-10, etc.) en stérile dH2O, à l’aide d’un équilibre subtil à peser les lyophilisés sonde composé11. Calculer le volume de dH2O pour ajouter basée sur la masse pesée et poids moléculaire de la sonde.
-
Préparation de cultures bactériennes
NOTE : Pour cette méthode, Staphylococcus aureus a été utilisé comme la souche exemplar. Toute souche bactérienne approprié peut être sélectionné. N’importe quel colorant commercial que les bactéries avec des spectres d’excitation et d’émission de labels peut être sélectionnée pour marquer positivement les bactéries.- Sélectionnez une seule colonie de souche bactérienne désirée dans une gélose de frais lysogénie bouillon (LB) à l’aide d’une anse stérile. Ensemencer la colonie dans 10 mL de la LB dans un tube à centrifuger 50 mL en plongeant la fin de la boucle dans les milieux de culture. Incuber à 37 ° C, 250 tr/min pendant 16 h (ou toute la nuit).
- Déterminer l' OD595 de la culture au jour le jour en ajoutant 100 µL de la culture au jour le jour à 900 µL LB dans une cuvette de 1 mL. Mesurer le diamètre extérieur à 595 nm (en utilisant une cuvette avec 1 mL LB comme blanc) dans un spectrophotomètre. Multipliez la do obtenue par 10 pour obtenir le diamètre extérieur pour la culture au jour le jour.
- Repiquer la culture pendant la nuit. Pour ce faire ajuster la densité optique à 595 nm (OD595) à 0,1 dans 10 mL de frais lb calculer le volume requis de la culture au jour le jour à ajouter à 10 mL frais LB pour ajuster l' OD595 à 0,1. Incuber la culture à 37 ° C, 250 tr/min jusqu'à ce que la culture atteint la phase logarithmique (OD595 0,6 - 0,8), environ 4 h.
- Mesurer la densité optique de la culture (étape 1.2.2) et la récolte 1 x 108 unités formant des colonies (UFC) (OD595 ~ 1-1 x 108 UFC/mL) de la culture bactérienne dans un microtube de 1,5 mL (par exemple, si la culture bactérienne est OD595 0.6, recueillir 1,67 mL). Centrifuger la culture à 10 000 x g à température ambiante pendant 1 min granuler les bactéries. Laver le culot deux fois en phosphate solution saline tamponnée (PBS) par resuspendant (pipetage monte et descend avec précaution) le culot dans 1 mL de PBS, centrifugation comme indiqué ci-dessus, jeter le surnageant et en répétant. Prendre soin de ne pas pour déloger la pastille bactérienne lorsque vous retirez le surnageant. Resuspendre le culot final dans 1 mL de PBS.
NOTE : Préparez autant d’échantillons tel que requis pour chaque procédure d’étiquetage. Le protocole peut être suspendu ici pendant 1 h, suivi par étape 1.2.5.1, 1.2.5.2 ou 1.2.5.3. - Coloration bactérienne
- Pour étiqueter les bactéries avec calcéine AM, ajouter le colorant à une concentration finale de 1 µM dans la culture bactérienne lavée. Incuber la culture pendant 30 min à 37 ° C sous agitation à 300 tr/min. Laver la suspension bactérienne colorée dans PBS 3 fois par centrifugation comme au point 1.2.4 pour éliminer le colorant excédentaire. Remettre en suspension dans 1 mL de PBS, diluer 100 µL 1:1 dans du PBS pour obtenir 200 µL d’OD595 calcéine 0,5 suis tachée de bactéries. Le protocole peut être suspendu ici pendant 1 h.
- Pour étiqueter les bactéries avec des sondes de test (p. ex., UBI-3 ou UBI-10), diluer 100 µL de la culture bactérienne 1:1 dans du PBS pour obtenir OD595 0,5 dans 200 µL PBS. Ajouter que soit des sondes à une concentration finale de 10 µM. inverser le microtube plusieurs fois pour assurer un mélange intime de la bactérie et la sonde.
Remarque : L’imagerie doit être effectuée immédiatement après l’ajout de la sonde pour imiter le scénario clinique. - Pour préparer le contrôle échantillons bactériens non colorés, diluer 100 µL de la culture 1:1 avec du PBS pour obtenir 200 µL de non-colorées OD595 0.5 échantillon.
-
Préparation des ex vivo des tissus pulmonaires humains
Remarque : Les échantillons de tissus pulmonaires humains proviennent de patients devant subir une résection chirurgicale pour le cancer du poumon. Tous les tissus utilisés pour l’imagerie a été obtenue à partir d’échantillons de tissus pulmonaires normales de la tumeur cancéreuse. Des échantillons ont été prélevés fraîches en provenance du bloc opératoire et conservées dans des tubes de microtubes ou une centrifugeuse à-80 ° C jusqu'à l’utilisation.- Immédiatement avant l’imagerie, enlever l’échantillon de tissu de poumon humain du congélateur sur la glace sèche. À température ambiante, laissez le tissu décongeler un peu ; juste assez pour être tranchés avec un scalpel en sections de 1 x 4 mm2 .
Remarque : Le niveau de décongélation est important ; trop gelé et le tissu ne sera pas trancher sans écaillage, trop décongelés et le tissu est trop molle pour trancher. - Avec une pincette, placez le tissu pulmonaire humain en tranches dans des puits d’une plaque 96 puits clair fond plat culture de tissus. Retourner n’importe quel tissu de poumon humain non utilisés immédiatement pour le conteneur de stockage et de la place sur la glace sèche pour le transport vers le congélateur à-80 ° C.
- Ajouter 100 µL PBS à chaque échantillon de tissu pulmonaire avec une pipette. Utilisez la pipette pour s’assurer que tout le tissu est couvert dans du PBS (et pas collé aux parois du puits). Les tissus vont gonfler légèrement et peuvent flotter. Laisser le PBS sur l’échantillon pendant quelques minutes permettre à n’importe quel sang à s’infiltrer dans les tissus dans la solution. Enlevez autant de la PBS que possible. Le tissu peut bloquer l’extrémité de l’embout de la pipette ; essayez à l’angle de la mise en place de plaque/extrémité afin d’éviter cela.
- Distribuer 100 µL de non colorés, calcéine suis étiqueté ou test-Sonde étiquetée bactéries pour chaque bien contenant du tissu pulmonaire. Également mis en place des contrôles avec les tissus pulmonaires et 100 µL de PBS. Ces puits de contrôle, sondes sans bactéries peuvent être ajoutés pour mesurer toute augmentation de fluorescence de fond et/ou l’activation non spécifique de la sonde par le tissu de poumon seul. Un puits avec des tissus pulmonaires et PBS devraient également être inclus.
- Immédiatement avant l’imagerie, enlever l’échantillon de tissu de poumon humain du congélateur sur la glace sèche. À température ambiante, laissez le tissu décongeler un peu ; juste assez pour être tranchés avec un scalpel en sections de 1 x 4 mm2 .
2. imagerie avec l’appareil CLE FCFM
-
Mise en place du dispositif CLE
NOTE : Préparez le système CLE 20 min avant le calibrage pour permettre le laser pour se réchauffer.- Appuyez sur l’interrupteur marche/arrêt au dos du transformateur du système et allumez l’ordinateur désigné. Appuyez sur le bouton marche/arrêt sur le devant de l’unité (LSU) de balayage au laser. Confirmer l’apparition de la lumière verte, indiquant que l’appareil est allumé.
- Double-cliquez sur l’icône du logiciel CLE. Entrez les informations de connexion et d’attendre le SJM initialiser (10-30 s).
- Installation avec le CD fourni est nécessaire pour utiliser FCFM nouvelle imagerie fibres. Insérez le CD d’installation dans l’ordinateur, lecteur de CD et suivez les instructions à l’écran.
- Nettoyez l’unité d’imagerie des connecteur fibre optique FCFM avec une fibre plus propre. Frotter le connecteur sur le ruban de nettoyage dans un mouvement vers l’avant pour enlever toute poussière/saleté. Retirez le capuchon protecteur de jaune à l’avant de l’USJ.
- Préparer la plaque tournante de la LSU en tournant doucement le moyeu argent vers la gauche jusqu’en butée. Insérez le connecteur de fibre d’imagerie FCFM dans le moyeu avec le côté plat du connecteur vers le haut. Maintenez la fibre en place et faire tourner le moyeu argenté dans le sens horaire jusqu'à ce qu’il clique deux fois. Terminer la connexion en faisant tourner le moyeu argent vers la droite par une autre à 45°.
Remarque : Si la fibre n’est pas reconnue, vérifiez que le FCFM imagerie fibre a été installé et branché dans le bon sens. - Suivez les instructions qui seront affichera pour remplir le FCFM imagerie étalonnage de fibre. Il y a 3 étapes : test de fibre d’imagerie (1) FCFM (étapes 2.1.7 - 2.1.8), acquisition de fond (2) (étape 2.1.9), détection de fibre (3) (étape 2.1.10).
- Appuyez sur le bouton « start laser » sur l’écran. Le laser sera centré.
- Sélectionnez les flacons fraîches (jaune : calibrer ; rouge : clean ; bleu : rinçage) de l’étalonnage kit et suivez les instructions à l’écran : Placez l’extrémité distale de la FCFM imagerie fibre dans le flacon jaune et surveiller l’augmentation de fluorescence sur le moniteur, puis placez le extrémité de la fibre dans le flacon rouge (sans remuer). Attendez que la fluorescence (tel qu’indiqué sur l’écran d’ordinateur) à disparaître. Enfin, rincer l’extrémité de la fibre dans le flacon bleu.
Remarque : Si la fluorescence ne disparaît pas, nettoyez la fibre d’imagerie FCFM avec 8 % H2O2 et de tissus de nettoyage pour lentilles et recommencer. Répétez le processus jusqu'à ce que des résultats satisfaisants sont obtenus (la qualité de l’image est claire et sans marques de saleté sont apparentes). - Placez le FCFM imagerie fibre du flacon bleu. Appuyez sur « start laser » suivie de « calculer » quand cela devient une option.
- Placez le FCFM imagerie fibre dans le flacon jaune. Appuyez sur « start laser » suivie de « calculer » quand cela devient une option.
- Au cours de l’étalonnage automatisé, nettoyer l’extrémité distale de la FCFM imagerie fibre en plaçant dans le flacon rouge pour > 10 s, suivie le flacon bleu pour > 4 s, comme il est indiqué par le logiciel.
-
Collecte de données avec CLE
- Après installation, une fenêtre pour sélectionner l’emplacement de stockage et préfixe de fichier s’ouvre. Sélectionner le répertoire pour stocker les données, puis nommez le préfixe en conséquence.
- Placez les pédales afin qu’ils soient facilement accessibles par l’opérateur. Pédale de gauche : laser marche/arrêt ; pédale de centre : faire une pause ; pédale de droite : enregistrement/arrêt.
Remarque : Les commandes de laser sont également accessibles par le biais de commandes à l’écran. - Cliquez sur « Démarrer » à l’écran ou appuyez sur la pédale gauche pour allumer l’appareil. Cela démarrera l’acquisition et obtenir des images en utilisant 100 % laser de puissance et une cadence de 12 images/s (par défaut).
Remarque : Pour d’autres applications, ces paramètres peuvent être modifiés à l’écran si nécessaire, selon le type d’échantillon. - Images de chacun des échantillons une suspension bactérienne.
- Insérez l’extrémité distale de la fibre d’imagerie FCFM et déplacer la fibre lentement par le biais de la suspension d’interroger l’échantillon.
- Enregistrer des vidéos de n’importe quelle longueur (jusqu'à 10 min) en appuyant sur la pédale du pied droit ou en sélectionnant les commandes à l’écran d’enregistrement, tel que la fibre se déplace lentement autour de l’échantillon.
- Nettoyez l’extrémité distale de la fibre d’imagerie FCFM avec 8 % H2O2 et de tissus entre les échantillons de nettoyage pour lentilles.
Remarque : Les longueurs vidéo typiques de 10-30 s suffisent pour in vitro de l’imagerie.
- Images de chacun des échantillons de tissu pulmonaire.
- Insérez l’extrémité distale de la FCFM fibre d’imagerie dans l’échantillon, ce qui garantit que le contact direct entre l’extrémité de la fibre et le tissu est fait. Déplacer doucement l’extrémité de la fibre d’imagerie autour d’interroger l’échantillon.
NOTE : L’extrémité de la fibre de tissu de levage supprimera le tissu du plan focal ; Toutefois, cela peut servir à image étiquetée de bactéries qui ne sont pas respectées le tissu. - Enregistrer des vidéos de n’importe quelle longueur (jusqu'à 10 min) en appuyant sur la pédale du pied droit ou en sélectionnant les commandes à l’écran d’enregistrement, tel que la fibre se déplace lentement autour de l’échantillon.
Remarque : En général, des longueurs vidéo de 30 s suffisent pour l’imagerie ex vivo sur des tissus. - Nettoyez l’extrémité distale de la fibre d’imagerie FCFM avec tissus et 8 % H2O2 entre les échantillons de nettoyage pour lentilles.
- Insérez l’extrémité distale de la FCFM fibre d’imagerie dans l’échantillon, ce qui garantit que le contact direct entre l’extrémité de la fibre et le tissu est fait. Déplacer doucement l’extrémité de la fibre d’imagerie autour d’interroger l’échantillon.
-
Mise hors tension du système
- Éteindre le laser en appuyant sur la pédale gauche ou en cliquant sur le bouton à l’écran.
- Débranchez la fibre d’imagerie FCFM le dispositif CLE en tournant le moyeu LSU argenté dans le sens anti-horaire jusqu'à la butée. Retirez le FCFM imagerie fibre du Hub de LSU en tirant doucement sur le connecteur de la fibre de l’USJ.
- Nettoyez et désinfectez la fibre d’imagerie FCFM avec 8 % H2O2 et de tissus de nettoyage pour lentilles. Retourner les capuchons de protection à l’extrémité proximale de la fibre d’imagerie FCFM et l’avant de l’appareil LSU. Placez délicatement la fibre dans la boîte de rangement.
- Fermer les données logiciel de capture et copiez tous les fichiers enregistrés sur un périphérique USB externe. Arrêtez l’ordinateur et éteignez l’appareil LSU en appuyant sur la face avant I/O pour 3 s jusqu'à ce que la lumière verte disparaît.
- Éliminer les tissus pulmonaires humains et bactéries conformément aux réglementations locales.
3. analyse des données
- Ouvrez le logiciel et en sélectionnant le répertoire approprié sur l’ordinateur par le biais de l’icône « Aller à » sur le tableau de bord logiciel d’importer les fichiers pour analyse. Sinon, des fichiers peuvent être traînés et est tombés dans le panneau de commandes de logiciels.
- Double-cliquez sur chaque fichier vidéo pour les ouvrir. Lit les vidéos automatiquement avec la table de correspondance des couleurs optimisée (LUT) et réglage de la table des couleurs. Désactiver l’intensité automatique de mise à l’échelle, en cliquant sur le bouton de la baguette au-dessus de la barre d’échelle intensité. La fonctionnalité est désactivée lorsqu’il n’y a aucun ombrage en noir autour du bouton.
NOTE : Mise à l’échelle d’intensité automatique doit être désactivé pour empêcher l’amélioration du contraste continue tout au long de chaque vidéo, il est impossible de comparer et d’analyser des vidéos de la même série de données. - Sélectionnez l’intensité désirée, mise à l’échelle en déplaçant les barres minimum et maximum pour donner le meilleur contraste. Utilisez l’outil histogramme quand choisissant l’intensité mise à l’échelle afin d’assurer la plus large plage dynamique est capturé.
Remarque : Vérifiez que la plage dynamique est telle que les images ne sont pas saturés (c'est-à-dire limiter les régions blanches de l’image, qui indiquent la saturation), afin que les caractéristiques de faible intensité ne sont pas manqués. - Une fois la mise à l’échelle voulue a été atteint, faites un clic droit sur le bouton de menu déroulant répertorié comme « Par défaut (vert) ». Sélectionnez l’option Enregistrer le LUT. Enregistrer le LUT dans un endroit désiré.
- Pour l’autre vidéo au sein de l’ensemble des données, appliquer la même LUT par un clic droit sur le menu déroulant « Par défaut (vert) » et sélectionnez « Load LUT ». Sélectionnez le fichier approprié d’appliquer l’intensité conforme à toutes les vidéos dans un dataset.
- Exporter les vidéos transformés en cliquant sur le bouton « moulinet movie ». Sélectionner le format vidéo désiré, par exemple « à des fins de présentation », qui produira un fichier .mpg. Appuyez sur « Export » et choisi l’emplacement de fichier pour enregistrer le fichier vidéo. Instantanés d’images individuelles peuvent être exportées en cliquant sur le bouton « camera ». Il est possible d’enregistrer un fichier .png, .bmp ou .jpg. Choisir la destination du fichier, puis appuyez sur Enregistrer.
Remarque : Les vidéos ne peuvent ensuite être importés dans n’importe quel logiciel pour la préparation des présentations ou encore de quantification. Bactéries étiquetés sont visualisées comme des points verts « clignotant » dans la vidéo. La structure du tissu pulmonaire ressortira comme brins fluorescents ordonnées, avec l’espace alvéolaire qui apparaissent en noir.
Résultats
Dans cette étude, nous avons démontré une méthode pour le dépistage rapide des nouvelles sondes de bactéries spécifiques dans un modèle ex vivo pulmonaire alvéolaire humaine tissu d’infection en utilisant un appareil CLE cliniquement approuvé.
CLE par FCFM est bien adapté pour obtenir des informations structurales du poumon distal, car cette région (en raison d’une forte abondance d’élastine et de collagène) est naturellement très fluorescente lorsqu’il est excité avec un 488 nm laser8. À l’inverse, l’espace alvéolaire ne pas sont fluorescents, et ainsi permet un contraste élevé entre la structure du tissu et de l’espace aérien à être visualisée (Figure 1).
L’ajout de maladie associés sondes ou agents de contraste, telles que des sondes de bactéries spécifiques devraient permettre des informations fonctionnelles sur les processus morbides d’obtenir en temps réel. Nous avons déjà décrit la synthèse et initiale en vitro screening d’une bibliothèque de bactéries spécifiques sondes11; Lorsque la spécificité bactérienne, stabilité protéolytique et maintien en poste au sein de la membrane bactérienne au fil du temps a été déterminé. Une sonde prometteuse des bactéries spécifiques (UBI-10) a été identifiée dans l’étude, ainsi que celui qui a montré la mauvaise rétention au sein de la membrane de la cellule bactérienne (UBI-3). Ceux-ci ont été comparés à un contrôle de commercial contre-coloration (calcéine AM) qui servait à marqués de S. aureus.
Non souillées enregistré, UBI-10 marqués de S. aureus , calcéine AM et UBI-3 ont été photographié en suspension par FCFM avec 100 % 488 nm laser de puissance et une cadence de 12 images/s (Figure 2). Lorsque les bactéries non étiquetées dans du PBS ont été imagées, aucun signal fluorescent n’est décelable. Cette méthode diffère lorsque bactéries marqués ont été imagées. Lorsque les suspensions bactériennes avec UBI-3 ou UBI-10 ont été photographiées par FCFM, il était évident que la fluorescence de fond général de la solution a été élevée par rapport aux seuls contrôles de PBS, c’est parce que le jour ouvrable suivant (le fluorophore de sonde) émet une petite quantité de signal de fluorescence en solution aqueuse, cependant, points ponctuées lumineux sont visibles tout au long de la solution, sans la nécessité d’une étape de lavage. Cela est dû à une augmentation du signal de fluorescence émise par NDB dans un environnement polaire c'est-à-dire, la membrane bactérienne. Calcéine AM n’est pas une sonde activable, donc un pas de lavage après coloration bactérienne a été nécessaire pour supprimer le fond fluorescent haut de sonde non liée à la solution. Comme UBI-3 et UBI-10 bactéries marquées, étiquetées avec calcéine AM ont été détectés en solution par FCFM comme points ponctuées de verts lumineux. Comme les données sont recueillies en format vidéo, ces points semblent « twinkle » comme ils se déplacent entre les carottes et -and-out de mise au point, un trait caractéristique de l’imagerie bactéries marquées par cette méthode.
Les bactéries marqués ont été ensuite ajoutés de petites tranches de ex vivo des tissus pulmonaires humains et imagés à nouveau par FCFM (Figure 3). Où seuls PBS ou sans étiquette S. aureus a été ajouté pour le tissu pulmonaire, seulement la structure auto-fluorescente pulmonaire tissulaire a été détectée (considérés comme des brins verts vives de collagène et d’élastine et les zones sombres de l’espace alvéolaire). Pas ponctuée de points ont été détectés pour ces conditions de contrôle. De même, la structure de tissu seul poumon (et pas ponctuée de points) a été visualisées pour l’état des tissus pulmonaires avec S. aureus plus UBI-3 ; indiquant que cette sonde ne restait pas stablement dans le bacterial cell membrane c'est-à-dire, il a été emporté et/ou se dégrade en présence d’enzymes protéolytiques natives dans le tissu pulmonaire (comme démontré précédemment11).
Toutefois, les points ponctuées lumineux étaient visibles dans les deux la calcéine AM étiqueté échantillon de S. aureus de contrôle positif et avec la sonde plus prometteur des bactéries spécifiques (UBI-10), S. aureus échantillon. Les points « scintillant » étaient visibles malgré l’autofluorescence de tissu solide (Figure 3). Ainsi, les résultats obtenus par FCFM a été en concurrence avec l’in vitro de la présélection du panneau des sondes de bactéries spécifiques par CLSM et démontré une méthode de détection cliniquement pertinente pour l’imagerie en temps réel, les infections.
Les résultats présentés ici montrent que le poumon est un système d’organe compétent pour l’imagerie par FCFM en raison de son caractère distinctif autofluorescence. Les structures lumineuses distinctifs permettent à l’opérateur CLE déterminer qu’elles sont dans l’espace alvéolaire. Ces régions, couplées avec les sacs d’air alvéolaires sombres offrent un décor parfait pour l’imagerie des bactéries fluorescent étiquetés avec un contraste élevé.
Bien que la détection de bactéries présentées dans cette étude est déterminée qualitativement en visualisant les points ponctuées lumineux, il serait possible de quantifier le nombre de points ponctuées, image par image en utilisant un logiciel secondaire afin de caractériser bibliothèques de la sonde.
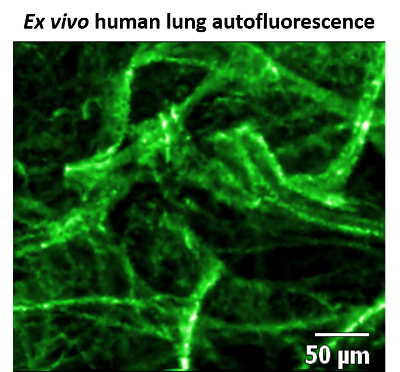
Figure 1 : Une image statique d’autofluorescence des tissus pulmonaires humains. Confocal laser endomicroscopie (CLE) image de ex vivo des tissus pulmonaires humaines à l’aide de la microscopie en fluorescence confocale fibré (FCFM), à une excitation 488 nm et de puissance 100 % laser, 12 images/s. élastine et collagène sont très fluorescent (faux de couleur verte), considérant que l’espace alvéolaire n’est pas et s’affiche en tant que région noire. Ce chiffre a été modifié par Akram et al. 11 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
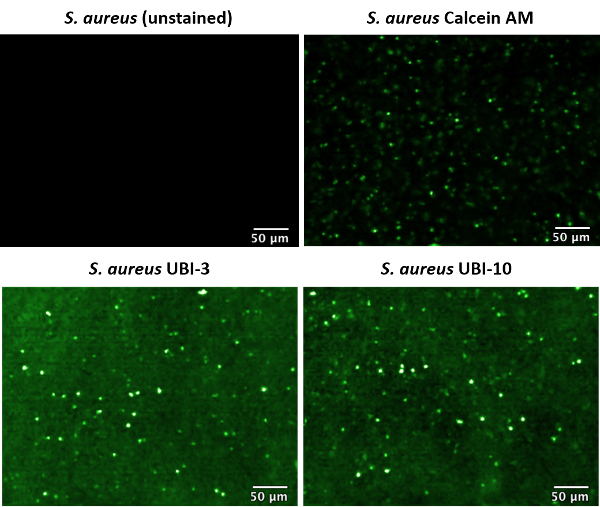
Figure 2 : Image endomicroscopie (CLE) laser confocal de marquées S. aureus en suspension. Microscopie à fluorescence confocale fibré (FCFM) servait à bactéries préalablement étiquetés d’image, à une excitation 488 nm et de puissance 100 % laser, 12 images/s. étiquetées bactéries affiche très fluorescents points ponctuées (fausse couleur vert). Ce chiffre a été modifié par Akram et al. 11 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : Image endomicroscopie (CLE) laser confocal de ex vivo des tissus pulmonaires humaines avec marqué S. aureus. Microscopie à fluorescence confocale fibré (FCFM) servait à image ex vivo humaine du tissu pulmonaire et étiqueté S. aureus, à une excitation 488 nm, puissance 100 % laser et les 12 images/s. étiquetées bactéries Voir la comme très fluorescents points ponctuées (fausse couleur vert) au sein de l’échantillon de tissu pulmonaire quand étiqueté avec calcéine AM ou UBI-10. Le contraste plus élevé est observé lorsque les bactéries sont imagés au sein de l’espace alvéolaire. Ce chiffre a été modifié par Akram et al. 11 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Infections des voies respiratoires inférieures représentent la deuxième plus forte charge de morbidité dans le monde12,13et une forte hausse le nombre d’infections attribuées à des bactéries résistantes aux antimicrobiens a été rapporté14. Pneumonie reste une cause fréquente d’hospitalisation. En réanimation, le développement d’une pneumonie est aggravé par l’incertitude diagnostique et est associé à un taux de mortalité extrêmement élevé15. Lors de l’apparition de la pneumonie, les bactéries prolifèrent au sein de l’espace alvéolaire pulmonaire distale, une zone qui est relativement stérile, avec le microbiote minimal en matière de santé.
Cette méthode décrit relativement tardive stade ex vivo validation des bactéries spécifiques optique d’imagerie sondes11, mais la conception, synthèse et évaluation de sonde avant le début de cette étape de validation est impérative, comme démontré précédemment11 .
CLE est une technique émergente clinique d’interrogation de maladie précise in situ en temps réel. Il offre de nombreux avantages par rapport aux techniques traditionnelles d’enquête sur les présumés pathologie pulmonaire, qui peut impliquer une biopsie et une collection du liquide de lavage. Biopsies sont invasives et peuvent provoquer la morbidité et la mortalité chez les patients ventilés, et le liquide de lavage collectées est souvent contaminé par des bactéries présentes dans les voies aériennes supérieures. L’utilisation de la CLE dans la détection de la pneumonie est cependant quelque peu limitée en raison de la mauvaise disponibilité d’imagerie compatible sondes qui peuvent fournir des informations fonctionnelles de la maladie, malgré les nombreux efforts concertés10. Combinant la CLE avec agents optiques offre la perspective de diagnostic de pneumonie plus rapide et moins invasive par rapport aux pratiques actuelles de standard.
Les étapes critiques du présent protocole sont dans la préparation de l’échantillon et le programme d’installation de la plateforme CLE. Obtention des tissus humains liées à l’application clinique finale est également importante, tels que les tissus pulmonaires humains comme l’a démontré dans cette étude. Il est nécessaire d’utiliser des tissus humains parce que l’étendue des tissus autofluorescence montre de grandes variations entre les espèces et peut donc induire en erreur la sensibilité de la sonde de bactéries étant imagée. En outre, il est essentiel d’obtention d’éthique pour la récupération et l’utilisation des tissus pulmonaires humains. D’une technique niveau, bon nettoyage, fixation de la fibre d’imagerie sur la plate-forme d’imagerie LSU et l’étalonnage est indispensable pour la bonne résolution et l’imagerie cohérente, comme est d’assurer une quantité équivalente de bactéries est ajoutée à chaque échantillon de tissu pulmonaire. Pour accroître l’utilité de cette méthode de dépistage des panneaux des sondes, il est nécessaire de répéter la procédure avec un éventail d’agents pathogènes, tels que ceux qui sont susceptibles d’être des agents responsables de la pneumonie.
La plus grande limitation de cette technique est que l’appareil cliniquement approuvé de CLE n'a qu’un seul laser (488 nm). Donc, actuellement, le choix du fluorophore pour la conception de la sonde est limité pour une utilisation avec ce système, si cliniquement approuvé unicolores dispositifs existent avec excitation longueurs d’onde de 660 nm et le proche infrarouge. Il est hautement souhaitable de disposer d’une deuxième ligne laser mis en œuvre dans le même appareil pour activer une sonde à développer avec un fluorophore spectralement distinct pour améliorer la sensibilité des bactéries-sonde sur le niveau de tissu autofluorescence. Tandis que les dispositifs de CLE bicolores sont en cours d’élaboration, ils ne sont pas cliniquement soit approuvées et/ou leur coût est significative16.
CLE in vitro à l’aide de bactéries pathogènes et ex vivo des tissus pulmonaires humaines aux sondes potentielles d’écran comble le fossé entre les classiques en vitro techniques comme la cytométrie en flux et CLSM et utilité clinique. Cette étape vous propose de confiance lors de la sélection des composés prometteurs reporterez être couplé avec CLE Clinique d’imagerie ; et fournira une indication quant à savoir si la sonde testée conserve la spécificité de cible, ou montre tout étiquetage hors cible, tels que la liaison directement vers les tissus ou montre l’instabilité avec hôte des enzymes protéolytiques. Il serait également judicieux d’ajouter chacune des sondes activables directement à des échantillons de tissus pulmonaires humains plus de bactéries, pour caractériser complètement la vitesse de la sonde liaisons et l’activation en temps réel.
Nous croyons que notre portefeuille pour contrôler rapidement de nouvelles sondes de bactéries spécifiques afin d’évaluer leur potentiel pour l’imagerie du poumon distal des patients se traduira par une traduction beaucoup plus rapide à la clinique. C’est en grande partie parce que la sonde de bactéries spécifiques ont pu être livrée sur place dans le poumon par un cathéter inséré dans le canal opérateur d’un bronchoscope, ce qui signifie que microdose (< 100µg) montants pouvaient être livrées. Par conséquent, délivrance systémique et biodistribution du composé n’est pas un sujet de préoccupation, comme c’est le cas pour de nombreux autres objectifs de l’infection dans le corps, ou avec l’imagerie nucléaire. En outre, offrant la sonde d’imagerie dans une telle petite dose réduit le risque de toxicité des complications (bien qu’il faudrait recourir au dépistage de la toxicité pour la traduction). Après instillation de la sonde, le cathéter pourrait ensuite être remplacé par la fibre FCFM et dans la même région du poumon interrogé par CLE, de la même manière nous avons effectué au sein de cette méthode. L’imagerie doit être effectuée rapidement après l’installation de la sonde avant que la sonde lave aux concentrations indétectables.
Il est également important de noter que le dépistage de maladies-identification des sondes par cette technique ne devrait pas être limitées à des agents bactériens-imagerie, mais pourrait également s’étendre à la validation des sondes avec des cibles alternatives, telles que l’inflammation. Cette approche devrait également être adaptable à d’autres endroits de la maladie dans le corps lorsque l’imagerie via FCFM est autorisé.
Déclarations de divulgation
KD : Directeur fondateur de l’imagerie moléculaire d’Édimbourg. Conseils reçus de Mauna Kea Technologies comme conseiller.
MB : Directeur fondateur de l’imagerie moléculaire d’Édimbourg.
Remerciements
Nous tenons à remercier Engineering and Physical Sciences Research Council (EPSRC, Royaume-Uni) Collaboration interdisciplinaire de recherche subvention EP/K03197X/1, le ministère de la santé et le Wellcome Trust à travers le fonds défi santé l’Innovation (HICF) . Numéro de référence de financement : 0510-069.
matériels
| Name | Company | Catalog Number | Comments |
| 1-14 Microfuge | SciQuip | 90616 | Small benchtop microcentrifuge |
| 96-well plate | Corning | 3370 | Assay plate |
| Calcein AM | Sigma Aldrich | 17783 | Commercial fluorescent dye |
| Cellvizio 488 nm Research CLE | Mauna Kea Technologies | LC-0001-488 | Confocal laser endomicroscopy device |
| Cletop-S | Cletop | 14110601 | Fibre cleaner |
| Eppendorf (1.5 mL) | Eppendorf | 30120086 | 1.5 mL microfuge tube |
| Eppendorf Research Plus Pipettes | Fisher Scientific | 11568663 | Micro pipettes |
| Falcon tube (50 mL) | Scientific Lab Supplies | 352070 | 50 ml centrifugation tube |
| Gibco Phosphate Buffered Saline | Thermo Fisher Scientific | 10010023 | PBS - wash media |
| IC-Viewer | Mauna Kea Technologies | LW-0001 | Data collection and processing software for the research CellVizio 488 nm system |
| Incu-Shake midi | Sciquip | SQ-4020 | Floor standing shaking incubator |
| Lysogeny Broth | Sigma Aldrich (Miller) | L3522 | LB Growth media for S. aureus |
| non-standard research AlveoFlex 488 nm | Mauna Kea Technologies | MP-0002-AF3 | Fibred confocal fluorescence microscopy fibre |
| Quanti Kit 488 nm | Mauna Kea Technologies | LQ-0005 | Calibration kit for the CellVizio 488 system |
| S. aureus ATCC 25923 | ATCC | 25923 | Bacterial strain used in this study |
| Semi-micro spectrophotometry cuvette | Sigma Aldrich | C5416-100EA | For spectrophotometry |
| Thermomixer comfort | Eppendorf | 41102422 | Benchtop heater with shaking |
| UV 1101 Biotech photometer | Biochrom WPA | Spectrophotometer |
Références
- Tackling drug-resistant infections globally: final report and recommendations. London: H M Government/Wellcome Trust Available from: https://amr-review.org/sites/default/files/160518_Final%20paper_with%20cover.pdf (2016)
- Caliendo, A. M., et al. Better Tests, Better Care: Improved Diagnostics for Infectious Diseases. Clin. Infect. Dis. 57, 139-170 (2013).
- Zumla, A., et al. Rapid point of care diagnostic tests for viral and bacterial respiratory tract infections-needs, advances, and future prospects. Lancet Infect. Dis. 14 (11), 1123-1135 (2014).
- Neumann, H., Kiesslich, R. . Yamada's Textbook of Gastroent. , 2944-2949 (2015).
- Chauhan, S. S., et al. Confocal laser endomicroscopy. Gastrointest Endosc. 80 (6), 928-938 (2014).
- Goetz, M., Malek, N. P., Kiesslich, R. Microscopic imaging in endoscopy: endomicroscopy and endocytoscopy. Nat Rev Gastroenterol Hepatol. 11 (1), 11-18 (2014).
- Abbaci, M., et al. Confocal laser endomicroscopy for non-invasive head and neck cancer imaging: A comprehensive review. Oral Oncol. 50 (8), 711-716 (2014).
- Thiberville, L., et al. Human in vivo fluorescence microimaging of the alveolar ducts and sacs during bronchoscopy. Eur Respir J. 33, (2009).
- Thiberville, L., et al. Confocal fluorescence endomicroscopy of the human airways. Proc Am Thorac Soc. 6 (5), 444-449 (2009).
- Mills, B., Bradley, M., Dhaliwal, K. Optical imaging of bacterial infections. Clin. Transl. Imaging. 4 (3), 163-174 (2016).
- Akram, A. R., et al. A labelled-ubiquicidin antimicrobial peptide for immediate in situ optical detection of live bacteria in human alveolar lung tissue. Chem. Sci. 6 (12), 6971-6979 (2015).
- Dickson, R. P., Erb-Downward, J. R., Huffnagle, G. B. Towards an ecology of the lung: new conceptual models of pulmonary microbiology and pneumonia pathogenesis. Lancet Respir Med. 2 (3), 238-246 (2014).
- Lozano, R., et al. Global and regional mortality from 235 causes of death for 20 age groups in 1990 and 2010: a systematic analysis for the Global Burden of Disease Study 2010. Lancet. 380 (9859), 2095-2128 (2012).
- Magiorakos, A. P., et al. The rise of carbapenem resistance in Europe: just the tip of the iceberg. Antimicrob Resist Infect Control. 2 (1), 6 (2013).
- Chastre, J., Fagon, J. -. Y. Ventilator-associated Pneumonia. Am. J. Respir Crit Care Med. 165 (7), 867-903 (2002).
- Krstajić, N., et al. Two-color widefield fluorescence microendoscopy enables multiplexed molecular imaging in the alveolar space of human lung tissue. J Biomed Opt. 21 (4), 046009-046009 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon