Method Article
Détermination des propriétés thermodynamiques des alliages de métaux alcalino-terreux-liquide en utilisant la Technique de Force électromotrice
Dans cet article
Résumé
Ce protocole décrit la mesure de la force électromotrice d’éléments alcalino-terreux dans les alliages métalliques liquides à des températures élevées (723-1 123 K) afin de déterminer leurs propriétés thermodynamiques, y compris l’activité, entropie molaire partielle, molaire partielle enthalpie et des températures de transition de phase, sur une plage large composition.
Résumé
Une cellule électrochimique novateur basée sur un électrolyte solide de FAC2 a été développée pour mesurer la force électromotrice (emf) des alliages de métaux alcalino-terreux-liquide binaires en fonction de la composition et la température afin d’acquérir données thermodynamiques. La cellule se compose d’un chimiquement stables à l’état solide FAC2-AF2 électrolyte (où A est l’élément alcalino-terreux comme Ca, Sr ou Ba), avec alliage binaire de A-B (où B est le métal liquide comme Bi ou Sb) travail des électrodes et un pur un métal électrode de référence. EMF données sont collectées sur une plage de température de 723 à 1 123 K en incréments de 25 K pour plusieurs compositions d’alliages par l’expérience et les résultats sont analysés pour obtenir les valeurs de l’activité, températures de transition de phase et les entropies/enthalpies molaires partielles pour chaque composition.
Introduction
Les mesures de force électromotrice (emf) peuvent directement déterminer la modification partielle molaire enthalpie libre de réaction chimique et fournissent des propriétés thermodynamiques précises comme activité, enthalpie molaire partielle et entropie molaire partielle1. L’acquisition de données thermochimiques est cruciale à une variété de sujets de recherche dans la communauté de matériaux, de l’affinement des diagrammes de phase multi-composants, à la validation expérimentale des matériaux de premier-principe de modélisation, à la synthèse de nouveaux intermétalliques espèces ayant des propriétés avantageuses. Récemment, Kim et coll. utilisées mesures emf afin d’évaluer la viabilité de l’utilisation des électrodes métalliques liquides à séparer les espèces alcalino-terreux des électrolytes sel fondu2.
Séparation électrochimique à l’aide de sels fondus (p. ex., LiCl-KCl) est une technologie prometteuse pour séparer l’uranium et transuraniens métaux du combustible nucléaire pour le recyclage de3. Comme le combustible irradié est traitée comme une anode dans le sel fondu, avec des potentiels de réduction standards plus faibles que l’uranium, les produits de fission sont oxydés et s’accumulent dans le sel fondu sous forme d’ions dissoutes (p. ex., Ba2 +Sr2 +, Cs+et terres rares les cations métalliques)4. Par conséquent, l’électrolyte sel fondu doit être remplacé périodiquement ou traitée à la suite de séparer les produits de fission accumulé4. Particulièrement préoccupants sont les produits de fission de l’alcali/alcalino-terreux (Ba2 +, Sr2 +et Cs+) car ces ions présentent les potentiels de réduction standard le plus bas parmi les cations constitutifs, ce qui les rend difficiles à séparer de la solution de sel fondue.
Cependant, Lichtenstein et coll. a récemment démontré que baryum présente une faible activité thermodynamique dans le bismuth liquide (8,7 x 10-12 au baryum mole fraction xBa (en Bi) = 0,05, 1 123 K), ce qui implique de fortes atomique interactions entre le baryum et le bismuth5. Kim et coll. a observé que ces interactions a provoqué un changement dans les potentiels de dépôts d’ions baryum dans une électrode de bismuth liquide (-3.74 V à-2.49 V vs Cl–/CL2(g)), ce qui entraîne un dépôt préférentiel de baryum de la solution d’électrolyte (BaCl2- LiCl-CaCl2- NaCl, 16-29-35-20 mol%) 773-973 K6. Ce changement de potentiel de dépôt pourrait être exploité à l’aide des électrodes métalliques liquides produits de fission alcalins/alcalino-terreux sélectivement séparer l’électrolyte utilisé pour le traitement électrochimique du combustible nucléaire irradié. Pour déterminer la viabilité de séparer les produits de fission alcalins/alcalino-terreux d’électrolyte sel fondu, les propriétés thermodynamiques de ces éléments dans les éventuels métaux liquides (p. ex., Bi, Sb) doivent être déterminées.
Dans des études précédentes, Delcet et coll. utilisé titrage coulométrique pour déterminer les propriétés thermodynamiques des alliages binaires (par exemple, Ba-Bi, Ba-Sb, Ba-Pb)7. Pour les alliages de Ba-Bi jusqu'à xBa = 0,50, ils salariés titrage coulométrique utilisant un électrolyte de2 BaF monocristaux à 1 123 K et observé des valeurs d’activité comparable de baryum dans le bismuth (2,4 x 10-12 à x BA (en Bi) = 0,05, 1 123 K). Toutefois, il a été signalé que les résultats étaient inexacts en raison de l’incertitude au sujet de la teneur en baryum dans les alliages binaires. Baryum métal est très réactive et soluble dans ses sels haloïdes (~ 15 mol% de BaCl2 à 1 163 K), qui peuvent causer la conduction électronique accrue dans le sel haloïde aux températures plus élevées et conduire à inexacte comptabilité composition durant coulométrique titrage. Pour déterminer les propriétés thermodynamiques (p. ex., excès partielle molaire enthalpie libre, enthalpie molaire partielle, entropie molaire partielle) des alliages binaires contenant des éléments très réactifs, la méthode décrite dans le présent protocole a été utilisée.
Propriétés thermochimiques des alliages binaires peuvent être déterminées en mesurant l’équilibre cellulaire potentiel Ecellule (c.-à-d., emf) d’un alliage (A-B) par rapport au potentiel de référence de la pur a métal. Ensuite, le potentiel de la cellule est directement lié à la variation partielle molaire enthalpie libre (ou potentiel chimique) de la réaction de la cellule selon la relation de Nernst (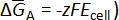 ).
).
Pour les mesures emf des alcalino-terreux alliages dans cet ouvrage, l’ion fluorure conductrice CaF2 choisie comme électrolyte base car la Ca2 +/nom potentiel redox (E0 =-5.59 V) est plus négatif que l’autre potentiels rédox alcalino-terreux (par exemple, 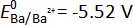 ,
, 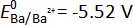 versus F–/f2(g) à 873 K) dans le système de fluorure8. Cela implique que la CaF2 est plus chimiquement stable que les autres fluorures alcalino-terreux AF2 (A = Sr ou Ba), et que Sr2 + ions Ba2 + ou sont les espèces électroactives dans les FAC2BaF -2 et de la CaF 2- SrF2 électrolyte, respectivement. Grâce à la grande stabilité de CaF2, qui minimise les réactions secondaires avec Ba ou Sr alliages ainsi que de la conductivité ionique de CaF2 à des températures élevées, les FAC binaire monophasé2électrolyte de AF -2 a été utilisée avec succès pour mesurer avec précision l’emf d’alliages de métaux alcalino-terreux-liquide binaires. Confirmation de la formation de l’électrolyte binaire monophasé est confirmée par analyse de la diffraction des rayons x (DRX) Figure 19.
versus F–/f2(g) à 873 K) dans le système de fluorure8. Cela implique que la CaF2 est plus chimiquement stable que les autres fluorures alcalino-terreux AF2 (A = Sr ou Ba), et que Sr2 + ions Ba2 + ou sont les espèces électroactives dans les FAC2BaF -2 et de la CaF 2- SrF2 électrolyte, respectivement. Grâce à la grande stabilité de CaF2, qui minimise les réactions secondaires avec Ba ou Sr alliages ainsi que de la conductivité ionique de CaF2 à des températures élevées, les FAC binaire monophasé2électrolyte de AF -2 a été utilisée avec succès pour mesurer avec précision l’emf d’alliages de métaux alcalino-terreux-liquide binaires. Confirmation de la formation de l’électrolyte binaire monophasé est confirmée par analyse de la diffraction des rayons x (DRX) Figure 19.
Pour mesurer la cellule potentiel d’un alliage alcalino-terreux, la cellule électrochimique suivante a été implémenté à l’aide d’un à semi-conducteurs FAC binaire2-AF2 (97 mol % CaF2, 3 mol % AF2) électrolyte10:
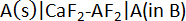 ,
,
où le pur alcaline – terre metal A (A = Ca, Sr ou Ba) sert de l’électrode de référence (RE),2-AF2 FAC solide comme électrolyte, fixe des alliages de composition A-B comme électrodes (nous) et B est un métal liquide candidat comme Bi ou Sb. Les réactions demi-élément élément dans la cellule électrochimique sont :
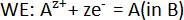
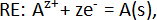
et la réaction globale de la cellule est :
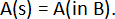
où e– est un électron échangé dans les réactions cellulaires et z est le nombre d’électrons échangés (z = 2 pour les éléments des alcalino-terreux). Pour cette réaction globale, la variation partielle molaire enthalpie libre du métal A, 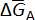 , est donnée par :
, est donnée par :
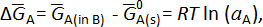
où est le Gibbs standard libre énergie de pur un métal, R est la constante des gaz parfaits, T est la température en Kelvin et d' uneA est l’activité de A à la b de métal. La FEM de la cellule mesurée, Ecell, est directement liée à la variation partielle molaire enthalpie libre de A par l’équation de Nernst
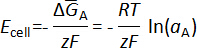
où F est la constante de Faraday.
Protocole
1. fabrication de composants de la cellule électrochimique
- Fabrication de la binaire CaF 2-électrolyte 2 AF
- calculer la masse nécessaire pour chaque composant du fichier binaire ELECTROLYTE pour un mélange de 5,0 g ± 350,0 avec 97 mol % CaF 2 et 3 mol % AF 2 (p. ex., 333,4 g de CaF 2 et 16,6 g SrF 2).
- Mesure sortie et verser le mélange de sels dans une bouteille en plastique de 1,5 L, avec environ 1,3 kg de zircone stabilisée à l’yttrium fraisage médias (3 mm de diamètre) et 25,0 ± 0,1 g d’alcool polyvinylique (PVA, liant organique). Puis ajoutez l’alcool isopropylique (IPA) jusqu'à ce que la bouteille soit 4/5 complet. Fermer le flacon et agiter manuellement son contenu pendant environ 1 min répartir les composants du mélange.
- Placer la bouteille en plastique avec le mélange de sels sur le broyeur à boulets (deux rouleaux, 12,5 " longueur). Régler la vitesse de la broyeur à boulets à 250 tours par minute (tr/min) et Moulin pendant 24 h.
- Verser le mélange dans un tamis (maille 10) dans une casserole pour séparer les médias de la mouture et le mélange de sels. À l’aide d’une pissette, rincer le tamis légèrement avec 10 mL d’IPA pour capturer le reste du mélange.
- Sécher le mélange homogène blanchi-ball sous une hotte pour ~ 24 h et puis Hachez le mélange en poudre fine à l’aide d’un mortier et un pilon.
Remarque : Si le processus de séchage doit être accéléré, le moule peut être placé sur une plaque chauffante sur 373 K. - Mesurer 130,0 ± 1,0 g de poudre d’électrolytes et charge la poudre uniformément dans une matrice de pellet (diamètre 75 mm, hauteur 60 mm).
- à l’aide d’une presse de matrice, presser uniaxialement la poudre avec 30 MPa de pression pendant 2 mn pour former un vert-pellet 75 mm de diamètre et 17 mm d’épaisseur. Pour supprimer le culot de la filière granulés, inverser la matrice pellet, placer un anneau en acier inoxydable (101 mm de diamètre extérieur (OD), hauteur 35 mm, 4,8 mm d’épaisseur) centré sur le dessus de la filière granulés avec le culot centré dans l’anneau. Enfoncez doucement le punch de die granulés avec ~1.0 bar de pression pour enlever la pastille de la matrice.
- Utiliser une mèche fine (1 mm de diamètre) pour créer des trous (~0.5 mm de profondeur) dans la pastille verte, une au centre et six également espacés 25.4 mm entre les centres de forage. Puis utilisez le gros foret (11,2 mm de diamètre) pour forer manuellement des sept puits centrées sur les trous, chacun environ 12 mm de profondeur (environ les ¾ de la voie par le culot).
- Pour chaque calotte six électrolyte requis, mesurer 4,5 ± 0,5 g de poudre d’électrolytes et charger la poudre uniformément dans un moule de pellet (diamètre de 19 mm, 50 mm de hauteur).
- Appuyez uniaxialement sur la poudre d’électrolytes avec 7,5 MPa pendant 1 min dans une pastille verte de 19 mm × 10 mm de diamètre et d’épaisseur. Pour supprimer le culot de la filière granulés, inverser la matrice pellet, placer un anneau en acier inoxydable (37,5 mm OD, hauteur 30 mm, 3,5 mm d’épaisseur) centré sur le dessus de la filière granulés avec le culot centré dans l’anneau. Enfoncez doucement le punch de die granulés avec ~1.0 bar de pression pour enlever la pastille de la matrice. Utiliser une mèche fine (2 mm de diamètre) pour forer manuellement un trou central à travers chaque Cap.
Remarque : Vert pastilles de 1.1.8. et 1.1.10. sont prêts pour frittage former un électrolyte solide monophasé dans les étapes suivantes. - Chaque pellet électrolyte grand et de l’ensemble des six chapeaux petite électrolyte, recouvrir légèrement une plaque d’alumine (10 cm de diamètre, 4,65 mm d’épaisseur) avec de la poudre d’alumine grossier pour faciliter la séparation de la pastille frittée de la plaque de l’alumine. Placer les morceaux d’électrolyte sur le dessus de la poudre d’alumine, tels qu’ils ne touchent pas l’autre.
- Placer l’ensemble ci-dessus de 1.1.11 dans un four à haute température boîte. Les pièces avec le profil de chauffage suivant de frittage : 393 K pendant 12 h pour enlever l’humidité, 823 K pendant 12 h pour brûler le PVA et 1 273 K pendant 3 h à fritter, avec des taux de 5 K/min de chauffage. Refroidir ensuite à 298 K à raison de 2,5 K/min.
- Fabrication des électrodes alcalino-terreux alliage
- dans une boîte à gants rempli d’argon, mesurer la masse des deux composantes de l’alliage binaire, avec une masse totale d’au moins 6,0 g (p. ex., 5,6 g de Bi et 0,4 g de Ba alliage de Ba-Bi au baryum mole fraction x Ba = 0,10). Placer dans un plateau et de retirer de la boîte à gants.
Remarque : Les métaux réactifs sont stockées sous huile minérale pour éviter l’oxydation. Pour enlever l’huile minérale, laisser agir les morceaux de métal alcalino-terreux dans l’acétone pour 10 s. - Placer toutes les pièces métalliques sur le centre de la scène de l’arc-fondeur et fixer la scène.
- Pull vide sur la chambre pour 3 min jusqu'à l’obtention d’un vide d’environ -1,0 bar (pression manométrique) et puis remplir d’argon à 0.0 bar (pression manométrique). Répétez cette procédure au moins trois fois pour assurer une atmosphère inerte argon pendant le processus de fusion arc.
- Fermer le bouclier de protection de l’oeil sur l’unité de l’arc-fondeur et sur le courant pour créer un arc électrique stable entre la scène et la pointe de l’électrode de l’arc-fondeur. Faire fondre les morceaux de métal en une seule pièce homogène en exposant les pièces à l’arc électrique. Suffisant de fusion peut être confirmé par l’absence de phases distinctes observables dans la pièce en alliage.
Remarque : Si des éléments très réactifs sont fondus, en utilisant un courant élevé pendant plus de 5 ~ s pouvez vaporisation du matériau et provoquer des incohérences dans la composition de l’alliage. - Après la fonte des pièces en un seul alliage, éteignez le courant et l’arc-fondeur. Dévisser la scène de la chambre, retournez l’alliage et revisser la scène dans la chambre de l’arc-fondeur. Répétez 1.2.3 - 1.2.5 trois fois pour former un alliage homogène.
- Après re-fusion de l’alliage, dévissez la scène de la chambre à nouveau et casser ou couper l’alliage en environ 3 à 6 petits morceaux. Placer les morceaux sur la scène et revisser la scène dans la chambre de l’arc-fondeur. Faire fondre les morceaux en une seule pièce suivant étapes 1.2.3 - 1.2.5.
- Laisser le système refroidir pendant 3-5 min. détacher la scène du système arc-fondeur et conserver l’alliage dans un sac en plastique. Placez le sac sous une atmosphère inerte argon (p. ex., boîte à gants) jusqu'à l’assemblage final cellule électrochimique.
Remarque : Pour chaque expérience, deux morceaux d’alliage électrode référence et jusqu'à quatre travaillant électrode alliage pièces de différentes compositions seront requis.
- dans une boîte à gants rempli d’argon, mesurer la masse des deux composantes de l’alliage binaire, avec une masse totale d’au moins 6,0 g (p. ex., 5,6 g de Bi et 0,4 g de Ba alliage de Ba-Bi au baryum mole fraction x Ba = 0,10). Placer dans un plateau et de retirer de la boîte à gants.
- Préparation des câbles électriques de tungstène et thermocouple
- Couper 6 fils de tungstène (1 mm de diamètre) 46 cm de longueur. Manuellement de sable sur toute la longueur de chaque fil pour éliminer les contaminants de surface, comme une couche d’oxyde, à l’aide de papier d’émeri grain 100. Nettoyer la surface du fil à l’aide de lingettes humidifiés avec de l’acétone.
- Insérer le fil dans un tube d’alumine (6,35 mm de diamètre, 30,5 cm de long) qui permettra d’éviter un court-circuit électrique entre l’électrique conduit et test en acier inoxydable de chambre pendant la mesure électrochimique. Laisser environ 12,7 cm à une extrémité (en bas) dans le bare fil pour prise de contact avec les électrodes et 2,5 cm de l’autre côté (en haut) pour fils de contact électrique avec le potentiostat.
- Mélanger environ 3 g d’époxy de remède rapide et durcisseur pendant 1 min à l’aide de l’extrémité d’un bâtonnet de bois.
- Avec le fil dans le tube, appliquer environ 3 g de l’époxy à l’extrémité supérieure du tube à sceller. Poser le tube et fil verticalement à l’aide d’un stand de laboratoire et permettre à l’époxy guérir pendant 15 min. répétition pour chaque fil de tungstène (fil électrique).
- Insérer l’extrémité inférieure d’un thermocouple de 45 cm (type K) dans la partie supérieure d’un nouveau tube d’alumine long de 30,5 cm et étanchéiser l’écart entre le tube de thermocouple et d’alumine à l’aide d’un époxyde de remède rapide semblable à l’étape 1.3.4, laissant environ 5 mm du thermocouple exposée au sommet. Laissez l’époxy à polymériser pendant 15 min.
2. Assemblage de la cellule électrochimique
- nettoyage des composants d’assemblage de la cellule électrochimique
- avant l’assemblage de la cellule électrochimique, dépolir la surface intérieure de la chambre d’essai en acier inoxydable avec 100 papier d’émeri de grain jusque là n’est aucune contamination visible sur les surfaces en acier inoxydable. Nettoyer la chambre d’essai, des bouchons de chambre et creuset en alumine (8,2 cm de diamètre, 3. 0 cm hauteur) en utilisant de l’eau désionisée et rincer avec IPA.
- Laisser agir les parties de l’aménagement sous vide et les joints toriques dans l’isopropanol pendant environ 10 min et laissez-les sécher dans l’étuve à ~ 373 K. appliquer une mince couche de graisse sous vide à joints toriques pour l’amélioration de la qualité sous vide. Puis déplacez tous les composants de configuration électrochimique dans une boîte à gants argon rempli pour Assemblée.
- De chargement de l’assembly de cellule électrochimique
- Placer l’électrolyte fritté (étape 1.1) au milieu du creuset alumine situé dans la porte de chambre test.
- Charger assez matériau d’électrode dans chaque puits, telle que la partie supérieure de la matière est affleure la surface de l’électrolyte. Remplir deux puits avec matériaux d’électrode de référence (p. ex., Ba-Bi (x Ba = 0,05)) de composition identique. Puis remplissez quatre puits avec travail matériau d’électrode, chaque bien ayant une composition différente ( Figure 2). Dans cette étape, façonner les matériaux d’électrodes arc-fondu à proximité de la forme cylindrique des puits électrolytique et percez un centre par trou (diamètre 2 mm) pour l’insertion de fil électrique à l’aide des outils d’usinage (p. ex., mini tour, forets, etc.) .
Remarque : Réduire au minimum la durée de l’exposition des échantillons d’air pour limiter l’oxydation. Une oxydation est indiquée par la présence d’une couche de surface non brillant (terne) sur les échantillons. Pour retirer la couche d’oxyde, poncer la surface de l’échantillon à l’aide de papier d’émeri grain 100 et nettoyer avec un chiffon sec. - Insérez le fil électrique (fil de tungstène avec tube d’alumine au point 1.3) à travers le vide montage de port de la PAC de la chambre, les déflecteurs de la chambre, le trou dans un plafond d’électrolyte et dans le trou à une électrode en alliage. Répétez cette procédure pour tous les six électrodes. Puis insérez le thermocouple à travers le vide dernier montage port et dans le septième puits au centre. Fermement de toucher la surface de l’électrolyte à l’alliage. Un ensemble complet est illustré dans la Figure 2 et Figure 3.
Remarque : Chaque fil de tungstène doit toucher fermement la surface de l’électrolyte. Si l’alliage est trop fragile à usiner, le fil de tungstène peut être tenu appuyé contre l’alliage en appuyant sur le fil contre l’alliage et de sécuriser son placement en serrant le vide sur le vide montage port. - Placer le grand joint torique dans la rainure du haut de la chambre à vide en acier inoxydable. Abaissez soigneusement les cellules électrochimiques assemblés dans la chambre d’essai. Bien serrer tous les composants de vide-joint et le collier de la chambre d’essai.
- Enlever l’humidité et l’oxygène de l’assemblage de cellule électrochimique pour la mesure de l’emf
- charger la chambre d’essai assemblés dans un four à creuset. Mettre 2 couches qui se chevauchent d’isolant en fibre de verre autour de la surface exposée de la chambre à vide qui n’est pas dans le four pour assurer une répartition uniforme de la température dans la cellule électrochimique et prévenir la défaillance des joints époxy au sommet de l’épreuve chambre.
- Fixer les canalisations d’eau refroidissement sur les ports tube refroidissement en entrée et sortie de la chambre d’essai ( Figure 3 et Figure 4).
- Attacher la ligne vide/argon à l’entrée de la chambre d’essai et fermer la valve de port de sortie. Évacuer la chambre d’essai jusqu'à ce que le manomètre à vide est inférieure à 10 mtorr.
Remarque : Si le niveau de vide ne peut pas atteindre moins de 10 mtorr, cocher composants de sceau de la chambre d’essai, y compris les joints toriques, colliers, raccords de tube et époxy phoques. - Sous vide active (< 10 mtorr), augmenter la température du four à 373 K à une vitesse de chauffage de 5 K/min et maintenez pendant 10 h ; augmenter à 543 K à la même vitesse de chauffe et pendant 10 h. Remarque : la procédure de séchage prend environ 20 h.
- Une fois la procédure ci-dessus de séchage est terminée, purger la chambre avec argon ultra haute pureté. Répétez l’évacuation (< 10 mtorr) et d’argon purge (~ 1 atm) au moins trois fois pour assurer une atmosphère inerte pour fonctionner à des températures élevées.
- Après l’argon dernière purge, ouvrir les robinets de l’entrée et la sortie de la chambre d’essai et ajustez le débitmètre pour maintenir un flux continu d’argon de 50,0 mL/min à la pression atmosphérique ambiante (~ 1 atm).
3. Mesures électrochimiques
- établir un contact électrique entre cellules et potentiostat
- Connectez le câble d’électrode de compteur et le câble d’électrode de référence de la potentiostat une fois que le four a atteint 543 K.
Remarque : Chaque câble d’électrode (p. ex., l’électrode de référence, contre-électrode, électrode de travail, câbles d’électrodes de détection) comporte un bouchon à l’extrémité du câble qui permet le raccordement électrique. - Joindre une pince crocodile à la fin du câble d’électrode de référence de la potentiostat et emboîtez-le sur le fil électrique de l’électrode de référence provenant de l’ensemble de la cellule. Boîte de
- prise en cinq câbles électrode de travail, une dans chaque port 1 à 5, le commutateur de multiplexage (MUX). Fixer une pince crocodile à chaque câble d’électrode de travail et Branchez chaque pince crocodile au câble électrique pour chaque électrode de travail de l’ensemble de la cellule électrochimique, permettant des mesures de tension séquentielle de l’autre parent de cinq électrodes à l’électrode de référence.
Remarque : Une électrode de travail doit posséder la même composition que l’électrode de référence. La différence de tension entre ces deux électrodes identiques devrait être environ égal à zéro et devrait être surveillée pendant la mesure entière. Une différence de tension inférieure à 2-3 mV indique la stabilité et la fiabilité du système électrode de référence pour les mesures exactes emf. - Branchez une extrémité d’un câble de masse à la chambre d’essai en acier inoxydable et brancher l’autre direc finTLY dans le port de terre d’une prise électrique.
Remarque : Cette procédure supprime efficacement le bruit électrique provenant du four à résistances parce que la chambre d’essai en acier inoxydable sert une cage faradique pendant les mesures électrochimiques. - Créer un programme qui utilise le logiciel électrochimique pour mesurer le potentiel de circuit ouvert (OCP) pour chaque électrode de travail dans l’ordre en utilisant le logiciel potentiostat sous mode galvanostatique.
NOTE : Le programme personnalisé, disponible sur demande, des mesures et des enregistrements de l’OCP de chaque électrode de travail, une rotation de chaque électrode de travail séquentiellement au fil du temps, à chaque rotation dure pendant 15 min. Le programme doit tourner à travers le jeu d’électrodes pour des mesures d’OCP Records à chaque incrément de température. - Augmenter la température du four de 543 K à 1 073 K à 5,0 K/min, où l’électrolyte devient ioniquement conducteur pour les mesures emf.
Remarque : À 1 073 K, l’électrode de référence doit être entièrement fondu d’établir un contact électrique stable avec l’électrolyte et le fil électrique pour une meilleure stabilité des potentiels d’électrode de référence au cours des mesures emf.
- Connectez le câble d’électrode de compteur et le câble d’électrode de référence de la potentiostat une fois que le four a atteint 543 K.
- Définissant le profil thermique du four pour faire du vélo pendant la mesure de l’emf thermique
Remarque : la plage de température dépend le comportement de transition de phase de la composition de l’électrode (p. ex., fusion température) ainsi que la réactivité de la composition de l’alliage. Un profil de température typique pour l’étude des systèmes d’alliage Sr-Bi, entre 723 et 1 073 K et Ba-Bi est donné ci-dessous. Contrôleur- programme du fourneau pour diminuer la température du four de 1 073 K à 723 K et passer de 723 K à 1 073 K en intervalles de 25 K à un taux de rampe de ± 5 K/min. À chaque étape de la température (chaque intervalle 25 K), maintenir la température pendant 1-2 h permettre des composants atteindre l’équilibre thermique et électrochimique.
Remarque : L’équilibre thermique est atteint dès que la température se maintient au sein de ± 1 K à chaque étape de la température comme indiqué par les données de thermocouple affichées par le système d’acquisition (DAQ) de données associées.
- programme du fourneau pour diminuer la température du four de 1 073 K à 723 K et passer de 723 K à 1 073 K en intervalles de 25 K à un taux de rampe de ± 5 K/min. À chaque étape de la température (chaque intervalle 25 K), maintenir la température pendant 1-2 h permettre des composants atteindre l’équilibre thermique et électrochimique.
- Collecte de données de températures et CAG
- noter la température de la cellule électrochimique pendant tout le cycle thermique en utilisant un système d’acquisition de données de thermocouple ; inclure les limites supérieure et inférieure de la température du four programme et le type de thermocouple. Commencer le programme de mesures emf en même temps que l’enregistrement de la température.
Remarque : La mesure de l’OCP de chaque électrode de travail est mesurée contre l’électrode de référence. La mesure de l’OCP entre les deux électrodes de référence doit être inférieur à 2-3 mV. - Utiliser la température de la cellule et les mesures de l’OCP de chaque électrode de travail pour déterminer les valeurs de l’emf de chaque alliage métal alcalino-terreux-liquide en fonction de la température. Les valeurs de l’OCP à chaque température sont les valeurs de CEM entre les électrodes de référence et de travail.
- noter la température de la cellule électrochimique pendant tout le cycle thermique en utilisant un système d’acquisition de données de thermocouple ; inclure les limites supérieure et inférieure de la température du four programme et le type de thermocouple. Commencer le programme de mesures emf en même temps que l’enregistrement de la température.
Résultats
La figure 5 affiche des mesures emf effectués après refroidissement et réchauffage d’une cellule électrochimique : Ba-Bi (xBa = 0,05) | FAC2BaF -2| BA-Bi (xBa = 0,05, 0,10 et 0,20), où un alliage de Ba-Bi à xBa = 0,05 sert comme l' électrode de référence5.
La différence de potentiel entre les deux alliages de Ba-Bi identiques au xBa = 0,05 reste inférieure à 2 mV pendant la mesure entière, démontrant la stabilité et la fiabilité de l’électrode de référence. Pour les compositions d’alliages à xBa = 0,10 et xBa = 0,20, un profil symétrique emf est obtenu pendant le chauffage et le refroidissement des cycles, indiquant des valeurs de l’emf reproductible au cours de cycles thermiques. À chaque étape de la température (chaque intervalle 25 K), la température de la cellule et la valeur de cellule emf atteint équilibre thermique et électrochimique en moins de 1-2 h (Figure 5)5.
Pour déterminer les propriétés thermodynamiques des alliages contre l’état standard de pure Ba(s), les valeurs de CEM de la Ba-Bi Ba-Bi (xBa = 0,05) électrode de référence alliage doit être étalonné à l’égard de Ba pure. Les valeurs de l’emf de l’électrode de référence en ce qui concerne la pure Ba sont déterminées en utilisant une cellule électrochimique distincte : Ba(s) | FAC2BaF -2| BA-Bi (xBa = 0,05) et les résultats sont présentés dans la Figure 6. En utilisant le linéaire fit de cette mesure à xBa = 0,05 (Figure 6), l’emf d’alliages Ba-Bi (Ecellule), les valeurs sont déterminées par rapport au pur Ba métal5.
Les valeurs de l’emf d’alliages de Ba-Bi, par rapport au Ba(s) pur, sont tracées en fonction de la température à chaque composition de l’électrode, comme illustré à la Figure 7 pour certains alliages de Ba-Bi (xBa = 0,05 - 0,25)5. Des ajustements linéaires des données emf tracées en fonction de la température, la variation d’entropie molaire partielle a été calculée selon l’équation thermodynamique suivante :
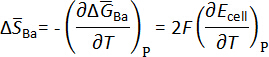
et l’enthalpie molaire partielle de baryum en bismuth peut être calculée en utilisant des relations thermodynamiques telles que l’équation de Gibbs-Helmholtz, comme indiqué ci-dessous. Les résultats sont résumés dans le tableau 15.
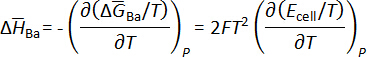
L’activité de baryum a été également déterminée en utilisant les valeurs recueillies emf et l’équation de Nernst :
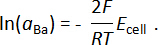
Les résultats sont résumés dans le tableau 25.
Les valeurs de CEM pour les alliages de Ba-Bi (xBa = 0,05 - 0,80) ont également servi à déterminer la température de transition de phase pour chaque composition de l’alliage. En collaboration avec différentiel données numérisation de transition de phase de calorimétrie, inductif plasma d’émission atomique spectroscopie (ICP-AES) données sur la composition, semblables à celui affiché dans le tableau 312et structure cristalline données d’analyse DRX, données emf ont servi à peaufiner le diagramme de phase de Ba-Bi plus récent rapporté par Okamoto (Figure 8)5,11.
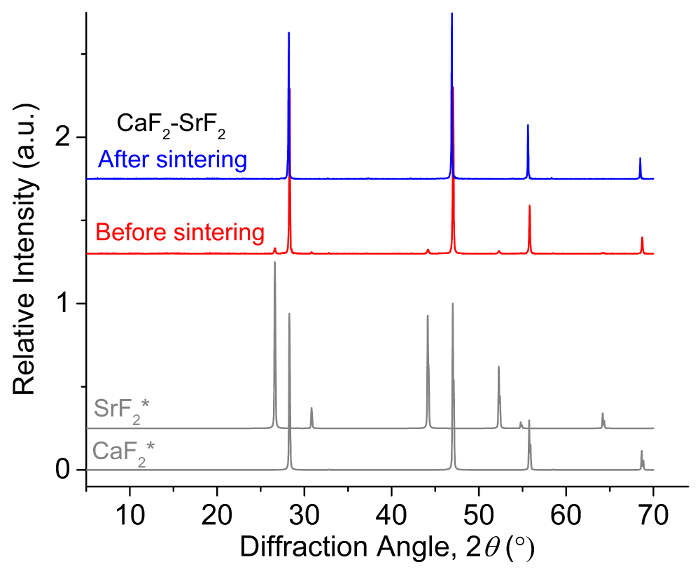
Figure 1 : FAC monophasé2- SrF2 spectres XRD d’électrolyte. Spectres XRD (normalisés pour le pic plus intense pour chaque spectre) de FAC2- SrF2 électrolyte avant et après le frittage. Pure (*) CaF2 et SrF2 patrons de diffraction sont fournis à titre de comparaison. Ce chiffre a été modifié par Smith et al. 9 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
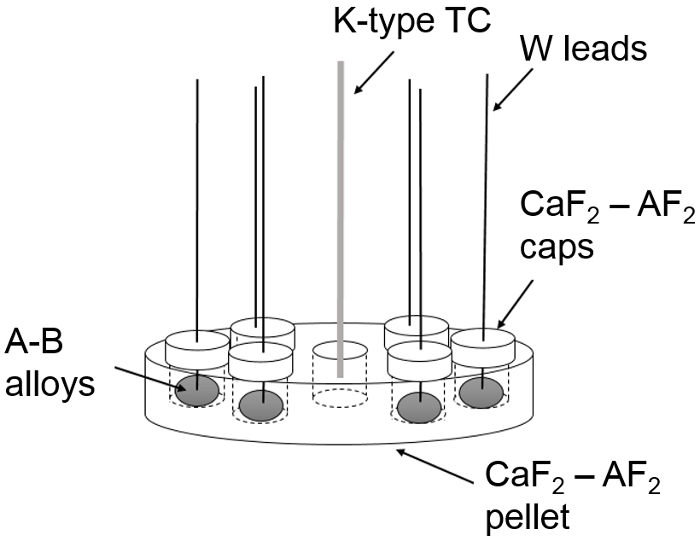
Figure 2 : la cellule électrochimique des alliages de métaux alcalino-terreux-liquide A-B. Une représentation schématique de l’Assemblée de cellule électrochimique utilisée pour les mesures emf avec électrolyte, capitales de l’électrolyte, matériaux d’électrodes, fils de tungstène et thermocouple (TC). Deux des 6 alliages A-B sont des électrodes de référence et 4 électrodes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 3 : installation électrochimique pour les mesures emf. Une illustration des composants cellule électrochimique et les composants associés pour les conditions de fonctionnement correcte. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
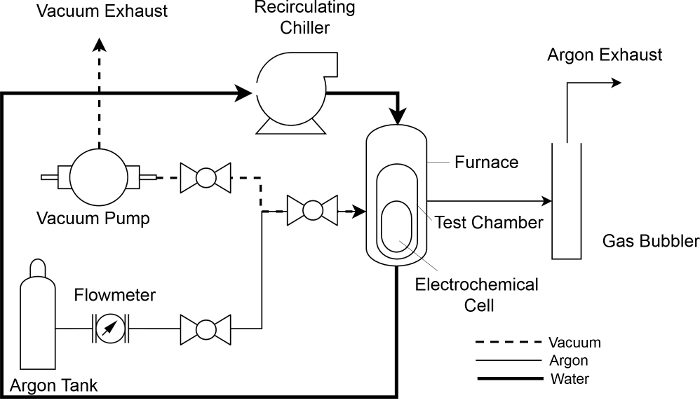
Figure 4 : schéma d’Instrumentation du montage expérimental. Un schéma de refroidissement de l’eau (solide, "BOLD"), l’argon (solide, mince) et sous vide (en pointillés) écoulement du fluide à travers le système de mesure CEM. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
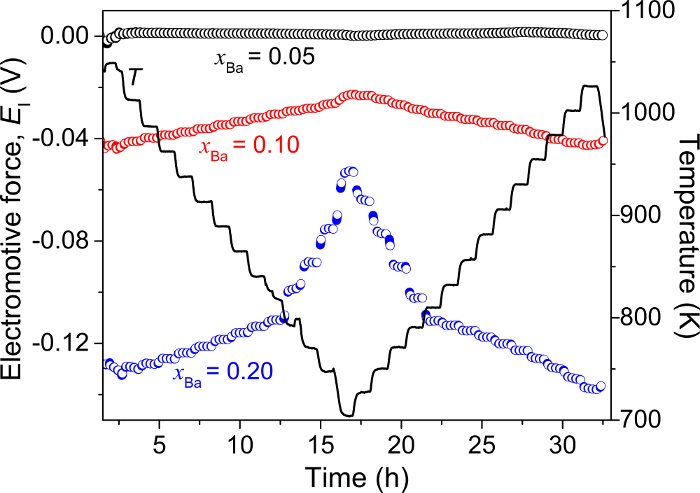
Figure 5 : Mesures de emf électrochimique des alliages de Ba-Bi (xBa = 0,05 - 0,20). Force électromotrice (E1) et la température mesurée en fonction du temps de refroidissement et réchauffage un Ba-Bi (xBa = 0,05) | FAC2BaF -2| BA-Bi (xBa = 0,05, 0,10 et 0,20) cellule. Ce chiffre a été modifié par Lichtenstein et al. 5 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
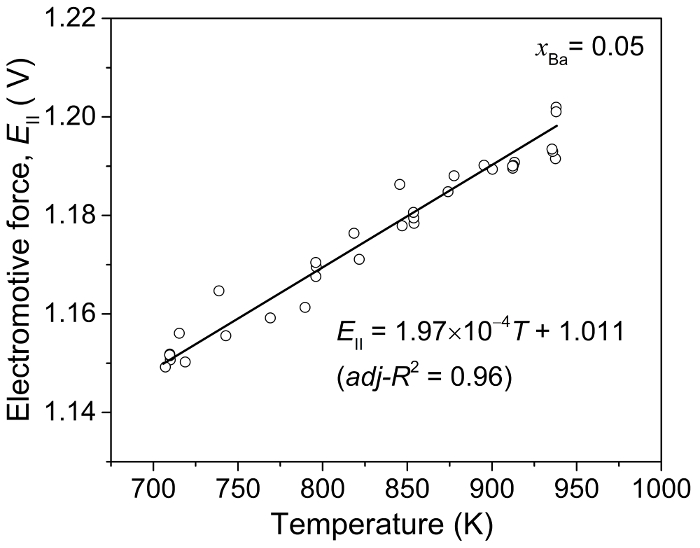
Figure 6 : Alliage de Pure Ba vs Ba-Bi(xBa = 0,05) calibration valeur emf. Force électromotrice (EII) mesurée en fonction de la température à l’aide d’un Ba(s) | FAC2BaF -2| BA-Bi (xBa = 0,05) cellule. Ce chiffre a été modifié par Lichtenstein et al. 5 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
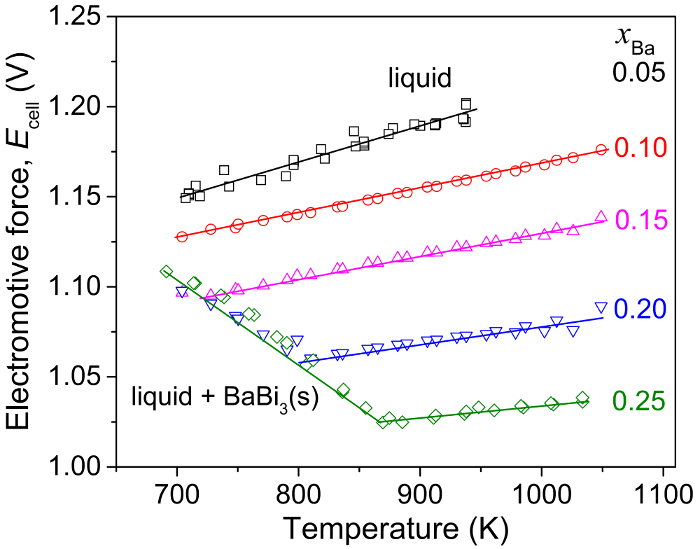
Figure 7 : Mesures d’Emf d’alliages de Ba-Bi (xBa = 0,05 - 0,25). Force électromotrice (Ecellule) en fonction de la température pour Ba-Bi alliages à xBa = 0.05, 0.10, 0.15, 0.20 et 0,25 basé sur un Ba(s) | FAC2BaF -2| BA-Bi (XBa = 0,05 - 0,25), où les lignes pleines représentent ajustement linéaire. Ce chiffre a été modifié par Lichtenstein et al. 5 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
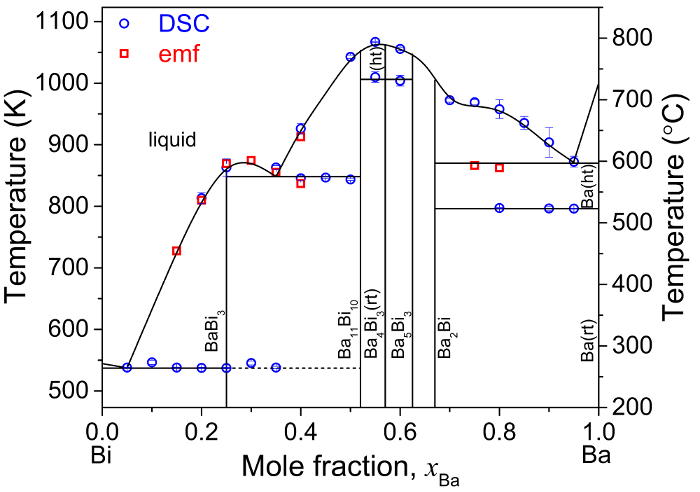
Figure 8 : diagramme de phase de Ba-Bi. Diagramme de phase déterminée expérimentalement Ba-Bi basée sur mesures emf en complément avec DSC et XRD caractérisation des alliages de Ba-Bi, où (rt) et (ht) représentent la température ambiante et la température élevée, respectivement. Ce chiffre a été modifié par Lichtenstein et al. 5 s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| x Ba | T (K) | ∂Ecellule/∂T (μV K\u20121) | ∂(ECell/T)/∂(1/T) (mV) | 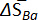 (J mol\u20121 K\u20121) (J mol\u20121 K\u20121) | 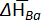 (kJ mol\u20121) (kJ mol\u20121) |
| 0.05 | 707-938 | 197 ± 6 | 1011 ± 5 | 38 | -195.1 |
| 0,1 | 704-1048 | 137 ± 1 | 1031 ± 1 | 26.4 | -199 |
| 0,15 | 728-1048 | 125 ± 2 | 1005 ± 2 | 24.1 | -193.9 |
| 0,2 | 809-1048 | 94 ± 7 | 984 ± 6 | 18.1 | -189.9 |
| 0.25 | 881-1048 | 73.4 ± 5 | 961 ± 5 | 14.2 | -185.4 |
| 0.25 | 704-881 | -480 ± 14 | 1448 ± 13 | -92.6 | -279.4 |
Tableau 1 : propriétés thermodynamiques des alliages de Ba-Bi (xBa = 0,05 - 0,25). Changement dans les entropies molaires partielles (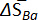 ) et enthalpies molaires partielles (
) et enthalpies molaires partielles (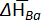 ) pour Ba-Bi alliage compositions xBa = 0,05 xBa = 0,25 calculé à partir des ajustements linéaires des valeurs emf, où les pentes et interceptions sont
) pour Ba-Bi alliage compositions xBa = 0,05 xBa = 0,25 calculé à partir des ajustements linéaires des valeurs emf, où les pentes et interceptions sont 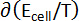 et
et 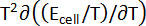 , respectivement. Ce tableau a été modifié par Lichtenstein et al. 5
, respectivement. Ce tableau a été modifié par Lichtenstein et al. 5
| x Ba | E (V) | ln a Ba | ||||
| 773 K | 873 K | 973 K | 773 K | 873 K | 973 K | |
| 0.05 | 1.164 | 1,183 | 1.203 | -35 | -31.5 | -28,7 |
| 0,10 | 1,137 | 1.15 | 1.164 | -34.1 | -30,6 | -27.8 |
| 0,15 | 1.101 | 1.114 | 1.127 | -33 | -29.6 | -26,9 |
| 0.20 | 1.075 | 1,066 | 1,076 | -32.2 | -28,3 | -25.7 |
| 0.25 | 1.075 | 1,027 | 1,032 | -32.2 | -27.3 | -24,6 |
Tableau 2 : valeurs de CEM (E) et le logarithme naturel de l’activité de baryum dans le bismuth (ln aBa). Les valeurs mesurées emf d’alliages de Ba-Bi (xBa = 0,05 - 0,25) versus Ba(s) et le logarithme naturel de l’activité de baryum dans le bismuth à 773 K, 873 K et K. 973 Ce tableau a été modifié par Lichtenstein et al. 5
| Fraction molaire, x Ba | |
| Nominal | Mesurée |
| 0,03 | 0,03 |
| 0.05 | 0.05 |
| 0,10 | 0,09 |
| 0,15 | 0,14 |
| 0.20 | 0.20 |
| 0.25 | 0.25 |
| 0.30 | 0.30 |
Tableau 3 : Nominales et mesuré la teneur en baryum des alliages binaires Ba-Sb. La teneur en baryum nominaux et mesurée des alliages binaires Ba-Sb. Teneur en baryum d’alliages de Ba-Sb a été confirmée en utilisant inductivement couplé plasma émissio atomiquespectroscopie de n (ICP-AES). Ce tableau a été modifié par Lichtenstein et al. 12
Discussion
La cellule d’emf dans cet ouvrage utilise un CaF2-base de matériaux solides d’électrolyte et d’électrode à compositions fixes, par rapport à une cellule d’emf qui utilise une technique de titrage coulométrique où la composition de l’électrode a été changée à une température constante. Avec titrage coulométrique, la composition de l’électrode est déterminée par la Loi de Faraday, en supposant que la parfaite efficacité coulombienne. Cependant, très réactifs métaux des terres alcalines – sont modérément soluble (par exemple, Ba ~ 15 mol % solubilité dans BaCl2) dans leurs propres sels haloïdes, qui peut favoriser la conduction électronique à travers l’électrolyte et prévenir un contrôle précis de la composition de l’électrode lors de titrage coulométrique7,13. La cellule électrochimique dans cet ouvrage fonctionne en matériaux d’électrodes à compositions fixes, éliminant ainsi l’incertitude en comptabilité composition par titrage coulométrique et permet des mesures précises emf d’alliages alcalino-terreux. En outre, l’unique cellule électrochimique dans cet ouvrage mesure les valeurs de l’emf de compositions d’alliages quatre simultanément au sein de la même expérience pour accélérer l’évaluation des propriétés thermodynamiques sur une large gamme de compositions et températures.
Comme l’arc-fondeur est utilisée pour fabriquer des alliages binaires, il est possible que la composition finale des alliages peut s’écarter de la composition initiale en raison de la température élevée de l’arc électrique et les hautes pressions de vapeur des métaux. Pour signaler correctement la relation de l’emf-température des alliages binaires, leur composition a été confirmée en utilisant inductivement couplé spectrométrie d’émission atomique à plasma (ICP-AES), comme illustré dans le tableau 3 pour le système de Ba-Sb12.
Avant de sécher les composants de la cellule électrochimique selon étape 2.3.4, difficultés pour obtenir qualité vide (< 10 mtorr) peuvent survenir. Le joint torique dans la configuration de la chambre à vide ne peut pas être assis correctement dans sa rainure en acier inoxydable. Aussi, il peut y avoir une lacune dans les joints époxy des tubes d’alumine, qui époxy supplémentaire peut-être s’appliquer pour brancher les éventuelles fuites. Lors des mesures de CEM, si les fils électriques perdent contact avec les alliages A-B et des fluctuations importantes dans les valeurs de l’emf sont observées, contact peut être rétabli avec les alliages en tournant doucement le tube d’alumine, ainsi mouiller l’alliage liquide au conducteur.
Parfois les valeurs emf peuvent présenter une grande hystérésis entre le refroidissement et les cycles de chauffage. En général, une hystérésis de valeurs emf entre refroidissement/chauffage cycles peuvent provenir de (1), la dégradation de l’électrolyte avec des compositions d’électrode réactif, en particulier à des concentrations élevées d’alcalino-terreux ; (2) la dégradation des matériaux d’électrode en raison de l’évaporation à des températures élevées et l’oxydation avec l’oxygène résiduel à l’intérieur de la chambre d’essai ; ou (3) comportement de la phase de non-équilibre de matériaux d’électrodes, y compris la coulabilité des effets et la formation des phases métastables pendant le cycle de refroidissement.
Lorsque la réaction de dégradation entre l’électrode et l’électrolyte est évidente, le montage expérimental peut être modifié afin d’atténuer la dégradation de la cellule électrochimique en diminuant la température de fonctionnement maximale. En présence de sous-refroidissement effets, valeurs de emf obtenues durant le cycle de chauffage peuvent être utilisées dans le calcul des propriétés thermodynamiques de l’équilibre. Lorsque la formation des phases métastables provoque une hystérésis dans les mesures de l’emf, le comportement de phase des matériaux d’électrodes nécessite un examen par le biais de techniques complémentaires, par exemple, la caractérisation structurale par DRX, analyse des constituants de la phase microscopie électronique par balayage (SEM) avec spectroscopie dispersive en énergie (EDS) et des températures de transition de phase de DSC. Données de transition de phase peuvent également être difficiles à obtenir avec la technique de mesure CEM décrit au-dessus de 1 223 K, comme la CaF électrolyte de2 2-AF peut commencer à se dégrader.
La technique de mesure des emf dans cet ouvrage peut servir à déterminer les propriétés thermodynamiques empiriques des binaires alliages de métaux alcalino-terreux-liquide, y compris l’activité, entropie molaire partielle, enthalpie molaire partielle et températures de transition de phase. Ces données thermodynamiques sont utilisées comme une base expérimentale à raffiner les diagrammes de phase binaires des alcalino-terreux alliages avec des techniques complémentaires (XRD, DSC et SEM), comme illustré à la Figure 85. Basé sur les valeurs de l’activité de chaque métal alcalino-terreux (A = Ca, Ba et Sr) dans les métaux liquides (B = Bi et Sb), la force des interactions atomiques entre alcalino-terreux et métaux liquides peut être un levier pour séparer électrochimiquement alcalino-terreux produits de fission de solutions de sels fondues.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêt à divulguer concernant le matériel dans la publication.
Remerciements
Ce travail a été soutenu par le US Department of Energy, Office de l’énergie nucléaire de programmes universitaires de l’énergie nucléaire (prix no DE-NE0008425) ; Université intégrée programme Graduate Fellowship (prix no. DE-NE0000113) ; et le ministère du commerce, l’industrie & énergie, République de Corée, l’efficacité énergétique & ressources de base programme de technologie de l’Institut coréen de l’évaluation de technologies de l’énergie et de la planification (KETEP) (n° 20142020104190). Publication de cet article a été financée en partie par The Pennsylvania State Université bibliothèques Open Access Fund Publishing.
matériels
| Name | Company | Catalog Number | Comments |
| 1 L bottle | US Plastic | 69032 | HDPE, wide mouth |
| Acetone, 99.5% | Alfa Aesar | 30698 | ACS Grade |
| Alumina dish | AdValue Technology | AL-4120 | 81 mm OD, 30 mm height |
| Alumina plate | AdValue Technology | AL-D-82-6 | 10 cm in diameter, 4.65 mm thickness |
| Alumina powder | AluChem | AC99 tabular alumina | |
| Alumina tube | Coorstek | 66631-12.0000 | 0.25 in. OD, 12 in. length |
| Arc-Melter | Edmund Buhler GmbH | MAM1 | |
| Argon, 99.999% | Praxair | AR 5.0UH-K | Ultrahigh purity |
| Ball mill | Norton Chemical Process Products Corporation | CF-70109 | 6 sets of 2 12.5 in. rollers, RPM 1725/1425 |
| Barium | Alfa Aesar | 653 | 99.2% purity |
| Barium fluoride | Sigma-Aldrich | 652458 | 99.999% purity |
| Bismuth | Sigma-Aldrich | 556130 | 99.999% purity |
| Boron nitride | Saint-Gobain | AX-05 | |
| Calcium fluoride | Alfa Aesar | 11055 | 99.95% purity |
| Cotton tip applicator | Dynarex | 4301 | 100 count, 3 in. long |
| Die press | Carver, Inc. | 3850 | Clamping force: 12 tons; Platens: 6 x 6 in. |
| Drill bit 29 piece set | Chicago-Latrobe | 45640 | 1/16 in. - 1/2 in. x 1/64 in. |
| Drying pan | Pyrex | 5300114 | 15.5 in. x 9.5 in. x 2.25 in. |
| Emery paper | McMaster-Carr | 4681A21 | Grit size: 100 |
| Fiberglass insulation | McMaster-Carr | 9346K38 | |
| Flowmeter | Brooks | MR3A00SVVT | Range: 0.1 to 1 standard cubic feet per hour (SCFH) of Air |
| Gas bubbler | Ace Glass | 8761-10 | |
| High temperature box furnace | Thermolyne | F48020-80 | 48000 Furnace, 8-segment program, Max. 1,200 °C |
| High temperature crucible furnace | Mellen | CC12-6X12-1Z | 6 in. ID, 12 in. depth. Max temp 1,200 °C. 208 V |
| High vacuum grease | Sigma-Aldrich | Z273554 | Brand: Dow Corning |
| Inert atmopshere glovebox | Mbraun | MB200 | |
| Isopropyl alcohol | Macron Chemicals | 3032-21 | ACS Grade |
| Large pellet die set | MTI Corporation | EQ-Die-75D | |
| Polyvinyl alcohol, 99+% | Sigma-Aldrich | 341584-5KG | Hydrolyzed, molecular weight (MW): 89,000-98,000 |
| Potentiostat | Autolab | PGSTAT302N | |
| Potentiostat-multiplexing switch box | Autolab | MUX SCANNER16 F/16 X WE | Multiplexer (MUX) SCANNER16 |
| Potentiostat control software | NOVA | NOVA 1.11 | |
| Precision mini lathe | Harbor Freight Tools | 93212 | Brand: Central Machinery |
| Quick cure epoxy | Grainger | 5A462 | Brand: Devcon |
| Recirculating chiller | VWR International | 13271-204 | Model: 1175PD |
| Small pellet die set | MTI Corporation | EQ-Die-18D-B | |
| Sonicator | VWR International | 97043-968 | |
| Squeeze bottle | VWR International | 16650-022 | LDPE, 500 mL |
| Stainless steel mesh sieve | Amazon | 10 mesh, 2 mm holes | |
| Strontium | Sigma-Aldrich | 343730 | 99% purity |
| Strontium fluoride | Sigma-Aldrich | 450030 | 99.99% purity |
| Thermocouple | Omega | KMQXL-125U-18 | K-type thermocouple |
| Thermocouple acquisiton board | National Instruments | NI-9211 | |
| Tungsten wire | ThermoShield | 88007-0.100 | 99.95% wire |
| Vacuum pump | Pfeiffer | PK D56 707 | Duo Line 1.6 |
| Wipes | Kimtech | S-8115 | ULine distributor |
| Wire cutters | McMaster-Carr | 5372A4 | |
| Yttria-stabilized zirconia milling media | Tosoh, USA | 3 mm diameter |
Références
- Ipser, H., Mikula, A., Katayama, I. Overview: The emf method as a source of experimental thermodynamic data. CALPHAD: Comput. Coupling Phase Diagrams Thermochem. 34 (3), 271-278 (2010).
- Kim, H., Smith, N., Kumar, K., Lichtenstein, T. Electrochemical Separation of Barium into Liquid Bismuth by Controlling Deposition Potentials. Electrochim. Acta. 220, 237-244 (2016).
- National Research Council. . Electrometallurgical Techniques for DOE Spent Fuel Treatment: Final Report. , (2000).
- Simpson, M. F. Projected Salt Waste Production from a Commercial Pyroprocessing Facility. Sci. Technol. Nucl. Install. 2013, 1-8 (2013).
- Lichtenstein, T., Smith, N. D., Gesualdi, J., Kumar, K., Kim, H. Thermodynamic properties of Barium-Bismuth alloys determined by emf measurements. Electrochim. Acta. 228, 628-635 (2017).
- Kim, H., Boysen, D. A., Ouchi, T., Sadoway, D. R. Calcium-bismuth electrodes for large-scale energy storage (liquid metal batteries). J. Power Sources. 241, 239-248 (2013).
- Delcet, J., Delgado-Brune, A., Egan, J. J. Coulometric Titrations Using CaF2 and BaF2 Solid Electrolytes to Study Alloy Phases. Symp. Calc. Phase Diagrams Thermochemistry Alloy Phases. 275, 275-287 (1979).
- Roine, A. . Outokummpu HSC Chemistry 5.1. Chemical Reaction and Equilibrium Software with Extensive Thermochemical Database. , (2002).
- Smith, N. D., Lichtenstein, T., Gesualdi, J., Kumar, K., Kim, H. Thermodynamic Properties of Strontium-Bismuth Alloys Determined by Electromotive Force Measurements. Electrochim. Acta. 225, 584-591 (2017).
- Kim, H., et al. Thermodynamic properties of Calcium-Bismuth alloys determined by emf measurements. Electrochim. Acta. 60, 154-162 (2012).
- Okamoto, H. . Ba-Bi (Barium-Bismuth). , (1990).
- Lichtenstein, T., Gesualdi, J., Nigl, T. P., Yu, C. T., Kim, H. Thermodynamic Properties of Barium-Antimony Alloys Determined by Emf Measurements. Electrochim. Acta. , (2017).
- Wagner, C. Limitation of the Use of CaF2 in Galvanic Cells for Thermodynamic Measurements due to the Onset of Electronic Conduction under Reducing Conditions. J. Electrochem. Soc. 115 (9), 933-935 (1968).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon