Method Article
Determinação de propriedades termodinâmicas de líquidos alcalinos terrosos de ligas metálicas utilizando a técnica de força eletromotriz
Neste Artigo
Resumo
Este protocolo descreve a medição da força eletromotriz de terra alcalina-elementos em ligas de metal líquidas a altas temperaturas (723-1.123 K) para determinar suas propriedades termodinâmicas, incluindo atividade, entropia molar parcial, parcial molar entalpia e temperaturas de transição de fase, sobre uma escala larga de composição.
Resumo
Uma célula eletroquímica romance, baseada em um eletrólito de estado sólido de2 CaF foi desenvolvida para medir a força electromotive (emf) de binários líquido alcalino-ferrosas como funções de composição e temperatura, a fim de adquirir dados termodinâmicos. A célula consiste de um quimicamente estável estado sólido CaF2-AF2 eletrólito (onde A é o elemento terra alcalina-tais como Ca, Sr ou Ba), com a liga binária de A-B (onde B é o metal líquido como Bi ou Sb) trabalhando eletrodos e um puro, um metal eletrodo de referência. EMF dados são coletados ao longo de uma faixa de temperatura de 723 K de 1.123 K em incrementos de 25 K para várias composições de liga por experiência e os resultados são analisados para gerar valores de atividade, temperaturas de transição de fase e entropias/enthalpies molares parciais para cada composição.
Introdução
Medições de força electromotive (emf) diretamente podem determinar a alteração parcial molar energia livre de Gibbs de uma reação química e fornecer propriedades termodinâmicas precisas como atividade parcial molar entalpia e entropia molar parcial1. A aquisição de dados termoquímicos é crucial para uma variedade de tópicos de investigação na Comunidade de materiais, de refinamento de diagramas de fase multicomponentes, a validação experimental do primeiro princípio materiais de modelagem, para a síntese de novo intermetálicos espécies com propriedades vantajosas. Recentemente, Kim et al utilizou as medições de campos eletromagnéticos para avaliar a viabilidade do uso de eletrodos de metal líquidos para separar terra alcalina-espécie de eletrólitos sal derretido2.
Separação eletroquímica usando sais fundidos (por exemplo, LiCl-KCl) é uma tecnologia promissora para separar o urânio e transurânicos metais de combustível nuclear usado para reciclagem3. Como combustível é processada como um ânodo no sal fundido, produtos de fissão, com potenciais de redução padrão menores do que o urânio são oxidados e se acumulam no sal fundido como íons dissolvidos (por exemplo, Ba+ 2, Sr2 +, Cs+e terras raras cátions metálicos)4. Consequentemente, o eletrólito de sal fundido deve ser periodicamente substituído e/ou transformado na sequência separado a fissão acumulada produtos4. De particular interesse são produtos de fissão alcalino-/ alcalino-terrosos (Ba2 +, Sr2 +e Cs+) porque estes íons apresentam os menores potenciais de redução padrão entre os cátions constituintes, tornando-os difíceis de separar a partir da solução de sal fundida.
No entanto, Lichtenstein et al recentemente demonstraram que o bário apresenta baixa atividade termodinâmica no líquido bismuto (8,7 x 10-12 no bário mole fração xBa (em Bi) = 0,05, 1.123 K), implicando forte atômica interações entre bário e bismuto5. Kim et al observaram que essas interações causaram uma mudança nos potenciais de deposição de íons bário em um eletrodo de bismuto líquido (-3.74 V-2.49 V vs Cl–/Cl2(g)), resultando em uma deposição preferencial de bário do solução eletrolítica (BaCl2- lici-CaCl2- NaCl, 16-29-35-20% de mol) 773-973 K6. Esta mudança no potencial de deposição pode ser aproveitada por meio de eletrodos de metal líquidos para separar produtos de fissão alcalino-/ alcalino-terrosos seletivamente o eletrólito usado para eletroquímico processamento de combustível nuclear usado. Para determinar a viabilidade de separar produtos de fissão alcalino-/ alcalino-terrosos de eletrólito de sal fundido, as propriedades termodinâmicas desses elementos em metais líquidos em perspectiva (por exemplo, Bi, Sb) devem ser determinadas.
Em estudos anteriores, Delcet et al utilizaram deteção titulação para determinar as propriedades termodinâmicas de ligas binárias (por exemplo, Ba-Bi, Sb, Ba-Ba-Pb)7. Para ligas de Ba-Bi até xBa = 0,50, eles empregados deteção titulação usando um eletrólito de2 do único-cristal BaF a 1.123 K e observados valores de actividade comparável de bário em bismuto (2,4 x 10-12 no x BA (em Bi) = 0,05, 1.123 K). No entanto, foi relatado que os resultados eram imprecisos devido a incerteza quanto ao teor de bário nas ligas binárias. Bário metal é altamente reativo e solúvel em seus sais haletos (~ 15 mol % na BaCl2 em 1.163 K), que podem causar aumento da condução eletrônica no sal haleto em temperaturas mais altas e levar a contabilidade composicional imprecisa durante a deteção titulação. Para determinar as propriedades termodinâmicas (por exemplo, excesso parcial molar Gibbs a energia livre, entalpia molar parcial, entropia molar parcial) de ligas binárias contendo elementos altamente reativos, foi utilizado o método de emf descrito neste protocolo.
Termoquímicos Propriedades de ligas binárias podem ser determinadas medindo-se o equilíbrio celular potenciais Ecélula (ou seja, emf) de uma liga (A-B) em relação ao potencial de referência da de metal puro. Então, o potencial de célula está diretamente relacionado à mudança de parcial molar energia livre de Gibbs (ou potencial químico) da reação da célula de acordo com a relação de Nernst (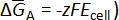 ).
).
Para a medição de campos eletromagnéticos da terra alcalina-ligas neste trabalho, o íon fluoreto-condução CaF2 é escolhido como o eletrólito base porque o Ca2 +/nome da CA potencial redox (E0 =-5.59 V) é mais negativa do que outro potenciais redox de terra alcalina (p. ex., 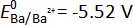 ,
, 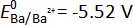 versus F–/f2(g) a 873 K) no flúor sistema8. Isto implica que a CaF2 é mais quimicamente estável do que o outro terra alcalina-flúor AF2 (A = Sr ou Ba), e que a Ba2 + ou Sr2 + íons são as espécies de eletroativos no CaF2- BaF2 e CaF 2- SrF2 eletrólito, respectivamente. Utilizando a alta estabilidade do CaF2, que minimiza as reações colaterais com Ba ou ligas de Sr, bem como a condutividade iônica do CaF2 em temperaturas elevadas, o CaF binário monofásico2eletrólito de2 -AF foi empregado com sucesso para medir com precisão o emf de binários líquido alcalino-ferrosas. Confirmação da formação do eletrólito binário monofásica é confirmada com a análise de difração de raios x (XRD) na Figura 19.
versus F–/f2(g) a 873 K) no flúor sistema8. Isto implica que a CaF2 é mais quimicamente estável do que o outro terra alcalina-flúor AF2 (A = Sr ou Ba), e que a Ba2 + ou Sr2 + íons são as espécies de eletroativos no CaF2- BaF2 e CaF 2- SrF2 eletrólito, respectivamente. Utilizando a alta estabilidade do CaF2, que minimiza as reações colaterais com Ba ou ligas de Sr, bem como a condutividade iônica do CaF2 em temperaturas elevadas, o CaF binário monofásico2eletrólito de2 -AF foi empregado com sucesso para medir com precisão o emf de binários líquido alcalino-ferrosas. Confirmação da formação do eletrólito binário monofásica é confirmada com a análise de difração de raios x (XRD) na Figura 19.
Para medir a célula potencial de uma terra alcalina-liga, a seguinte célula eletroquímica foi implementado usando um Solid-State binário CaF2-AF2 (97 mol % CaF2, 3 mol % AF2) eletrólito10:
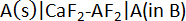 ,
,
onde a pura metais alcalino - terrosos A (A = Ca, Sr ou Ba) atua como o eletrodo de referência (RE), sólido CaF2-AF2 como o eletrólito, fixo ligas de composição A-B como eletrodos de trabalho (nós) e B é um metal líquido de candidato como Bi ou Sb. As reações de posicionada na célula eletroquímica são:
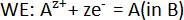
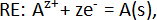
e a reação geral da célula é:
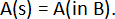
onde e– é um elétron trocado nas reações celulares e z é o número de elétrons trocados (z = 2 para elementos alcalino-terra). Para esta reação global, a mudança na parcial molar energia de Gibbs livre do metal A, 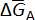 , é dada por:
, é dada por:
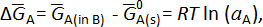
Onde é a energia molar de Gibbs livre, parcial, de um metal no metal B,
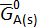 é o padrão Gibbs energia de puro livre um metal, R é a constante dos gases ideais, T é a temperatura em Kelvin e umA é a atividade de A em b metal. A célula de medição emf, Ecélula, está diretamente relacionada à mudança de parcial molar energia de Gibbs livre da pela equação de Nernst,
é o padrão Gibbs energia de puro livre um metal, R é a constante dos gases ideais, T é a temperatura em Kelvin e umA é a atividade de A em b metal. A célula de medição emf, Ecélula, está diretamente relacionada à mudança de parcial molar energia de Gibbs livre da pela equação de Nernst,
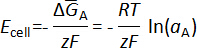
onde F é a constante de Faraday.
Protocolo
1. fabricação de células eletroquímicas componentes
- fabricação do binário CaF 2-eletrólito de 2 AF
- calcular a massa necessária para cada componente do binário eletrólito para uma mistura de 5,0 g ± 350,0 com 97 mol % CaF 2 e 3 mol % AF 2 (por exemplo, 333,4 g de CaF 2 e 16,6 g da SrF 2).
- Medida para fora e despeje a mistura de sal em uma garrafa de plástico de 1,5 L, junto com aproximadamente 1,3 kg de zircônia estabilizada ítria moagem media (3 mm de diâmetro) e 25,0 ± 0,1 g de álcool polivinílico (PVA, aglutinante orgânico). Em seguida, adicione álcool isopropílico (IPA) até que o frasco é 4/5 completo. Feche o frasco e agitar manualmente seu conteúdo para cerca de 1 min distribuir uniformemente os componentes da mistura.
- Coloque a garrafa de plástico com a mistura de sal sobre o moinho de esfera (dois-cilindros, 12.5 " comprimento). Definir a velocidade do moinho de bola para 250 rotações por minuto (RPM) e moinho para 24 h.
- Despeje a mistura por uma peneira (malha 10) em uma panela para separar os meios de moagem e mistura de sal. Usando uma garrafa, enxágue a peneira levemente com 10 mL de IPA para capturar a mistura restante.
- Secar a mistura homogênea bola-moído em uma coifa para ~ 24 h e em seguida, Triture a mistura em um pó fino usando um almofariz e um pilão.
Nota: Se o processo de secagem precisa ser acelerado, a panela pode ser colocada sobre uma chapa quente conjunto para 373 K. - Medir 130.0 ± 1,0 g de pó de eletrólito e carregar o pó uniformemente em um die pellet (diâmetro de 75 mm, 60 mm de altura).
- Uniaxially usando uma imprensa de morrer, pressione o pó com 30 MPa de pressão por 2 minutos para formar um verde de pelotas 75 mm de diâmetro e 17 milímetros de espessura. Para retirar o chumbo do morrer a pelota, inverter a morrer sedimento, coloque um anel de aço inoxidável (diâmetro externo 101mm (OD), altura de 35 mm, 4,8 mm de espessura), centrado em cima a morrer sedimento com a pelota centralizada dentro do anel. Pressione cuidadosamente o soco de morrer sedimento com ~1.0 bar de pressão para retirar o chumbo da morrer.
- Usar uma broca pequena (diâmetro de 1 mm) para criar o rosqueamento de furos (~0.5 mm de profundidade) na pelota verde, uma no centro e seis uniformemente espaçados 25.4 mm entre centros de broca. Em seguida, use a broca grande (11,2 mm de diâmetro) para manualmente perfurar sete poços centrados sobre os buracos de batida, cada um cerca de 12 mm de profundidade (aproximadamente ¾ do caminho através da pelota).
- Para cada um do seis eletrólito caps necessários, meça 4,5 ± 0,5 g de pó de eletrólito e carregar o pó uniformemente em um die pellet (diâmetro de 19 mm, 50 mm de altura).
- , Uniaxially, pressione o pó eletrolítica com 7,5 MPa para 1 min em uma pelota verde 19 mm × 10 mm de diâmetro e espessura. Para remover o sedimento de morrer a pelota, inverter a morrer sedimento, coloque um anel de aço inoxidável (37,5 milímetros OD, altura de 30 mm, 3,5 mm de espessura), centrado em cima a morrer sedimento com a pelota centralizada dentro do anel. Pressione cuidadosamente o soco de morrer sedimento com ~1.0 bar de pressão para retirar o chumbo da morrer. Use uma broca pequena (2 mm de diâmetro) para manualmente, faça um furo de centro através de cada Cap...
Nota: Verde pelotas de 1.1.8. e 1.1.10. estão prontos para sinterização para formar um eletrólito sólido monofásico nas etapas a seguir. - Para cada eletrólito grande pelota e conjunto de seis tampas de eletrólitos pequenos, levemente cobrir uma placa de alumina (10 cm de diâmetro, 4,65 mm de espessura) com pó de alumina grossa para facilitar a separação da sinterizado pelota da placa da alumina. Coloque os pedaços de eletrólito em cima do pó da alumina, tal que eles não se tocam.
- Colocar o conjunto acima de 1.1.11 num forno de alta temperatura de caixa. Sedimento das peças com o seguinte perfil de aquecimento: 393 K para 12 h para remover a umidade, 823 K para 12h para queimar o PVA e 1.273 K para 3h de sedimento, todos com taxas de 5 K/min de aquecimento. Em seguida, refresque a 298 K a uma taxa de 2,5 K/min.
- Fabricação de eletrodos terra alcalina - liga
- em uma caixa de luvas cheias de argônio, medir a massa dos dois componentes da liga binária, com uma massa combinada de pelo menos 6,0 g (por exemplo, 5,6 g de Bi e 0,4 g de Ba para liga Ba-Bi no bário mole fração x Ba = 0,10). Coloque em uma bandeja e retire do porta-luvas.
Nota: Metais reactivos são armazenados sob óleo mineral para evitar a oxidação. Para remover o óleo mineral, proceda à sonicação as peças de metais alcalino - terrosos em acetona por 10 s. - Colocar todas as peças de metal no centro do palco solo arco e prenda o palco.
- Puxar vácuo na câmara para 3 min até alcançar a um vácuo de aproximadamente -1,0 bar (pressão manométrica) e depois encha com argônio como 0,0 bar (pressão manométrica). Repita este procedimento pelo menos três vezes para garantir uma atmosfera de Argônio inerte durante o processo de derretimento de arco.
- Feche o escudo de protecção dos olhos na unidade arco-melter e ligue a corrente para criar um arco elétrico estável entre o palco e a ponta de tungstênio do solo arco. Derreta as peças de metal em uma única parte homogênea, expondo as peças para o arco elétrico. Suficiente de fusão pode ser confirmada pela ausência de fases separadas observáveis na peça liga.
Nota: Se os elementos altamente reativos estão sendo derretidos, usando uma corrente alta por mais de ~ 5 s pode resultar na vaporização do material e causar inconsistências na composição da liga. - Depois de derreter os pedaços em uma única liga, desligar a corrente e o arco-mão de cera. Desapertar o palco da câmara, a liga da aleta e parafusar o palco volta a câmara do solo arco. Repetição 1.2.3 - 1.2.5 três vezes para formar uma liga homogênea.
- Após a re-fusão da liga, desaparafuse o palco da câmara novamente e quebrar ou cortar a liga em aproximadamente 3 a 6 pedaços menores. Coloque os pedaços no palco e parafusar o palco volta a câmara do solo arco. Re-derreter as peças em uma única peça de acordo com passos 1.2.3 - 1.2.5.
- Permitir que o sistema legal para desanexar o estágio do sistema de arco-melter 3-5min e armazenar a liga em um saco plástico. Coloque o saco sob uma atmosfera inerte de argônio (por exemplo, porta-luvas) até a montagem final de célula eletroquímica.
Nota: Para cada experimento, duas peças de liga de eletrodo de referência até quatro trabalhando peças de liga do eletrodo de diferentes composições são necessárias e.
- em uma caixa de luvas cheias de argônio, medir a massa dos dois componentes da liga binária, com uma massa combinada de pelo menos 6,0 g (por exemplo, 5,6 g de Bi e 0,4 g de Ba para liga Ba-Bi no bário mole fração x Ba = 0,10). Coloque em uma bandeja e retire do porta-luvas.
- Preparação dos condutores elétricos de tungstênio e termopar
- cortar 6 fios de tungstênio (1 mm de diâmetro) 46 cm de comprimento. Manualmente a areia ao longo do comprimento de cada fio para remover contaminantes superficiais, tais como uma camada de óxido, usando papel de esmeril de grão 100. Limpe a superfície do fio usando toalhetes humedecidos com acetona.
- Inserir o fio num tubo da alumina (6,35 mm de diâmetro, 30,5 cm de comprimento) que irá evitar curto-circuito elétrico entre a elétrica leva e teste de aço inoxidável de câmara durante a medição eletroquímica. Deixe aproximadamente 12,7 cm em uma extremidade (inferior) como barfio e para fazer contato com os eletrodos e 2,5 cm na outra extremidade (superior) para contato elétrico com o potentiostat conduz.
- Misturar aproximadamente 3 g de cura rápida epóxi e endurecedor para 1 min usando a extremidade de uma vara de madeira aplicador.
- Com o fio no tubo, aplicar aproximadamente 3 g do epóxi a extremidade superior do tubo para selá-lo. Colocar o tubo e o fio verticalmente usando um carrinho de laboratório e permitem que o epóxi curar durante 15 min. Repita para cada fio de tungstênio (ligação elétrica).
- Inserir a extremidade inferior de um termopar de 45cm (tipo K) na parte superior de um novo tubo de longa da alumina 30,5 cm e fechar a lacuna entre o termopar e alumina tubo usando um cola epoxy rápida cura semelhante ao passo 1.3.4, deixando ~ 5 mm do termopar exposto na parte superior. Permitir que o epóxi curar durante 15 min.
2. Montagem da célula eletroquímica
- a limpeza dos componentes do conjunto de células eletroquímicas
- antes da montagem da célula eletroquímica, areia completamente a superfície interna da câmara de teste de aço inoxidável com papel de esmeril de grão 100 até lá não é nenhuma contaminação visível nas superfícies de aço inoxidável. Limpe a câmara de teste, tampa de câmara e o cadinho de alumina (8,2 cm de diâmetro, altura de 3,0 cm) usando água deionizada e enxágue com IPA.
- Proceda à sonicação as peças de encaixes a vácuo e os o-rings em isopropanol para ~ 10 min e deixe-os secar dentro do forno de secagem na ~ 373 K. aplicar uma fina camada de graxa de vácuo para anéis para melhor qualidade de vácuo. Em seguida, mova todos os componentes de instalação eletroquímico em uma caixa de luvas de argônio preenchido para assembly.
- Carregamento de assembly a célula eletroquímica
- Coloque o eletrólito sinterizado (etapa 1.1) no centro do cadinho de alumina localizado no porta-bebés câmara teste.
- Carregar bastante material do eletrodo em cada poço, tal que o topo do material é nivelado com a superfície do eletrólito. Preencher dois poços com materiais de eletrodo de referência (por exemplo, Ba-Bi (x Ba = 0.05)) de composição idêntica. Em seguida, preencha quatro poços com trabalho material do eletrodo, cada um bem que tem uma composição diferente ( Figura 2). Nesta etapa, moldar materiais de eletrodo arc-derretida perto da forma cilíndrica de poços do eletrólito e perfurar um centro através do furo (2 mm de diâmetro) para inserção de chumbo elétrica usando ferramentas de usinagem (por exemplo, mini torno, brocas, etc.) .
Nota: Minimize a duração de exposição de amostras de ar para minimizar a oxidação. Oxidação de extensa é indicada pela presença de uma camada de superfície não-brilhante (fosco) nas amostras. Para remover a camada de óxido, a superfície da amostra usando 100 papel de esmeril de grão de areia e limpar com uma limpeza a seco. - Introduza o conjunto de pista elétrica (fio de tungstênio com tubo da alumina em 1.3) através do vácuo montagem porto da PAC câmara, as placas de defletor da câmara, o buraco na tampa eletrólito e no buraco em um eletrodo de liga. Repita este procedimento para todos os seis eletrodos. Em seguida, insira o termopar através do vácuo último montagem Porto e no sétimo bem no centro. Firmemente toca a superfície do eletrólito com a liga. Um conjunto completo é mostrado na Figura 2 e Figura 3.
Nota: Cada fio de tungstênio firmemente deve tocar a superfície do eletrólito. Se a liga é muito frágil para ser usinado, o fio de tungstênio pode ser realizado pressionado contra a liga pressionando o fio contra a liga e protegendo seu posicionamento apertando o vácuo que encaixe no vácuo montagem Porto - Coloque a junta grande na ranhura da parte superior da câmara de vácuo do aço inoxidável. Desça cuidadosamente as células eletroquímicas montadas na câmara de teste. Aperte bem todos os componentes de vácuo-selo e o grampo da câmara de teste.
- Remoção de umidade e oxigênio da célula eletroquímica montagem para medição emf
- carregar a câmara de teste montado em um forno de cadinho. Coloque duas camadas sobrepostas de isolamento de fibra de vidro em torno da superfície exposta da câmara de vácuo que não está na fornalha para garantir uma distribuição uniforme da temperatura na célula eletroquímica e impedir o fracasso dos selos epóxi na parte superior do teste Câmara.
- Anexar as linhas de água de refrigeração para arrefecimento tubo da entrada e saída de portos na câmara de teste ( Figura 3 e Figura 4).
- Anexar a linha de vácuo/argônio para a porta de entrada da câmara de teste e fechar a válvula de porta de saída. Evacuar a câmara de teste, até que a leitura do vacuômetro é abaixo de 10 mtorr.
Nota: Se o nível de vácuo não pode obter menos de 10 mtorr, verificação de componentes do selo da câmara de teste, incluindo anéis, grampos, encaixes de tubo e epóxi selos. - Sob vácuo ativo (< 10 mtorr), aumentar a temperatura do forno para 373 K a uma taxa de aquecimento de 5 K/min e segure por 10 h; aumentar a 543 K com a mesma taxa de aquecimento e segure por 10 h. Nota: O procedimento de secagem leva cerca de 20 h.
- , Uma vez que o procedimento de secagem acima é concluído, limpar a câmara com argônio de ultra-alta pureza. Repita a evacuação (< 10 mtorr) e argônio purge (~ 1 atm) pelo menos três vezes para garantir uma atmosfera inerte para operação em temperaturas elevadas.
- Após o último argônio purge, abra as válvulas de entrada e a saída da câmara de teste e ajuste o medidor de fluxo para manter um fluxo contínuo de argônio de 50,0 mL/min, à pressão ambiente atmosférico câmara (~ 1 atm).
3. Medições eletroquímicas
- estabelecer contato elétrico entre a célula montagem e potentiostat
- conectar o cabo do eletrodo de contador e o cabo do eletrodo de referência do potentiostat uma vez que o forno tem chegou a 543 K.
Nota: Cada cabo-eletrodo (por exemplo, o eletrodo de referência, eletrodo contador, eletrodo de trabalho, detecção de cabos eletrodo) tem um plug na extremidade do cabo que permite a conexão elétrica. - Anexar um grampo jacaré à extremidade do cabo do eletrodo de referência do potentiostat e encaixá-lo para a ligação elétrica do eléctrodo de referência do conjunto da célula. Caixa de
- plug em cinco cabos de eletrodo de trabalho, um em cada porta de 1 a 5, o interruptor de multiplexação (MUX). Anexar um grampo jacaré para cada cabo de eletrodo de trabalho e conecte cada agrafo no cabo elétrico para cada eletrodo de trabalho do conjunto da célula eletroquímica, permitindo medições de tensão sequencial de outro parente a cinco eletrodos para o eletrodo de referência.
Nota: Um eletrodo de trabalho deve possuir a mesma composição que o eletrodo de referência. A diferença de tensão entre esses dois eletrodos idênticos deve ser aproximadamente zero e deve ser monitorizada durante a medição inteira. Uma diferença de tensão menor que 2-3 mV indica a estabilidade e a confiabilidade do sistema de eletrodo de referência para medições precisas de emf. - Conecte uma extremidade de um cabo de terra para a câmara de teste de aço inoxidável e conecte a outra extremidade direcquentemente à porta do chão de uma tomada elétrica.
Nota: Este procedimento efetivamente suprime o ruído elétrico provenientes da fornalha, elementos de aquecimento, porque a câmara de aço inoxidável teste serve como uma gaiola de Faradaic durante as medições electroquímicas. - Criar um programa usando software eletroquímico para medir o potencial de circuito aberto (OCP) para cada eletrodo de trabalho sequencialmente utilizando o software potentiostat sob a modalidade de galvanostatic.
Nota: O programa personalizado, disponível por pedido, medidas e registros o OCP de cada eletrodo de trabalho, rotação sequencialmente através de cada eletrodo de trabalho ao longo do tempo, com cada rotação dura por 15 min. O programa deve rodar através do conjunto de eletrodos de trabalho para medições de OCP recordes a cada incremento de temperatura. - Aumentar a forno temperatura de 543 K a 1.073 K K 5,0/min, onde o eletrólito torna-se condutor ionically para medições de campos eletromagnéticos.
Nota: A 1.073 K, o eletrodo de referência deve ser totalmente derretido para estabelecer contato elétrico estável com o eletrólito e ligação elétrica para maior estabilidade de potenciais de eletrodo de referência durante as medições de emf.
- conectar o cabo do eletrodo de contador e o cabo do eletrodo de referência do potentiostat uma vez que o forno tem chegou a 543 K.
- Definindo o perfil térmico do forno de ciclos térmicos durante a medição emf
Nota: A escala de temperatura está subordinada o comportamento de transição de fase (por exemplo, derretendo as composições de eletrodo temperatura) bem como a reatividade da composição da liga. Um perfil de temperatura típico para o estudo da Ba-Bi e sistemas de liga Sr-Bi, entre 723 e 1.073 K, é dada abaixo. Controlador de- programa do forno para diminuir a temperatura do forno de 1.073 K a 723 K e de aumentar de 723 K para 1.073 K em intervalos de 25 K a uma taxa de subida de ± 5 K/min. Em cada etapa de temperatura (a cada intervalo de 25K), mantenha a temperatura de 1-2 h permitir que componentes atingir o equilíbrio térmico e eletroquímico.
Nota: Equilíbrio térmico é atingido, uma vez que a temperatura da célula permanece constante dentro de ± 1 K em cada etapa de temperatura conforme indicado pelos dados do termopar exibidos pelo sistema de aquisição (DAQ) de dados associados.
- programa do forno para diminuir a temperatura do forno de 1.073 K a 723 K e de aumentar de 723 K para 1.073 K em intervalos de 25 K a uma taxa de subida de ± 5 K/min. Em cada etapa de temperatura (a cada intervalo de 25K), mantenha a temperatura de 1-2 h permitir que componentes atingir o equilíbrio térmico e eletroquímico.
- Coleta de dados de temperatura e emf
- gravar a temperatura da célula eletroquímica durante todo o ciclo térmico utilizando um sistema DAQ de termopar; incluem os limites superior e inferior da temperatura do forno programa e o tipo do termopar. Iniciar o programa de medição de campos eletromagnéticos ao mesmo tempo como a gravação de temperatura.
Nota: A medição de OCP de cada eletrodo de trabalho é medida contra o eletrodo de referência. A medida de OCP entre os dois eletrodos de referência deve ser inferior a 2-3 mV. - Usar a temperatura da célula e as medições de OCP de cada eletrodo de trabalho para determinar os valores de campos eletromagnéticos de cada liga metálica terra alcalina-líquido em função da temperatura. Os valores OCP a cada temperatura são os valores de campos eletromagnéticos entre os eletrodos de referência e de trabalho.
- gravar a temperatura da célula eletroquímica durante todo o ciclo térmico utilizando um sistema DAQ de termopar; incluem os limites superior e inferior da temperatura do forno programa e o tipo do termopar. Iniciar o programa de medição de campos eletromagnéticos ao mesmo tempo como a gravação de temperatura.
Resultados
A Figura 5 exibe medições de campos eletromagnéticos feitas após resfriamento e reaquecimento de uma célula eletroquímica: Ba-Bi (xBa = 0.05) | CaF2- BaF2| BA-Bi (xBa = 0,05, 0,10 e 0,20), onde uma liga Ba-Bi no xBa = 0,05 serve como o eletrodo de referência5.
A diferença de potencial entre as duas ligas de Ba-Bi idênticas no xBa = 0,05 permanece inferior a 2 mV durante a medição toda, demonstrando a estabilidade e a confiabilidade do eletrodo de referência. Para composições de liga no xBa = 0,10 e xBa = 0.20, um perfil de emf simétrica é obtido durante o aquecimento e arrefecimento de ciclos, indicando valores de campos eletromagnéticos podem ser reproduzidos durante a ciclagem térmica. Em cada etapa de temperatura (a cada intervalo de 25 K), a temperatura da célula e o valor da célula emf alcançam térmica e eletroquímica-estado estacionário em menos de 1-2h (Figura 5)5.
Para determinar as propriedades termodinâmicas das ligas contra o estado padrão de Ba(s) puro, os valores de campos eletromagnéticos da Bi-Ba Ba-Bi (xBa = 0.05) eletrodo de referência de liga deve ser aferido em relação ao Ba puro. Os valores de emf o eletrodo de referência relativamente puro Ba são determinados por meio de uma célula eletroquímica separada: Ba(s) | CaF2- BaF2| BA-Bi (xBa = 0,05) e os resultados são apresentados na Figura 6. Usar o linear ajuste desta medida em xBa = 0,05 (Figura 6), o emf valores de ligas de Ba-Bi (Ecelular) são determinadas em relação pura Ba metal5.
Os valores de campos eletromagnéticos de ligas de Ba-Bi, em relação a Ba(s) pura, são plotados em função da temperatura em cada composição do eletrodo, conforme mostrado na Figura 7 para ligas de Ba-Bi selecionadas (xBa = 0,05 - 0,25)5. De ajustes lineares de dados emf representados graficamente em função da temperatura, a mudança na entropia molar parcial foi calculada usando a seguinte equação termodinâmica:
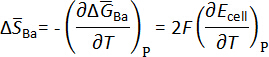
e a entalpia molar parcial de bário em bismuto pode ser calculada usando relações termodinâmicas como a equação de Gibbs-Helmholtz, como mostrado abaixo. Os resultados estão resumidos na tabela 15.
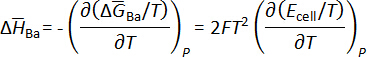
A atividade de bário também foi determinada usando os valores coletados emf e a equação de Nernst:
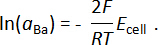
Os resultados estão sumarizados na tabela 25.
Valores de EMF para ligas de Ba-Bi (xBa = 0.05 - 0,80) também foram utilizados para determinar as temperaturas de transição de fase para cada composição da liga. Em conjunto com diferencial digitalização dados de transição de fase calorimetria (DSC), acoplado indutivamente plasma emissão atômica espectroscopia (ICP-AES) composição dados, semelhantes ao exibido na tabela 3,12e estrutura cristalina foram utilizados dados de análise XRD, dados emf para refinar o diagrama de fase de Ba-Bi mais recente relatado por Okamoto (Figura 8)5,11.
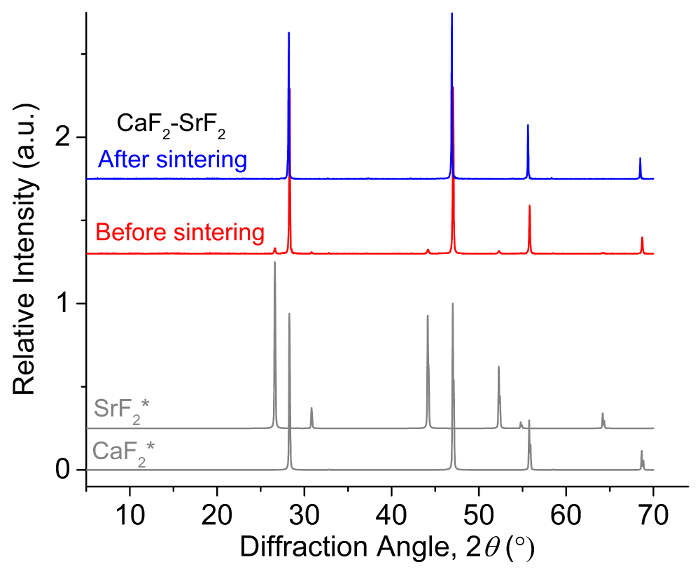
Figura 1: CaF monofásico2- SrF2 espectros XRD de eletrólito. Espectros XRD (normalizados até ao pico mais intenso para cada espectro) de CaF2- SrF2 eletrólito antes e após a sinterização. Pure (*) CaF2 e SrF2 padrões de difração são fornecidos para comparação. Esta figura foi modificada de Smith et al. 9 clique aqui para ver uma versão maior desta figura.
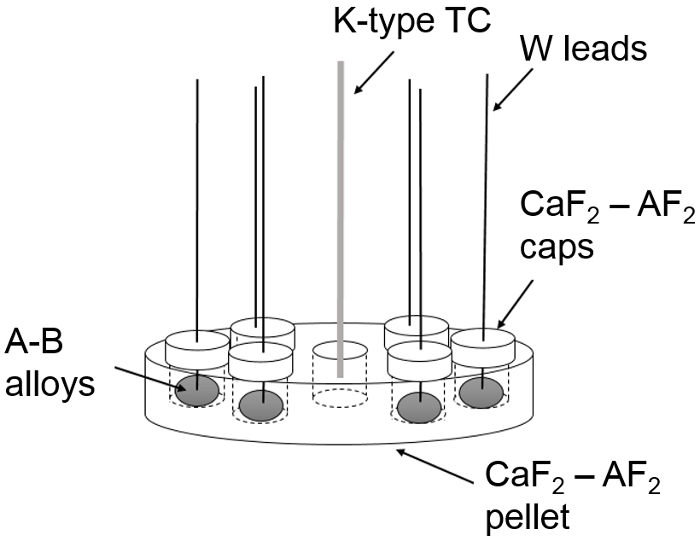
Figura 2: células eletroquímicas de ligas de metal alcalino-líquido A-B. Um esquema de célula eletroquímica assembly usado para medições de campos eletromagnéticos com eletrólito, tampões de eletrólito, materiais de eletrodo, pistas de tungstênio e termopar (TC). Duas das 6 ligas A-B são eletrodos de referência e 4 são eletrodos de trabalho. Clique aqui para ver uma versão maior desta figura.

Figura 3: instalação eletroquímica para medições de emf. Uma ilustração dos componentes de células eletroquímicas e componentes associados para condições adequadas de funcionamento. Clique aqui para ver uma versão maior desta figura.
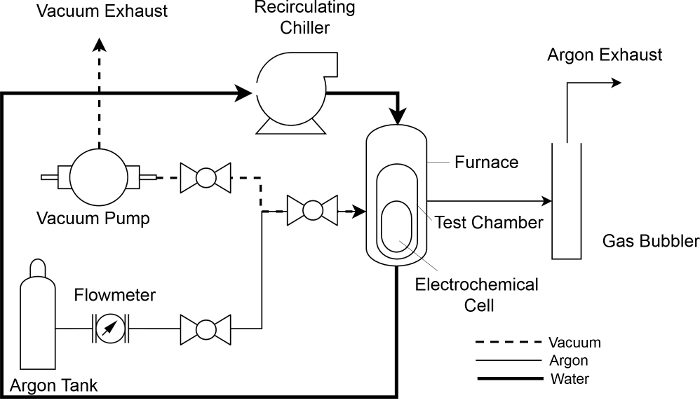
Figura 4: diagrama de instrumentação da instalação experimental. Um esquema de refrigeração de água (sólido, bold (realce)), argônio (sólido, fino) e vácuo (tracejado) fluxo de fluido através do sistema de medição de campos eletromagnéticos. Clique aqui para ver uma versão maior desta figura.
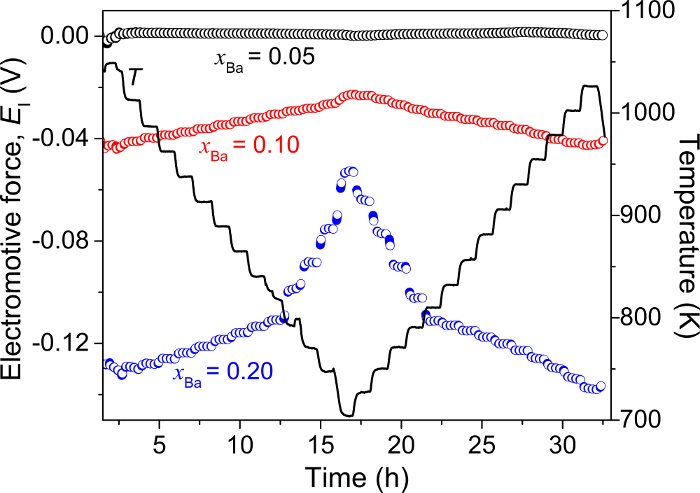
Figura 5: Medições de emf eletroquímico de ligas de Ba-Bi (xBa = 0.05 - 0,20). Força eletromotriz (E1) e a temperatura medida em função do tempo de resfriamento e reaquecimento um Ba-Bi (xBa = 0.05) | CaF2- BaF2| BA-Bi (xBa = 0,05, 0,10 e 0,20) célula. Esta figura foi modificada de Lichtenstein et al 5 , por favor clique aqui para ver uma versão maior desta figura.
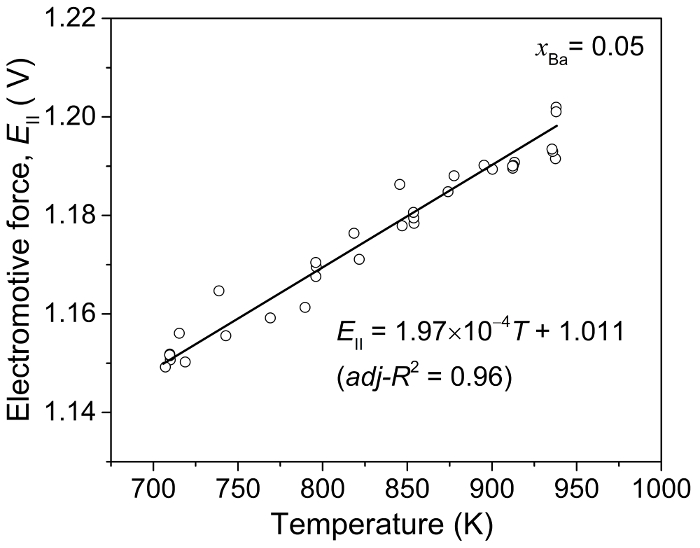
Figura 6: Liga de pura Ba vs Ba-Bi(xBa = 0.05) calibração do valor de emf. Força eletromotriz (EII) medido em função da temperatura utilizando um Ba(s) | CaF2- BaF2| BA-Bi (xBa = 0.05) célula. Esta figura foi modificada de Lichtenstein et al 5 , por favor clique aqui para ver uma versão maior desta figura.
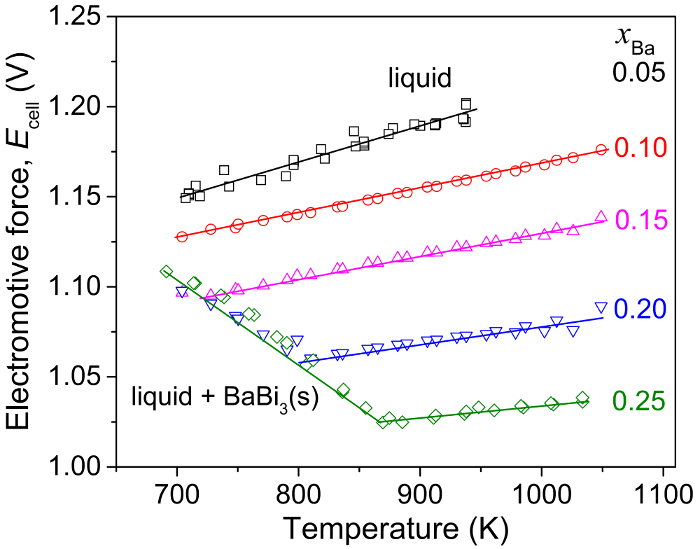
Figura 7: Medições de campos eletromagnéticos de ligas de Ba-Bi (xBa = 0,05 - 0,25). Força eletromotriz (Ecelular) em função da temperatura para Ba-Bi ligas no xBa = 0,05, 0,10, 0,15, 0,20 e 0,25 com base em um Ba(s) | CaF2- BaF2| BA-Bi (XBa = 0,05 - 0,25), onde as linhas contínuas representam linear se encaixa. Esta figura foi modificada de Lichtenstein et al 5 , por favor clique aqui para ver uma versão maior desta figura.
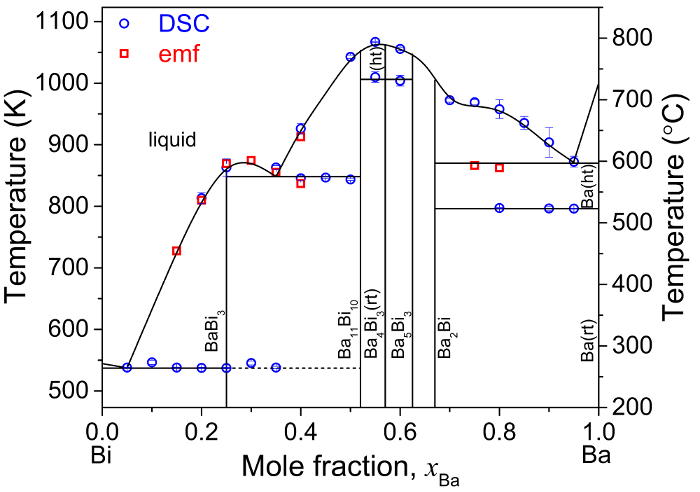
Figura 8: diagrama de fase de Ba-Bi. Diagrama de fase de Ba-Bi determinado experimentalmente com base em medições de campos eletromagnéticos em complemento com DSC e XRD caracterização de ligas de Ba-Bi, onde (rt) e (ht) representam a temperatura e a alta temperatura, respectivamente. Esta figura foi modificada de Lichtenstein et al 5 , por favor clique aqui para ver uma versão maior desta figura.
| x Ba | T (K) | ∂E /∂ decélulaT (μV K\u20121) | ∂(ECell/T)/∂(1/T) (mV) | 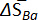 (J mol\u20121 K\u20121) (J mol\u20121 K\u20121) | 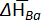 (kJ mol\u20121) (kJ mol\u20121) |
| 0.05 | 707-938 | 197 ± 6 | 1011 ± 5 | 38 | -195.1 |
| 0.1 | 704-1048 | 137 ± 1 | 1031 ± 1 | 26,4 | -199 |
| 0.15 | 728-1048 | 125 ± 2 | 1005 ± 2 | 24,1 | -193.9 |
| 0.2 | 809-1048 | 94 ± 7 | 984 ± 6 | 18,1 | -189.9 |
| 0.25 | 881-1048 | 73,4 ± 5 | 961 ± 5 | 14.2 | -185.4 |
| 0.25 | 704-881 | -480 ± 14 | 1448 ± 13 | -92.6 | -279.4 |
Tabela 1: propriedades termodinâmicas de ligas de Ba-Bi (xBa = 0,05 - 0,25). Mudança de entropias molares parciais (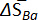 ) e enthalpies molares parciais (
) e enthalpies molares parciais (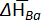 ) para Ba-Bi da liga composições xBa = 0,05 xBa = 0.25, calculado a partir de ajustes lineares dos valores de campos eletromagnéticos, onde as encostas e as interceptações são
) para Ba-Bi da liga composições xBa = 0,05 xBa = 0.25, calculado a partir de ajustes lineares dos valores de campos eletromagnéticos, onde as encostas e as interceptações são 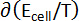 e
e 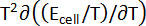 , respectivamente. Esta tabela foi modificada de Lichtenstein et al. 5
, respectivamente. Esta tabela foi modificada de Lichtenstein et al. 5
| x Ba | E (V) | ln um Ba | ||||
| 773 K | 873 K | 973 K | 773 K | 873 K | 973 K | |
| 0.05 | 1.164 | 1.183 | 1.203 | -35 | -31.5 | -28.7 |
| 0,10 | 1.137 | 1.15 | 1.164 | -34.1 | -30.6 | -27.8 |
| 0.15 | 1.101 | 1.114 | 1.127 | -33 | -29.6 | -26.9 |
| 0.20 | 1.075 | 1.066 | 1.076 | -32.2 | -28.3 | -25.7 |
| 0.25 | 1.075 | 1.027 | 1.032 | -32.2 | -27.3 | -24.6 |
Tabela 2: emf valores medidos (E) e o logaritmo natural da atividade de bário em bismuto (ln umBa). Os valores medidos emf de ligas de Ba-Bi (xBa = 0,05 - 0,25) versus Ba(s) e o logaritmo natural da atividade de bário em bismuto em 773 K, K 873 e 973 K. Esta tabela foi modificada de Lichtenstein et al 5
| Fração molar, x Ba | |
| Nominal | Medido |
| 0,03 | 0,03 |
| 0.05 | 0.05 |
| 0,10 | 0,09 |
| 0.15 | 0,14 |
| 0.20 | 0.20 |
| 0.25 | 0.25 |
| 0,30 | 0,30 |
Tabela 3: Nominal e medido o teor de bário de ligas binárias de Ba-Sb. O conteúdo de bário nominal e medido de ligas binárias de Ba-Sb. Teor de bário de ligas de Ba-Sb foi confirmada usando indutivamente acoplado emissio atômica de plasmaespectroscopia de n (ICP-AES). Esta tabela foi modificada de Lichtenstein et al 12
Discussão
A célula de emf neste trabalho usa um CaF2-com base em materiais sólidos de eletrólito e eletrodo em composições fixas, em comparação com uma célula de emf que usa uma técnica de deteção de titulação onde a composição do eletrodo é alterada a uma temperatura constante. Com titulação de deteção, a composição do eletrodo é determinada pela lei de Faraday, assumindo a perfeita eficiência coulombic. No entanto, altamente reativos alcalino - terrosos são moderadamente solúvel (por exemplo, solubilidade em Ba ~ 15 mol % em BaCl2) em seus próprios sais haletos, que pode promover a condução eletrônica através do eletrólito e impedir o controle exato do composição do eletrodo durante a titulação de deteção de7,13. A célula eletroquímica neste trabalho opera com materiais de eletrodo em composições fixas, eliminando assim a incerteza na contabilidade composicional por titulação deteção e permite medições precisas de emf da terra alcalina-ligas. Além disso, a única célula eletroquímica neste trabalho mede os valores de campos eletromagnéticos de composições de quatro liga simultaneamente dentro do mesmo experimento para acelerar a avaliação das propriedades termodinâmicas ao longo de uma ampla variedade de composições e temperaturas.
Como o solo arc é usado para fabricar as ligas binárias, é possível que a composição final das ligas pode desviar a composição inicial devido à alta temperatura do arco elétrico e as altas pressões de vapor dos metais. Para relatar com precisão a relação de campos eletromagnéticos-temperatura das ligas binárias, sua composição foi confirmada usando indutivamente acoplado a espectroscopia de emissão atômica de plasma (ICP-AES), conforme mostrado na tabela 3 para o Ba-Sb sistema12.
Antes de secar os componentes da célula eletroquímica conforme item 2.3.4, dificuldades na obtenção de vácuo de alta qualidade (< 10 mtorr) pode ocorrer. O-Ring na configuração da câmara de vácuo não pode ser encaixado corretamente na sua Ranhura de aço inoxidável. Também pode haver uma lacuna nos selos da cola epoxy de tubos de alumina, ao qual epóxi adicional pode ser aplicada para vedar possíveis fugas. Durante as medições de campos eletromagnéticos, se os contatos elétricos perdem contato com as ligas A-B e grandes flutuações nos valores de campos eletromagnéticos são observadas, o contato pode ser restabelecido com as ligas rodando suavemente o tubo da alumina, desse modo, molhando a liga líquida para a liderança.
Ocasionalmente, os valores de campos eletromagnéticos podem apresentar uma grande histerese entre ciclos de aquecimento e o arrefecimento. Em geral, uma histerese de valores de campos eletromagnéticos entre ciclos de resfriamento/aquecimento pode se originar de (1) a degradação do eletrólito com composições de eletrodo reativa, especialmente em altas concentrações de terra alcalina; (2) a degradação dos materiais do eletrodo devido a vaporização em temperaturas elevadas e oxidação com o oxigênio residual dentro da câmara de teste; ou (3) comportamento de desequilíbrio de fase dos materiais de eletrodo, incluindo undercooling efeitos e a formação de fases metaestáveis durante o ciclo de refrigeração.
Quando a reação de degradação entre o elétrodo e o eletrólito é evidente, a montagem experimental pode ser modificada para mitigar a degradação da célula eletroquímica, diminuindo a temperatura operacional máxima. Na presença de Subrefrigeração efeitos, valores de campos eletromagnéticos obtidos durante o ciclo de aquecimento podem ser utilizadas na determinação de propriedades termodinâmicas de equilíbrio. Quando a formação de fases metaestáveis provoca uma histerese em medições de campos eletromagnéticos, o comportamento de fase dos materiais de eletrodo requer controlo através de técnicas complementares, por exemplo, caracterização estrutural por XRD, análise dos componentes de fase por microscopia eletrônica (MEV) com espectroscopia de energia dispersiva (EDS) e as temperaturas de transição de fase por DSC. Dados de transição de fase também podem ser difícil de obter com a técnica de medição de campos eletromagnéticos descritos acima 1.223 K, como o CaF2eletrólito de2 -AF pode começar a degradar.
A técnica de medição de campos eletromagnéticos neste trabalho pode ser usada para determinar as propriedades termodinâmicas empíricas de ligas de metal líquido alcalino-binárias, incluindo atividade, entropia molar parcial, entalpia molar parcial e temperaturas de transição de fase. Estes dados termodinâmicos são utilizados como uma base experimental para refinação de diagramas de fase binários de terra alcalina-ligas com técnicas complementares (XRD, DSC e SEM), como exemplificado na Figura 85. Com base nos valores de atividade de cada metais alcalino - terrosos (A = Ca, Ba e Sr) em metais líquidos (B = Bi e Sb), a força das interações atômicas entre elementos alcalino-terra e metais líquidos pode ser aproveitada para separar eletroquimicamente terra alcalina- produtos de fissão de soluções de sal fundidos.
Divulgações
Os autores têm sem conflitos de interesse a divulgar sobre o material na publicação.
Agradecimentos
Este trabalho foi financiado pelo departamento de energia, escritório da Energia Nuclear a energia Nuclear Universidade programas (n º prêmio DE-NE0008425); Universidade integrada programa pós comunhão (n. º prêmio DE-NE0000113); o Ministério de comércio, indústria e & energia, República da Coreia, a eficiência energética & recursos do núcleo programa de tecnologia do Instituto de Coreia da avaliação de tecnologia de energia e planejamento (KETEP) (n º 20142020104190). A publicação deste artigo foi financiada em parte pelo Pensilvânia estado Universidade bibliotecas Open Access Publishing fundo.
Materiais
| Name | Company | Catalog Number | Comments |
| 1 L bottle | US Plastic | 69032 | HDPE, wide mouth |
| Acetone, 99.5% | Alfa Aesar | 30698 | ACS Grade |
| Alumina dish | AdValue Technology | AL-4120 | 81 mm OD, 30 mm height |
| Alumina plate | AdValue Technology | AL-D-82-6 | 10 cm in diameter, 4.65 mm thickness |
| Alumina powder | AluChem | AC99 tabular alumina | |
| Alumina tube | Coorstek | 66631-12.0000 | 0.25 in. OD, 12 in. length |
| Arc-Melter | Edmund Buhler GmbH | MAM1 | |
| Argon, 99.999% | Praxair | AR 5.0UH-K | Ultrahigh purity |
| Ball mill | Norton Chemical Process Products Corporation | CF-70109 | 6 sets of 2 12.5 in. rollers, RPM 1725/1425 |
| Barium | Alfa Aesar | 653 | 99.2% purity |
| Barium fluoride | Sigma-Aldrich | 652458 | 99.999% purity |
| Bismuth | Sigma-Aldrich | 556130 | 99.999% purity |
| Boron nitride | Saint-Gobain | AX-05 | |
| Calcium fluoride | Alfa Aesar | 11055 | 99.95% purity |
| Cotton tip applicator | Dynarex | 4301 | 100 count, 3 in. long |
| Die press | Carver, Inc. | 3850 | Clamping force: 12 tons; Platens: 6 x 6 in. |
| Drill bit 29 piece set | Chicago-Latrobe | 45640 | 1/16 in. - 1/2 in. x 1/64 in. |
| Drying pan | Pyrex | 5300114 | 15.5 in. x 9.5 in. x 2.25 in. |
| Emery paper | McMaster-Carr | 4681A21 | Grit size: 100 |
| Fiberglass insulation | McMaster-Carr | 9346K38 | |
| Flowmeter | Brooks | MR3A00SVVT | Range: 0.1 to 1 standard cubic feet per hour (SCFH) of Air |
| Gas bubbler | Ace Glass | 8761-10 | |
| High temperature box furnace | Thermolyne | F48020-80 | 48000 Furnace, 8-segment program, Max. 1,200 °C |
| High temperature crucible furnace | Mellen | CC12-6X12-1Z | 6 in. ID, 12 in. depth. Max temp 1,200 °C. 208 V |
| High vacuum grease | Sigma-Aldrich | Z273554 | Brand: Dow Corning |
| Inert atmopshere glovebox | Mbraun | MB200 | |
| Isopropyl alcohol | Macron Chemicals | 3032-21 | ACS Grade |
| Large pellet die set | MTI Corporation | EQ-Die-75D | |
| Polyvinyl alcohol, 99+% | Sigma-Aldrich | 341584-5KG | Hydrolyzed, molecular weight (MW): 89,000-98,000 |
| Potentiostat | Autolab | PGSTAT302N | |
| Potentiostat-multiplexing switch box | Autolab | MUX SCANNER16 F/16 X WE | Multiplexer (MUX) SCANNER16 |
| Potentiostat control software | NOVA | NOVA 1.11 | |
| Precision mini lathe | Harbor Freight Tools | 93212 | Brand: Central Machinery |
| Quick cure epoxy | Grainger | 5A462 | Brand: Devcon |
| Recirculating chiller | VWR International | 13271-204 | Model: 1175PD |
| Small pellet die set | MTI Corporation | EQ-Die-18D-B | |
| Sonicator | VWR International | 97043-968 | |
| Squeeze bottle | VWR International | 16650-022 | LDPE, 500 mL |
| Stainless steel mesh sieve | Amazon | 10 mesh, 2 mm holes | |
| Strontium | Sigma-Aldrich | 343730 | 99% purity |
| Strontium fluoride | Sigma-Aldrich | 450030 | 99.99% purity |
| Thermocouple | Omega | KMQXL-125U-18 | K-type thermocouple |
| Thermocouple acquisiton board | National Instruments | NI-9211 | |
| Tungsten wire | ThermoShield | 88007-0.100 | 99.95% wire |
| Vacuum pump | Pfeiffer | PK D56 707 | Duo Line 1.6 |
| Wipes | Kimtech | S-8115 | ULine distributor |
| Wire cutters | McMaster-Carr | 5372A4 | |
| Yttria-stabilized zirconia milling media | Tosoh, USA | 3 mm diameter |
Referências
- Ipser, H., Mikula, A., Katayama, I. Overview: The emf method as a source of experimental thermodynamic data. CALPHAD: Comput. Coupling Phase Diagrams Thermochem. 34 (3), 271-278 (2010).
- Kim, H., Smith, N., Kumar, K., Lichtenstein, T. Electrochemical Separation of Barium into Liquid Bismuth by Controlling Deposition Potentials. Electrochim. Acta. 220, 237-244 (2016).
- National Research Council. . Electrometallurgical Techniques for DOE Spent Fuel Treatment: Final Report. , (2000).
- Simpson, M. F. Projected Salt Waste Production from a Commercial Pyroprocessing Facility. Sci. Technol. Nucl. Install. 2013, 1-8 (2013).
- Lichtenstein, T., Smith, N. D., Gesualdi, J., Kumar, K., Kim, H. Thermodynamic properties of Barium-Bismuth alloys determined by emf measurements. Electrochim. Acta. 228, 628-635 (2017).
- Kim, H., Boysen, D. A., Ouchi, T., Sadoway, D. R. Calcium-bismuth electrodes for large-scale energy storage (liquid metal batteries). J. Power Sources. 241, 239-248 (2013).
- Delcet, J., Delgado-Brune, A., Egan, J. J. Coulometric Titrations Using CaF2 and BaF2 Solid Electrolytes to Study Alloy Phases. Symp. Calc. Phase Diagrams Thermochemistry Alloy Phases. 275, 275-287 (1979).
- Roine, A. . Outokummpu HSC Chemistry 5.1. Chemical Reaction and Equilibrium Software with Extensive Thermochemical Database. , (2002).
- Smith, N. D., Lichtenstein, T., Gesualdi, J., Kumar, K., Kim, H. Thermodynamic Properties of Strontium-Bismuth Alloys Determined by Electromotive Force Measurements. Electrochim. Acta. 225, 584-591 (2017).
- Kim, H., et al. Thermodynamic properties of Calcium-Bismuth alloys determined by emf measurements. Electrochim. Acta. 60, 154-162 (2012).
- Okamoto, H. . Ba-Bi (Barium-Bismuth). , (1990).
- Lichtenstein, T., Gesualdi, J., Nigl, T. P., Yu, C. T., Kim, H. Thermodynamic Properties of Barium-Antimony Alloys Determined by Emf Measurements. Electrochim. Acta. , (2017).
- Wagner, C. Limitation of the Use of CaF2 in Galvanic Cells for Thermodynamic Measurements due to the Onset of Electronic Conduction under Reducing Conditions. J. Electrochem. Soc. 115 (9), 933-935 (1968).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados