Method Article
Distinction simultanée de monospécifiques et modèles mixtes DFS70 cours ANA de dépistage avec un substrat de roman HEp-2 ELITE/DFS70 Knockout
Dans cet article
Résumé
Autoanticorps DFS70 imitent les modèles associés à la maladie d’anticorps antinucléaires communs faisant une interprétation exacte difficile lors de l’utilisation des substrats classiques de HEp-2. Le protocole décrit les avantages du nouveau substrat machiné de HEp-2 sur HEp-2 conventionnel à ANA de dépistage et de distinguer DFS70 modèles avec confiance élevée en monospécifiques et mixtes cas positifs de l’ANA.
Résumé
Auto-immune systémique du tissu conjonctif est caractérisé en faisant circuler des anticorps antinucléaires (ANA). Bien qu’il existe plusieurs technologies pour ANA dépistage, immunofluorescence indirecte (IFI) en utilisant des substrats de (HEp-2) 2-cellules humaines épithéliales reste la méthode primaire et recommandée en raison de sa sensibilité supérieure. HEp-2 substrats peuvent détecter une multitude de motifs découlant de la consolidation de l’auto-anticorps à divers antigènes de protéines et acides nucléiques répartis dans le noyau et le cytoplasme des cellules. La grande diversité des modèles mixtes résultant de réactions positives sur HEp-2 aussi de monospécifiques et compliquer l’interprétation et la justesse de l’information. Un exemple concret qui a récemment reçu une attention plus grande est la dense fine 70 (DFS70) moucheté résultant des auto-anticorps qui se lient spécifiquement à une protéine appelée facteur de croissance dérivé l’épithélium lentille (LEDGF). Absence de relation claire avec une maladie auto-immune systémique spécifique ainsi qu’une prévalence élevée dans les populations en bonne santé ont fait une interprétation exacte du modèle DFS70 important. Distinction précise du motif de DFS70 partir de motifs associés à la maladie en utilisant des substrats classiques de HEp-2 est un défi. En outre, cooccurrence fréquente du motif DFS70 avec motifs associés à la maladie comme modèles homogènes, mouchetés et mixtes homogène-moucheté compliquer l’interprétation de l’IIF. L’objectif de cet article est de démontrer que l’utilité d’un roman conçu substrat HEp-2 IIF qui conserve tous les avantages du substrat de HEp-2 conventionnel tout en offrant la capacité de distinguer le modèle DFS70 avec une confiance élevée dans les deux monospécifiques et mixtes exemples positifs de l’ANA. Le nouveau substrat est davantage capable de démasquer des ANA associés à la maladie, précédemment masquées par DFS70 modèle.
Introduction
ANAs sont une caractéristique de de maladies auto-immunes médiation systémique du tissu conjonctif1. Plusieurs méthodes sont employées pour le dépistage et confirmation de l’ANAs. Technique de l’IIF en utilisant les restes de substrat de HEp-2 le plus couramment utilisé et recommandé fréquemment procédé de criblage ANAs1,2. Malgré les progrès réalisés dans les méthodologies de test diagnostique de phase solide comme dosage immunoenzymatique (ELISA), immunoenzymatique (EIA), immuno-essai de chimiluminescence (CLIA) et analyses multiplexes perle, IIF de HEp-2 est la plus répandue projection méthode en raison de son utilité diagnostique et coût efficacité1,2,3. Les technologies de test susmentionné s’appuient sur un ensemble limité de native purifiée ou des antigènes recombinants, considérant que les préparations de monocouche de cellules HEp-2 sur les puits de lame de verre présentent une grande variété d’antigènes sous leur forme naturelle, répartis sur le noyau et le cytoplasme, qui réagissent avec les auto-anticorps du sérum du patient ou des contrôles positifs, ce qui entraîne une multitude de modèles qui sont associées à diverses maladies auto-immunes. Ces modèles sont classés en figures mitotiques, cytoplasmiques et nucléaires basés sur la localisation de l’antigène dans les cellules. Chaque motif et l’antigène/antigènes associés et états pathologiques sont bien caractérisés4. Dans la méthode de l’IIF, sérum de patient et contrôle est incubés sur les puits de lame de verre qui présentent une culture monocouche de cellules HEp-2 convenablement fixés pour préserver une multitude d’auto-antigènes dans leur configuration naturelle. Les autoanticorps dans les sérums de patients ou des contrôles positifs sont autorisés à lier les auto-antigènes présentés par les cellules HEp-2 sur le substrat (lame de verre bien) durant l’incubation. Après incubation, anticorps non fixés sont lavés au loin et les anticorps de classe IgG sont détectés avec conjugué anti-human IgG réactif de fluorescéine/fluorescéine isothiocyanate (FITC). Déclaré-conjugué non lié est éliminé et les lamelles de verre sont montées au sommet de la glisse à l’aide d’un support de montage qui préserve les réactions et facilite l’observation sous un microscope à fluorescence. Réactions sont observées sous un microscope à fluorescence équipé avec combinaison de filtre d’excitation-émission appropriés configuré selon le journaliste utilisé (pour journaliste FITC, un microscope diagnostic généralement utilise des filtres avec gamme d’excitation de 467 -498 nm et une gamme d’émissions de 513-556 nm). La présence d’ANA est démontrée par une fluorescence verte vif de structures spécifiques dans les cellules. Contrairement aux plateformes de test automatisé, méthodologie de l’IIF se fonde sur le laborieux processus de série diluant les sérums et la visuelle détermination positive de le les colorations qui oblige l’utilisateur importante expertise5,6. Malgré ces limites, IIF de HEp-2 reste le plus largement utilisé et recommandé de méthode pour le dépistage des Ana grâce aux efforts de normalisation vers nomenclature et interprétation du modèle par le consensus International sur ANA Comité de patrons (PICA), augmentation de la disponibilité des solutions d’automatisation pour le traitement des diapositives IIF et résultat interprétation3.
Parmi la multitude de modèles détectées par la méthode IIF HEp-2, autoanticorps ciblant le produit du gène psip1 (également dénommé p75/LEDGF/DFS70), ont acquis des intérêts importants dans ces dernières années pour plusieurs raisons4,5 ,6,7,8,9,10. DFS70 auto-anticorps sont présents dans des titres élevés chez les témoins sains, et études ont jusqu'à présent pas réussi à démontrer une association clinique distincte pour la présence de DFS70 autoanticorps7,8,9 ,10,11,12,13. Les taux de résultats positifs des autoanticorps DFS70 dans divers états pathologiques et les cohortes de santé variées entre études6,8,9,10,14 ,15,16,17,18,19,20,21,22,23 ,24,25,26,27,28. Le modèle monospécifiques DFS70 est bien différencié d’un modèle homogène ou moucheté, mais l’interprétation de modèles mixtes de homogène-moucheté et anticorps anti-DFS70 qui s’avec autres ANAs est difficile même pour les lecteurs experts. La génération actuelle de IIF dépistage des méthodes et des essais de phase solide spécifique DFS70 n’est pas capable de différencier un monospécifiques DFS70 réaction de modèles mixtes (Figure 1 a, jaune ombrée de l’algorithme). Une mauvaise interprétation du modèle DFS70 comme homogène, moucheté, ou modèle mixte ou vice versa, peut-être avoir des répercussions graves sur les soins aux patients. Le protocole actuel couramment utilisé est le suivant : les laboratoires cliniques utilisent un certain nombre de tests de confirmation en phase solide pour ANAs associés à la maladie ou d’une méthode d’immunoadsorption pour DFS70/LEDGF lorsque l’amende dense moucheté (AC-2) modèle est suspectée (Figure 1 a)4,5.
Ce protocole vise à démontrer l’utilité d’un roman conçu substrat IIF HEp-2 (HEp-2 ELITE/DFS70 knockout (KO), sera considérée comme ELITE HEp-2) qui conserve tous les avantages de HEp-2 classiques de dépistage ANAs tandis que simultanément distinguer DFS70 patron avec une confiance élevée en monospécifiques et mixtes ANA cas positifs (Figure 1 b, jaune ombrée de l’algorithme)5. Substrat de HEp-2 ELITE est composé d’un mélange approximatif de non modifiés les cellules HEp-2 et machinés cellules dépourvues de p75/LEDGF/DFS70 antigène dans le ratio de 1:95. La procédure de l’IIF pour ELITE HEp-2 est identique à la méthode conventionnelle de HEp-2. La configuration unique du substrat de HEp-2 ELITE non seulement conserve tous les avantages de HEp2 classiques mais peut différencier les modes de réaction homogène, moucheté et mixtes du modèle DFS70 à l’examen initial ou l’essai d’un échantillon (Figure 1 b )5. Le sérum du patient à faire réagir sur des lames avec substrat IIF HEp-2 doit être dilué 01:40 avec dilution de dépistage ou selon le critère de chaque laboratoire. Une réaction spécifique à 01:40 ou titre supérieur est considéré comme positive.
Dans cette étude, les sérums positifs pour centromère homogène, moucheté, nucléole, cytoplasme réticulaire/AMA et motifs DFS70 qui produit un signal positif de support (par rapport à la contrôle négatif et le positif ANA contrôle fourni par le kit) lors du dépistage dilution de 01:40 ont été sélectionnés pour simuler les modèles mono spécifiques et mixtes sur des substrats de HEp-2 (classiques et ELITE HEp-2). Le 01:40 dilué DFS70 sérums positifs ont été mélangés à 01:40 de dilutions d’individuelles associés à la maladie ANA mires de contrôles (homogène, moucheté, centromère, nucléole, ou cytoplasmique réticulaire-AMA) dans différents ratios (contrôle : DFS70 à 100 : 0, 80/20, 50/50, 20 : 80 et 0 : 100) et évaluées sur conventionnel et substrats de HEp-2 ELITE suite à procédure IIF standard décrite ci-dessous.
Protocole
Le protocole suit les directives du Comité d’éthique institutionnel recherche humaine Trinity Biotech.
1. échantillonnage et préparation du substrat
- Permettre les sachets contenant des lames de substrat (verre glisse avec 12 puits sur chaque diapositive contenant HEp2 ou HEp-2 + HEp2 KO cellule mélange) est proportionnelle à la température de la pièce pour des performances optimales et empêcher la condensation de l’humidité sur la surface de glissement avant le ajout de l’échantillon. Cela devrait prendre environ entre 10-15 min.
- Une fois équilibrés à température ambiante, retirez soigneusement les lames à l’aide de doigts sans les toucher les côtés de la pochette.
- Étiqueter les diapositives et les placer dans une chambre d’incubation (à température ambiante) doublé avec du papier absorbant imbibé d’eau pour éviter le dessèchement des diapositives en échantillon et conjugué d’incubation.
NOTE : Coloration Non spécifique peut entraîner des puits sec ; une serviette de papier humide à l’intérieur de la chambre d’incubation fournit l’humidité et prévient le dessèchement bien.
2. Ajout de contrôles et d’échantillons
- Administrer environ 50 µL des contrôles négatif/positif, combinaisons de sérums positifs DFS70-ANA comme décrit dans cette étude, ou des échantillons de sérum de patient sur puits de diapositive individuelle.
- Distribuer les commandes et les échantillons dans chaque puits de la diapositive.
- Pour éviter la contamination croisée bien, évitez de trop remplir les puits. Tandis que ne pas un trop-plein de puits, assurer une couverture complète de la surface bien et éviter les bulles d’air.
Remarque : Le volume recommandé est de 50 µL comme par l’Etape 2.1. - Placez le couvercle sur la chambre d’incubation et incuber les lames pendant 30 min à température ambiante. Si il n’y a aucune ANA présentes dans le sérum du patient, il se liera aux cellules présents dans chaque puits au cours de cette période d’incubation.
- Une fois la période d’incubation est terminée, retirez la diapositive de la chambre d’incubation. Tenez la lame à onglet fin et rincer doucement environ 10 mL tampon phosphate salin (PBS) tampon de lavage fourni dans le kit, à l’aide d’une pipette ou dans un bécher rempli avec du PBS pour 10-15 s. transférer immédiatement la lame dans une coloration avec tampon de lavage PBS et lavage) faire tremper) pendant 10 min. Répétez le processus avec toutes les autres diapositives.
Remarque : En plaçant plusieurs diapositives dans une coloration, s’assurer que le côté de la cellule de la lame ne touche pas une autre diapositive, comme cela se traduira par endommager les cellules ont adhéré sur la lame de verre.
3. Ajout de conjugué Fluorescent
- Retirer qu’une seule diapositive à la fois de la coloration. Pour retirer le tampon de lavage PBS excédentaire de la diapositive, doucement tap ou épongez la diapositive sur la serviette en papier. Chaque kit est fourni avec le FITC étiqueté conjugué fluorescent de IgG anti-humain. Sur chaque puits, exercez une légère 1 goutte (environ 50 µL) du conjugué fourni.
- Incuber les lames dans la chambre d’incubation coloration fermée pendant 30 min.
Remarque : L’utilisation de Fc des IgG conjugué est recommandée. Si il n’y a aucune ANA présentes dans le sérum du patient, le conjugué se lie à des cellules présentes dans chaque puits au cours de cette période d’incubation, qui se traduit par la fluorescence spécifique des cellules présentes dans les puits. Le conjugué est sensible à la lumière. La chambre d’incubation fermé permettra d’éviter les ingérences de la lumière avec la réaction conjuguée des cellules présentes dans chaque puits. - Une fois la période d’incubation est terminée, retirez la diapositive de la chambre d’incubation. Maintenez la lame à l’extrémité de la languette et rincer doucement avec environ 10 mL PBS de tampon de lavage fourni dans le kit, à l’aide d’une pipette ou dans un bécher rempli avec du PBS. Transférer immédiatement la lame dans une coloration avec tampon de lavage PBS et lavage (trempage) pendant 10 min. Répétez le processus avec toutes les autres diapositives.
Remarque : En plaçant plusieurs diapositives dans une coloration, s’assurer que le côté de la cellule de la lame ne touche pas une autre diapositive, comme cela se traduira par endommager les cellules ont adhéré sur la lame de verre. - Placer les lamelles qui sont fournis dans le kit sur un essuie-tout sec. Les supports de montage est fourni avec le kit. Le bord inférieur de la lamelle, s’appliquent entre 3-4 gouttes des supports de montage en ligne.
- Souscrire une diapositive à la fois de la coloration contenant le tampon de lavage. Pour retirer le tampon de lavage excessif, doucement tap ou épongez la diapositive sur la serviette en papier.
- Abaissez le glisser doucement sur la lamelle couvre-objet en plaçant le bord inférieur de la lame sur le bord de la lamelle. Cela permet aux médias de fixation présents sur la lamelle de bord inférieure à s’écouler vers le bord supérieur de la diapositive et minimise la formation de bulles d’air, qui peuvent gêner la lecture de chaque puits d’une diapositive.
NOTE : Pression minimale devrait être utilisée pour monter la lame de la couverture sur la diapositive. Tout excès de pression peuvent causer un mouvement latéral des feuillets de la couverture. Cela pourrait endommager la préparation monocouche de cellules et résultat en distorsion. - Stocker les lames dans l’obscurité entre 2 et 8 ° C. Examiner les lames dès qu’ils sont montés ou sous 48 h.
Remarque : Une conservation plus longue peut entraîner la détérioration du modèle et signal fluorescent.
4. identification des résultats positifs et négatifs
- Visionner les diapositives avec un microscope à fluorescence à l’aide d’un ensemble de filtre FITC, situé dans une pièce sombre.
- Examiner pour fluorescence vert lumineux spécifique sous un microscope à fluorescence à un grossissement de 200 X ou supérieur pour faire l’interprétation finale au sujet de la positivité et la tendance. Observer les contrôles positifs et négatifs.
Remarque : Le contrôle positif affichera une fluorescence verte vif dans le noyau (Figure 2 a, homogène). Le contrôle négatif n’affichera aucune fluorescence verte spécifique sous un microscope à fluorescence. - Enregistrer le résultat positif ou négatif pour chaque puits et inclure le modèle ANA pour les cas positifs.
Résultats
Substrat de hEp-2 ELITE/DFS70 KO préserve des ANA classique et facilite la Distinction claire du modèle DFS70 :
Cellules conventionnelles et ingénieries sur HEp-2 ELITE/DFS70 KO substrat sont identiques, préservant tous les antigènes à l’exception de la LEDGF/p75. Le contrôle négatif fourni par le kit établit le signal fluorescent de base. Des témoins positifs pour les modèles de nucléoles et mitochondrial homogène, moucheté, centromère, sur HEp-2 ELITE produisent un motif identique aux modèles prévus sur substrat classique de IIF HEp-2 (Figure 2 a). Ces patrons de référence ont été décrits en détail ainsi que de l’association de l’antigène et la maladie de chaque enchaînement précédemment4,29. Une brève description des tendances observées dans la Figure 2 a sont fournies dans le tableau 1.
DFS70 motif sur HEp-2 ELITE :
Environ 10 % des cellules chacune montrent bien un motif moucheté fin dense (ICAP assigné nomenclature : AC-2) qui peut être observé sur le noyau interphasique et marquage de chromatine associée est observé sur les noyaux mitotiques (Figure 2 b). Sur une classique HEp-2, toutes les cellules auront ce modèle quand réagit avec un échantillon positif de DFS70. Le reste environ 90 % des cellules HEp-2 ont le gène psip1 , codant pour l’antigène LEDGF assommé et par conséquent ne produira pas un signal ou un modèle quand réagit avec un monospécifiques DFS70 sérum positif (Figure 2 b). Si 10 % des cellules HEp-2 ont fluorescence plus lumineux correspondant au modèle DFS70 et reste des cellules supplémentaires modes actuels (p. ex., fine moucheté ou nucléolaires), alors cela indique la présence de modèles mixtes. Un examen plus attentif de ces modèles est indispensable pour confirmer toutes les spécificités des auto-anticorps qui sont présentes en plus du modèle DFS70. Pour démontrer la capacité du substrat HEp-2 ELITE, un panel de sérums échantillons a été créé avec différentes concentrations de DFS70 et ANA positifs séra et testé à la fois classiques et substrats de HEp-2 ELITE en utilisant un IIF standard du protocole (Figure 3 , Figure 4, Figure 5, Figure 6, Figure 7).
Interprétation de DFS70 monospécifiques et des réactions mitigées sur substrats élites classiques et HEp-2 :
Pour chaque modèle de ANA spécifique associés à la maladie (Figure 3, Figure 4, Figure 5, Figure 6, Figure 7), un monospécifiques ANA pattern sur la gauche la plupart colonne et l’un monospécifiques DFS70 tendance à droite plus colonne peuvent être observés. Les trois colonnes au milieu représentent divers rapports associés à la maladie et les témoins positifs de modèle DFS70. Les modèles mixtes qui en résultent sont difficiles à discerner sur conventionnel HEp-2 (Figure 3, Figure 4, Figure 5, Figure 6, Figure 7, ligne du haut). Toutefois, avec le substrat de Hep-2 ELITE roman, dans la plupart des échantillons, la différence d’intensités entre cellules non modifiés et d’ingénierie est distincte qui confirme non seulement la présence d’autoanticorps DFS70 (lorsque le rapport des plus lumineux au moins lumineux de cellules est 1:9) mais révèle aussi un motif secondaire de ANA. Dans le cas de DFS70-homogène ou moucheté-DFS70 des réactions mitigées, il est impossible de prédire avec certitude le modèle correct qui mène aux laboratoires optant pour exécuter un certain nombre d’essais supplémentaires (Figure 1 a). Dans le cas du centromère-DFS70 et nucléolaire-DFS70 mixte réactions, soupçonnant DFS70 positivité est très difficile (Figure 5, Figure 6). Avec des réactions de nucléoles et du cytoplasme réticulaire/AMA, le modèle DFS70 n’est pas dominant jusqu'à ce que le ratio sera atteint 50 %. Dans tous les exemples, le substrat de HEp-2 ELITE peut présenter le modèle de DFS70 et le modèle sous-jacent secondaire à une vaste gamme d’intensité niveaux et facilite ainsi une interprétation plus précise de ANA.
Pour observez bien les modèles mixtes, résultats pour diverses combinaisons de 50/50 de ANA et DFS70 positive de contrôles ont été élargie (Figure 8) pour les deux classiques et des substrats, HEp-2 ELITE. Il est invité à observer l’interphase et coloration mitotique pour tous les modèles de ANA y compris DFS70 sur HEp-2 substrats afin d’améliorer l’interprétation et la précision du modèle signalé. Cependant, pour des modèles mixtes, le différentiel modèle présenté en divisant les noyaux cellulaires ne peut-être pas suffisant pour faciliter l’interprétation exacte. Les flèches rouges (Figure 8) indiquent les noyaux mitotiques dans cellule classique et machinée. Il peut être observé que mélangés DFS70 réactions sur la Division des cellules ne sont pas conforment avec l’ensemble établi des règles pour l’interprétation des associés à la maladie ANA patrons. Les flèches jaunes et bleues indiquent respectivement les noyaux des cellules HEp-2 (DFS70 KO) non modifiés et machinés. Dans toutes les combinaisons (Figure 8), on observe une différence d’intensité claire entre la cellule non modifiées nucléaire coloration (~ 10 %) et cellule ingénierie nucléaire (~ 90 %) dans le même champ de vision microscopique, qui permet le dépistage simultané et confirmation du modèle DFS70.

Figure 1 : ANA dépistage des algorithmes utilisant des méthodes conventionnelles de HEp-2 et HEp-2 ELITE/DFS70 KO IIF. (A) schéma dénoue la déficience du conventionnel HEp-2 IIF en identifiant monospécifiques et mixtes DFS70 modèles positifs à l’étape de présélection (zone ombrée jaune) et son incapacité à écarter un secondaires associés à la maladie ANA modèle qui peut caché par DFS70 modèle. En outre, la génération actuelle de DFS70 spécifiques des essais de confirmation ne sont pas en mesure de confirmer la positivité de DFS70 monospécifiques qui conduit à des tests supplémentaires de confirmation pour ANAs en phase solide. Schéma (B) révèle les capacités de HEp-2 ELITE pour le dépistage des Ana, distinction simultanée de monospécifiques et DFS70 des réactions mitigées, et élimine le besoin d’une phase solide DFS70 des analyses de confirmation. Algorithme à l’aide de HEp-2 ELITE significativement simplifie l’ANA dépistage et réduit le nombre requis de tests de confirmation. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
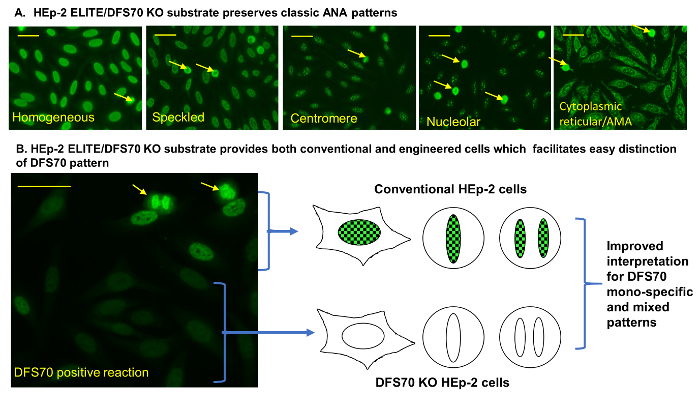
Figure 2 : modèle classique ANA et DFS70 sur HEp-2 ELITE/DFS70 KO substrat. (A) substrat de HEp-2 ELITE/DFS70 KO conserve classique des ANA. Classique réaction homogène et DFS70 des réactions positives ont été produites à l’aide de témoins positifs fournis par le kit. Autres réactions ont été produites à l’aide de sérums de contrôle positifs préétablis pour moucheté, centromère, nucléole et du cytoplasme réticulaire/AMA réactions5. (B) substrat HEp-2 ELITE/DFS70 KO fournit des cellules classiques et machinés, qui facilite la distinction facile du modèle DFS70. Schéma montre la réaction de monospécifiques DFS70 qui en résulte et le modèle sur l’interphase de marquage et divisant les noyaux cellulaires classiques et ingénierie des cellules (DFS70-KO). Ingénierie des cellules HEp-2 sont dépourvues d’antigène p75/LEDGF/DFS70 qui permet la détection simultanée des patrons secondaires qui sont habituellement dissimulées par réaction d’auto-anticorps DFS70 sur des substrats classiques de HEp-2. Flèches (jaune) indiquent les exemples des noyaux des cellules mitotiques. Barres d’échelle représentent 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
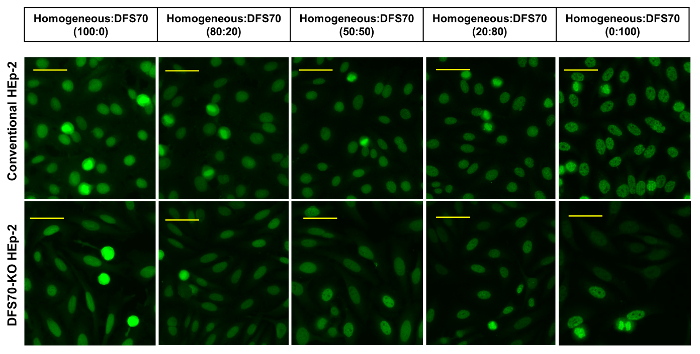
Figure 3 : DFS70 et sérums homogènes en combinaison. Sérums monospécifiques DFS70 ont été combinées à un contrôle positif homogène dans les différents ratios (100 : 0, 80/20, 50/50, 20 : 80 et 0 : 100) et testés sur des substrats (DFS70-KO) HEp-2 classiques et d’ingénierie. Barres d’échelle représentent 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
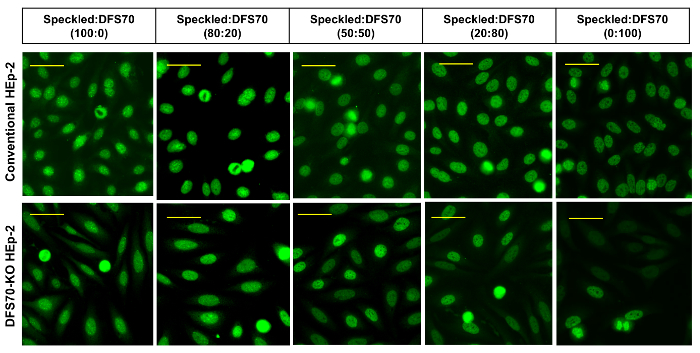
Figure 4 : DFS70 et moucheté de sérums en combinaison. Sérums monospécifiques DFS70 ont été combinées à un contrôle positif moucheté dans différents ratios (100 : 0, 80/20, 50/50, 20 : 80 et 0 : 100) et testés sur des substrats (DFS70-KO) HEp-2 classiques et d’ingénierie. Barres d’échelle représentent 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : DFS70 et centromère sérums en combinaison. Sérums monospécifiques DFS 70 ont été combinées à un contrôle positif centromère dans différents ratios (100 : 0, 80/20, 50/50, 20 : 80 et 0 : 100) et testés sur des substrats (DFS70-KO) HEp-2 classiques et d’ingénierie. Barres d’échelle représentent 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 : DFS70 et nucléolaire sérum combiné. Sérums monospécifiques DFS 70 ont été combinées à un contrôle positif nucléolaire dans différents ratios (100 : 0, 80/20, 50/50, 20 : 80 et 0 : 100) et testés sur des substrats (DFS70-KO) HEp-2 classiques et d’ingénierie. Barres d’échelle représentent 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
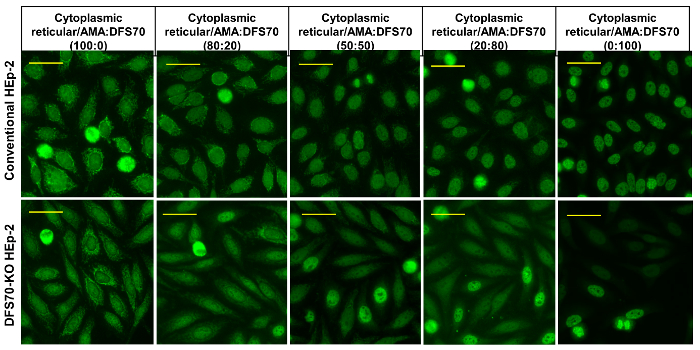
Figure 7 : DFS70 et cytoplasme réticulaire/AMA sérum combiné. Sérums monospécifiques DFS70 ont été combinées à un contrôle positif mitochondriale dans différents ratios (100 : 0, 80/20, 50/50, 20 : 80 et 0 : 100) et testés sur des substrats (DFS70-KO) HEp-2 classiques et d’ingénierie. Barres d’échelle représentent 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
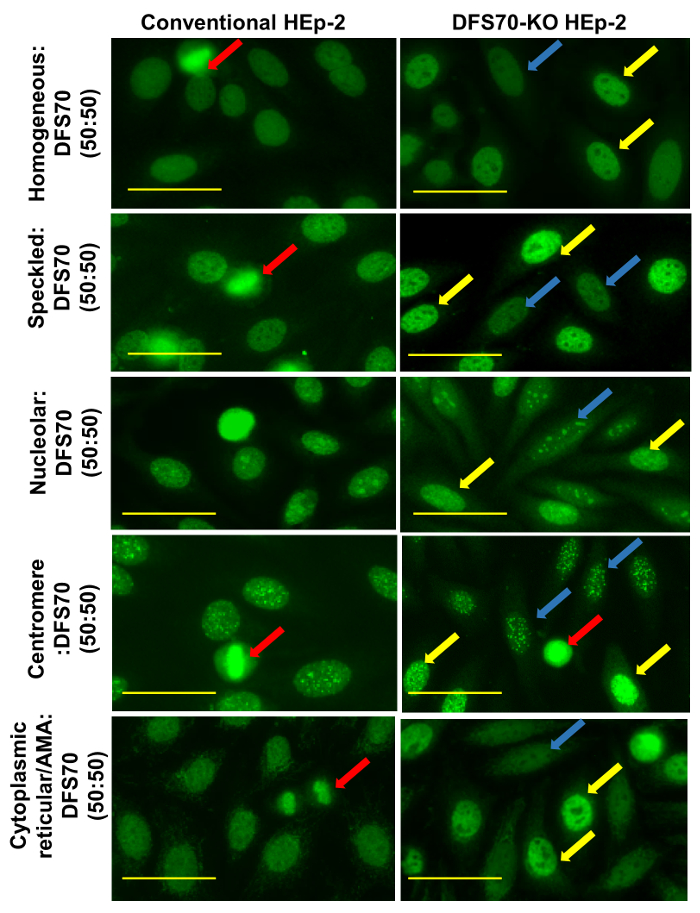
Figure 8 : mixte profils (rapport 50 : 50) produits sur conventionnel et substrats ELITE HEp-2. Différences entre les deux substrats sont révélés. Les flèches rouges indiquent les noyaux mitotiques des cellules classiques et ingénierie sur les deux substrats. Pour ces combinaisons, le différentiel modèle présenté en divisant les noyaux des cellules sur HEp-2 conventionnelle n’est pas suffisant pour une interprétation attentive des modèles mixtes. Il peut être observé que des réactions mitigées de DFS70 sur la Division des cellules peuvent perturber l’ensemble établi des règles pour l’interprétation des associés à la maladie ANA patrons. Les flèches jaunes et bleues indiquent respectivement les noyaux des cellules HEp-2 (DFS70 KO) non modifiés et machinés. Les résultats obtenus pour toutes les combinaisons testées sur le substrat ingénierie : une différence d’intensité claire entre le modèle nucléaire interphase appartenance à tels quels les cellules (~ 10 %) et les cellules modifiées (~ 90 %) a été observée, qui a permis simultanée détection et la confirmation du modèle DFS70. Barres d’échelle représentent 20 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Modèle d’ANA | Description | |
| Homogène | Le noyau entier émet une fluorescence uniformément avec un marquage diffus. | |
| Moucheté | Discret, grossiers aux fines mouchetures de fluorescence dans tout le noyau. Modes de moucheté fines mouchetés et grossiers ont été décrits. | |
| Nucléolaire | Les nucléoles tachent comme un corps solid ou moucheté multiples dans le noyau. Sous-types ont été décrites précédemment. | |
| Centromère | Mouchetures grands nombre fini. Antigène réactive sépare les chromosomes condensés dans les cellules en mitose. | |
| Cytoplasme réticulaire/AMA | Le cytoplasme apparaît granuleux avec coloration positive des mitochondries. | |
| DFS70 | •Les HEp-2 cellules : un motif moucheté fin dense est observé sur le noyau interphasique et la chromatine associés marquage est observé sur les noyaux mitotiques. | |
| Les cellules DFS70 KO •Engineered : anticorps Anti-DFS70 produisent une coloration négative | ||
| HEp-2 Elite / DFS70 KO a cellules conventionnelles et d’ingénierie (DFS70 KO) en rapport de 1:9 environ. Cellules classiques produisent typiquement DFS70 motif et machinés cellules produisent un modèle négatif quand réagit avec un DFS70 monospécifique ou isolées des réactions positives. | ||
Tableau 1 : Description des patrons ANA.
Discussion
Les anticorps antigènes nucléaires et cytoplasmiques sont très répandues dans les maladies auto-immunes systémiques. Bien qu’aucun test unique ne fournit le meilleure possible sensibilité et la spécificité, IIF de HEp-2 est considéré comme une méthode de dépistage très sensible et très rentable pour les maladies auto-immunes systémiques2,3,4 . Malgré la prévalence du protocole IIF depuis plus de 50 ans, précision du dosage de l’IIF est fortement tributaire de la compétence du technicien, exécution minutieuse des différentes étapes du protocole et interprétation exacte des résultats à l’aide d’un bien entretenu microscope à fluorescence. Diagnostic d’une maladie auto-immune systémique ne devrait pas reposer sur les résultats d’un seul test sérologique par exemple IIF de HEp-2.
Reconstitution des réactifs à l’aide de haute qualité de l’eau (distillée), l’utilisation de composants normalisés (diapositives avec monocouches de cellules HEp-2, de diluant, contrôles positifs et négatifs, préalablement dilué conjugué FITC optimisée et milieu de montage) avoir un impact positif sur les résultats. L’ajout de contrôles ou échantillons à sauter sur les puits peut encourager les fausses interprétations négatives. L’évaporation de diapositives à tout moment après que l’ajout de l’échantillon ou contrôle peut provoquer des réactions faussement positives artéfactuelle et/ou inappropriés patterns. Trop tampon de lavage à gauche de la diapositive ou séchage des puits de la diapositive avant la dispensation du milieu de montage peut entraîner des artefacts. Ajout d’une quantité insuffisante du support de montage ou en générant des bulles sur la surface avant de placer une lamelle peut entraîner des réactions qui semblent floues ou floue lorsque observé au microscope. Diapositives montées doivent être conservés entre 2 et 8 ° C et analysés dans la fenêtre recommandée de temps à minimiser les résultats faussement négatifs ou artéfactuelle.
En utilisant un microscope épi-fluorescence bien entretenu qui abrite une source lumineuse de LED/Hg/Xenon appropriée et nettoyer optiques composants y compris les filtres d’excitation et d’émission qui ne sont pas endommagés est essentielle pour obtenir des résultats exacts de IIF. Formation pour discriminant des intensités de réaction positive/négative et l’interprétation des modèles de l’utilisateur final est critique. Les dosages de IIF HEp-2 sont vulnérables au manque de normalisation dans les procédures, de configuration de microscope et de formation pour l’utilisateur final ou de compétences. Les modes de nomenclature et de représentant de consensus et les exemples d’images obtenues à l’aide de divers fabricants sont mis à disposition par le PICA (< www.ANApatterns.org>) pour des fins éducatives,4. Un arbre de classification de modèle cellulaire de HEp-2 fourni par ICAP pour divers modèles nucléaires et cytoplasmiques mitotiques est une précieuse ressource pour apprendre les différences subtiles entre les différents modèles qui peuvent ressembler aux yeux inexpérimentés4. Parmi les principaux exemples d’un modèle stimulant est le DFS70 qui manque également une liaison distincte avec une affection auto-immune, et tel que discuté dans les sections précédentes ce modèle est très répandu dans des populations saines de5.
Selon l’étude, la prévalence des anticorps anti-DFS70 varient entre les cohortes sains, ANA dépistage des populations et des individus positifs ANA sans aucun signe de maladie auto-immune systémique9,16,20 ,30,31. Autoanticorps DFS70 ont été signalés à se produire dans l’isolement, ainsi qu’avec d’autres modèles de ANA associés à la maladie. Isolées ou monospécifique DFS70 modèle est signalée dans 2-22 % des sujets sains, mais en moins de 1 % des cas avec la maladie rhumatismale auto-immune32. Basé sur ces tendances, modèle mono-positifs DFS70 a été proposé comme critère d’exclure dans les maladies auto-immunes rhumatismales par ICAP Comité3,31,32. Le Comité du PICA, établi pour promouvoir l’harmonisation de la nomenclature de test auto-anticorps et interprétation des résultats de l’IIF HEp-2, recommande DFS70 positivité de déclaration tout en relevant de l’ANA dépistage résultats4.
Avant d’exclure une maladie auto-immune systémique basée sur DFS70 mono-positivité, il est essentiel d’examiner l’état des méthodes actuelles de dépistage et de confirmation (en particulier ceux spécifique pour DFS70). Accord entre la positivité de l’IIF HEp-2 et des essais de confirmation de phase solide à savoir ELISA DFS70, CLIA et ligne immuno-essai/dot blot méthodes) varie entre diverses études13,22,25,33 . Interprétation de l’IIF et essai confirmatoire paramètres qui contribuent à ce désaccord ont été discuté précédemment5,13,,34. Une approche d’immunoadsorption récemment proposée pour la confirmation des anticorps anti-DFS70 aborde certaines des lacunes des tests actuels en phase solide (pour DFS70), mais oblige les laboratoires à effectuer une étape supplémentaire dans la procédure de l’IIF sur des échantillons suspects, qui augmente le temps de coût et délai d’exécution pour avoir signalé les résultats13. Cette étape supplémentaire n’est pas requise lorsque les cellules HEp-2 ELITE/DFS70 KO sont utilisés pour le dépistage de routine ANA. Cela réduit le coût global et plus il n’y a aucun incidence sur le délai d’exécution que DFS70 modèle est perçu dans la présélection n’étape27. Un inconvénient supplémentaire d’à l’aide de la méthode conventionnelle de IIF HEp-2 est qu’il est incapable de distinguer le modèle DFS70 qui s’avec d’autres ANA patrons à l’étape de la présélection. Toutefois, cet inconvénient est surmonté par l’utilisation de cellules HEp-2 ELITE/DFS70 KO27.
Évaluation comparative des classiques HEp-2 et la nouvelle ingénierie HEp-2 (HEp-2 ELITE/DFS70 KO) à l’aide de témoins positifs ANA et leurs combinaisons avec un contrôle de DFS70 mono-positif, démontrent l’utilité de la capacité du nouveau substrat à simultanément dépister les ANAs et confirmer le motif DFS70 (Figure 1). Le protocole de l’IIF pour le nouveau substrat est identique à la méthode conventionnelle de IIF HEp-2. Schéma d’interprétation pour tous les associés à la maladie des ANA est identique à l’exception du modèle DFS70 (tableau 1). Interprétation des modèles DFS70 mono-positif et mixtes a été relativement facile à l’aide de la méthode nouvelle et elle ne garantit pas des essais supplémentaires (Figure 1 b). Mise en œuvre de cette nouvelle méthode en laboratoire clinique simplifie le défi associé à l’interprétation du modèle DFS70 et améliore la précision globale de l’ANA, dépistage en révélant davantage associés à la maladie, ANA modèles précédemment masquées par DFS70 (mélangé d’habitudes).
Déclarations de divulgation
Les auteurs Kishore Malyavantham et Lakshmanan Suresh sont des employés de Trinity Biotech, USA.
Remerciements
Nous remercions Andrew Zenger pour effectuer les expériences de l’IIF et de collectionner des images.
matériels
| Name | Company | Catalog Number | Comments |
| HEp-2 ELITE / DFS70-KO 12 Well Slide sealed individually in pouch | Trinity Biotech | part of kit# 1108, 1108-120, 1108-240 | |
| ANA positive control | Trinity Biotech | part of kit# 1108, 1108-120, 1108-240, 1103, 1103-240 | |
| DFS70 antibody positive control | Trinity Biotech | part of kit# 1108, 1108-120, 1108-240 | |
| Negative control | Trinity Biotech | part of kit# 1108, 1108-120, 1108-240, 1103, 1103-240 | |
| Anti-human IgG FITC conjugate containing Evan's blue counterstain | Trinity Biotech | part of kit# 1108, 1108-120, 1108-240, 1103, 1103-240 | |
| Buffer diluent for serum | Trinity Biotech | part of kit# 1108, 1108-120, 1108-240, 1103, 1103-240 | |
| Phosphate buffered saline (PBS) | Trinity Biotech | part of kit# 1108, 1108-120, 1108-240, 1103, 1103-240 | |
| Mounting medium | Trinity Biotech | part of kit# 1108, 1108-120, 1108-240, 1103, 1103-240 | |
| Coverslips | Trinity Biotech | part of kit# 1108, 1108-120, 1108-240, 1103, 1103-240 | |
| ImmuGlo ANA HEp-2 Cells 12 well slide sealed individually in pouch | Trinity Biotech | part of kit# 1103, 1103-240 | |
| Name | Company | Catalog Number | Comments |
| Materials used in the study but not provided by the kits | |||
| Diagnostic fluorescent microscope | Nikon Eclipse 50i | Equipped with a spot dignostic camera, model 2.2.1 | |
| Incubation chamber | Trinity Biotech | provided for customers (no catalog #) | |
| Coplin jar | n/a | General labware | |
| Paper towels | n/a | General lab supplies | |
| distilled/deionized water | n/a | General lab supplies |
Références
- American College of Rheumatology. Position Statement. Methodology of testing for antinuclear antibodies. , Available from: https://www.rheumatology.org/Portals/0/Files/Methodology%20of%20Testing%20Antinuclear%20Antibodies%20Position%20Statement.pdf (2011).
- Meroni, P. L., Schur, P. H. ANA screening: an old test with new recommendations. Ann Rheum Dis. 69 (8), 1420-1422 (2010).
- Agmon-Levin, N., et al. International recommendations for the assessment of autoantibodies to cellular antigens referred to as anti-nuclear antibodies. Ann Rheum Dis. 73 (1), 17-23 (2014).
- Chan, E. K., et al. Report of the First International Consensus on Standardized Nomenclature of Antinuclear Antibody HEp-2 Cell Patterns 2014-2015. Front Immunol. 6, 412(2015).
- Malyavantham, K., Suresh, L. Analysis of DFS70 pattern and impact on ANA screening using a novel HEp-2 ELITE/DFS70 knockout substrate. Auto Immun Highlights. 8 (1), 3(2017).
- Sperotto, F., Seguso, M., Gallo, N., Plebani, M., Zulian, F. Anti-DFS70 antibodies in healthy schoolchildren: A follow-up analysis. Autoimmun Rev. , (2017).
- Ayaki, M., et al. Detection of cytotoxic anti-LEDGF autoantibodies in atopic dermatitis. Autoimmunity. 35 (5), 319-327 (2002).
- Ochs, R. L., et al. Autoantibodies to DFS 70 kd/transcription coactivator p75 in atopic dermatitis and other conditions. J Allergy Clin Immunol. 105 (6 Pt 1), 1211-1220 (2000).
- Watanabe, A., et al. Anti-DFS70 antibodies in 597 healthy hospital workers. Arthritis Rheum. 50 (3), 892-900 (2004).
- Yamada, K., et al. Humoral immune response directed against LEDGF in patients with VKH. Immunol Lett. 78 (3), 161-168 (2001).
- Seelig, C. A., Bauer, O., Seelig, H. P. Autoantibodies Against DFS70/LEDGF Exclusion Markers for Systemic Autoimmune Rheumatic Diseases (SARD). Clin Lab. 62 (4), 499-517 (2016).
- Ochs, R. L., et al. The significance of autoantibodies to DFS70/LEDGFp75 in health and disease: integrating basic science with clinical understanding. Clin Exp Med. 16 (3), 273-293 (2016).
- Bizzaro, N., et al. Specific chemoluminescence and immunoasdorption tests for anti-DFS70 antibodies avoid false positive results by indirect immunofluorescence. Clin Chim Acta. 451 (Pt B), 271-277 (2015).
- Bizzaro, N., et al. Antibodies to the lens and cornea in anti-DFS70-positive subjects. Ann N Y Acad Sci. 1107, 174-183 (2007).
- Daniels, T., et al. Antinuclear autoantibodies in prostate cancer: immunity to LEDGF/p75, a survival protein highly expressed in prostate tumors and cleaved during apoptosis. Prostate. 62 (1), 14-26 (2005).
- Dellavance, A., et al. The clinical spectrum of antinuclear antibodies associated with the nuclear dense fine speckled immunofluorescence pattern. J Rheumatol. 32 (11), 2144-2149 (2005).
- Gundin, S., et al. Measurement of anti-DFS70 antibodies in patients with ANA-associated autoimmune rheumatic diseases suspicion is cost-effective. Auto Immun Highlights. 7 (1), 10(2016).
- Kang, S. Y., Lee, W. I. Clinical significance of dense fine speckled pattern in anti-nuclear antibody test using indirect immunofluorescence method. Korean J Lab Med. 29 (2), 145-151 (2009).
- Lee, H., Kim, Y., Han, K., Oh, E. J. Application of anti-DFS70 antibody and specific autoantibody test algorithms to patients with the dense fine speckled pattern on HEp-2 cells. Scand J Rheumatol. 45 (2), 122-128 (2016).
- Mariz, H. A., et al. Pattern on the antinuclear antibody-HEp-2 test is a critical parameter for discriminating antinuclear antibody-positive healthy individuals and patients with autoimmune rheumatic diseases. Arthritis Rheum. 63 (1), 191-200 (2011).
- Marlet, J., et al. Thrombophilia Associated with Anti-DFS70 Autoantibodies. PLoS One. 10 (9), e0138671(2015).
- Mercado, M. V., et al. Detection of autoantibodies to DSF70/LEDGFp75 in Mexican Hispanics using multiple complementary assay platforms. Auto Immun Highlights. 8 (1), 1(2017).
- Muro, Y., Sugiura, K., Morita, Y., Tomita, Y. High concomitance of disease marker autoantibodies in anti-DFS70/LEDGF autoantibody-positive patients with autoimmune rheumatic disease. Lupus. 17 (3), 171-176 (2008).
- Muro, Y., Sugiura, K., Nakashima, R., Mimori, T., Akiyama, M. Low prevalence of anti-DFS70/LEDGF antibodies in patients with dermatomyositis and other systemic autoimmune rheumatic diseases. J Rheumatol. 40 (1), 92-93 (2013).
- Mutlu, E., Eyigor, M., Mutlu, D., Gultekin, M. Confirmation of anti-DFS70 antibodies is needed in routine clinical samples with DFS staining pattern. Cent Eur J Immunol. 41 (1), 6-11 (2016).
- Okamoto, M., et al. Autoantibodies to DFS70/LEDGF are increased in alopecia areata patients. J Autoimmun. 23 (3), 257-266 (2004).
- Pazini, A. M., Fleck, J., dos Santos, R. S., Beck, S. T. Clinical relevance and frequency of cytoplasmic and nuclear dense fine speckled patterns observed in ANA-HEp-2. Rev Bras Reumatol. 50 (6), 655-660 (2010).
- Schmeling, H., et al. Autoantibodies to Dense Fine Speckles in Pediatric Diseases and Controls. J Rheumatol. 42 (12), 2419-2426 (2015).
- Wiik, A. S., Hoier-Madsen, M., Forslid, J., Charles, P., Meyrowitsch, J. Antinuclear antibodies: a contemporary nomenclature using HEp-2 cells. J Autoimmun. 35 (3), 276-290 (2010).
- Mahler, M., Fritzler, M. J. The Clinical Significance of the Dense Fine Speckled Immunofluorescence Pattern on HEp-2 Cells for the Diagnosis of Systemic Autoimmune Diseases. Clin Dev Immunol. 2012, 494356(2012).
- Mahler, M., et al. Anti-DFS70/LEDGF Antibodies Are More Prevalent in Healthy Individuals Compared to Patients with Systemic Autoimmune Rheumatic Diseases. J Rheumatol. 39 (11), 2104-2110 (2012).
- Conrad, K., Rober, N., Andrade, L. E., Mahler, M. The Clinical Relevance of Anti-DFS70 Autoantibodies. Clin Rev Allergy Immunol. , (2016).
- Miyara, M., et al. Clinical Phenotypes of Patients with Anti-DFS70/LEDGF Antibodies in a Routine ANA Referral Cohort. Clin Dev Immunol. 2013, 703759(2013).
- Bizzaro, N., Tonutti, E., Villalta, D., et al. Recognizing the dense fine speckled/lens epithelium-derived growth factor/p75 pattern on HEP-2 cells: not an easy task! Comment on the article by Mariz et al. Arthritis Rheum. 63 (12), 4036-4037 (2011).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon