Method Article
Visualisation dynamique de Lignification chez les plantes à la chimie de clic : double étiquetage est le bonheur !
Dans cet article
Résumé
BLISS, un double étiquetage protocole pour l’étude dynamique de la lignification, a été développé. À l’aide de monolignols synthétique reporters et une combinaison séquentielle de bioorthogonal SPAAC et CuAAC cliquez sur réactions, cette paves de méthodologie la voie à une analyse approfondie des facteurs qui régulent la biogenèse des lignines en planta.
Résumé
La lignine est un des biopolymères plus répandues sur la planète et une composante importante de la biomasse lignocellulosique. Ce polymère phénolique joue un rôle structurel et protecteur dans le développement et la vie des plantes supérieures. Bien que les mécanismes complexes qui régissent lignification processus en vivo fortement un impact sur la valorisation industrielle de nombreux produits d’origine végétale, la communauté scientifique a encore un long chemin à parcourir pour déchiffrer. Dans un flux de travail trois étapes simple, le double étiquetage protocole présenté ci-après permet bioimaging études de lignifying activement les zones de tissus végétaux. La première étape consiste en l’incorporation métabolique des deux journalistes indépendants chimiques, substituts des deux monolignols natives qui donnent lieu à la lignine H - et G-unités. Après incorporation dans les polymères de lignine de plus en plus, chaque journaliste est spécifiquement étiqueté avec sa propre sonde fluorescente via une combinaison séquentielle SPAAC/CuAAC clic des réactions de bioorthogonal. Combiné avec la lignine autofluorescence, cette approche conduit à la génération des cartes de localisation trois couleurs de lignine dans les parois cellulaires des plantes par microscopie confocal fluorescence et fournit des informations spatiales précises sur la présence ou l’absence d’actif Machines de lignification à l’échelle des tissus végétaux, les cellules et les couches différentes cellules pariétales.
Introduction
Pendant les deux dernières décennies, la stratégie chimique journaliste a émergé comme une méthodologie puissante en deux étapes pour étudier la dynamique et les fonctions des biomolécules non génétiquement encodé. 1 , 2 , 3 dans la présente stratégie un analogue synthétique de la biomolécule d’intérêt avec une petite modulation – le journaliste chimique – est tout d’abord métabolisé par l’organisme vivant, puis une sonde chimique (p. ex.., un fluorophore pour fluorescence formation image de microscopie confocale) est liée de façon covalente à la journaliste incorporé via bioorthogonal click chemistry. La sonde doit réagir rapidement et plus précisément avec la modification introduite chimique tout en étant inerte à n’importe quel biomolécules présentes dans le système de vie. À bien des égards, cette méthode permet de surmonter les limites des communes bioconjugaison techniques grâce à l’utilisation des trompes de chimie de clic très spécifique offrant ainsi la possibilité de suivre des métabolites ou biomacromolecules qui étaient auparavant inaccessibles la vie des systèmes4,5,6.
Malgré la popularité de cette méthode puissante dans les cellules bactériennes et animales en plein essor, des rapports décrivant son utilisation en biologie végétale sont étonnamment peu et loin entre7,8,9,10, 11,12. Nous avons été particulièrement intéressés dans l’application de cette stratégie dans les plantes pour étudier la formation de lignine, d'entre les biopolymères plus répandues sur la planète et une composante importante de la biomasse lignocellulosique. 13 , 14 la lignine est un polymère phénolique qui joue un rôle structurel et protecteur vital dans le développement et la vie des plantes supérieures.
Il est généralement composé de trois fractions 4-hydroxyphenylpropanoid : H (p- hydroxyphényl), G (guaiacyl) et unités de S (syringyle) dérivé respectivement trois « monolignols » (p- coumaryl, coniférylique et sinapylique alcools) qui sont synthétisée par la voie des phénylpropanoïdes dans le cytoplasme de la cellule (Figure 1). Après avoir été exportées à la paroi cellulaire, les monolignols sont oxydés aux radicaux de peroxydases ou laccases, après quoi ils subissent des réactions de couplage radicalaire purement chimique de polymériser à polymères de lignine, un processus appelé lignification. 15 , 16 bien que lignines influer fortement la valorisation industrielle de nombreux végétaux produits, la communauté scientifique a encore un long chemin à parcourir pour décrypter les mécanismes complexes qui régissent lignification.
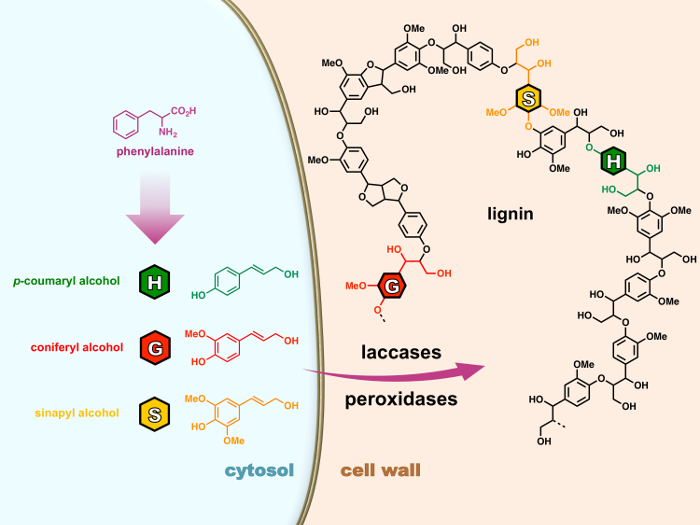
Figure 1 : le processus de lignification des cellules végétales. Les monolignols sont biosynthétisées à partir de la phénylalanine dans le cytosol. Après avoir été exportées à la paroi cellulaire, les monolignols sont oxydés aux radicaux de peroxydases ou laccases, après quoi ils subissent des réactions de couplage radicalaire purement chimique de polymériser à polymères de lignine, un processus appelé lignification. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Bien que les rapports sur l’utilisation des réactions de bioorthogonal pour l’analyse des glycanes sont nombreux,2,3,17 , leurs exemples d’application à d’autres types de biomolécules sont moins nombreux. L’utilisation de bioorthogonal chimie à des fins de bio-imagerie de la lignine a été récemment mis au point par Tobimatsu et al. 8 chez Arabidopsis thaliana à fournir des informations sur l’incorporation de coniférylique substituts d’alcool dans le polymère lignine où il forme les unités G,8,9 , démontrant ainsi la preuve de concept qui stratégies de journaliste chimiques sont applicables dans ce contexte. L’utilisation de CuAAC est également confirmée en utilisant un dérivé de l’alcool coniférylique différent quelques mois plus tard par Bukowski et al. 9 cependant, lignine contient également les unités H et S et une meilleure compréhension du processus de lignification nécessite plus de connaissances sur la façon dont tous les monolignols sont incorporés dans le polymère et quels facteurs peuvent contrôler sa composition. Nouvelles avancées dans ce domaine dépendent actuellement de l’élaboration de méthodes efficaces pour suivre plusieurs reporters chimiques simultanément dans les systèmes vivants. Même si quelques articles sur glycanes ont jeté les bases dans ces dernières années18,19,20,21,22, double étiquetage approches restent un défi majeur en chimie bioorthogonal. Si un protocole de clic simple marquage reproductible est difficile à développer, puis double étiquetage des approches qui nécessitent l’optimisation en tandem de deux mutuellement les réactions de bioorthogonal compatible sur deux reporters chimiques distinctes sont encore plus difficiles. Les quelques exemples qui ont mis au point cet aspect a utilisé une combinaison de cycloaddition contrainte-favorisé azoture-alcyne (SPAAC) et les réactions de Diels-Alder (DAinv) alcène-tetrazine inverse demande électronique pour étudier des glycanes dans les cellules animales. Cependant, nous avons pensé que le bioorthogonality de la réaction de DAinv ne pourrait pas garanti dans cette demande en raison des caractéristiques structurelles de la lignine (qui se compose de monomères de type cinnamyle substitués riches en électrons qui peuvent réagir avec les pauvres en électrons diènes comme les sondes tetrazine utilisés dans les réactions de DAinv) et que cela peut générer de marquage non spécifique. En outre, la réaction deinv DA exige des poignées chimiques synthétique difficiles d’accès, en plus d’être encombrant et lipophiles, ce qui soulève la possibilité que le taux d’incorporation, le transport et/ou la localisation de la substance chimique journaliste en vivo peut être affectée. Comme nous avons considéré que ce dernier aspect est particulièrement pertinent dans le cas d’une approche de chimie de clic pour étudier la lignification, nous a choisi une autre direction et mis au point un Bioorthogonal ligature d’imagerie séquentielle stratégie (BLISS) en utilisant un combinaison de Strain-Promoted azoture-alcyne Cycloaddition (SPAAC) et Cycloaddition d’azoture-alcyne catalysée cuivre (CuAAC) in vivo. 23
Ces deux réactions sont en effet les deux bioorthogonal principaux cliquez sur les réactions qui ont été utilisés à ce jour, et plus particulièrement dans les quelques exemples de lignine d’imagerie qui ont récemment été publiés. 8 , 9 notre double stratégie d’étiquetage permet l’utilisation d’une portion de l’azoture sur un monolignol journaliste et un alcyne terminal, d’autre part, deux poignées chimiques qui sont i) réagit pas vers des structures biologiquement pertinentes et ii) très petite taille (Figure 2 ). Ainsi, l’impact de ces modifications synthétiques sur les propriétés physico-chimiques de la biomolécule étudiée est minimisée, réduisant ainsi les écarts possibles entre les substrats monolignol artificiel et naturel en termes de transport et taux de métabolisation lors de l’étape d’incorporation métabolique. Bien que la combinaison du SPAAC et CuAAC semble très intuitive au premier abord, c’est à notre connaissance seulement le deuxième exemple de double marquage à l’aide de cette stratégie et la première application sur des structures autres que des glycanes. 12 , 23
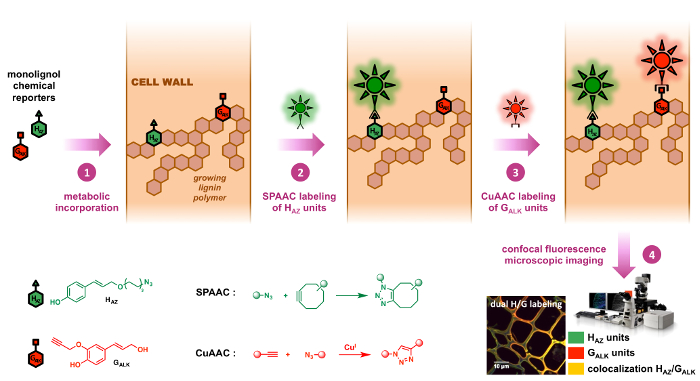
Figure 2 : double stratégie d’étiquetage BLISS. Chimiques reporters HAZ et GALK sont analogues marqués des natives monolignols H et G. Tout d’abord, elles sont incorporées dans les polymères de lignine croissante des parois cellulaires par l’alimentation exogène (étape 1). Cyclooctyne et azoture-fonctionnalisés sondes fluorescentes sont ensuite ligaturés séquentiellement aux reporters incorporés par bioorthogonal chimie de clic : la réaction de SPAAC (étape 2) est très spécifique d’unités HAZ et est suivie d’une réaction CuAAC ( étape 3) qui est spécifique des unités GALK (étape 3), ce qui permet la localisation précise de ces deux journalistes indépendamment dans le même échantillon. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Nous tout d’abord conçu et validé les monolignols azoture-tag reporter HAZ (mère porteuse d’alcool coumaryl - p) et précurseur des unités de lignine H et ensuite mis au point la stratégie double étiquetage de BLISS dans lequel il est utilisé en tandem avec le déjà signalé alcyne-tag GALK,9 (mère porteuse d’alcool coniférylique) et précurseur des unités G lignine. Dans le présent protocole reproductible, développées et testées dans le lin, une espèce de plante important sur le plan économique, l’incorporation métabolique double HAZ et GALK dans la lignine est tout d’abord réalisée avant séquentiel SPAAC/CuAAC l’étiquetage. Ici, étiqueté HAZ unités sont tout d’abord spécifiquement marquées par la ligature SPAAC d’un fluorophore cyclooctyne fonctionnalisés, suivi par ligature CuAAC par l’intermédiaire d’une deuxième sonde fluorescente sur tagged GALK unités. Cette méthode a été utilisée pour étudier la dynamique des processus de lignification dans les parois cellulaires des plantes et peut être appliquée en vivo pour enrayer les coupes transversales, vivant des tiges ainsi que les semis de différentes espèces de plantes.
Protocole
NOTE : Liquides et solides ½ MS media doit être préparé au préalable comme décrit dans la Table 1.
1. la Culture de plantes
-
Culture de plantes de lin 2 mois
- Semer les graines de lin (Linum usitatissimum L.) dans des pots en plastique à l’aide de terreau.
- Croître lin en chambre de croissance à 22 ° C avec une photopériode de 16 h/8 h jour/nuit.
- Plantes avec support vertical après 1 mois d’équiper et se développer jusqu'à ce qu’ils sont âgés de 2 mois.
-
Culture de semis lin de 2 semaines
- Enveloppez les 12 graines de lin dans un morceau de coton à fromage et fixer avec un élastique pour faire un paquet.
NOTE : Effectuer les étapes suivantes dans des conditions stériles sous une hotte à flux laminaire. - Placez le paquet de graines dans une bouteille en verre préalablement stérilisés à l’autoclave de 250 mL.
- Ajouter 70 mL 70 % EtOH dans la bouteille et doucement remuer pendant 1 min.
- Retirer délicatement l’EtOH par décantation tout en laissant le faisceau dans la bouteille.
- Ajouter 100 mL d’hypochlorite de sodium à 2 % et remuez doucement pendant 10 min.
- Supprimer la solution d’hypochlorite de sodium par décantation tout en laissant le faisceau dans la bouteille.
- Répétez les étapes 1.2.5-1.2.6.
- Ajouter 100 mL d’eau ultrapure stérile et remuez pendant 1 min.
- Répétez l’étape 1.2.8 3 fois, sur le temps de rinçage pour chaque rinçage (5, 10 et 15 min).
- Chauffer le milieu MS ½ solide, versez-la dans une boîte de culture de plantes stériles jusqu'à une hauteur de 2 cm et laisser refroidir jusqu'à solidification.
- Placez délicatement chaque graine sur milieu solide à l’aide d’une pince stérile.
- Fermez la boîte stérile.
- La boîte de transfert à une chambre de culture à 22 ° C avec une photopériode de 16 h/8 h jour/nuit et cultiver des semis de lin pendant 2 semaines.
- Enveloppez les 12 graines de lin dans un morceau de coton à fromage et fixer avec un élastique pour faire un paquet.
2. métabolique Incorporation de Reporters chimiques
NOTE : Trois modèles expérimentaux sont présentés ci-dessous : i) métabolique étiquetage des sections de tige, tiges ii) entières et iii) plants. Chaque protocole est présenté pour un réplicat biologique et quantités peuvent être adaptées au nombre de réplicats biologiques requis. Les solutions de monolignols sont préparées par des solutions mères qui sont faites comme décrit dans le tableau 2 avant l’expérience. Les solutions mères peuvent être stockées plusieurs mois à-20 ° C. La HAZ: GALK ou H:G des proportions peuvent être ajustées pour s’adapter à toutes les conceptions expérimentales sur mesure.
- Incorporation de journaliste chimique dans 2 mois lin tige coupes
- Préparer un 300 µL de solution de journaliste chimique contenant 10 µM de GALK et 10 µM de HAZ en milieu liquide de ½ MS stérile.
- Vortex HAZ/ solutionGALK et le transférer dans un puits d’une plaque de 48 puits avec une micropipette.
- Préparer un 300 µL de solution de contrôle négatif contenant 10 µM de G et 10 µM de H dans un milieu MS ½ liquide stérile.
- Vortex l' H/G solution et transférez-le vers un deuxième puits de la plaque de 48 puits même.
- Couper la tige d’une plante de lin 2 mois à 10 cm au-dessus du niveau du sol à l’aide d’une lame de rasoir Neuve.
- Délicatement préparer 50 coupes transversales à la volée de la tige à l’aide de la lame de rasoir (environ 150-250 µm d’épaisseur).
- Placer immédiatement les sections dans un milieu MS ½ liquide stérile dans un verre de montre.
- Inspecter visuellement et sélectionner des sections entières intactes et distribuer au hasard 10 d'entre eux dans le bien rempli avec HAZ/ solutionGALK .
- Répétez l’étape 2.1.8 pour bien rempli avec H/G solution (comme contrôle négatif).
- Répétez l’étape 2.1.8 pour un tiers bien rempli de 300 µL de milieu MS ½ (en tant que contrôle de fond pour régler le niveau de référence de fluorescence pendant le traitement ultérieur de données d’images de microscopie confocale).
- Incuber les plaques en lumière continue dans une chambre de croissance à 20 ° C pendant 20 h.
- Enlever la solution de monolignols dans chaque puits avec une micropipette.
- Ajouter 500 µL de milieu MS ½ dans chaque puits, remuer doucement pendant 10 min et enlever cette solution avec une micropipette de rinçage. Répéter 4 fois et passer à BLISS immédiatement d’étiquetage (article 3).
- Incorporation de journaliste chimique dans les 2 mois de tiges entières lin
- Préparer une solution de journaliste chimique de 5 mL contenant 10 µM de GALK et 10 µM de HAZ en milieu liquide de ½ MS stérile.
- Vortex HAZ/ solutionGALK et le transfert à un test de verre de 20 cm-haut tube avec une pipette.
- Préparer une solution de contrôle négatif de 5 mL contenant 10 µM de G et 10 µM de H dans un milieu MS ½ liquide stérile.
- Vortex l' H/G solution et transférer à un test de verre de 20 cm-haut tube.
- Préparer un troisième tube de verre contenant 5 mL de milieu MS ½ (sous contrôle de fond pour régler le niveau de référence de fluorescence pendant le traitement ultérieur de données d’images de microscopie confocale).
- Couper la tige d’une plante de lin 2 mois à 10 cm au-dessus du niveau du sol à l’aide d’une lame de rasoir Neuve. Jeter le système racinaire et la partie inférieure de la tige et passer à l’étape suivante avec la partie supérieure de la tige de la plante.
- Plongez la base de la tige entière coupée dans le tube contenant le HAZ/ solutionGALK . Placer la tige dans sa solution d’incubation immédiatement après le retrait du système racinaire pour éviter qu’elle ne sèche.
Remarque : Si la méthode est appliquée à des plantes plus jeunes/plus âgés ou d’autres espèces, le volume des monolignols solutions doit être ajusté selon la taille / age de la plante et le diamètre de la tige. - Fixez la tige à un support vertical de la tenir droite.
- Sceller le tube en verre avec du parafilm pour éviter l’évaporation de la solution.
- Répétez les étapes 2.2.6-2.2.9 pour l’échantillon témoin négatif avec l' H/G de solution.
- Répétez les étapes 2.2.6-2.2.9 pour l’échantillon de contrôle de fond de fluorescence contenant le milieu MS ½.
- Incuber chaque tige pendant 20 heures en lumière continue, avec une lampe néon.
- Après 20 h d’incorporation métabolique, ôter la tige incubée dans l' HAZ/ solutionGALK et rincez-la milieu MS ½.
- Couper et jeter bas 1 cm de la tige à l’aide d’une lame de rasoir et ensuite préparer un cylindre haut de 1 cm de la base de la tige restante.
- Soigneusement préparer 20 coupes transversales à main levée (environ 150-250 µm d’épaisseur) de ce cylindre et placez-les immédiatement dans un verre de montre, rempli de milieu MS ½.
- Mettre 500 µL de milieu MS ½ dans un puits d’une plaque de 48 puits.
- Inspecter visuellement et sélectionner des sections entières intactes et distribuer au hasard 10 d'entre eux dans le puits rempli d’une solution MS ½.
- Répétez les étapes 2.2.13-2.2.17 pour la tige de contrôle négatif incubée avec la solution d’H/G .
- Répétez les étapes 2.2.13-2.2.17 pour la tige de réglage de fond de fluorescence incubés avec milieu MS ½.
- Retirez soigneusement la solution dans chaque puits avec une micropipette.
- Ajouter 500 µL de milieu MS ½ dans chaque puits, remuer doucement pendant 10 min et enlever cette solution avec une micropipette de rinçage. Répéter 4 fois et passer à BLISS immédiatement d’étiquetage (article 3).
- Incorporation de journaliste chimique dans 2 semaine semis lin
Remarque : Les étapes suivantes sont effectués dans des conditions stériles.- Préparer une solution de journaliste chimique 2 mL contenant 10 µM de GALK et 10 µM de HAZ en milieu liquide de ½ MS stérile.
- Vortex HAZ/ solutionGALK et le transfert à un test de 20 cm de haut verre tube avec une pipette.
- Préparer une solution de contrôle négatif de 2 mL contenant 10 µM de G et 10 µM de H dans un milieu MS ½ liquide stérile.
- Vortex l' H/G solution et transférer à un test de 20 cm de haut verre tube.
- Préparer un troisième tube de verre de 20 cm-hauteur contenant 2 mL de milieu MS ½ (en tant que contrôle de fond pour régler le niveau de référence de fluorescence pendant le traitement ultérieur de données d’images de microscopie confocale).
- Retirer délicatement un semis de lin 2 semaines le milieu MS ½ solide à l’aide d’une longue paire de pincettes (section 1.2. ci-dessus).
- Transférer doucement la plantule dans le tube contenant HAZ/ solutionGALK , veiller à ce que ses racines soient immergées dans la solution.
- Fermer le tube de verre avec un bouchon en plastique pour éviter l’évaporation.
- Répétez les étapes 2.3.6-2.3.8 pour le tube témoin négatif avec l’H / G de solution.
- Répétez les étapes 2.3.6-2.3.8 pour le tube de contrôle de fond de fluorescence contenant le milieu MS ½.
- Incuber à chaque semis en lumière continue dans une chambre de croissance de 20 h à 20 ° C.
- Retirer délicatement la plantule incubée dans l' HAZ/ solutionGALK et rincez-la milieu MS ½.
- Délicatement préparer 20 coupes à main levée (environ 150-250 µm d’épaisseur) de l’hypocotyle.
- Mettre 500 µL de milieu MS ½ dans un puits d’une plaque de 48 puits.
- Inspecter visuellement et sélectionner des sections entières intactes et distribuer au hasard 10 d'entre eux dans le puits rempli d’une solution MS ½.
- Répétez les étapes 2.3.12-2.3.15 pour les semis de contrôle négatif incubés avec la solution d’H/G .
- Répétez les étapes 2.3.12-2.3.15 pour le semis de contrôle de fond de fluorescence incubés avec milieu MS ½.
- Retirez soigneusement la solution dans chaque puits avec une micropipette.
- Ajouter 500 µL de milieu MS ½ dans chaque puits, remuer doucement pendant 10 min et enlever cette solution avec une micropipette de rinçage. Répéter 4 fois et passer à BLISS immédiatement d’étiquetage (article 3).
3. double Fluorescence étiquetage des échantillons de végétaux coupe transversale par SPAAC et CuAAC
Remarque : Le bonheur étiquetage protocole est identique pour tous les 3 modèles expérimentaux (article 2).
-
Contrainte-favorisé azoture-alcyne Cycloaddition (SPAAC) étiquetage
- Préparer 1 mL d’une solution SPAAC contenant 5 µM de DBCO PEG4-5/6-carboxyrhodamine 110 dans un milieu MS ½ liquide stérile. La solution de vortex et gardez-le dans l’obscurité.
- Après le lavage final étapes du protocole incorporation métabolique [2.1.13, 2.2.21 ou 2.3.19 selon le protocole expérimental choisi], retirez le support MS ½ et ajouter 300 µL de la solution SPAAC / puits avec une micropipette.
- Protéger la plaque de 48-puits de lumière par revêtement de papier d’aluminium ou en le plaçant dans une boîte.
- Remuer doucement la plaque sur un agitateur mécanique dans l’obscurité à température ambiante pendant pour 1 heure.
-
Étiquetage de Cycloaddition d’azoture-alcyne (CuAAC) catalysées par le cuivre
- Laver, chaque puits 4 fois comme décrit à l’étape 2.1.13 tout en gardant la plaque dans l’obscurité.
- Préparer 1 mL d’une solution CuAAC ascorbate de sodium 2,5 mM, 0,5 mM CuSO4 et 5 µM de TAMRA-PEG-53-azoture dans un milieu MS ½ liquide stérile. La solution de vortex et gardez-le dans l’obscurité.
NOTE : Cette solution de CuAAC doit être fraîchement préparée avant de l’utiliser et ne peuvent pas être stockée plus de quelques jours à 4 ° C. - Retirez le support MS ½ dans chaque puits et directement ajouter 300 µL de la solution CuAAC / bien à l’aide d’une micropipette.
- Remuer doucement la plaque sur un agitateur mécanique dans l’obscurité à température ambiante pendant pour 1 heure.
- Enlever la solution de CuAAC à l’aide d’une micropipette.
- À l’aide d’une micropipette, ajouter 500 µL de ½ MS, remuer dans l’obscurité pendant 10 min puis retirer cette solution de lavage. Répéter deux fois.
- Ajouter 500 µL d’une solution de méthanol/eau 7:3, remuer dans l’obscurité pendant 1 h puis retirer la solution
ATTENTION : Le méthanol est toxique par contact cutané ou par inhalation et est désigné comme un cancérogène pour les humain. Son utilisation nécessite des gants et hottes chimiques. - Ajouter 500 µL de ½ MS, remuer dans l’obscurité pendant 10 min, puis retirer la solution. Répéter 4 fois.
4. montage d’échantillons sur Microscope Slides
- Déposer 5 gouttes de milieu de montage sur une lame de microscope.
- Déposer soigneusement chaque HAZ/GALKtag coupe transversale de la diapositive.
- Appliquer vernis à ongles sur les deux côtés opposés de la diapositive.
- Colorer avec une lamelle. Veillez à éviter les bulles d’air.
- Enlever le milieu de montage excès à l’aide d’une serviette en papier.
- Sceller l’échantillon avec le vernis à ongles sur les 4 côtés. Laisser les ongles vernis sèche à température ambiante (environ 30 min).
- Répétez les étapes 4.1 à 4.6 des coupes H/G contrôle négatif.
- Répétez les étapes 4.1 à 4.6 pour les sections de contrôle de fond de fluorescence.
- Conserver les lames à 4 ° C dans l’obscurité jusqu'à l’observation au microscope confocal.
Remarque : Les lames préparées peuvent être stockés pendant plusieurs semaines à plusieurs mois selon la qualité de la préparation. Si une nouvelle observation doit être effectuée après stockage, veiller à ce que les échantillons n’ont pas tari.
5. image Acquisition par microscopie confocale à Fluorescence
- Tourner sur toutes les unités nécessaires du système de microscopie confocale dans le bon ordre selon les instructions du fabricant.
- Sélectionner l’objectif recherché avec une ouverture numérique maximale et adaptée des longueurs d’onde d’excitation et d’émission (p. ex., obj. 60 x, N.A. 1.2. Canal de l’autofluorescence : λex 405 nm, λem 450 nm 25 ; Canal SPAAC HAZ : λex 488 nm, λem 525 nm 25 ; CuAAC GALK canal : λex 561 nm, λem 595 nm 25 ; mode séquentiel).
- Sélectionnez les paramètres souhaités pour la génération d’images dans le logiciel (12 ou 16 bits requis, taille de pixel adapté au critère de Nyquist).
- Placer la lame HAZ/gALC sur la platine du microscope et l’échantillon sous l’objectif.
- Observer et trouver la région souhaitée du tissu végétal.
-
Acquérir des images confocales de haute qualité de doublement marquée HAZ/g échantillonALK .
- Sélectionnez le plan plus fluorescent dans l’axe z.
- Ajuster le gain, offset et laser de puissance pour une distribution de signal optimale le long de la plage de niveau tout grise pour chaque canal (autofluorescence, HAZ et GALK). Les mêmes paramètres doivent être appliqués pour toutes les acquisitions suivantes.
- Lancer l’acquisition de l’image sélectionnée et enregistrez le fichier. Répétez pour chaque zone pertinente de l’échantillon.
Remarque : les reconstructions 3D de Z-pile aussi peuvent être acquises que si nécessaire.
- En utilisant les mêmes paramètres, acquérir des images de l’échantillon non marqué seulement incubés dans ½ MS pour déterminer le niveau d’autofluorescence (contrôle de fond fluorescence tel que décrit à l’article 2).
- En utilisant les mêmes paramètres, acquisition d’images pour les échantillons de contrôle négatif incubés avec natives monolignols H/G , afin de déterminer l’adhérence du fluorophore non-spécifique à l’échantillon.
- Appliquer traitement de données pour les images acquises à soustraire fond autofluorescence signaux dans les images de contrôle négatif H/G et HAZ/gALK .
Résultats
En utilisant le protocole présenté de BLISS impliquant des bioorthogonal et des analogues synthétiques monolignol chimie de clic, il est possible de visualiser la dynamique du processus de lignification dans les plantes vivantes. À la différence des techniques établies pour la lignine visualisation (par exemple histochimiques coloration, immunolocalisation ou autofluorescence), cela « double-cliquez sur » protocole exclusivement vise la lignine produite en reprenant au cours de l’incorporation métabolique étape et la différencie de la lignine préexistante de l’échantillon avec l’imagerie cellulaire triple-canal par microscopie confocal fluorescence (Figure 3). H AZ-unités sont détectés en utilisant les longueurs d’onde d’excitation et d’émission des DBCO PEG4-5/6-carboxyrhodamine 110 qui est spécifiquement encastrée sur les fonctions de l’azoture d’incorporé HAZ molécules au cours de l’étape SPAAC (λex 501 nm /λem 526 nm, canal vert), tandis que GALK-unités sont détectés de même à la longueur d’onde caractéristique de la sonde azidefluor 545 qui est spécifiquement encastrée sur les balises de l’alcyne terminal constituée de G ALK pendant l’étape de CuAAC (λex 546 nm /λem 565 nm, rouge canal) ; le troisième canal correspond à la lignine préexistante, qui est détectée à l’aide de l’autofluorescence intrinsèque à 405 nm (couche bleue). Cette approche mène à la génération de cartes de localisation trois couleurs de lignine dans les parois cellulaires des plantes qui fournissent des informations spatiales précises sur la présence ou l’absence de mécanisme de lignification active entre les différents tissus d’un organe (Figure 3 a ), entre différents types de cellules dans le même tissu (Figure 3 b-C) et au sein de différentes couches de la même cellule (Figure 3D). En d’autres termes, cette méthodologie permet de mettre en évidence et de localiser précisément les sites de lignification « actif » (HAZ et GALK canaux) en différenciant les unes provenant de zones où la lignine a été formée à une ancienne version stade de développement de la plante (autofluorescence canal). En outre, la sensibilité de la technique est considérablement améliorée par rapport à l’autofluorescence, et beaucoup de plus petites quantités de lignine fraîchement synthétisée peuvent être détectés (Figure 3 b).
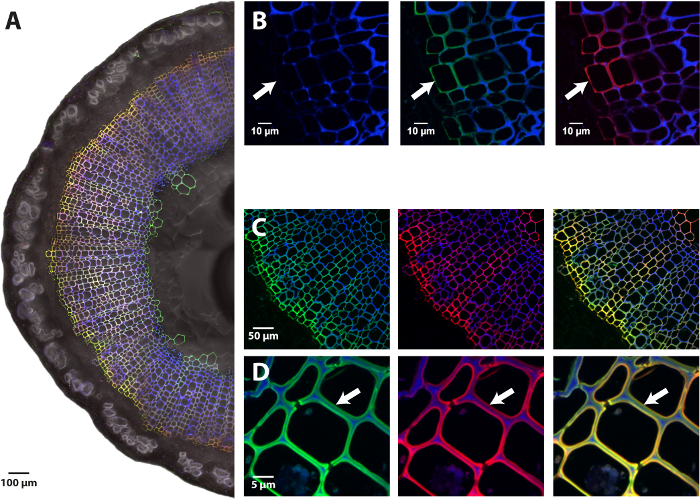
Figure 3 : imagerie de reporters chimique monolignol incorporés dans les tiges du lin. (A) la moitié d’une section transversale fabriqués à la main d’une tige de lin, photo reconstituée. (B) gros plan sur les premières couches de différenciation de xylème. Panneau latéral gauche: lignine autofluorescence (bleu, 405 nm), panneau central: fusionné autofluorescence de lignine (bleu) et la fluorescence HAZ (vert, 526 nm) canaux, panneau de droite: a fusionné la lignine autofluorescence (bleu) et GALK fluorescence (rouge, 565 nm) canaux. La flèche indique la première paroi cellulaire étiquetée de cambium illustrant la sensibilité accrue de bonheur par rapport à l’autofluorescence. (C) étiquetage en cellule différente types de xylème secondaire et (D) gros plan sur les cellules du xylème secondaire qui illustrent les variations d’étiquetage dans les différentes couches de la paroi cellulaire même. Panneau latéral gauche: fusionné autofluorescence de lignine (bleu) et la fluorescence HAZ (526 vert, nm) canaux, panneau central: fusionné autofluorescence de lignine (bleu) et la fluorescence GALK (rouge, 565 nm) canaux, droit panneau: fusionné autofluorescence de lignine (bleu), les HAZ (vert) et les canaux fluorescence GALK (rouge). Co-localisation HAZ et GALK est représentée en jaune. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Stratégies de journaliste chimiques tels que la méthode BLISS présenté ici ou les procédures de marquage unique précédemment publiés par Tobimatsu et al. 8 peut donc permettre une étude beaucoup plus fine que les méthodes précédemment accessibles comme immuno - ou coloration histochimique tout en étant très simple à mettre en œuvre. Par exemple, la Figure 4 montre que l’intensité du signal pour HAZ/GALK incorporation en fibres trachéides/bateaux (FT) du xylème secondaire lin est très élevée dans les parois des cellules peu premiers du cambium, mais diminue progressivement dans les cellules plus âgées. Ce profil est opposée à celle de l’autofluorescence et indique cette lignification maximale est atteint très rapidement dans les premières couches de cellule de deux à trois pieds de cambium. En revanche, les cellules des rayons (R) semblent continuer lignification à beaucoup de stades de leur développement comme HAZ/GALK incorporation est beaucoup plus constante dans les murs de toutes les cellules du cambium de la moelle. Il n’est pas surprenant que des types de cellules FT et R affichent lignification contraste dynamique, puisque ces types de cellules ont différents rôles biologiques avec les différences associées dans leur programme de développement. FTs sont des tubes en effet allongés qui mûrissent et meurent rapidement, laissant cellules mortes vides à épaisses parois lignifiées qui jouent un rôle essentiel en support mécanique et transport vertical de l’eau et de minéraux, alors que les rangs étroits de R les cellules qui composent le xylème les rayons sont vivants dans leur état mature et fonctionnel sans avoir d’épaisses parois lignifiées.
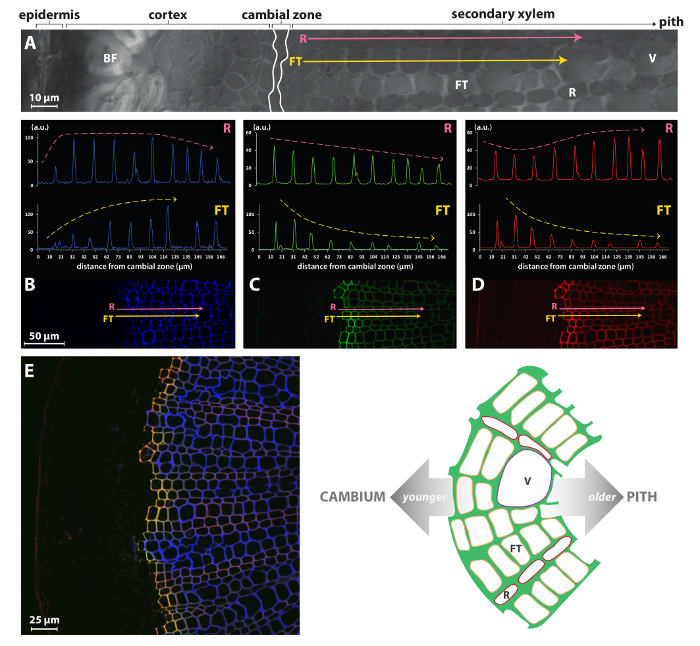
Figure 4 : spécificité cellulaire monolignol journaliste incorporation dans le xylème lin. Vue de la microscopie confocale Bright (A) d’une partie d’une coupe à main levée d’une tige de lin. Rose (cellules du parenchyme ray, R) et jaune (fibres trachéides des cellules, FT) flèches indiquent les vecteurs qui s’étend de la zone cambiale vers la moelle et analysés pour l’autofluorescence lignine à 405 nm (B), fluorescence HAZ à 526 nm (C) et G ALK fluorescence à 565 nm (D). (E) vue du xylème secondaire. Panneau latéral gauche: fusionne les canaux du autofluorescence (bleu), la lignine HAZ (vert) et GALK de fluorescence (rouge). Co-localisation HAZ et GALK est représentée en jaune. Panneau de droite: illustration schématique de la structure du xylème secondaire dans la tige de lin. V, navire ; FT, trachéides de fibre ; R, cellule de parenchyme de ray. Ce chiffre a été modifié par Lion et al. 23 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
En outre, l’utilisation de deux reporters chimiques distinctes correspondant à H-G-unités et avec deux réactions de bioorthogonal dans le protocole de BLISS permet des résultats quantitatifs plus à obtenir. Multiplexés étiquetage des stratégies telles que le bonheur pourrait éclairer supplémentaires sur le contrôle des monolignols ratios d’incorporation dans diverses conditions et pourrait contribuer à déchiffrer le processus de lignification insaisissable. Si les pourcentages relatifs des monolignols H, G et S en lignines sont en effet très variables selon les espèces, tissus, l’âge ou les conditions environnementales de la plante, les mécanismes complexes qui régissent cette composition ne sont pas encore entièrement compris. La technologie d’étiquetage double représente un moyen puissant d’enquêter sur certains des paramètres qui régissent la composition de la lignine. Par exemple, variant les HAZ: GALK ratio de bonheur nous a permis de démontrer que la composition de lignine dans les tissus du xylème secondaire est directement dépendante de la disponibilité de monolignols dans les parois cellulaires, plutôt que sur spécificité de la peroxydase/laccase (Figure 5).
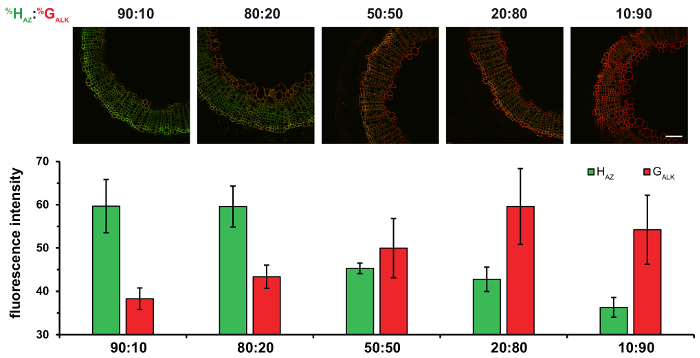
Figure 5 : Effet de l’incubation des Sections de la tige de lin avec des pourcentages différents Ratios de HAZ et GALK. HAZ: GALK% ratios sont donnés au-dessus de chaque colonne de chiffres. Haut : fusionne les canaux HAZ et GALK . En bas : histogrammes indiquant l’intensité de la fluorescence moyenne de HAZ et GALK pour les ratios différents %. Les valeurs sont exprimées sous forme de moyenne de l’intensité de fluorescence moyenne en niveaux de gris ± SD. échelle bar = 100 µm. ce chiffre a été modifié par Lion et al. 23 S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Lin est cultivé pour ses fibres libériennes (BF) qui sont utilisés pour fabriquer des textiles, papiers de luxe ou de matériaux composites respectueux de l’environnement. Un aspect important de leur valorisation industrielle, c’est qu’ils contiennent de très faibles quantités de lignine dans leurs parois cellulaires, qui se caractérisent par une très épaisse S2/G couche secondaire19,24. BLISS peut mettre en évidence les différences de dynamique de lignification entre les différentes couches de la paroi cellulaire même. Figure 6 a montre que HAZ et GALK incorporation de journaliste sont limitées aux coins de la cellule et paroi cellulaire lamelle/primaire de certains mais pas tous les fibres libériennes. L’absence totale de lignification dans la couche de la paroi cellulaire secondaire épaisse bast fibre même lorsque les monolignols reporters chimiques sont exogènes fourni révèle que leur état de hypolignified résulte de l’absence d’un environnement moléculaire approprié pour enzymatiquement médiée par oxydation et incorporation de monolignols dans une chaîne croissante de polymère, et qu’il n’est pas seulement en raison de la régulation transcriptionnelle des gènes de biosynthèse des monolignols tel que déjà signalé25. Cette observation corrèle aussi bien avec le fait que la peroxydase lin gènes sont régulée dans les tissus de la tige extérieure du mutant lin chimique lbf1 qui possède des fibres libériennes lignifiées26.
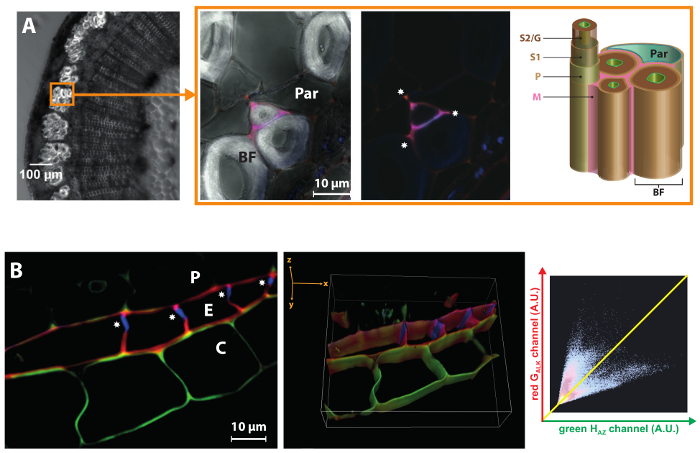
Figure 6 : BLISS met en évidence les différences propres à sous-structure ou couche pariétale. Panneau de gauche (A) : lumineux-zone image d’une section de la tige de lin. Le cercle indique un faisceau de fibres. Panneau de droite : gros plan sur les fibres libériennes. Fusionne les canaux HAZ et GALK (avec et sans champ lumineux) montrant cette lignification se limite aux coins de la cellule ( ) et la paroi cellulaire de certaines fibres libériennes lamelle/primaire. BF, fibres libériennes ; Nominale, cellule de parenchyme ; M, lamelle moyenne ; P, paroi cellulaire primaire ; S1, première couche de paroi secondaire ; S2/G, secondaire couche/gélatineux couche de paroi secondaire. (B) tranche 2D et 3D reconstruction de z-pile confocale zoom de région endoderme lin racine. La bande de Caspari (
) et la paroi cellulaire de certaines fibres libériennes lamelle/primaire. BF, fibres libériennes ; Nominale, cellule de parenchyme ; M, lamelle moyenne ; P, paroi cellulaire primaire ; S1, première couche de paroi secondaire ; S2/G, secondaire couche/gélatineux couche de paroi secondaire. (B) tranche 2D et 3D reconstruction de z-pile confocale zoom de région endoderme lin racine. La bande de Caspari ( ) seulement affiche autofluorescence et ne comportent pas HAZ ou GALK. La fluorogram associée montre un GALK/hAZ anti-corrélation : fluorescence verte élevée est associée à faible signal rouge (cortex) et vice versa (endoderme). Péricycle (P), endoderme (E), Cortex (C). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
) seulement affiche autofluorescence et ne comportent pas HAZ ou GALK. La fluorogram associée montre un GALK/hAZ anti-corrélation : fluorescence verte élevée est associée à faible signal rouge (cortex) et vice versa (endoderme). Péricycle (P), endoderme (E), Cortex (C). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Enfin, cette méthodologie de deux couleurs peut également fournir d’informations précieuses sur le « état de lignification » de sous-structures de paroi cellulaire à divers stades de développement et dans les organes végétaux autres que la tige. Par exemple, l’endoderme des racines Lin se caractérise par l’existence d’une bande de Caspari dans ses parois radiales et transversales durant les premiers stades du développement. Cette bande de biopolymère hydrophobe, faite de subérine ou la lignine, empêche l’eau et solutés absorbées par les racines d’entrer passivement à travers l’apoplaste et oblige à traverser la membrane plasmique par une voie symplastique contribuant ainsi à la capacités d’absorption sélective des racines des plantes. Lorsqu’il est appliqué aux racines lin, notre stratégie a montré que HAZ et GALK sont incorporés dans les parois tangentielles des cellules endodermiques ainsi que dans certaines parties des parois radiales où la bande de Caspari est absent (Figure 6 b). Toutefois, l’absence totale d’incorporation journaliste monolignols dans la bande de Caspari lui-même indique qu’il est mature à ce stade de développement tandis que les autres murs sont toujours le site d’autres dépôts de biopolymère. La vue 3D reconstituée d’un z-stack met clairement le Caspari en lumière. Fait intéressant, les parois de certaines cellules corticales adjacentes à l’endoderme s’est aussi avérée capables d’incorporer HAZ préférentiellement (indiquant ainsi la présence de lignine/subérine dans le cortex de la racine lin) mais pas GALK. Co-localisation analyse a montré une anti-corrélation entre HAZ et GALK, qui suggèrent l’existence de la machinerie enzymatique/structure paroi cellulaire spécifique dans ces deux types de cellules adjacentes.
La Table 1 : préparation du milieu MS ½ solide S’il vous plaît cliquez ici pour télécharger ce fichier.
La Table 2 : préparation des solutions mères journaliste chimique S’il vous plaît cliquez ici pour télécharger ce fichier.
Discussion
Tel que mentionné précédemment, le double étiquetage BLISS protocole présenté dans cet article est l’un des premiers exemples d’une combinaison SPAAC/CuAAC en vivo12,23. Chaque étape a été soigneusement optimisé et validé, et il est très important que l’ordre dans lequel les deux chimie étiquetage réactions sont exécutées séquentiellement de clic est respecté (c.-à-d. SPAAC tout d’abord, suivie par CuAAC). Tous les croix-contrôles ont montré que chaque étape d’étiquetage est spécifique, lorsque le protocole de BLISS est appliquée23 : effectuer l’étape SPAAC tout d’abord conduit à la chimiosélective hautement étiquetage des fonctions de l’azoture deAZ Hpar la cyclooctyne fonctionnalisés fluorophore par une réaction de cycloaddition [3 + 2] avec une cinétique rapide. Une fois HAZ unités sont étiquetées, l’étape de CuAAC, ce qui nécessite de cuivre (i) catalysé l’activation de GALK alcynes terminaux pour générer des liens de triazole par réaction avec la sonde 545 azoture-fluor peut être effectuée. En revanche, l’ordre inverse (c'est-à-dire, CuAAC tout d’abord, suivi par SPAAC) ne doit pas être utilisé car elle conduit à l’unité GALK et HAZ couplage croisé, qui est en concurrence avec un fluorophore ligature et induit une perte dramatique de signal . Il est également important d’insister sur la nécessité des étapes de lavage intermédiaire pour éviter de tacher non-spécifique.
Nous avons montré que notre méthode peut être appliquée aux diverses conceptions de l’expérimentation biologique. Le BLISS protocole d’étiquetage a été tout d’abord appliqué à des coupes à main levée des tiges de lin (environ 150-250 µm d’épaisseur) qui ont été préalablement coupés et incubées avec les monolignols prête à cliquer. Bien que cette conception a l’avantage de minimiser les quantités nécessaires de journaliste chimique (comme réduction des volumes d’incubation) et de faciliter la production des statistiques répliques, il n’est pas à proprement parler, un système in vivo et, dans certains cas, peuvent ne pas refléter tous les aspects de la dynamique de la lignification véritable spatio-temporelle. Dans un deuxième plan d’expérience, nous avons adapté donc le protocole de BLISS à une méthode qui a été précédemment utilisée pour étudier l’incorporation de monolignols radioactifs en pin et du gingko27. Dans cette approche, les racines et la tige de la plante sont physiquement séparées et la base de la tige entière est incubée dans la solution de monolignols dans ce qui peut être appelé l’approche « vase à fleur ». Après avoir quitté les tiges le temps désiré (incubation), les coupes sont coupées et le protocole de BLISS réalisée. Cela nous a permis de démontrer (i) que les monolignols modifiés sont transportés à travers la tige de la vie et sont incorporés dans les polymères de lignine dans les parois cellulaires de plus en plus et (ii) que le modèle de localisation est essentiellement identique à celle de la section transversale approche. Ce type d’expérience a le mérite d’être exécutée dans une usine de vie réel / cellules vivantes approche permettant de longues expériences et études plus approfondies, mais exige de plus grandes quantités de produits chimique journaliste. Enfin, le protocole de BLISS servait aussi aux semis de plante de lin, ce qui représente un véritable living plante modèle dans lequel les journalistes chimiques doivent être absorbés par les racines avant d’être transportée vers le haut de la tige. Alors que ce modèle a l’avantage d’être exécutée dans les plantes vivantes, dans la pratique, il est limité aux jeunes semis et n’est pas vraiment approprié pour enquêter sur les dynamiques de lignification chez les plants plus âgés pour des raisons pratiques (temps d’incubation longue, élevée quantité de produits chimiques reporters). Néanmoins, ces dessins trois expérience sont complémentaires et ont tous leurs avantages et inconvénients en ce qui concerne les aspects pratiques et signification biologique selon le type de question biologique qui se pose.
Mis au point pour étudier la dynamique de la lignification dans le lin, notre protocole est hautement adaptable, non seulement en termes de plan d’expérience biologique, mais aussi en ce qui concerne son application à d’autres plantes espèces et les organes/tissus. Par exemple, BLISS peuvent facilement être transférées à l’Arabidopsis ou les genres de Populus qui sont plus propices aux études avec divers gènes mutants knock out ou précipitation. En principe, étiquetage duale avec notre approche peut être étendu aux autres biomolécules à l’aide de deux précurseurs mis à jour le distinctes de polymères pariétaux de végétaux - y compris tous les trois monolignols principaux ou leurs précurseurs métaboliques ainsi que diverses monosaccharides qui constituent la matrice polysaccharidique. Depuis sa création, bioorthogonal chimie a en effet été principalement développé pour étudier glycanes/polysaccharides par oligosaccharide métabolique ingénierie (MOE)4,5,17,28, mais curieusement il y a eu seulement très peu d’applications de la biologie des plantes jusqu'à7,8,9,10,11,12. En ce qui concerne la compatibilité des réactions, l’étude de la lignine a été en effet une affaire complexe à résoudre les deux reporters chimiques sont reprises dans le même polymère réticulé. La possibilité de non étiquetées HAZ-GALK réticulation formation était le principal problème à surmonter en raison de la proximité spatiale des GALK et HAZ unités au sein de la 3D structure de la lignine23, une limitation qui ne peut être présente que si les deux journalistes chimiques ne sont pas incorporés dans le même type de biopolymères ou dans la même région spatiale d’une cellule donnée.
Dans une portée plus large la méthodologie de BLISS peut essentiellement être appliquée à toute étude d’imagerie de fluorescence de deux couleurs dans les modèles bactériennes ou animales à l’aide de deux reporters chimiques distinctes portant un azoture et tag alcyne terminal, respectivement.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrentes.
Remerciements
Nous sommes redevables à la FRABio de Fédération de recherche et de la plate-forme d’imagerie TisBio (Univ. de Lille, CNRS, FR 3688, FRABio, BiochimieStructurale et Fonctionnelle des Assemblages Biomoléculaires) pour fournir l’environnement technique propice à la réalisation de ce travailler.
matériels
| Name | Company | Catalog Number | Comments |
| (E)-4-(3-(2-(2-(2-azidoethoxy)ethoxy)ethoxy)prop-1-en-1-yl)phenol (HAZ) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| (E)-4-hydroxy-3-propargyloxycinnamyl alcohol (GALK) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| 2% sodium hypochlorite | |||
| 20 cm high glass tube | |||
| 250 mL Schott glass bottle | |||
| 48-well Plate | |||
| 5/6-TAMRA-PEG3-Azide | Jena Bioscience | CLK-AZ109-1 | |
| Aluminium foil | |||
| Cheese cloth | |||
| Compost containing clay | |||
| Coniferyl alcohol (G) | Sigma Aldrich | MFCD00002922 | |
| Copper (II) sulfate pentahydrate | |||
| DBCO-PEG4-5/6-Carboxyrhodamine 110 | Jena Bioscience | CLK-A127-1 | |
| Milli-Q Ultrapure water | |||
| Eppendorf 1,5 mL | |||
| EtOH | |||
| Flax seeds (L. usitatissimum L.) | |||
| Fluoromount-G™ Slide Mounting Medium | Electron Microscopy Sciences | 17984-25 | |
| Glass coverslip | |||
| Glass microscope slide | |||
| Growth chamber | CLF-Plant Climatics | For 2-week-old plants culture | |
| Growth chamber | Angelantoni Life Sciences | For 2-month-old plants culture | |
| Magenta plant culture box | For 2-week-old seedling culture | ||
| Methanol | Toxic (SGH02, SGH06, SGH08), work with gloves under a hood | ||
| Micropipette | |||
| Nail polish | |||
| Nikon A1R confocal microscope | Nikon | ||
| Orbital shaker | |||
| Parafilm | |||
| p-Coumaryl alcohol (H) | Carbosynth | FC145653 | |
| Plastic cap | |||
| Plastic pipette | |||
| Plastic pot | For 2-month-old plants culture | ||
| Razor blade | |||
| Rubber band | |||
| Sodium Ascorbate | |||
| Sterile clamp | |||
| Vertical support | |||
| Vortex | |||
| Reagents for liquid and solid ½ MS medium | |||
| KH2PO4 | |||
| KNO3 | |||
| NH4NO3 | |||
| MgSO4.7H2O | |||
| CaCl2.2H2O | |||
| MnSO4.H2O | |||
| ZnSO4.7H2O | |||
| H3BO3 | |||
| KI | |||
| Na2MoO4.2H2O | |||
| CuSO4.5H2O | |||
| CoCl2.6H2O | |||
| Na2EDTA.2H2O | |||
| FeSO4.7H2O | |||
| Thiamine.HCl | |||
| Pyridoxine.HCl | |||
| Glycine | |||
| Nicotinic acid | |||
| Myo-inositol | |||
| Saccharose | |||
| MES hydrate | |||
| Agar |
Références
- Grammel, M., Hang, H. C. Chemical reporters for biological discovery. Nat Chem Biol. 9 (8), 475-484 (2013).
- Prescher, J. A., Bertozzi, C. R. Chemistry in living systems. Nat Chem Biol. 1 (1), 13-21 (2005).
- Sletten, E. M., Bertozzi, C. R. Bioorthogonal chemistry: fishing for selectivity in a sea of functionality. Ange Chemie (Int Ed. Engl). 48 (38), 6974-6998 (2009).
- Chang, P. V., et al. Metabolic labeling of sialic acids in living animals with alkynyl sugars. Ange Chemie (Int Ed. Engl). 48 (22), 4030-4033 (2009).
- Gilormini, P. A., et al. A sequential bioorthogonal dual strategy: ManNAl and SiaNAl as distinct tools to unravel sialic acid metabolic pathways. Chem. Commun. 52 (11), 2318-2321 (2016).
- Mbua, N. E., et al. Abnormal accumulation and recycling of glycoproteins visualized in Niemann-Pick type C cells using the chemical reporter strategy. Proc Natl Acad Sci U S A. 110 (25), 10207-10212 (2013).
- Anderson, C. T., Wallace, I. S., Somerville, C. R. Metabolic click-labeling with a fucose analog reveals pectin delivery, architecture, and dynamics in Arabidopsis cell walls. Proc Natl Acad Sci U S A. 109 (4), 1329-1334 (2012).
- Tobimatsu, Y., et al. A click chemistry strategy for visualization of plant cell wall lignification. Chem. Commun. 50 (82), 12262-12265 (2014).
- Bukowski, N., et al. Development of a clickable designer monolignol for interrogation of lignification in plant cell walls. Bioconjugate Chem. 25 (12), 2189-2196 (2014).
- Pandey, J. L., et al. A versatile click-compatible monolignol probe to study lignin deposition in plant cell walls. PLOS ONE. 10 (4), e0121334 (2015).
- Pandey, J. L., et al. Investigating biochemical and developmental dependencies of lignification with a click-compatible monolignol analog in Arabidopsis thaliana stems. Front Plant Sci. 7, (2016).
- Zhu, Y., Wu, J., Chen, X. Metabolic labeling and imaging of N-linked glycans in Arabidopsis thaliana. Ange Chemie (Int Ed. Engl). 55 (32), 9301-9305 (2016).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annu Rev Plant Biol. 54, 519-546 (2003).
- Weng, J. -. K., Chapple, C. The origin and evolution of lignin biosynthesis. New Phytol. 187 (2), 273-285 (2010).
- Mottiar, Y., Vanholme, R., Boerjan, W., Ralph, J., Mansfield, S. D. Designer lignins: harnessing the plasticity of lignification. Curr Opin Biotechnol. 37, 190-200 (2016).
- Rinaldi, R., et al. Paving the way for lignin valorisation: recent advances in bioengineering, biorefining and catalysis. Ange Chemie (Int Ed). 55 (29), 8164-8215 (2016).
- Wratil, P. R., Horstkorte, R., Reutter, W. Metabolic glycoengineering with N-acyl side chain modified mannosamines. Ange Chemie (Int Ed. Engl). 55 (33), 9482-9512 (2016).
- Feng, L., et al. Bifunctional unnatural sialic acids for dual metabolic labeling of cell-surface sialylated glycans. J Am Chem Soc. 135 (25), 9244-9247 (2013).
- Dumont, M., et al. Plant cell wall imaging by metabolic click-mediated labelling of rhamnogalacturonan II using azido 3-deoxy- d - manno -oct-2-ulosonic acid. Plant J. 85 (3), 437-447 (2016).
- Niederwieser, A., et al. Two-color glycan labeling of live cells by a combination of Diels-Alder and click chemistry. Ange Chemie Int Ed. 52 (15), 4265-4268 (2013).
- Späte, A. -. K., et al. Exploring the potential of norbornene-modified mannosamine derivatives for metabolic glycoengineering. Chem Bio Chem. 17 (14), 1374-1383 (2016).
- Späte, A. -. K., et al. Rapid Labeling of metabolically engineered cell-surface glycoconjugates with a carbamate-linked cyclopropene reporter. Bioconjugate Chem. 25 (1), 147-154 (2014).
- Lion, C., et al. BLISS: a bioorthogonal dual-labeling strategy to unravel lignification dynamics in plants. Cell Chem Biol. 24 (3), 326-338 (2017).
- del Río, J. C., et al. Structural characterization of guaiacyl-rich lignins in flax (Linum usitatissimum) fibers and shives. J Agric Food Chemist. 59 (20), 11088-11099 (2011).
- Huis, R., et al. Natural hypolignification is associated with extensive oligolignol accumulation in flax stems. Plant Physiol. 158 (4), 1893-1915 (2012).
- Chantreau, M., et al. Ectopic lignification in the flax lignified bast fiber1 mutant stem is associated with tissue-specific modifications in gene expression and cell wall composition. The Plant Cell. 26 (11), 4462-4482 (2014).
- Terashima, N., Ko, C., Matsushita, Y., Westermark, U. Monolignol glucosides as intermediate compounds in lignin biosynthesis. Revisiting the cell wall lignification and new 13C-tracer experiments with Ginkgo biloba and Magnolia liliiflora. Holzforschung. 70 (9), 801-810 (2016).
- Noel, M., et al. Probing the CMP-sialic acid donor specificity of two human β-d-galactoside sialyltransferases (ST3Gal I and ST6Gal I) selectively acting on O- and N-glycosylproteins. Chembiochem: Eur J Chem Biol. , (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon