Method Article
Visualizzazione di lignificazione Dynamics in piante con chimica clicca: doppia etichettatura è beatitudine!
In questo articolo
Riepilogo
BLISS, un doppio protocollo d'etichettatura per lo studio delle dinamiche di lignificazione, è stato sviluppato. Utilizzando sintetico monolignol reporter e una combinazione sequenza di SPAAC e CuAAC bioorthogonal fare clic su reazioni, apre questa metodologia il modo per un'analisi approfondita dei fattori che regolano la biogenesi di lignine in planta.
Abstract
La lignina è uno dei biopolimeri più diffusi del pianeta e una componente importante della coltura da biomassa lignocellulosica. Questo polimero fenolico gioca un ruolo strutturale e protettivo nello sviluppo e nella vita delle piante superiori. Anche se i meccanismi intricati che regolano processi lignificazione in vivo fortemente impatto la valorizzazione industriale di molti prodotti di origine vegetale, la comunità scientifica ha ancora una lunga strada da percorrere per decifrarli. In un semplice workflow di tre fasi, il doppio protocollo d'etichettatura presentato qui permette studi di Bioimmagini di attivamente lignifying zone di tessuti vegetali. Il primo passo consiste nell'incorporazione metabolica di due reporter indipendente chimico, surrogati dei due monolignols nativo che danno origine alla lignina unità H e G. Dopo l'incorporazione in polimeri di lignina in crescita, ogni giornalista quindi è specificamente etichettata con propria sonda fluorescente tramite una combinazione sequenza di bioorthogonal SPAAC/CuAAC clic reazioni. Combinato con lignina autofluorescenza, questo approccio conduce alla generazione di mappe di localizzazione tre colori della lignina all'interno di pareti cellulari della pianta mediante microscopia a fluorescenza confocale e fornisce precise informazioni spaziali sulla presenza o sull'assenza del principio attivo macchinari di lignificazione alla scala di tessuti vegetali, cellule e parete cellulare diversi strati.
Introduzione
Negli ultimi due decenni, la strategia chimica reporter è emerso come una metodologia potente in due fasi per studiare le dinamiche e le funzioni delle biomolecole non geneticamente codificato. 1 , 2 , 3 in questa strategia un analogo sintetico di biomolecole di interesse con una modulazione piccola – il reporter chimico – in primo luogo viene metabolizzato dall'organismo vivente e quindi una sonda chimica (ad es., un fluoroforo per fluorescenza formazione immagine di microscopia confocale) è covalentemente al reporter incorporata tramite bioorthogonal clic chimica. La sonda deve reagire rapidamente e in modo specifico con la modificazione chimica introdotta pur essendo inerte a qualsiasi biomolecole presenti nel sistema vivente. In molti modi, questo metodo supera i limiti delle tecniche di bioconjugation comuni attraverso l'uso di legature di chimica altamente specifico clicca fornendo in tal modo la possibilità di tenere traccia di metaboliti o biomacromolecules che prima erano inaccessibili nella vita di sistemi4,5,6.
Nonostante la crescente popolarità di questo metodo potente in cellule batteriche e animali, rapporti che descrivono il suo uso in biologia vegetale sono sorprendentemente pochi e lontani tra7,8,9,10, 11,12. Eravamo particolarmente interessati nell'applicare questa strategia in piante di studiare la formazione della lignina, uno dei biopolimeri più diffusi del pianeta e una componente importante della coltura da biomassa lignocellulosica. 13 , 14 la lignina è un polimero fenolico che svolge un ruolo strutturale e protezione vitale nello sviluppo e nella vita delle piante superiori.
Generalmente è composto da tre gruppi di 4-hydroxyphenylpropanoid: H (p- idrossifenil), G (guaiacyl) e S (syringyl) unità derivate rispettivamente da tre 'monolignols' (p- coumaryl, coniferilico e sinapilico alcool) che sono sintetizzati attraverso la via fenilpropanoide nel citoplasma della cellula (Figura 1). Dopo essere esportati verso la parete cellulare, sono ossidati monolignols ai radicali di perossidasi o laccasi dopo che subiscono reazioni di accoppiamento radicale puramente chimico di polimerizzare a polimeri lignina, un processo definito lignificazione. 15 , 16 anche se le lignine impatto fortemente la valorizzazione industriale di molti vegetali prodotti, la comunità scientifica ha ancora una lunga strada da percorrere per decifrare i complessi meccanismi che regolano la lignificazione.
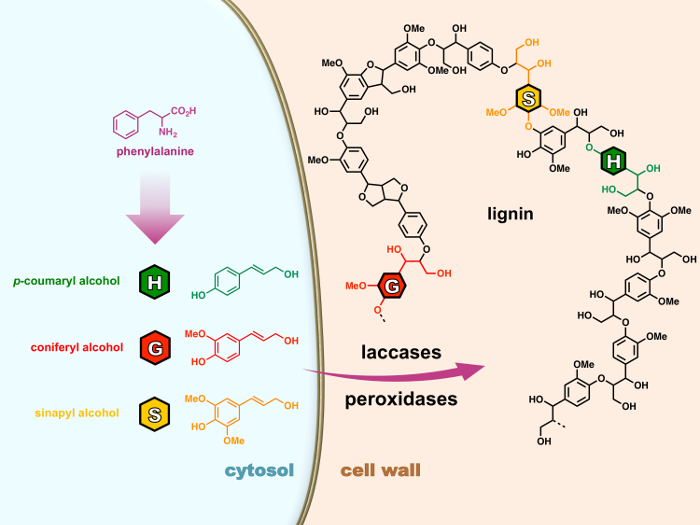
Figura 1: il processo di lignificazione nelle cellule vegetali. Monolignols sono biosynthesized da fenilalanina nel citosol. Dopo essere esportati verso la parete cellulare, sono ossidati monolignols ai radicali di perossidasi o laccasi dopo che subiscono reazioni di accoppiamento radicale puramente chimico di polimerizzare a polimeri lignina, un processo definito lignificazione. Clicca qui per visualizzare una versione più grande di questa figura.
Anche se numerosi rapporti sull'uso delle reazioni di bioorthogonal per l'analisi di glycan,2,3,17 loro esempi di applicazione ad altri tipi di biomolecole sono meno. L'uso di bioorthogonal chimica fini bioimaging lignina solo recentemente è stata introdotta da Tobimatsu et al. 8 in Arabidopsis thaliana per fornire informazioni sull'incorporazione di coniferil surrogati di alcol al polimero di lignina dove forma l'unità G,8,9 , dimostrando così la prova del concetto che strategie di chimica reporter sono applicabili in questo contesto. L'uso di CuAAC è stato anche illustrato utilizzando un derivato di Alcol coniferilico diverso qualche mese più tardi da Bukowski et al. 9 tuttavia, lignina inoltre contiene unità H e S e una più profonda comprensione del processo di lignificazione richiede più la conoscenza di come tutti i monolignols sono incorporati in polimero e quali fattori possono controllare la sua composizione. Nuovi progressi in questo campo dipendono attualmente lo sviluppo di metodologie efficaci per tenere traccia di reporter chimici multipli simultaneamente nei sistemi viventi. Anche se un paio di articoli su glicani hanno gettato le basi in ultimi anni18,19,20,21,22, doppia etichettatura approcci rimangono una sfida importante in bioorthogonal chimica. Se un protocollo riproducibile di clic singolo-etichettatura è difficile da sviluppare, quindi doppia etichettatura approcci che richiedono l'ottimizzazione in tandem di due reciprocamente compatibili bioorthogonal reazioni su due reporter chimico separato sono ancora più difficile. I pochi esempi che è stato il pioniere di questo aspetto ha usato una combinazione di ceppo-promosso azide-alchino cicloaddizione (SPAAC) e reazioni di Diels-Alder (DAinv) alchenico-tetrazine inversa richiesta elettronica per studiare glicani in cellule animali. Tuttavia, abbiamo pensato che il bioorthogonality della reazione DAinv potrebbe non essere garantito in questa applicazione a causa delle caratteristiche strutturali della lignina (che è costituito da monomeri di elettrone-ricchi sostituito cinnamil-tipo che possono reagire con carente di elettroni dieni come le sonde tetrazine utilizzate nelle reazioni di DAinv) e che questo potrebbe generare contrassegno non specifico. Inoltre, la reazione diinv DA richiede maniglie chimiche che sono sinteticamente difficile accesso, oltre ad essere ingombranti e lipofilico quindi sollevando la possibilità che il tasso di incorporazione, di trasporto e/o di localizzazione del prodotto chimico Reporter in vivo potrebbe essere interessato. Come abbiamo considerato che quest'ultimo aspetto è stato particolarmente rilevante nel caso di un approccio di chimica di click per lo studio di lignificazione, abbiamo scelto una direzione diversa e sviluppato un Bioorthogonal legatura Imaging sequenziale strategia (beatitudine) utilizzando un combinazione di Strain-Promoted Azide-alchino cicloaddizione (SPAAC) e rame catalizzato Azide-alchino cicloaddizione (CuAAC) in vivo. 23
Queste due reazioni sono infatti le due bioorthogonal principale fare clic su reazioni che sono stati utilizzati fino ad oggi, e più particolarmente in pochi esempi di lignina imaging che sono stati recentemente pubblicati. 8 , 9 il nostro duplice strategia di etichettatura consente l'utilizzo di una parte di azide sul un monolignol reporter e un alchino terminale da altro, due maniglie chimiche che sono ii) molto piccole dimensioni (Figura 2 e i) non reattivo verso biologicamente rilevanti strutture ). Di conseguenza, l'impatto di queste modifiche sintetiche sulle proprietà fisico-chimiche della biomolecola sotto studio è ridotto al minimo riducendo così possibili discrepanze tra i substrati monolignol innaturale e naturale in termini di trasporto e tariffe di metabolizzazione durante la fase di incorporazione metabolica. Sebbene la combinazione di SPAAC e CuAAC sembra molto intuitiva a prima vista, è a nostra conoscenza solo nel secondo esempio di doppia marcatura utilizzando questa strategia e la prima applicazione su strutture diverse da glicani. 12 , 23
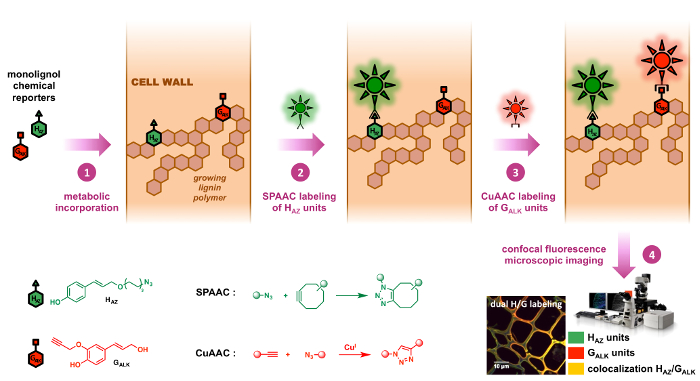
Figura 2: BLISS doppia etichettatura strategia. Reporter chimico HAZ e GALK sono taggati analoghi del nativo monolignols H e G. In primo luogo sono incorporati nei polimeri di lignina crescente delle pareti della cellula alimentando esogeno (passaggio 1). Cyclooctyne e azide-funzionalizzati sonde fluorescenti in sequenza sono quindi legati ai reporter incorporato di bioorthogonal clic su chimica: la reazione di SPAAC (passaggio 2) è altamente specifica di unità HAZ ed è seguita da una (reazione di CuAAC Passo 3) che è specifico di unità GALK (passaggio 3), permettendo così la localizzazione specifica di entrambi giornalisti indipendentemente nello stesso campione. Clicca qui per visualizzare una versione più grande di questa figura.
Abbiamo in primo luogo progettato e convalidato l'azoturo-etichetta monolignol reporter HAZ (surrogato di p- coumaryl alcohol) e precursore delle unità di lignina H e poi messo a punto la strategia di etichettatura dual BLISS in cui è utilizzato in tandem con il precedentemente segnalati alchino-etichetta GALK,9 (surrogato di Alcol coniferilico) e precursore delle unità G lignina. In questo protocollo riproducibile sviluppato e testato in lino, una specie di pianta economicamente importante, l'incorporazione di metabolica dual di HAZ e GALK in lignina è in primo luogo raggiunto prima del sequenziale SPAAC/CuAAC etichettatura. Qui, con tag HAZ unità in primo luogo sono etichettati in particolare tramite la legatura di SPAAC di un fluoroforo cyclooctyne-funzionalizzati, seguita da CuAAC-mediato legatura di una seconda sonda fluorescente su tagged GALK unità. Questo metodo è stato usato per studiare la dinamica dei processi di lignificazione all'interno di pareti cellulari della pianta e può essere applicata in vivo per arginare le sezioni trasversali, vivono steli, come pure le piantine di diverse specie vegetali.
Protocollo
Nota: Liquidi e solidi ½ MS media deve essere preparato in anticipo, come descritto nella tabella 1 supplementare.
1. pianta cultura
-
Cultura delle piante del lino di 2 mesi
- Seminare i semi di lino (Linum usitatissimum L.) in vasi di plastica utilizzando terriccio.
- Crescere del lino in camere di crescita a 22 ° C con un fotoperiodo di 16 h/8 h giorno/notte.
- Dotare le piante con supporto verticale dopo 1 mese e crescere fino a quando essi sono 2 mesi.
-
Cultura di 2 settimana-vecchio lino piantine
- 12 semi di lino in un pezzo di panno di formaggio di avvolgere e fissare con un elastico per fare un fascio.
Nota: Eseguire i passaggi successivi in condizioni di sterilità sotto una cappa a flusso laminare. - Posizionare il pacchetto di semi in una bottiglia di vetro precedentemente sterilizzati nell'autoclave 250 mL.
- Aggiungere 70 mL di 70% EtOH in bottiglia e delicatamente mescolare per 1 min.
- Rimuovere con cautela l'EtOH per decantazione, lasciando il bundle in bottiglia.
- Aggiungere 100 mL di ipoclorito di sodio al 2% e mescolare delicatamente per 10 min.
- Rimuovere la soluzione di ipoclorito di sodio per decantazione, lasciando il bundle in bottiglia.
- Ripetere i passaggi 1.2.5-1.2.6.
- Aggiungere 100 mL di acqua distillata sterile e mescolare per 1 min.
- Ripetere il passaggio 1.2.8 3 volte, aumentare il tempo di risciacquo per ogni risciacquo (5, 10 e 15 min).
- Scaldare mezzo solido ½ MS, versarlo in una scatola di cultura pianta sterile per un'altezza di 2 cm e lasciate raffreddare fino a solidificazione.
- Posizionare delicatamente ogni seme su terreno solido utilizzando pinze sterili.
- Chiudere la finestra di sterile.
- Trasferire la casella a una camera di crescita a 22 ° C con un fotoperiodo di 16 h/8 h giorno/notte e coltivare piantine di lino per 2 settimane.
- 12 semi di lino in un pezzo di panno di formaggio di avvolgere e fissare con un elastico per fare un fascio.
2. metabolica incorporazione dei reporter chimico
Nota: Tre modelli sperimentali sono presentati di seguito: i) metabolica etichettatura di sezioni trasversali di staminali, ii) interi steli e iii) pianta piantine. Ogni protocollo è presentato per una replica biologico e quantità può essere adattata al numero di repliche biologiche necessarie. Le soluzioni di monolignol sono preparate dalle soluzioni di riserva che sono fatti come descritto in tabella 2 prima dell'esperimento. Le soluzioni di riserva possono essere memorizzate diversi mesi a-20 ° C. La HAZ: GALK o H:G proporzioni possono essere regolate per adattarsi tutti i disegni sperimentali su misura.
- Incorporazione di chimica reporter in 2 sezioni trasversali di mese-vecchio lino staminali
- Preparare un 300 µ l di soluzione chimica reporter contenente 10 µM di GALK e 10 µM di HAZ in liquido sterile a ½ MS.
- Vortice HAZ/GALK soluzione e trasferirlo in un pozzetto di una piastra a 48 pozzetti con una micropipetta.
- Preparare un 300 µ l di soluzione controllo negativo contenente 10 µM di G e 10 µM di H in mezzo liquido sterile di ½ MS.
- Vortice H/G di soluzione e trasferirlo in un secondo pozzetto della piastra 48-pozzo stesso.
- Tagliare il gambo di una pianta di lino mesi 2 a 10 cm sopra il livello del suolo utilizzando una nuova lama di rasoio.
- Delicatamente preparare 50 sezioni trasversali a mano libera del gambo con la lama di rasoio (circa 150-250 µm di spessore).
- Posizionare immediatamente le sezioni trasversali in mezzo ½ MS liquido sterile in un vetro da orologio.
- Ispezionare visivamente, selezionare sezioni trasversali tutta intatte e distribuire in modo casuale 10 dei quali in ben riempito con HAZ/GALK soluzione.
- Ripetere il passaggio 2.1.8 per ben riempito con H/G di soluzione (come controllo negativo).
- Ripetere il passaggio 2.1.8 per un terzo ben riempito con 300 µ l di terreno di ½ MS (come il controllo dello sfondo per regolare la linea di base di fluorescenza durante la successiva elaborazione di dati di immagini di microscopia confocale).
- Incubare la piastra a luce continua in una camera di crescita a 20 ° C per 20 h.
- Rimuovere la soluzione di monolignol in tutti i pozzetti con una micropipetta.
- Aggiungere 500 µ l di terreno di ½ MS in ciascun pozzetto, mescolare delicatamente per 10 minuti e rimuovere questo risciacquo soluzione con una micropipetta. Ripetere 4 volte e procedere alla beatitudine etichettatura immediatamente (sezione 3).
- Incorporazione di chimica reporter in 2 mesi lino interi steli
- Preparare una soluzione di reporter chimico 5 mL contenente 10 µM di GALK e 10 µM di HAZ in liquido sterile a ½ MS.
- Vortice HAZ/GALK soluzione e il trasferimento di un test di vetro alta 20 cm tubo con una pipetta.
- Preparare una soluzione di controllo negativo 5 mL contenente 10 µM di G e 10 µM di H in mezzo liquido sterile di ½ MS.
- Vortice H/G di soluzione e il trasferimento di un test di vetro alta 20 cm tubo.
- Preparare una terza provetta di vetro contenenti 5 mL di terreno di ½ MS (come il controllo dello sfondo per regolare la linea di base di fluorescenza durante la successiva elaborazione di dati di immagini di microscopia confocale).
- Tagliare il gambo di una pianta di lino mesi 2 a 10 cm sopra il livello del suolo utilizzando una nuova lama di rasoio. Scartare il sistema della radice e la parte inferiore del gambo e procedere al passaggio successivo con la parte superiore del gambo della pianta.
- Non immergere la base del tronco intero taglio in provetta contenente HAZ/GALK soluzione. Posizionare l'attacco nella sua soluzione di incubazione immediatamente dopo la rimozione dell'apparato radicale, al fine di evitare che si secchi.
Nota: Se il metodo è applicato a piante più giovani/anziani e/o altre specie, il volume di monolignol soluzioni deve essere regolato secondo la dimensione / età della pianta e il diametro del suo tronco. - Fissare lo stelo ad un supporto verticale per tenerlo dritto.
- Sigillare il tubo di vetro con parafilm per evitare l'evaporazione della soluzione.
- Ripetere i passaggi 2.2.6-2.2.9 per il campione di controllo negativo con la H/G di soluzione.
- Ripetere i passaggi 2.2.6-2.2.9 per il campione di controllo di priorità bassa fluorescenza contenente il mezzo di ½ MS.
- Incubare ogni stelo per 20 h in luce continua utilizzando una luce al neon.
- Dopo 20 h di incorporazione metabolica, rimuovere lo stelo incubato in HAZ/GALK soluzione e sciacquare con ½ MS Media.
- Tagliare e scartare la parte inferiore di 1 cm di fusto utilizzando una lama di rasoio e poi preparare un cilindro alto 1 cm dalla base del gambo restante.
- Con cura preparare 20 sezioni trasversali a mano libera (circa 150-250 µm di spessore) da questo cilindro e metterli immediatamente in un vetro da orologio riempito con ½ MS Media.
- Mettere 500 µ l di terreno di ½ MS in un pozzetto di una piastra a 48 pozzetti.
- Ispezionare visivamente, selezionare sezioni trasversali tutta intatte e distribuire a caso 10 di loro nel pozzo riempito con soluzione ½ MS.
- Ripetere i passaggi da 2.2.13-2.2.17 per lo stelo di controllo negativo incubato con la soluzione di H/G .
- Ripetere i passaggi 2.2.13-2.2.17 per l'asta di regolazione di priorità bassa fluorescenza incubati con ½ MS Media.
- Rimuovere con attenzione la soluzione in tutti i pozzetti con una micropipetta.
- Aggiungere 500 µ l di terreno di ½ MS in ciascun pozzetto, mescolare delicatamente per 10 minuti e rimuovere questo risciacquo soluzione con una micropipetta. Ripetere 4 volte e procedere alla beatitudine etichettatura immediatamente (sezione 3).
- Incorporazione di chimica reporter in 2 settimana-vecchio lino piantine
Nota: I passaggi seguenti sono tutti realizzati in condizioni di sterilità.- Preparare una soluzione di chimica reporter di 2 mL contenente 10 µM di GALK e 10 µM di HAZ in liquido sterile a ½ MS.
- Vortice HAZ/GALK soluzione e il trasferimento di un test di 20 cm-alto vetro tubo con una pipetta.
- Preparare una soluzione di controllo negativo di 2 mL contenente 10 µM di G e 10 µM di H in mezzo liquido sterile di ½ MS.
- Vortice H/G di soluzione e il trasferimento di un test di 20 cm-alto vetro tubo.
- Preparare una terza provetta di vetro alta 20 cm, contenenti 2 mL di terreno di ½ MS (come il controllo dello sfondo per regolare la linea di base di fluorescenza durante la successiva elaborazione di dati di immagini di microscopia confocale).
- Rimuovere delicatamente un semenzale di lino 2-settimana-vecchio da coltura solido ½ MS utilizzando un lungo paio di pinzette (sezione 1.2. sopra).
- Trasferire delicatamente la piantina nella provetta contenente il HAZ/GALK soluzione, assicurando che le sue radici sono immerse nella soluzione.
- Chiudere il tubo di vetro con un tappo di plastica per evitare l'evaporazione.
- Ripetere i passaggi 2.3.6-2.3.8 per il tubo di controllo negativo con la H / G di soluzione.
- Ripetere i passaggi 2.3.6-2.3.8 per il tubo di controllo di priorità bassa fluorescenza contenente il mezzo di ½ MS.
- Incubare ogni piantina in luce continua in una camera di crescita per 20 h a 20 ° C.
- Rimuovere delicatamente il semenzale incubato in HAZ/GALK soluzione e sciacquare con ½ MS Media.
- Preparare delicatamente a mano libera 20 sezioni trasversali (circa 150-250 µm di spessore) dell'ipocotile.
- Mettere 500 µ l di terreno di ½ MS in un pozzetto di una piastra a 48 pozzetti.
- Ispezionare visivamente, selezionare sezioni trasversali tutta intatte e distribuire a caso 10 di loro nel pozzo riempito con soluzione ½ MS.
- Ripetere i passaggi da 2.3.12-2.3.15 per il semenzale di controllo negativo incubato con la soluzione di H/G .
- Ripetere i passaggi 2.3.12-2.3.15 per il semenzale di controllo di priorità bassa fluorescenza incubati con ½ MS Media.
- Rimuovere con attenzione la soluzione in tutti i pozzetti con una micropipetta.
- Aggiungere 500 µ l di terreno di ½ MS in ciascun pozzetto, mescolare delicatamente per 10 minuti e rimuovere questo risciacquo soluzione con una micropipetta. Ripetere 4 volte e procedere alla beatitudine etichettatura immediatamente (sezione 3).
3. Doppia fluorescenza etichettatura dei campioni di sezione trasversale di piante da SPAAC e CuAAC
Nota: La beatitudine etichettatura protocollo è identica per tutti i 3 modelli sperimentali (sezione 2).
-
Ceppo-promosso etichettatura Azide-alchino cicloaddizione (SPAAC)
- Preparare 1 mL di una soluzione SPAAC contenente 5 µM di DBCO-PEG4-5/6-carboxyrhodamine 110 in liquido sterile a ½ MS. Vortice la soluzione e tenerlo al buio.
- Dopo il lavaggio finale passaggi del protocollo metabolico incorporazione [2.1.13, 2.2.21 o 2.3.19 a seconda il disegno sperimentale scelto], rimuovere il mezzo di ½ MS e aggiungere 300 µ l della soluzione SPAAC per pozzetto con una micropipetta.
- Scudo, la piastra dalla luce 48 coprendo con carta stagnola o inserendolo in una scatola.
- Mescolare delicatamente la piastra con un agitatore meccanico per 1 h al buio a temperatura ambiente.
-
Rame-catalizzata di etichettatura Azide-alchino cicloaddizione (CuAAC)
- Lavare ogni ben 4 volte come descritto nel passaggio 2.1.13 mantenendo la piastra al buio.
- Preparare 1 mL di una soluzione di CuAAC contenente l'ascorbato di sodio 2,5 mM, 0,5 mM CuSO4 e 5 µM 5-TAMRA-PEG3-azide in liquido sterile a ½ MS. Vortice la soluzione e tenerlo al buio.
Nota: Questa soluzione di CuAAC dovrà essere preparata prima dell'uso e non può essere memorizzata più di un paio di giorni a 4 ° C. - Rimuovere il mezzo di ½ MS in ciascun pozzetto e direttamente aggiungere 300 µ l della soluzione CuAAC per bene usando una micropipetta.
- Mescolare delicatamente la piastra con un agitatore meccanico per 1 h al buio a temperatura ambiente.
- Rimuovere la soluzione di CuAAC utilizzando una micropipetta.
- Usando una micropipetta, aggiungere 500 µ l di ½ MS, mescolare al buio per 10 minuti, quindi rimuovere la soluzione di lavaggio. Ripetere due volte.
- Aggiungere 500 µ l di una soluzione di metanolo/acqua di 7:3, mescolare al buio per 1 h, quindi rimuovere la soluzione
Attenzione: Metanolo è tossico per contatto con la pelle o inalazione e viene designato come agente cancerogeno umano. Il suo utilizzo richiede guanti e cappe chimiche. - Aggiungere 500 µ l di ½ MS, mescolare al buio per 10 minuti, quindi rimuovere la soluzione. Ripetere 4 volte.
4. montaggio di campioni su microscopio Slides
- Posto 5 gocce di mezzo di montaggio su un vetrino per microscopio.
- Deposito con attenzione ogni HAZ/GALKetichetta sezione trasversale sulla diapositiva.
- Applicare lo smalto su due lati opposti della diapositiva.
- Coprire il vetrino con un vetrino coprioggetti. Fare attenzione a evitare bolle d'aria.
- Rimuovere il mezzo di montaggio in eccesso con un tovagliolo di carta.
- Sigillare il campione con smalto per unghie su tutti e 4 i lati. Lasciate che il chiodo vernice asciugare a temperatura ambiente (circa 30 min).
- Ripetere i passaggi 4.1-4.6 per le sezioni trasversali di controllo negativo H/G .
- Ripetere i passaggi 4.1-4.6 per le sezioni di controllo di priorità bassa fluorescenza.
- Conservare i vetrini a 4 ° C al buio fino a osservazione al microscopio confocale.
Nota: Vetrini preparati possono essere memorizzati per parecchie settimane a parecchi mesi a seconda della qualità della preparazione. Se una nuova osservazione deve essere fatta dopo il deposito, è necessario assicurarsi che i campioni non hanno prosciugato.
5. immagine acquisizione mediante microscopia confocale a fluorescenza
- Accendere tutte le unità necessarie del sistema di microscopia confocale nel giusto ordine secondo le istruzioni del produttore.
- Selezionare lo scopo perseguito con la massima apertura numerica e adattato le lunghezze d'onda di eccitazione e di emissione (ad esempio, obj. 60 x, N.A. 1.2. Canale di autofluorescenza: λex 405 nm, λem 450 nm 25; Canale HAZ SPAAC: λex 488 nm, λem 525 nm 25; CuAAC GALK canale: λex 561 nm, λem 595 nm 25; modalità sequenziale).
- Selezionare i parametri desiderati per la generazione di immagini nel software (12 - o 16 bit richiesto, dimensione pixel adattato per il criterio di Nyquist).
- Porre il vetrino HAZ/GALK sul tavolino del microscopio e posizionare il campione sotto la lente dell'obiettivo.
- Osservare e cercare l'area desiderata del tessuto della pianta.
-
Acquisire immagini confocal di alta qualità di doppiamente etichettato HAZ/g campioneALK .
- Selezionare il piano più fluorescente nell'asse z.
- Regolare il guadagno, potenza laser e offset per ottenere una distribuzione ottimale del segnale lungo l'intero grigio intervallo del livello per ogni canale (autofluorescenza, HAZ e GALK). Gli stessi parametri devono essere applicati per tutti i seguenti acquisizioni.
- Avviare l'acquisizione dell'immagine selezionata e salvare il file. Ripetere per ogni area pertinente del campione.
Nota: ricostruzioni 3D Z-stack possono essere acquisiti anche se necessario.
- Utilizzando le stesse impostazioni, acquisire immagini di campione senza tag solo incubati in ½ MS per determinare il livello di autofluorescenza (controllo di fluorescenza dello sfondo come descritto nella sezione 2).
- Utilizzando le stesse impostazioni, acquisizione di immagini per i campioni di controllo negativo incubati con nativo monolignols H/G per determinare aspecifici fluoroforo adesione al campione.
- Applicare il trattamento dei dati per le immagini acquisite a sottrarre sfondo autofluorescence segnali in entrambe le immagini di controllo negativo H/G e HAZ/GALK immagini.
Risultati
Utilizzando il protocollo presentato di BLISS che coinvolge bioorthogonal e gli analoghi sintetici monolignol scegliere chimica, è possibile visualizzare le dinamiche del processo di lignificazione in piante viventi. A differenza di tecniche consolidate per lignina visualizzazione (ad esempio istochimiche macchiatura, immunolocalizzazione o autofluorescenza), questo 'doppio click' protocollo esclusivamente mira la lignina prodotto de novo durante l'incorporazione metabolica passo e lo differenzia dalla lignina preesistente del campione con triplo canale imaging cellulare mediante microscopia a fluorescenza confocale (Figura 3). H AZ-unità vengono rilevati utilizzando lunghezze d'onda di eccitazione e di emissione della DBCO-PEG4-5/6-carboxyrhodamine 110 che specificamente si fa clic su funzioni di azoturo di incorporati HAZ molecole durante il passo SPAAC (λex 501 nm/λem 526 nm, canale verde), mentre GALK-unità allo stesso modo vengono rilevati presso le lunghezze d'onda caratteristiche della sonda azidefluor 545 che specificamente è cliccato sui tag incorporato alchini terminali di G ALK durante il passo di CuAAC (canale nm, rosso λex 546 nm/λem 565); il terzo canale corrisponde alla lignina pre-esistente, che è rilevato usando la sua intrinseco autofluorescence a 405 nm (canale blu). Questo approccio porta alla generazione di mappe di localizzazione tre colori della lignina all'interno di pareti cellulari della pianta che forniscono informazioni precise spaziale sulla presenza o assenza di macchinari di lignificazione attivo tra diversi tessuti di un organo (Figura 3A ), tra diversi tipi di cellule all'interno del tessuto stesso (Figura 3B-C) e all'interno di strati diversi della parete della cellula stessa (Figura 3D). In altre parole, questa metodologia ci permette di evidenziare e localizzare in modo specifico i siti di lignificazione 'attivo' (HAZ e GALK canali) da differenziandoli da zone dove la lignina è formata presso una precedente fase di sviluppo di pianta (autofluorescenza canale). Inoltre, la sensibilità della tecnica è migliorata drammaticamente rispetto ad autofluorescenza, e molto più piccola quantità di lignina appena sintetizzato può essere rilevato (Figura 3B).
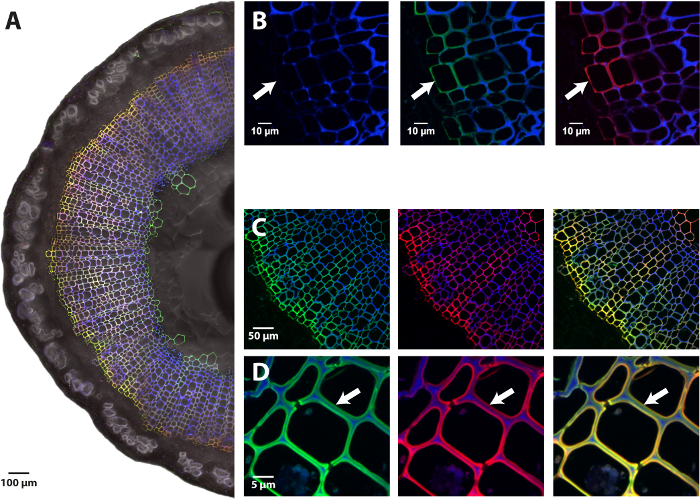
Figura 3: Imaging dei reporter chimico monolignol incorporato in lino steli. (A) la metà di una sezione trasversale fatta a mano di un gambo del lino, l'immagine ricostruita. (B) Close-up dei primi strati di differenziazione xylem. Pannello sinistro: lignina autofluorescenza (blu, 405 nm), Pannello centrale: fuse lignina autofluorescenza (blu) e HAZ fluorescenza (verde, 526 nm) canali, Pannello di destra: fuse lignina autofluorescenza (blu) e GALK fluorescenza (rosso, 565 nm) canali. La freccia indica la prima parete cellulare con etichetta dal cambio che illustrano la sensibilità aumentata di beatitudine confrontato con autofluorescenza. (C) etichettatura nella cella diversa tipi di xylem secondario e (D) si chiudono su cellule di xylem secondario che illustra le variazioni d'etichettatura in diversi strati della parete della cellula stessa. Pannello sinistro: fuse lignina autofluorescenza (blu) e HAZ fluorescenza (verde, 526 nm) canali, Pannello centrale: fuse lignina autofluorescenza (blu) e fluorescenza GALK (rosso, 565 nm) canali, diritto pannello: fuse lignina autofluorescenza (blu), HAZ (verde) e i canali di fluorescenza GALK (rosso). HAZ e GALK co-localizzazione è raffigurata in giallo. Clicca qui per visualizzare una versione più grande di questa figura.
Strategie di reporter chimico come il metodo BLISS presentato qui o le procedure di etichettatura singolo precedentemente pubblicate da Tobimatsu et al. 8 può pertanto consentire uno studio molto più preciso rispetto ai metodi precedentemente accessibili come immuno - o colorazione istochimica pur essendo molto semplice da implementare. Per esempio, la figura 4 illustra che l'intensità del segnale per HAZ/GALK incorporazione in fibra tracheidi/navi (FT) di lino xilema secondario è molto elevato nelle pareti cellulari pochi prime dal cambio ma diminuisce progressivamente nelle cellule vecchie. Questo profilo è opposta a quella del autofluorescence e indica che quel lignificazione massima viene raggiunta molto rapidamente nei primi strati delle cellule due o tre FT dal cambio. Al contrario, il raggio (R) cellule sembrano continuare lignificazione a più stadi del loro sviluppo come HAZ/GALK incorporazione è molto più costante nelle pareti di tutte le cellule dal cambio per il midollo. Non sorprende che tipi di cellule FT e R visualizzare contrasto lignificazione dinamiche, poiché questi tipi di cellule hanno diversi ruoli biologici con associate differenze nel loro programma di sviluppo. FTs sono tubi infatti allungate che maturo e muoiono rapidamente, lasciando le cellule morto vuote con spesse mura lignificata che svolgono un ruolo essenziale supporto meccanico e trasporto verticale di acqua e minerali, e considerando che le righe strette di R cellule che compongono lo xilema i raggi sono vivi nel loro stato maturo e funzionale senza avere pareti spesse lignificate.
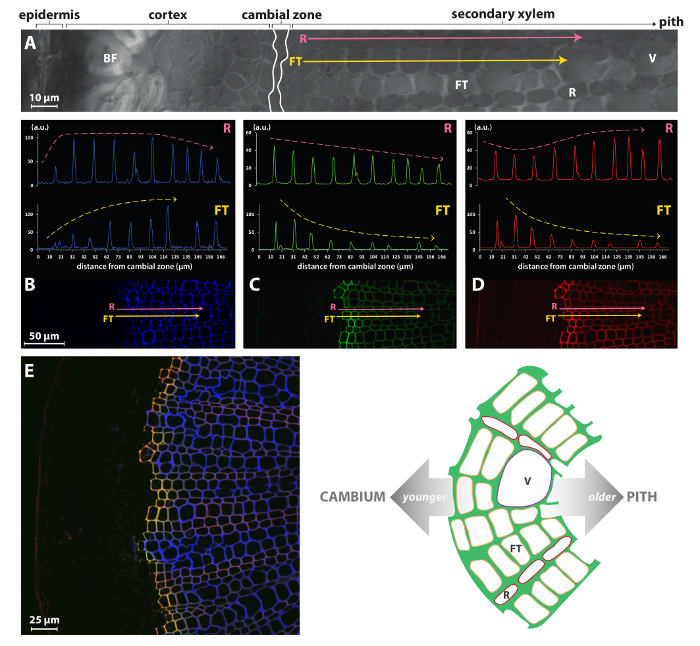
Figura 4: incorporazione di reporter monolignol cellula-specifico in lino xilema. Vista di microscopia confocale Bright-campo (A) di parte di una sezione trasversale a mano libera da uno stelo di lino. Rosa (ray parenchima cellule, R) e giallo (cellule della fibra tracheid, FT) frecce indicano vettori si estende dalla zona cambial verso il midollo e analizzati per lignina autofluorescence a 405 nm (B), HAZ fluorescenza a 526 nm (C) e G ALK fluorescenza a 565 nm (D). (E) View di xilema secondario. Pannello sinistro: fuse canali lignina autofluorescenza (blu), HAZ (verde) e GALK fluorescenza (rossa). HAZ e GALK co-localizzazione è raffigurata in giallo. Pannello di destra: illustrazione schematica della struttura secondaria xilema nel gambo del lino. V, vaso; FT, tracheid fibra; R, cellula del parenchima di ray. Questa figura è stata modificata da Lion et al. 23 Clicca qui per visualizzare una versione più grande di questa figura.
Inoltre, l'uso di due distinti reporter chimico corrispondente a H e G-unità con due bioorthogonal reazioni nel protocollo BLISS permette di ottenere più risultati quantitativi. Multiplexed etichettatura strategie come BLISS potrebbe fornire ulteriori approfondimenti sul controllo dei monolignol rapporti di incorporazione in varie condizioni e potrebbe contribuire a decifrare il processo di lignificazione sfuggente. Se le percentuali relative dei monolignols H, G e S in lignine sono infatti molto variabile secondo la specie, tessuto, età o condizioni ambientali dell'impianto, è possibile che i complessi meccanismi che regolano questa composizione ancora non completamente sono capiti. La tecnologia d'etichettatura dual rappresenta un potente modo di indagare alcuni dei parametri che regolano la composizione di lignina. Ad esempio, variando la HAZ: GALK rapporto con BLISS ha permesso di dimostrare che composizione di lignina in tessuti di xylem secondario dipende direttamente dalla disponibilità monolignol all'interno delle pareti delle cellule, piuttosto che su perossidasi/laccasi specificità (Figura 5).
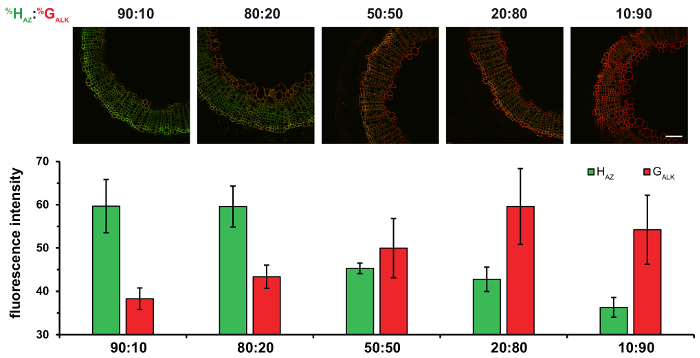
Figura 5: Effetto di incubazione sezioni di gambo del lino con percentuali differenti rapporti di HAZ e GALK. HAZ: rapporti di % GALKsono dato sopra ogni colonna delle figure. Top: fuse canali HAZ e GALK . Fondo: gli istogrammi che indica l'intensità di fluorescenza media di HAZ e GALK per i rapporti diversi %. I valori sono espressi come media dell'intensità media di fluorescenza in livelli di grigio ± SD. scala bar = 100 µm. questa figura è stata modificata da Lion et al. 23 Clicca qui per visualizzare una versione più grande di questa figura.
Lino viene coltivato per le sue fibre liberiane (BF) che vengono utilizzati per la fabbricazione di prodotti tessili, articoli di lusso o materiali compositi eco-compatibili. Un aspetto importante della loro valorizzazione industriale è che essi contengono livelli molto bassi di lignina in loro pareti della cellula, che sono caratterizzati da un forte spessore S2/G strato secondario19,24. BLISS può evidenziare le differenze di dinamica di lignificazione tra i diversi strati della parete della cellula stessa. Figura 6A Mostra che HAZ e GALK incorporazione di reporter sono limitati a cella angoli e parete cellulare medio lamella/primario di alcune ma non tutte le fibre liberiane. La totale assenza di lignificazione nello strato parete spessa liberiane fibra cella secondaria anche quando monolignol chimica reporter sono esogenicamente fornito rivela che il loro stato di hypolignified nasce dall'assenza di un ambiente molecolare adatto l'ossidazione mediata enzimaticamente e incorporazione di monolignols in una catena crescente del polimero, e che non è solo a causa di regolazione trascrizionale di geni di biosintesi di monolignol come precedentemente segnalato25. Questa osservazione anche correla bene con il fatto che lino perossidasi geni sono up-regolati nei tessuti del lino chimica lbf1 mutante che possiede fibre Liberiane lignificata26stelo esterno.
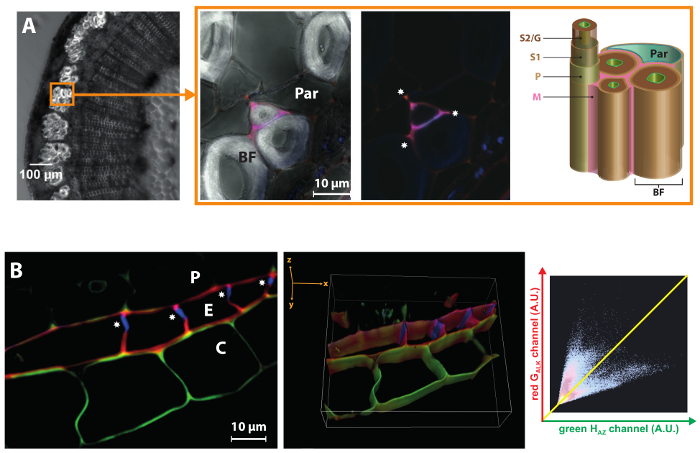
Figura 6: BLISS evidenzia differenze specifiche della sottostruttura o strato di parete cellulare. Pannello di sinistra (A): campo chiaro immagine di una sezione di fusto del lino. Il cerchio indica un fascio di fibre ottiche. Pannello di destra: stretta su fibre liberiane. Fuse canali HAZ e GALK (con e senza campo chiaro) mostrando che lignificazione è limitata agli angoli delle cellule ( ) e parete cellulare medio lamella/primario di alcune fibre liberiane. BF, liberiane fibra; Par, cellula del parenchima; M, lamella centrale; P, parete primaria delle cellule; S1, il primo strato della parete cellulare secondario; S2/G, secondario strato/gelatinoso strato della parete cellulare secondario. (B) 2D fetta e ricostruzione 3D della z-stack di confocal zoom della regione endodermis radice del lino. La striscia di Casparian (
) e parete cellulare medio lamella/primario di alcune fibre liberiane. BF, liberiane fibra; Par, cellula del parenchima; M, lamella centrale; P, parete primaria delle cellule; S1, il primo strato della parete cellulare secondario; S2/G, secondario strato/gelatinoso strato della parete cellulare secondario. (B) 2D fetta e ricostruzione 3D della z-stack di confocal zoom della regione endodermis radice del lino. La striscia di Casparian ( ) solo Visualizza autofluorescenza e non incorporare HAZ o GALK. L'associato fluorografia Mostra un GALK/hAZ anti-correlazione: alta fluorescenza verde è associato a basso segnale rosso (corteccia) e vice-versa (endodermis). Periciclo (P), Endodermis (E), Cortex (C). Clicca qui per visualizzare una versione più grande di questa figura.
) solo Visualizza autofluorescenza e non incorporare HAZ o GALK. L'associato fluorografia Mostra un GALK/hAZ anti-correlazione: alta fluorescenza verde è associato a basso segnale rosso (corteccia) e vice-versa (endodermis). Periciclo (P), Endodermis (E), Cortex (C). Clicca qui per visualizzare una versione più grande di questa figura.
Infine, questa metodologia di due colori può anche fornire informazioni preziose sullo 'stato lignificazione' della parete cellulare sottostrutture alle varie fasi di sviluppo e in altri organi della pianta rispetto lo stelo. Per esempio, endodermis delle radici del lino è caratterizzato dall'esistenza di una banda di Casparian nelle sue pareti cellulari radiali e trasversali durante le prime fasi di sviluppo. Questa banda di biopolimero idrofobo, fatto di Suberina e/o lignina, impedisce di acqua e soluti presi dalla radice penetri passivamente attraverso l'apoplasto e li costringe a passare attraverso la membrana plasmatica tramite un itinerario simplastico contribuendo così alla capacità di assorbimento selettivo delle radici delle piante. Quando applicato alle radici del lino, la nostra strategia ha mostrato che HAZ e GALK sono incorporati nelle pareti tangenziali delle cellule endodermiche pure come nelle parti dei muri radiali dove la band di Casparian è assente (Figura 6B). Tuttavia, totale assenza di incorporazione di reporter monolignol nella banda Casparian sé indica che è maturo in questa fase inerente allo sviluppo mentre le altre pareti sono ancora il sito di deposizione di biopolimero ulteriormente. Visualizzazione 3D ricostruita di uno z-stack porta chiaramente la band Casparian alla luce. Interessante, le pareti di alcune cellule corticali adiacenti al endodermis anche dimostrato in grado di incorporare HAZ preferenzialmente (indicando così la presenza di lignina/suberina nella corteccia radice del lino) ma non GALK. Analisi di co-localizzazione ha mostrato un'anti-correlazione tra HAZ e GALK, che suggeriscono l'esistenza di macchinario struttura/enzimatico parete cellula-specifico in questi due tipi di cellule adiacenti.
Supplementare tabella 1: preparazione del mezzo solido ½ MS Per favore clicca qui per scaricare questo file.
Supplementare tabella 2: preparazione delle soluzioni madri chimica reporter Per favore clicca qui per scaricare questo file.
Discussione
Come accennato in precedenza, il doppio protocollo BLISS etichettatura presentato in questa carta è uno dei primi esempi di una combinazione SPAAC/CuAAC in vivo12,23. Ogni passaggio è stato accuratamente ottimizzato e validato, ed è molto importante che sia rispettato l'ordine in cui i due clic su Chimica reazioni d'etichettatura vengono eseguite in modo sequenziale (cioè, SPAAC in primo luogo, seguito da CuAAC). Tutti i controlli di croce ha mostrato che ogni passaggio d'etichettatura è specifico quando il protocollo di BLISS è applicata23 : prima svolgere il passo SPAAC conduce alla chemoselective altamente etichettatura delle funzioni di azideAZ Hdella Cyclooctyne-funzionalizzate fluoroforo attraverso una reazione di cicloaddizione [3 + 2] con la cinetica veloce. Una volta HAZ unità sono contrassegnati, il passo di CuAAC che richiedono l'attivazione di rame (i) catalizzata di GALK alchini terminali per generare i collegamenti triazolo da reazione con la sonda 545 azide-fluor può essere effettuato. Al contrario, l'ordine inverso (cioè, CuAAC in primo luogo, seguito da SPAAC) non deve essere utilizzato come porta ad unità GALK e HAZ Croce-accoppiamento, che compete con la legatura fluoroforo e induce una drammatica perdita di segnale . È anche importante sottolineare la necessità dei passaggi di lavaggio intermedio per evitare colorazione aspecifica.
Abbiamo dimostrato che il nostro metodo può essere applicato a vari disegni di esperimento biologico. La beatitudine etichettatura protocollo fu applicata per la prima volta a sezioni trasversali a mano libera dei gambi del lino (circa 150-250 µm di spessore) che sono stati precedentemente tagliati e incubati con il monolignols clic-ready. Sebbene questo disegno ha il vantaggio di ridurre al minimo le quantità necessarie di reporter chimico (come sono ridotti volumi di incubazione) e di facilitare la produzione delle ripetizioni di statistiche, non è, strettamente parlando, un sistema in vivo e in alcuni casi, potrebbero non riflettere tutti gli aspetti della dinamica di lignificazione reale spazio-temporali. In un secondo disegno sperimentale, abbiamo adattato di conseguenza il protocollo BLISS a un metodo che è stato precedentemente utilizzato per studiare l'incorporazione di radiomarcato monolignols in pino e gingko27. In questo approccio, le radici e il gambo della pianta sono fisicamente separati e la base del gambo intero viene incubata nella soluzione monolignol in quello che può essere chiamato l'approccio di 'vaso di fiori'. Dopo aver lasciato i gambi il tempo desiderato (incubazione), sezioni trasversali sono il taglio e il protocollo di BLISS eseguita. Questo ci ha permesso di mostrare (i) che il monolignols modificate sono trasportati attraverso lo stelo di vivere e sono incorporati nella coltivazione di polimeri di lignina entro le pareti della cellula e (ii) che il modello di localizzazione era sostanzialmente identico a quella della sezione trasversale approccio. Questo tipo di esperimento ha il merito di essere eseguita in una pianta vivente reale / cellula viva approccio consentendo più esperimenti e studi più approfonditi, ma richiede una maggiore quantità di chimica reporter. Infine, il protocollo di beatitudine fu utilizzato anche con semenzali della pianta del lino, che rappresenta un vero e proprio living modello d'impianto in cui i giornalisti chimici devono essere assorbiti attraverso le radici prima di essere trasportati il gambo. Mentre questo modello ha il chiaro vantaggio di essere eseguita in piante vive, in pratica, è limitato ai giovani semenzali e non è molto adatto per lo studio di dinamiche di lignificazione nei vecchi impianti per motivi pratici (tempo di incubazione lungo, elevato quantità di giornalisti chimici). Tuttavia, questi disegni tre esperimento sono complementari e tutti hanno i loro vantaggi e svantaggi per quanto riguarda gli aspetti pratici e significato biologico a seconda del tipo di domanda biologica a cui rispondere.
Sviluppato per lo studio della dinamica di lignificazione in lino, il nostro protocollo è altamente adattabile, non solo in termini di design esperimento biologico, ma anche in termini di sua applicazione altra pianta specie e organi/tessuti. Per esempio, BLISS possono essere facilmente trasferiti per l'Arabidopsis o generi Populus che sono più favorevoli agli studi con mutanti knock-out o knock-down per vari geni. In linea di principio, gli studi d'etichettatura dual con il nostro approccio possono essere esteso anche ad altre biomolecole utilizzando due distinti modificati precursori dei polimeri di parete cellulare vegetale - tra cui tutti i tre principali monolignols o loro precursori metabolici così come vari monosaccaridi che costituiscono la matrice polisaccaridica. Fin dalla sua nascita, bioorthogonal chimica è infatti stato principalmente sviluppato per indagare glicani/polisaccaridi attraverso metabolica oligosaccaride ingegneria (MOE)4,5,17,28, ma sorprendentemente ci sono stati solo pochissime applicazioni di biologia della pianta finora7,8,9,10,11,12. In termini di compatibilità delle reazioni, lo studio della lignina era infatti un complesso caso da risolvere come entrambi giornalisti chimici sono incorporati nel polimero reticolato stesso. La possibilità di adenoide HAZ-GALK cross-link formazione era il problema principale da superare dovuto la prossimità spaziale di GALK e HAZ unità entro il 3D struttura della lignina23, una limitazione che potrebbe non essere presente se i due reporter chimici non sono incorporati nello stesso tipo di biopolimero o nella stessa regione spaziale di ogni cellula.
In un ambito più ampio della metodologia di BLISS essenzialmente potrebbe essere applicata a qualsiasi studio di formazione immagine di fluorescenza di due colori nei modelli batteriche o animale utilizzando due distinti reporter chimico recanti un'azide e tag di alchini terminali, rispettivamente.
Divulgazioni
Gli autori dichiarano di non avere nessun concorrenti interessi finanziari.
Riconoscimenti
Siamo in debito con il FRABio di Federazione di ricerca e la piattaforma di imaging TisBio (Univ. di Lille, CNRS, FR 3688, FRABio, BiochimieStructurale et Biomoléculaires Fonctionnelle des Assemblages) per fornire l'ambiente tecnico idoneo per realizzare questo lavoro.
Materiali
| Name | Company | Catalog Number | Comments |
| (E)-4-(3-(2-(2-(2-azidoethoxy)ethoxy)ethoxy)prop-1-en-1-yl)phenol (HAZ) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| (E)-4-hydroxy-3-propargyloxycinnamyl alcohol (GALK) | Synthesized as in Lion et al. Cell Chem. Biol. 2017, 24, 3, 326-338 | ||
| 2% sodium hypochlorite | |||
| 20 cm high glass tube | |||
| 250 mL Schott glass bottle | |||
| 48-well Plate | |||
| 5/6-TAMRA-PEG3-Azide | Jena Bioscience | CLK-AZ109-1 | |
| Aluminium foil | |||
| Cheese cloth | |||
| Compost containing clay | |||
| Coniferyl alcohol (G) | Sigma Aldrich | MFCD00002922 | |
| Copper (II) sulfate pentahydrate | |||
| DBCO-PEG4-5/6-Carboxyrhodamine 110 | Jena Bioscience | CLK-A127-1 | |
| Milli-Q Ultrapure water | |||
| Eppendorf 1,5 mL | |||
| EtOH | |||
| Flax seeds (L. usitatissimum L.) | |||
| Fluoromount-G™ Slide Mounting Medium | Electron Microscopy Sciences | 17984-25 | |
| Glass coverslip | |||
| Glass microscope slide | |||
| Growth chamber | CLF-Plant Climatics | For 2-week-old plants culture | |
| Growth chamber | Angelantoni Life Sciences | For 2-month-old plants culture | |
| Magenta plant culture box | For 2-week-old seedling culture | ||
| Methanol | Toxic (SGH02, SGH06, SGH08), work with gloves under a hood | ||
| Micropipette | |||
| Nail polish | |||
| Nikon A1R confocal microscope | Nikon | ||
| Orbital shaker | |||
| Parafilm | |||
| p-Coumaryl alcohol (H) | Carbosynth | FC145653 | |
| Plastic cap | |||
| Plastic pipette | |||
| Plastic pot | For 2-month-old plants culture | ||
| Razor blade | |||
| Rubber band | |||
| Sodium Ascorbate | |||
| Sterile clamp | |||
| Vertical support | |||
| Vortex | |||
| Reagents for liquid and solid ½ MS medium | |||
| KH2PO4 | |||
| KNO3 | |||
| NH4NO3 | |||
| MgSO4.7H2O | |||
| CaCl2.2H2O | |||
| MnSO4.H2O | |||
| ZnSO4.7H2O | |||
| H3BO3 | |||
| KI | |||
| Na2MoO4.2H2O | |||
| CuSO4.5H2O | |||
| CoCl2.6H2O | |||
| Na2EDTA.2H2O | |||
| FeSO4.7H2O | |||
| Thiamine.HCl | |||
| Pyridoxine.HCl | |||
| Glycine | |||
| Nicotinic acid | |||
| Myo-inositol | |||
| Saccharose | |||
| MES hydrate | |||
| Agar |
Riferimenti
- Grammel, M., Hang, H. C. Chemical reporters for biological discovery. Nat Chem Biol. 9 (8), 475-484 (2013).
- Prescher, J. A., Bertozzi, C. R. Chemistry in living systems. Nat Chem Biol. 1 (1), 13-21 (2005).
- Sletten, E. M., Bertozzi, C. R. Bioorthogonal chemistry: fishing for selectivity in a sea of functionality. Ange Chemie (Int Ed. Engl). 48 (38), 6974-6998 (2009).
- Chang, P. V., et al. Metabolic labeling of sialic acids in living animals with alkynyl sugars. Ange Chemie (Int Ed. Engl). 48 (22), 4030-4033 (2009).
- Gilormini, P. A., et al. A sequential bioorthogonal dual strategy: ManNAl and SiaNAl as distinct tools to unravel sialic acid metabolic pathways. Chem. Commun. 52 (11), 2318-2321 (2016).
- Mbua, N. E., et al. Abnormal accumulation and recycling of glycoproteins visualized in Niemann-Pick type C cells using the chemical reporter strategy. Proc Natl Acad Sci U S A. 110 (25), 10207-10212 (2013).
- Anderson, C. T., Wallace, I. S., Somerville, C. R. Metabolic click-labeling with a fucose analog reveals pectin delivery, architecture, and dynamics in Arabidopsis cell walls. Proc Natl Acad Sci U S A. 109 (4), 1329-1334 (2012).
- Tobimatsu, Y., et al. A click chemistry strategy for visualization of plant cell wall lignification. Chem. Commun. 50 (82), 12262-12265 (2014).
- Bukowski, N., et al. Development of a clickable designer monolignol for interrogation of lignification in plant cell walls. Bioconjugate Chem. 25 (12), 2189-2196 (2014).
- Pandey, J. L., et al. A versatile click-compatible monolignol probe to study lignin deposition in plant cell walls. PLOS ONE. 10 (4), e0121334 (2015).
- Pandey, J. L., et al. Investigating biochemical and developmental dependencies of lignification with a click-compatible monolignol analog in Arabidopsis thaliana stems. Front Plant Sci. 7, (2016).
- Zhu, Y., Wu, J., Chen, X. Metabolic labeling and imaging of N-linked glycans in Arabidopsis thaliana. Ange Chemie (Int Ed. Engl). 55 (32), 9301-9305 (2016).
- Boerjan, W., Ralph, J., Baucher, M. Lignin biosynthesis. Annu Rev Plant Biol. 54, 519-546 (2003).
- Weng, J. -. K., Chapple, C. The origin and evolution of lignin biosynthesis. New Phytol. 187 (2), 273-285 (2010).
- Mottiar, Y., Vanholme, R., Boerjan, W., Ralph, J., Mansfield, S. D. Designer lignins: harnessing the plasticity of lignification. Curr Opin Biotechnol. 37, 190-200 (2016).
- Rinaldi, R., et al. Paving the way for lignin valorisation: recent advances in bioengineering, biorefining and catalysis. Ange Chemie (Int Ed). 55 (29), 8164-8215 (2016).
- Wratil, P. R., Horstkorte, R., Reutter, W. Metabolic glycoengineering with N-acyl side chain modified mannosamines. Ange Chemie (Int Ed. Engl). 55 (33), 9482-9512 (2016).
- Feng, L., et al. Bifunctional unnatural sialic acids for dual metabolic labeling of cell-surface sialylated glycans. J Am Chem Soc. 135 (25), 9244-9247 (2013).
- Dumont, M., et al. Plant cell wall imaging by metabolic click-mediated labelling of rhamnogalacturonan II using azido 3-deoxy- d - manno -oct-2-ulosonic acid. Plant J. 85 (3), 437-447 (2016).
- Niederwieser, A., et al. Two-color glycan labeling of live cells by a combination of Diels-Alder and click chemistry. Ange Chemie Int Ed. 52 (15), 4265-4268 (2013).
- Späte, A. -. K., et al. Exploring the potential of norbornene-modified mannosamine derivatives for metabolic glycoengineering. Chem Bio Chem. 17 (14), 1374-1383 (2016).
- Späte, A. -. K., et al. Rapid Labeling of metabolically engineered cell-surface glycoconjugates with a carbamate-linked cyclopropene reporter. Bioconjugate Chem. 25 (1), 147-154 (2014).
- Lion, C., et al. BLISS: a bioorthogonal dual-labeling strategy to unravel lignification dynamics in plants. Cell Chem Biol. 24 (3), 326-338 (2017).
- del Río, J. C., et al. Structural characterization of guaiacyl-rich lignins in flax (Linum usitatissimum) fibers and shives. J Agric Food Chemist. 59 (20), 11088-11099 (2011).
- Huis, R., et al. Natural hypolignification is associated with extensive oligolignol accumulation in flax stems. Plant Physiol. 158 (4), 1893-1915 (2012).
- Chantreau, M., et al. Ectopic lignification in the flax lignified bast fiber1 mutant stem is associated with tissue-specific modifications in gene expression and cell wall composition. The Plant Cell. 26 (11), 4462-4482 (2014).
- Terashima, N., Ko, C., Matsushita, Y., Westermark, U. Monolignol glucosides as intermediate compounds in lignin biosynthesis. Revisiting the cell wall lignification and new 13C-tracer experiments with Ginkgo biloba and Magnolia liliiflora. Holzforschung. 70 (9), 801-810 (2016).
- Noel, M., et al. Probing the CMP-sialic acid donor specificity of two human β-d-galactoside sialyltransferases (ST3Gal I and ST6Gal I) selectively acting on O- and N-glycosylproteins. Chembiochem: Eur J Chem Biol. , (2017).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon