Method Article
Un dosage des terriers/Tunneling pour détection d’hypoxie chez les larves de Drosophila melanogaster
Dans cet article
Résumé
Le protocole décrit une analyse simple pour identifier des larves de drosophile qui sont confrontés à une hypoxie selon les niveaux de l’oxygène atmosphérique normale. Ce protocole permet des larves hypoxiques être distinguée des autres mutants qui montrent des phénotypes qui se chevauchent comme la lenteur ou une croissance lente.
Résumé
Carence en oxygène chez les animaux peut résulter d’une exposition à des niveaux faibles concentrations d’oxygène atmosphérique ou contre les dommages de tissu interne qui entrave la distribution de l’oxygène. Il est également possible que le comportement aberrant des neurones détection d’oxygène pouvait induire hypoxie-comme le comportement en présence de concentrations d’oxygène normale. Chez d. melanogaster, développement à faibles teneurs en oxygène résulte en l’inhibition de la croissance et le comportement léthargique durant les phases larvaires. Cependant, ces manifestations établies du déficit en oxygène se chevauchent considérablement avec les phénotypes des nombreuses mutations qui régulent la croissance, les réactions de stress ou de locomotion. En conséquence, il n’y a actuellement aucun test pour identifier l’hypoxie i) cellulaire induite par une mutation ou une hypoxie comme ii) comportement quand induit par un comportement anormal neuronal.
Nous avons récemment identifié deux comportements distinctifs chez les larves de d. melanogaster qui se produisent à des niveaux d’oxygène normale en réponse à la détection interne de l’hypoxie. Tout d’abord, à tous les stades, ces larves éviter de s’enfouir dans la nourriture, souvent de s’égarer loin d’une source de nourriture. Deuxièmement, tunneling dans un substrat mou, qui se produit normalement au cours de la troisième phase de stade errant est complètement aboli si les larves sont hypoxiques. Le test décrit ici est conçu pour détecter et quantifier ces comportements et donc de fournir un moyen de détecter une hypoxie induite par des dommages internes plutôt que de faibles concentrations d’oxygène extérieure. Plaques d’essai avec un substrat d’agar et une prise centrale de pâte de levure sont utilisées pour soutenir les animaux par le biais de la vie larvaire. Les positions et l’état de larves sont suivies tous les jours comme ils procèdent d’abord au troisième stade larvaire. La mesure de tunneling dans le substrat agar phase errant est dosée après nymphose à l’aide de NIH ImageJ. Le test va être utile pour déterminer quand l’hypoxie est une composante d’un phénotype mutant et donnent donc un aperçu de sites possibles de l’action du gène en question.
Introduction
Le tableau sophistiqué d’outils génétiques moléculaires disponibles chez d. melanogaster en font un organisme précieux pour l’étude des processus biologiques évolutivement conservés. Principales réponses moléculaires à la disponibilité de l’oxygène sont sont révélés être conservée à travers l’évolution et les études antérieures chez d. melanogaster ont généré un aperçu les composants universels de ces voies 1,2, de signalisation 3,4,5,6.
Dans le cadre d’une étude vise à disséquer la fonction des neurones sensoriels chez les larves de d. melanogaster , nous avons identifié deux réponses comportementales qui se sont révélées être activé par hypoxie tissulaire normale d’oxygène niveaux 7. L’un d'entre eux, échec à s’enfouir dans la nourriture, est fortement lié à la réponse aux faibles teneurs en oxygène rapporté par Wingrove et o ' Farrell 8. Le deuxième comportement, échec de tunnel dans un substrat mou pendant le troisième stade tardif errant phase, n'avait pas été précédemment identifié comme liées à une hypoxie. Nous avons déterminé qu’exposer les larves errant de type sauvage à faibles teneurs en oxygène inhibe également substrat tunneling 7, établissant ainsi que les deux ces comportements proviennent d’hypoxie - soit induite par des lésions tissulaires ou par les niveaux de consommation d’oxygène. Nous décrivons ici un test, que nous avons mis au point pour quantifier ces deux comportements induits par l’hypoxie, qui commence avec les observations immédiatement après l’éclosion de larve.
Des réponses hypoxiques dans les premiers stades larvaires n’ont pas été examinées précédemment et donc effectuer une analyse tout au long de la vie larvaire est un élément précieux de notre essai. La plupart des manifestations évidentes d’hypoxie – développement lent, faible croissance et locomotrice lenteur – se chevauche avec les phénotypes larves produites par nombreuses mutations. Mais nous avons trouvé que seulement troisième stade larvaire avec hypoxie montre un échec complet de tunnel 7. Ainsi, nous avons déterminé que même les larves plus compromis en termes de croissance et de la locomotion que nos larves hypoxiques, toujours effectuée quelques tunneling, tandis que les larves hypoxiques jamais tunnelé 7. Un autre élément précieux de ce test est donc qu’il fournit un moyen d’établir lors de l’hypoxie est la source d’un ensemble particulier de phénotypes pléiotropes, par opposition à d’autres stress ou un dysfonctionnement métabolique. Comme une démonstration de l’essai, les auteurs décrivent ici son utilisation pour caractériser les réponses des larves avec expression trachéale réduite de uninflatable, un gène qui fonctionne dans les larves airways 9.
Nous envisageons que ce test sera utile pour les chercheurs engagés dans la caractérisation des phénotypes larvaires qui comprennent une mauvaise croissance et comportement léthargique. En conséquence, de nouveaux gènes qui influent sur la distribution, utilisation ou les réponses, l’oxygène dans tout le corps pouvait être identifié. En outre, intégrant un mutant protocole de dépistage de ce dosage fournirait une route directe à l’identification des mutations qui produisent une hypoxie. Ce test sera également utile pour analyser les circuits qui suscite des comportements innés induite par l’hypoxie décrites ici. Analyse de réseau de neurones de ce type est une mise au point de nombreuses recherches actuelles et le système nerveux simple de la larve de d. melanogaster est un système utile pour disséquer les comportements automatiques. Les neurones sensoriels impliqués dans la perception des larves d’oxygène ont déjà été identifiés, fournissant une première étape dans la définition de la complète des circuits pour les réponses induites par l’hypoxie 10,11. Avec notre essai en combinaison avec sélective neuronale knockdown via le système de GAL4-UAS12 est un itinéraire clair pour délimiter davantage de composants de réseaux de neurones.
Protocole
1. préparation des larves
- Deux jours ou plus avant de commencer l’essai, mis en place des croisements de la désirée expérimentale et de contrôler les combinaisons (minimums 20 femelles et 10 mâles) dans les plats de œufs pondre décrite par Wieschaus et Nusslein-Volhard 13 , mais à l’aide de polypropylène 50 mL bechers et 6,0 cm plats de Pétri jetables contenant des raisin agar et enduit avec de la levure coller juste avant utilisation. Garder les mouches dans les plats de œufs pondre dans l’obscurité à température ambiante jusqu’au moment.
- Recette de raisin agar – mélanger 100 mL gelée 100 % raisin jus concentré, 350 mL d’eau deioinized, 5 mL glaciaire acétique et 13 g d. melanogaster agar dans un bécher de verre de 1 L. Micro-ondes en rafales de 1-2 min, en remuant entre les rafales, jusqu'à ce que l’agar est dissous. Refroidir la solution pendant quelques minutes puis ajouter 10 mL de 10 % (p/v) de Nipagen (méthyl-p-hydroxybenzoate) dans l’éthanol à 95 %. Mix, puis pipette 7 mL par plaque en Pétri jetables 6,0 cm, laisser gélifier et sécher à température ambiante pendant 3-4 h. magasin à 4 0C dans des sacs en plastique.
- Pâte de levure recette – sec de 7 g de levure, 10 mL d’eau désionisée, mélanger avec une spatule jusqu'à consistance uniforme.
- Collections oeuf chronométré pour générer expérimentale et contrôler les larves. En utilisant de nouvelles, plaques de levure-enduit, raisins, ramasser les œufs à température ambiante pendant 4 heures dans l’obscurité pendant les heures de la matinée. Enlever ces plaques de collection de 4 h et remplacez-les par des plaques fraîches. Incuber les boîtes de collecte de 4 h du jour au lendemain à 25 0C jusqu'à l’après-midi du lendemain, quand la plupart des larves est ont éclos. Recueillir ces premier stade larvaire et utilisez-les pour entamer l’expérience.
2. mise en place des plaques de dosage
- Préparation des plaques d’essai. Pour un même essai du dosage, préparer cinq test plaques chaque 10 larves expérimentales et cinq boîtes de 10 larves de contrôle. Utilisez un perce-bouchon 1,5 cm pour supprimer un noyau central de gélose de chaque plaque, créant un trou pour la nourriture. Mettre la pâte (0,8 - 0,9 g) de levure dans le trou et pat doucement avec une spatule pour faire un monticule le trou de remplissage.
- Préparation de plaques de gélose – combinez 700 mL d’eau désionisée avec agar de d. melanogaster 16 g dans un bécher de verre de 2 L et micro-onde pendant 5 min. retirer du micro-ondes et remuer avec une baguette de verre pour apporter agar dissous dans la solution. Ajouter 17,5 mL de 10 % (p/v) Nipagen dans l’éthanol à 95 %, mix, puis continuer le chauffage par micro-ondes en 30 s rafales suivie en remuant, jusqu'à dissolution complète de tous les agar. Cool pendant une minute ou deux, puis pipetez aliquotes 15 mL dans Pétri en plastique de 10 cm. Permettre à agar gel, couvercles avec couvercles et laissez-les sécher à température ambiante pendant quelques heures ou toute la nuit. Plaques de magasin dans des sacs en plastique scellés à 18 ° C.
, Note 1 : Pour éviter la formation de cristaux de Nipagen sur la surface des plaques à cause de la dessiccation excessive, utiliser des plaques dans les quelques jours de préparation. Si nécessaire, cristaux peut être re-dissous en laissant tomber quelques microlitres d’alcool à 95 % sur eux.
Note 2 : lots de gélose peuvent avoir différentes propriétés gélifiantes. Les plaques de gel sèche doivent être ferme au toucher et suffisamment résistante qu’un cercle propre et intact de gélose peut être retiré lorsque vous utilisez le perce-bouchon pour créer le trou d’alimentation (voir ci-dessus). - Mise en place des larves dans des plats de l’essai. Utilisez une pression mécanique à la pointe d’un microspatula en plastique de la courbe et tremper la pointe dans la pâte de levure pour fournir « colle » pour ramasser les larves. Ramasser des larves de premier stade individuellement et placez-les sur la gélose à proximité de la butte de nourriture. Préparer des plaques répétées au moins cinq des 10 larves à la fois expérimentale et des génotypes de contrôle. Une fois terminé, Boucher et étiqueter chaque plaque et mettre les plaques (côté couvercle vers le haut) dans un espace sombre à température ambiante (dans notre laboratoire c’est 22 ° C).
3. surveillance des plaques d’essai
- Examiner les plaques quotidiennement sous un microscope à dissection et noter le nombre de larves sur le dessus de la nourriture ou sur la surface de la gélose. Notez toutes les larves mortes ou mourantes visibles. Remarque Lorsqu’et si, tunnel dans le substrat de la gélose est vu comme les larves envahissent le troisième stade larvaire. Dates de Remarque nymphes commencent à se former et de noter toutes les anomalies pupes. Poursuivre les observations quotidiennes jusqu'à ce que toutes les larves sont morts ou pupated.
- Retirer soigneusement pupes de la plaque avec un penchant taquiner l’aiguille et le transfert d’une plaque de raisin. Si vous le souhaitez, continuer à suivre les nymphes pour déterminer combien d’eclose en tant qu’adultes.
4. préparer l’essai de plaques d’imagerie
- Retirez délicatement et jetez tous les aliments levure du puits central de chaque plaque.
- Doucement, inonder chaque plaque avec l’eau du robinet et utilisez le pinceau de l’artiste un doux soigneusement déteindra de débris qui a été l’objet d’un suivi sur la surface de la gélose. Remplacer l’eau plusieurs fois et continuer le brossage doux jusqu'à ce que chaque plaque est parfaitement propre. Donne plaques un rinçage à l’eau désionisée, leur casquette et laisser à température ambiante pendant la nuit pour sécher.
Remarque : Tunneling dans l’agar est plus intense autour de la butte de nourriture (voir Figure 2). Ainsi, le bord de l’orifice d’alimentation est généralement étendu au-delà du diamètre initial de 1,5 cm. En outre, la fragilité de l’agar a travaillé dans cette région peut provoquer des petits morceaux d’agar par tunnel à perdre de la circonférence du trou pendant le nettoyage. Augmentation de la concentration d’agar gel pourrait aider avec ces problèmes, mais les corrections sont possibles au cours des étapes de quantification Image J (voir ci-dessous).
5. quantification de tunneling
- Les plaques de l’image. Préparer une image de chaque plaque prise sur un fond noir afin de montrer les tunnels dans la gélose comme des lignes blanches lumineuses.
Remarque : Nous utilisons un système couramment utilisé à l’image des gels d’ADN pour cette étape (voir Table des matières et réactifs). Alternative d’imagerie des systèmes capables de générer des fichiers tiff, tels que les appareils photo numériques ou les caméras de téléphone cellulaire pourrait être ajusté pour produire des images appropriées. - Utilisez le programme domaine public NIH Image J pour doser le tunneling larvaire. Télécharger le programme de http://rsb.info.nih.gov/ij/download.html. Pour plus d’informations sur le programme, allez à http://imagej.nih.gov/ij/docs/intro.html.
Remarque : Les autres systèmes d’imagerie pourraient servir pour doser le tunneling. Les instructions ci-dessous s’appliquent aux NIH Image J. - Après avoir ouvert une image de fichier tiff d’une plaque de tunneling, utilisez l’outil ovale pour définir une zone pour le dosage qui représente la surface de la gélose ensemble mais affleure le bord en plastique de la plaque.
- Appliquer le seuil automatique pour produire une image inversée de la plaque, avec les tunnels montrant que les lignes noires. Utilisez le sélecteur de couleur et les outils pinceau blanc sur toutes les zones noires qui représentent des dommages à la gélose plutôt que les tunnels.
- Dans le menu déroulant analyser , sélectionnez Echelle de Set | Cliquez ici pour enlever le calcaire et puis dans la fenêtre définir des mesures (voir aussi l' analyse), vérifier la zone et jusqu’au seuil.
- Appuyez sur la touche Ctrl + la touche M pour afficher la zone noire (tunnels) en pixels.
- Copiez et collez la valeur en pixels pour chaque plaque est dans un tableur (comme Excel) qui permettre une analyse quantitative.
- Le trou central est généralement augmenté en raison des intenses tunneling dans cette région. Pour doser le tunneling manquant, décochez la case « Limite de seuil » et l’outil baguette magique permet de définir le trou central. Appuyez sur la touche Ctrl + la touche M pour obtenir la valeur de pixel de ce domaine. Soustraire de cette valeur la valeur de pixel d’un trou de 1,5 cm et ajouter la différence pour la tunneling valeur obtenue au point 5.6.
- Pour certains plats, le trou central peut manquer un morceau d’agar tunnelé qui comprend une région d’agar untunneled côté du trou. Lorsque quantifiant le trou central pour ces plaques utilisation du sélecteur de couleurs et peinture pinceau outils pour ajouter une barre noire dans toute la région manquante pour définir la région tunnelée et exclure la zone non-tunnel de quantification.
, Note 1 : Si les larves expérimentales effectuent tout tunnel, ce dosage permet le calcul de moyenne tunneling des valeurs pour les jeux de plaques et une comparaison statistique de contrôle et les valeurs expérimentales.
Résultats
Comme une démonstration de la valeur de ce test nous l’avons utilisé pour étudier le potentiel hypoxie chez les larves dont la fonction altérée du gène uninflatable (uif) dans la trachée. UIF encode une grosse protéine transmembranaire qui est fortement exprimée à la surface apicale des cellules trachéales larvaires. Mutants de uif étaient précédemment relevées des comportements aberrants qui indiquerait l’hypoxie tissulaire en raison de dysfonctionnement trachéal 9. Nous avons supprimé spécifiquement uif expression dans la trachée de larve à l’aide du système de Gal4-UAS. Gal4 deux lignées ont été utilisées : i) hors d’haleine (btl)-Gal4, qui est fortement exprimée dans les trachées dès le début de leur développement embryonnaire et ii) coupé(ue)-Gal4, qui commence l’expression dans une petite région occipitale la trachée tronc dorsal principal à la fin de l’embryogenèse et continue de forte expression dans cette région tout au long de la vie larvaire 7. Un SAMU -uif ligne Arni a été obtenue depuis le centre de recherche de drosophile de Vienne (VDRC ID #1050).
Comme décrit dans le protocole ci-dessus, cinq répliquer les plaques de nouvellement éclos premier stade larves ont été mis en place pour chacun des quatre croix comme suit.
Expérience 1
1) contrôle 1 - couper(ue)-Gal4 x Canton-S (+)
2) expérimental 1 - couper(ue)-Gal4 x UAS-uif Arni
Expérience 2
3) contrôle 2 - btl-Gal4 x Canton-S (+)
4) expérimental 2 - btl-Gal4 x UAS-uif Arni
Le comportement de la couper(ue)-Gal4 > SAMU -uif Arni larves d’expérience 1 était comparable à celle de la commande couper(ue)-Gal4 > + animaux en termes de terriers, de tunneling et de survie pour la nymphose, (Figure 1 et Figure 2). En revanche, down-régulation uif expression dans tout le réseau trachéale de début de développement (expérience 2) produit des réponses nettement différentes. Le btl-Gal4 > SAMU -uif Arni larves affichent les deux manifestations comportementales d’hypoxie tissulaire – réduit les aliments s’enfouir et une absence totale de substrat tunnel plus tard dans la vie larvaire (Figure 1 et Figure 2 de ). Les larves expérimentales ont été également sensiblement plus petit, plus mince et plus lente que chez les témoins (Figure 3) et a montré un taux élevé de mortalité au cours de l’essai. Comme indiqué plus haut, une croissance réduite, lenteur et organismique mort sont connus des symptômes de l’hypoxie larvaire. En outre, la plupart des larves expérimentales n’a pas pu tenter la pupaison et est resté sous le troisième stade larvaire larves longues après que contrôle des larves avaient pupated. Certaines larves ont survécu plus de quinze jours, avant de finalement mourir sans poupée (Figure 1 a). Quelques uns des larves expérimentales essayé pour se nymphoser, mais dans tous les cas anormaux nymphes se sont formés qui n’ont pas généré adultes viables.
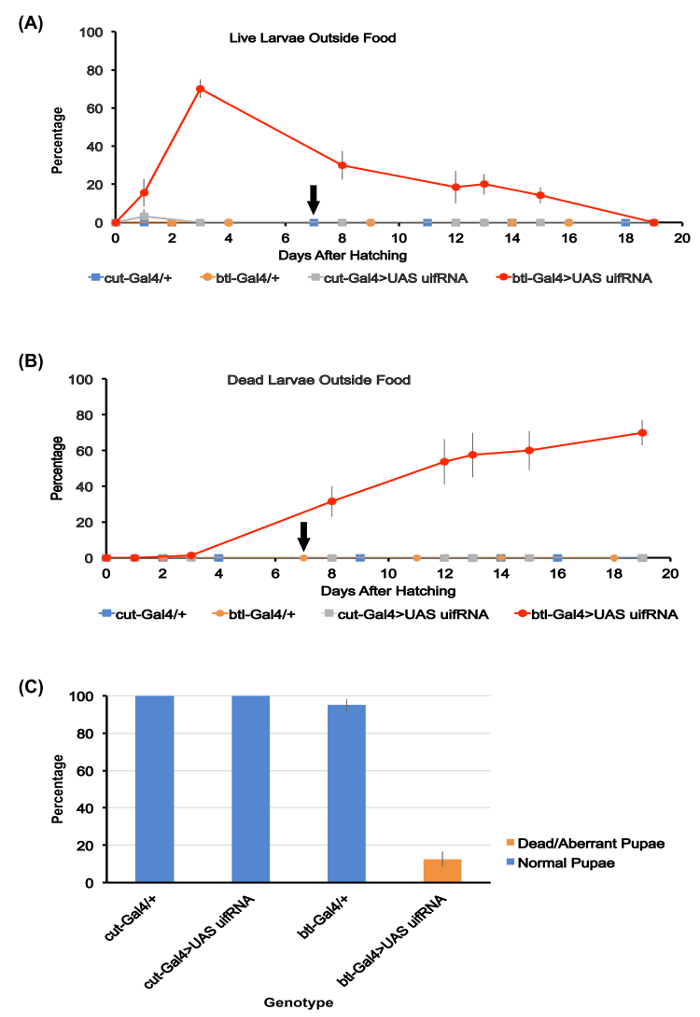
La figure 1. Dosage de développement larvaire et fouisseurs alimentaires.
(A) le pourcentage de larves vivantes en dehors les monticules de nourriture pour les quatre génotypes étudiés ici. Les moyennes pour les plaques de cinq test utilisés pour chaque génotype sont reportées. Jour 3 après l’éclosion, environ 70 % de la btl-Gal4 > SAMU uif Arni larves étaient en dehors de la nourriture, alors qu’aucune larve ont été détectés en dehors de la nourriture ou sur la surface de la gélose pour les trois autres génotypes. Le btl-Gal4 > larve de RNAi SAMU uif mourir lentement entre les jours 4-20, avec environ 15 % d'entre eux encore en vie 15 jours après l’éclosion. La flèche noire le long de l’axe des x ici et au point B indique le jour par lequel toutes les larves des trois autres génotypes avaient pupated.
(B) pourcentage des larves mortes visibles en dehors de la nourriture pour les quatre génotypes. Les moyennes pour les plaques de cinq essai pour chaque génotype sont reportées. Mort de btl-Gal4 > larves de RNAi uif SAMU s’accumulent au fil du temps avec la plupart meurent en dehors de la nourriture. Les autres génotypes tous survivent à la nymphose
(C) le pourcentage de survie à la nymphose pour les quatre génotypes étudiés. Les moyennes pour les plaques de cinq essai pour chaque génotype sont reportées. Aucun nymphes normales de la btl-Gal4 > génotype de RNAi uif SAMU ont été produites. Barres d’erreur tout au long de la figure représentent SEMs. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
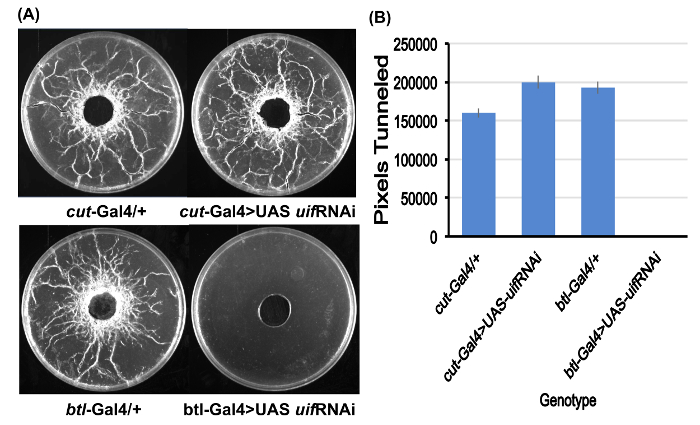
La figure 2. Dosage de tunneling larvaire.
(A) exemples des plaques dosage pour tous les quatre génotypes étudiés après sa préparation pour le dosage de tunneling. Notez l’absence totale d’effet tunnel pour le btl-Gal4 > larve de SAMU uif Arni. Plaques d’essai sont plats de Pétri de 10 cm.
(B) tunneling quantification dérivé Image J pour les quatre génotypes. Moyenne des valeurs des pixels pour les plaques de cinq essai pour chaque génotype. Aucun tunnel n’a été observée pour le btl-Gal4 > larve de SAMU uif Arni. Barres d’erreur = SEMs. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

La figure 3. Comparaison de btl-Gal4 > SAMU uif RNAi et btl-Gal4 > + larves
Larves d’âge similaire (jour 6 après l’éclosion) pour le btl-Gal4 > SAMU uif Arni (A) et btl-Gal4 > + génotypes (B). Flèches rouges pointent vers la trachée tronc dorsal. Les deux larves imagés au même grossissement. Echelle = 0,5 mm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Nous présentons ici un essai simple, conçu pour détecter l’hypoxie tissulaire chez les larves de d. melanogaster . Le diagnostic repose sur une diminution s’enfouir dans les monticules de nourriture au début de la vie larvaire et l’absence de substrat tunnel vers la fin de la vie larvaire. La densité larvaire peut causer migration prématurée loin d’une source de nourriture et un aspect critique du test est donc qu’un petit nombre de larves est dosé en présence d’un grand excès de nourriture. Inclusion de du benzoate de hydroxyle fongicide en méthyl-p (Nipagen) dans les boîtes de gélose est également essentielle de prévention des moisissures pendant le test.
Nous trouvons que les plaques de gélose peuvent être une source de variabilité dans le dosage. En général, larves du même génotype, provenant de différents lots de parents, ou de différentes collections de larves, montrent une variation relativement limitée dans leur comportement lors de l’essai. En revanche, les géloses faite sur des jours différents ou avec différents lots d’agar peuvent produire des différences dans le tunnel. Une stipulation est donc ce contrôle et expérimentales larves doivent tous être testés à l’aide des boîtes de gélose de la préparation de commandes. Gélose de différents fabricants ou même les envois provenant de la fabrication même peuvent varier dans leur force de gélifiant, et donc il peut être nécessaire des ajuster la concentration en agar vers le haut de la 2,2 % utilisé ici pour réaliser un gel optimal. Nous avons constaté que les larves de type sauvage peuvent s’enfouir facilement par des gels de 3 % d’agar.
Afin de démontrer la valeur de ce test, nous l’avons utilisé pour étudier le potentiel hypoxie tissulaire chez les larves avec la fonction supprimée de uninflatable dans la trachée. Nos résultats fournissent un appui solide de l’hypothèse que la perte de l’expression de ce gène peut produire hypoxie : btl-Gal4 > SAMU -uif Arni larves faisaient état à s’enfouir dans la nourriture et l’absence totale de substrat tunneling pendant le troisième stade. Dans nos études antérieures d’autres génotypes, nous avons observé que perte induite par l’hypoxie des terriers de nourriture n’est pas aussi complet que la perte de tunneling de substrat et le btl-Gal4 > SAMU -uif Arni larves étudiés ici se sont comportés de la même façon. Le composant défectueux de tunneling de cet essai fournit donc la plus forte indication d’hypoxie.
Bien que le btl-Gal4 > uif Arni larves ont montré des traits comportements diagnostique de l’hypoxie, la coupe(ue)-Gal4 > SAMU -uif Arni ne montrent pas ces anomalies. Le btl et couper(ue), Gal4 pilotes sont exprimés à des stades différents et dans différents modèles, dans la trachée larvaire. Le btl-pilote de Gal4 est exprimée dans le système trachéen commençant à son développement dans l’embryogenèse et continuant à travers la vie larvaire. En revanche, l’expression de Gal4 du couper(ue)-Gal4 pilote seulement commence à la fin de la vie embryonnaire, après la morphogénèse de la trachée et est limitée aux sections extrêmes postérieures des troncs dorsales, les gros vaisseaux longitudinales de le système trachéen. knockdown UIF avec cette ligne de Gal4 ne peut pas par conséquent réduire uif expression suffisamment tôt ou largement suffisant pour produire certains seuil d’hypoxie requis pour déclencher les comportements mesurés dans ce test.
Une étude préalable constaté que le troisième stade larvaire, exposés à de faibles concentrations d’oxygène (10 %) montre une diminution de la croissance et initiation du puparium 14retardée. Le btl-Gal4 > SAMU -uif Arni larves étudiés ici a progressé pour le troisième stade, mais les effets sur leur taux de croissance et de la nymphose étaient plus prononcés : ils étaient beaucoup plus petites que les contrôles avec très peu de tissu adipeux sous la épiderme (Figure 3) et seulement une fraction mineure (~ 10 %) ont tenté puparium. Ces différences suggèrent la btl-Gal4 > SAMU -uif Arni larves ont connu un plus grand degré d’hypoxie, soit parce qu’uif knockdown dans la trachée a été présent tout au long de leur vie larvaire, il produit une plus privation d’oxygène sévère au troisième stade larvaire. Comment la perte de fonction uif dans les trachées pourrait empêcher de transport de l’oxygène n’est pas clair à ce stade. Les trachées de la btl-Gal4 > SAMU -uif Arni larves sont facilement visibles à travers la cuticule (Figure 3), une indication qu’ils contenaient air et n’étaient pas endommagées au point que l’entrée fluide compromis fonction. Il est officiellement possible dès lors que les dommages à la trachée créé par perte de fonction uif ne pas permis d’obtenir l’hypoxie, mais plutôt un autre vice qui inhibe le tunneling. Pour les génotypes étudiés précédemment, nous avons déterminé que l’incapacité à tunnel est associée à des niveaux élevés de LDH ARNm7, l’indicateur canonique de la glycolyse et hypoxie en fin troisième stade larves 15. Ainsi, la confirmation définitive d’hypoxie pour le btl-Gal4 > SAMU -uif Arni larves (et chez les larves examinées à l’avenir utiliser faussement) impliquerait la RT-PCR afin d’évaluer la LDH ARNm ou l’utilisation d’un indicateur disponible dans le commerce pour mesurer niveaux d’oxygène intracellulaire (par exemple voir 16).
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrentes.
Remerciements
Karen M. Qiang a reçu 2016 le prix George J. Schroepfer Research à l’Université Rice. Fanli Zhou est le récipiendaire d’une bourse universitaire de l’Université Rice. Les services de la drosophile Bloomington Stock Center, la facilité de voyage de Harvard, le centre de ressources de drosophile de Vienne sont tient à reconnaître.
matériels
| Name | Company | Catalog Number | Comments |
| REAGENTS | |||
| Dehydrated yeast | |||
| Frozen grape juice concentrate | Welch's | Available at most large supermarkets | |
| Glacial acetic acid | Sigma-Aldrich | 320099 | |
| Drosophila agar | Apex Bioresearch Products | 66-103 | |
| Methyl-para-hydroxybenzoate | Apex Bioresearch Products | 20-658 | |
| EQUIPMENT | |||
| 50 ml polypropylene beakers | |||
| 6.0 cm disposable Petri dishes | Falcon | 08757100B | |
| 10 cm disposable plastic Petri dishes | E+K Scientific | EK-24104 | |
| Plastic microspatulas | Corning Incorporated | 3012 | |
| Bent teasing needle | Nasco | S08848MH | |
| Dissecting microscope | Any microscope with 10-30X magnification |
Références
- O'Farrell, P. H. Conserved responses to oxygen deprivation. J. Clin. Invest. 107 (6), 671-673 (2001).
- Lavista-Llanos, S., et al. Control of the hypoxic response in D. melanogaster by the basic helix-loop-helix pas protein Similar. Mol. Cell. Biol. 22 (19), 6842-6853 (2002).
- Reiling, J. H., Hafen, E. The hypoxia-induced paralogs Scylla and Charybdis inhibit growth by down-regulating S6K activity upstream of Tsc in D. melanogaster. Genes Dev. 18 (23), 2879-2892 (2004).
- Gorr, T. A., Gassmann, M., Wappner, P. Sensing and responding to hypoxia via Hif in model invertebrates. J. Insect Physiol. 52 (4), 349-364 (2006).
- Romero, N. M., Dekanty, A., Wappner, P. Cellular and developmental adaptations to hypoxia: A D. melanogaster perspective. Meth. Enzymol. 435, 123-144 (2007).
- Dijkers, P. F., O'Farrell, P. H. Dissection of a hypoxia-induced, nitric oxide-mediated signaling cascade. Mol. Biol.Cell. 20 (18), 4083-4090 (2009).
- Zhou, F., Qiang, K. M., Beckingham, K. M. Failure to burrow and tunnel reveals roles for jim lovell in the growth and endoreplication of the D. melanogaster larval tracheae. PLOS ONE. 11, e0160233 (2016).
- Wingrove, J. A., O'Farrell, P. H. Nitric oxide contributes to behavioral, cellular, and developmental responses to low oxygen in D. melanogaster. Cell. 98 (1), 105-114 (1999).
- Zhang, L., Ward, R. E. Uninflatable encodes a novel ectodermal apical surface protein required for tracheal inflation in D. melanogaster. Dev. Biol. 336 (2), 201-212 (2009).
- Langlais, K. K., Stewart, J. A., Morton, D. B. Preliminary characterization of two atypical soluble guanylyl cyclases in the central and peripheral nervous system of D. melanogaster melanogaster. J. Expt. Biol. 207 (13), 2323-2338 (2004).
- Morton, D. B. Behavioral responses to hypoxia and hyperoxia in D. melanogaster larvae. Fly. 5 (2), 119-125 (2011).
- Brand, A., Perrimon, N. Targeted gene expression as a means of altering cell fates and generating dominant phenotypes. Development. 118 (2), 401-415 (1993).
- Wieschaus, E., Nusslein-Volhard, C., Roberts, D. B. Looking at embryos. Drosophila: a practical approach. , 199-227 (1986).
- Callier, V., Shingleton, A. W., Brent, C. S., Ghosh, S. M., Kim, J., Harrison, J. F. The role of reduced oxygen in the developmental physiology of growth and metamorphosis initiation in D. melanogaster. J. Expt. Biol. 216 (23), 4334-4340 (2013).
- Li, Y., et al. Hif- and non-Hif-regulated hypoxic responses require the estrogen-related receptor in D. melanogaster. PLoS genetics. 9 (1), e1003230 (2013).
- Grifoni, D., Sallazzo, M., Fontana, E., Froldi, F., Pession, A. Multiple strategies of oxygen supply in Drosophila malignancies identify tracheogenesis as a novel cancer hallmark. Scient. Rep. 5 (9061), (2015).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon