Method Article
Adaptation de la microélectrode Array technologie pour l’étude de la neurotoxicité induite par l’anesthésie dans le cerveau Intact Porcinet
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Cette étude explore la nouvelle utilisation de la technologie de baies (MEA) de microélectrodes à base d’enzymes pour surveiller l’activité du neurotransmetteur in vivo chez les porcelets. L’hypothèse était que ce dérèglement du glutamate contribue au mécanisme de neurotoxicité anesthésique. Nous présentons ici un protocole visant à adapter la technologie de la MEA pour étudier le mécanisme de la neurotoxicité induite par l’anesthésie.
Résumé
Chaque année, des millions d’enfants subissent une anesthésie pour une multitude de procédures. Cependant, les études chez les animaux et les humains ont remis en question la sécurité de l’anesthésie chez les enfants, impliquant des anesthésiques comme étant potentiellement toxiques pour le cerveau en développement. A ce jour, aucune étude n’ont avec succès élucidé le mécanisme par lequel l’anesthésie peut s’avérer neurotoxique. Études chez l’animal permettent d’investigation de ces mécanismes et porcelets nouveau-nés représentent un excellent modèle pour étudier ces effets en raison de leurs similitudes frappantes du développement du cerveau humain.
Ce protocole s’adapte à l’utilisation de technologie de microélectrodes à base d’enzymes (MEA) comme une nouvelle façon d’étudier les mécanismes de la neurotoxicité induite par l’anesthésie (AIN). AME permettre un suivi en temps réel des in vivo l’activité de neurotransmetteur et offre une résolution spatiale et temporelle exceptionnelle. Il est possible que neurotoxicité anesthésique est causée en partie par le dérèglement de glutamate et ame offre une méthode pour mesurer le glutamate. La mise en œuvre novatrice de la technologie de la MEA dans un modèle de porcelet offre une occasion unique pour l’étude de l’AIN.
Introduction
Chaque année, des millions d’enfants subissent une anesthésie pour des procédures invasives et non invasive dans les États-Unis1. Pendant des années, fournisseurs de l’anesthésie ont rassuré les parents de l’innocuité des agents anesthésiques, même dans les petits enfants et les nouveau-nés. Cependant, en 1999, il a été constaté que transitoire blocage du sous-type de récepteurs de glutamate durant le début de la vie N-méthyl-D-aspartate (NMDA) pourrait provoquer l’apoptose neuronale généralisée en rat2. Récemment, la FDA a publié une communication de sécurité médicamenteuse qui exigera que les étiquettes des médicaments anesthésiques pour y inclure un avertissement concernant les anesthésiques généraux et leurs effets négatifs potentiels sur le cerveau en développement des enfants de moins de 3 ans (U.S. Food et Drug Administration, 2017). Toutefois, il demeure nécessaire d’élucider les mécanismes possibles et les mesures possibles de neuroprotecteurs.
L’activité normale de neurotransmetteurs comme le glutamate et l’acide gamma-amino butyrique (GABA) sont essentiels pour neurologique normal de se produire. Bien que la plupart des voies impliquées dans l’AIN sont toujours insaisissable, des systèmes de neurotransmetteurs sont très susceptibles d’être impliqués comme anesthésiques sont connus pour moduler ces voies pour produire de l’inconscience. En particulier, le neurotransmetteur excitateur de glutamate provoque l’excitotoxicité lorsque son activité est dysrégulation. Ce neurotransmetteur est impliqué normalement dans la neurogenèse, plasticité neuronale, croissance synaptique et neuronale et un certain nombre d’autres fonctions de cerveau une importance critique. Cependant, activation prolongée des récepteurs du glutamate peut causer l’excitotoxicité et l’apoptose neuronale, particulièrement dans des conditions de stress tels que la chirurgie, la privation d’oxygène et de disponibilité énergétique réduite3. La liaison de glutamate pour le NMDA récepteur a démontré au Na+ et Cl− afflux. La dépolarisation subséquente est censée mener à l’ouverture du Ca2 + canal et libération de Ca intracellulaire2 + stocke4. Ce dysfonctionnement probable mène à une cascade de dérangements métaboliques qui finissent par diminuer la prolifération neuronale, augmenter l’inflammation et conduire à la mort neuronale. Bien que ces hypothèses, le véritable ou les mécanismes de l’AIN demeurent peu claires5. En raison de son rôle dans l’apoptose, dérèglement du glutamate représente une nouvelle voie qui peut-être contribuer au mécanisme d’apoptose neuronale précédemment documenté, une caractéristique de l’AIN.
Un des obstacles à l’étude des processus neuronaux est leur complexité élevée, surtout dans le cadre du développement neuronal. Les premiers mois de vie sont la période de vulnérabilité maximale aux blessures, au cours de laquelle la plupart des étapes importantes du développement neuronal comme l’apoptose physiologique (élagage neuronale), synaptogenèse, gliogenesis et myélinisation prennent place6 . Étant donné la nature complexe de la communication neuronale et la difficulté d’étudier ces processus sans perturber le fonctionnement normal de CNS, nouvelles technologies ont été développées qui visent à l’in vivo de détection et la quantification des éléments importants de la communication neuronale.
Technologie MEA-enzymatique a été utilisée dans cette étude comme une nouvelle façon d’étudier les mécanismes de l’AIN dans un modèle de porcelet ayant une pertinence clinique. Cette technologie peut être utilisée pour étudier les processus complexes in vivo électrochimique cerveau, y compris le dérèglement de glutamate. Les sites incorporé 4 canaux platine enregistrement des AME (2 sites sensibles au glutamate et 2 centres sentinelles) permettent auto-référence, qui contribue à la précision de détection. En outre, une couche d’exclusion est appliquée sur chaque électrode, sélectivité attributive en empêchant les autres molécules parasites d’être détecté7. En outre, la conception low-profile de l’Ame permet traumatisme minime par rapport aux technologies antérieures. Cette même caractéristique confère à l’Ame une résolution spatiale supérieure, qui facilite l’étude des régions microscopiques dans le cerveau. Par exemple, des régions discrètes de l’hippocampe (gyrus denté, CA1, CA2) peuvent être spécifiquement étudié8. Des informations détaillées concernant les fonctionnalités des AME ont été décrites précédemment9.
En comparaison de l’électrochimie MEA, microdialyse incorpore une membrane placée entre la solution d’intérêt et une solution de composition similaire, permettant la détection de liquide extracellulaire vire10. Bien que la microdialyse est un pilier de la neurochimie et a longtemps été utilisé pour la détection des neurotransmetteurs, il présente l’inconvénient de temps faible résolution, détection tardive du changement de glutamate et tissus important traumatisme11.
AME peut détecter indirectement de neurotransmetteurs tels que le glutamate, l’acétylcholine et la choline, en utilisant des enzymes appropriées oxydase qui produisent des molécules journaliste électroactifs comme H2O2 ou O212,13 .
Technologie de la MEA a été employé couramment chez les rats et les primates non humains pour l’étude de neurotoxicité dans le contexte des processus physiopathologiques autre que AIN7,14. Parmi ces processus physiopathologiques, technologie de la MEA a été utilisée pour l’étude de la maladie d’Alzheimer, l’épilepsie, traumatisme crânien et l’effet des composés pharmacologiques sur communication synaptique8,15 , 16 , 17. bien que l’Ame ont été utilisés pour étudier ces pathologies chez les rats et les primates non humains, la développement forte similarité entre les humains et les cerveaux de Porcinet met l’adaptation de la technologie MEA chez les porcelets une technique parfaitement adaptée pour l’étude de l’AIN ou des mécanismes18.
Protocole
Porcelets (Sus scrofa) sont reçus par une batterie de serveurs locale approuvée au préalable par le Comité d’utilisation (IACUC) et de l’Ohio State University (OSU) institutionnels animalier. Suite à l’approbation du protocole, les expérimentations animales sont effectuées conformément à la politique IACUC.
1. porcelets et manipulation de Porcinet
- Utiliser les porcelets mâles et femelles d’une manière systématique et randomisée pour éliminer toute confusion potentiels fondée sur le sexe conformément à l’arrivée de lignes directrices19.
Remarque : Étant donné que la période de croissance maximale de cerveau est 3-5 jours de naissance du porcelet, expérimentation se faite uniquement avec des porcelets âgés de 3 à 5 jours. - S’assurer que les porcelets arrivent dans le vivarium au moins 24h avant l’expérimentation afin de permettre l’acclimatation à l’environnement.
NOTE : Du personnel vétérinaire qualifié fournit des soins courants aux animaux. Les porcelets sont gardés dans des cages individuellement maintenu à la température, surveillance continue et reçoivent un lait nutritionnellement complet de remplacement ad libitum pour prévenir l’hypoglycémie. Les porcelets sont également conservés sans remplacement de lait (néant par système d’exploitation), pendant au moins 3 h avant l’anesthésie et sont fournis avec des couvertures et des jouets pour assurer un niveau normal de la stimulation. Si possible, conservez les porcelets multiples dans la même cage pour permettre la socialisation.
2. développement et personnalisation des AME pour études AIN dans un modèle de porcelet
NOTE : Cette technique utilise des AME fondées sur les enzymes qui est revêtues avec enzyme et plaqué avec m-phénylènediamine dihydrochloride (mPD). Les électrodes ont été personnalisées conçue avec une tige rigide de 40 mm et fabriqués pour une utilisation chez les porcelets (Figure 1).
- Pour éviter la redondance, veuillez consulter que la description détaillée de la préparation de la MEA et étalonnage décrite précédemment15 (Figure 2).
3. l’anesthésie et l’utilisation des appareil stéréotaxique personnalisé pour le porcelet
- Anesthésier les animaux à l’aide d’une station de travail de l’anesthésie avec un ventilateur approprié et des dispositifs de surveillance et de surveiller les paramètres physiologiques tels que l’oxymétrie de pouls, tension artérielle non invasive, l’électrocardiographie et température tout au long de la totalité de l’expérience décrite précédemment19. Intuber et ventiler les porcelets et administrent sévoflurane anesthésie à 1 concentration alvéolaire minimale (MAC) (environ 2,5 à 3 %) de 3,5 h. s’assurer que le personnel de laboratoire compétent membres sont présents pour ces expériences. Fourrure recouvrant la zone chirurgicale est supprimée à l’aide de tondeuses électriques avant la préparation de la peau.
Remarque : La concentration et la durée d’anesthésie utilisé permet l’expérience simuler la durée de l’exposition réelle de l’anesthésie au cours d’une intervention chirurgicale. En outre, le sévoflurane est le plus couramment utilisé anesthésie générale dans la population pédiatrique, assurer l’enquête entourant la sécurité d’une importance capitale. - Avant la mise en place dans le cadre stéréotaxique, commencer un rocuronium chargement la dose de 2,5 mg/kg et une infusion de 1,5 mg/kg/h pour empêcher tout déplacement animal obtenu dans le cadre.
- Placez le cochon de lait dans le cadre stéréotaxique de porcelet spécifique lorsqu’une profondeur adéquate de l’anesthésie est confirmée par l’orteil-pincée.
- Fournir le rembourrage approprié dans le cadre stéréotaxique en plaçant le porcelet sur un coussin chauffant air pulsé avec un rembourrage supplémentaire (p. ex., positionneur fluidisé) pour prévenir les ulcères de pression.
- Placez les dents de la mandibule supérieure sur la dent bar (Figure 3).
Remarque : La barre de la dent doit être à un niveau suffisant pour maintenir le crâne très fermement en place. - Fixer et serrer les barres d’oreilles pénétrant dans les oreilles, en prenant soin de faire en sorte que le porcelet est en position médiane. Poste les bouts pointus du latéral occupe dans le conduit auditif et insérer l’oreille barres assez fermement pour entendre le bruit de « pop » associé à la pénétration de la membrane tympanique. Fermement, fixer les barres de l’oreille au crâne et insérer à profondeur égale de chaque côté afin d’empêcher tout mouvement du crâne au cours de l’expérience (Figure 4groupe A).
Remarque : Il est primordial de maintenir le cochon de lait chaud (~ 37,8-38,6 ° C) et de surveiller en permanence la température pendant toute la procédure pour le maintien de la normothermie. Ceci peut être accompli via une couverture ou une lampe chauffante. N’oubliez pas de placer la lampe chauffante à une distance appropriée pour éviter les brûlures de la peau de l’animal.
- Créer une incision médiane de 4 à 6 cm le long du crâne à l’aide de prudence pour éviter de marquer le crâne avec le scalpel. Une fois que l’incision est faite, utiliser la rétraction douce et dissection émoussée pour élever le cuir chevelu du crâne. Frottez doucement le crâne avec une compresse de gaze pour enlever n’importe quel tissu conjonctif et exposer les lignes de suture (Figure 4groupe B).
Remarque : Il n’est pas nécessaire de maintenir la stérilité au cours d’expériences sans survie. Toutefois, la stérilité doit être maintenue au cours d’expériences de survie. - Approfondir la réflexion du cuir chevelu, si nécessaire, d’exposer la zone d’intérêt et de déterminer le lieu prévu pour la craniotomie (Figure 5groupe A). Utiliser une perceuse chirurgicale pour créer une fenêtre de craniotomie d’environ 0,25 cm2 (peut être plus ou moins importants selon les objectifs expérimentaux) recouvrant la structure d’intérêt, à l’aide d’attention ne pas à blesser la dure-mère ou le cerveau sous-jacent (Figure 5 , Groupe B). Utilisez des ciseaux chirurgicaux pour exciser la dure-mère recouvrant le tissu cérébral (Figure 5tableau C).
- Positionner l’électrode aussi verticalement que possible sur le bregma en sécurisant le bras métallique de la tête pour le micromanipulateur de la stereotax de porcelet. Abaisser l’électrode autant que possible sans toucher la surface du crâne. Enregistrer les coordonnées de la bregma (Figure 6groupe A).
- Déterminer l’antéro-postérieur et latéral médial coordonne ainsi que la profondeur de la structure d’intérêt en ce qui concerne le bregma. Déterminer les coordonnées stéréotaxiques utilisant une espèce et atlas stéréotaxiques adaptées à leur âge. Dans ce cas, utiliser un atlas stéréotaxique développé spécifiquement pour les porcelets20.
- Repositionner l’électrode afin qu’il ait le bon endroit antéro-postérieur et latéral médial, assurant que la microélectrode et l’appareil est perpendiculaires à la surface. Placer l’électrode de Pseudo-référence sous le cuir chevelu, en assurant le contact avec l’animal (Figure 6groupe B).
- Lentement et doucement, abaissez l’électrode à la profondeur appropriée dans le cerveau à l’aide du bras stéréotaxique. Pour la finale de 2 mm, utilisez une microdrive hydraulique à disque supplémentaire l’électrode à l’emplacement exact (Figure 6groupe C).
Remarque : La position de l’électrode doit recouvrent la fenêtre craniotomie. La profondeur de l’électrode peut varier selon la structure du cerveau d’intérêt. Il n’est pas nécessaire de fermer l’incision à la fin de la collecte de données dans des expériences sans survie.
4. mesure de Glutamate extracellulaire sous anesthésie sévoflurane
- Assurez-vous que le porcelet est sous surveillance physiologique continue tout au long de l’intégralité de cette procédure. Porcelets sont anesthésiés inhalationally (via le cône de visage) en vue de la procédure.
- Après l’implantation de la MEA, attendre 30 min pour permettre l’électrode atteindre la ligne de base pour s’assurer qu’une mesure correcte sera obtenue pendant 3 h (Figure 7).
- bupivacaïne 0,25 % (1 mL/kg) est administrée par voie sous-cutanée sur le site de la chirurgie pour la gestion de la douleur postopératoire. En outre, soutenir-libèrent la buprénorphine est sous-cutanée q72h selon les besoins.
5. la perfusion et le Sacrifice
- Effectuer les procédures de collecte de tissus perfusion et le cerveau comme décrit précédemment21. Chirurgie sans survie, d’animaux est euthanasiés immédiatement après expérimentation tandis que toujours sous anesthésie générale.
- Prendre des coupes brutes du cerveau Porcinet fixe et microscopie optique permet de visualiser la trajectoire de l’électrode comme décrit précédemment22 pour permettre la vérification du placement de la MEA, assurant un placement correct dans la zone d’intérêt.
Résultats
Cette étude de validation avec céramique MEA technologie enzymatique dans un modèle de porcelet peut donnent un aperçu exceptionnel de la dynamique de glutamate qui sous-tendent AIN. Cette étude montre que technologie MEA enzymatique peut être adaptée avec succès dans le modèle de cochon de lait à mesurer les changements physiologiques et associée à l’anesthésie dans l’activité de la neurotransmetteur à haute sensibilité et haute spatiale et temporelle résolution. Homéostasie physiologique a été maintenu tout au long de nos expériences à l’aide des normes et méthodes cliniquement pertinents, et aucun porcelet ne présentait des signes de perturbations physiologiques.
Les données obtenues indiquent la capacité d’ame de Mensurations de neurotransmetteur dans les structures cérébrales corticaux et sous-corticaux de résoudre précisément et spatialement. L’utilisation d’un appareil stéréotaxique permet une identification claire d’une structure de surface de référence (bregma) afin de repérer systématiquement la région d’intérêt, quelles que soient les différences individuelles en taille de porcelet et l’anatomie. Visualisation claire des sutures facilite cohérente placement régional de l’Ame avec précision dans l’ordre du micromètre (Figure 4). Obtenir l’accès à la surface corticale du cerveau est très peu traumatisante avec saignement négligeable, veiller à ce que toute dynamique de glutamate in vivo ne résultent pas insulte systémique ou locale non intentionnel (Figure 5). La MEA personnalisée, rigide est ensuite alignée perpendiculairement au plan frontal du cochon de lait (Figure 6). Défaut d’aligner correctement la MEA avant l’insertion peut empêcher exacte inscription spatiale de la région ciblée, notamment pour les régions sous-corticales.
En temps réel en vivo glutamate Mensurations ont été prises dans l’hippocampe des porcelets anciennes 3-4 jours (n = 4) sous anesthésie sévoflurane de 2,5 à 3 % (environ 1 MAC). Ampérométrie Mensurations ont été enregistrées à 4Hz et converties en concentration à l’aide d’une régression linéaire basée sur les paramètres d’étalonnage (Figure 8groupe A). Pour chaque point dans le temps, les signaux des deux sites sensibles au glutamate étaient en moyenne avant de soustraire le signal de sentinelles en moyenne pour obtenir un signal de glutamate a été corrigé. Ces mesures en continu ont été lissées en appliquant une moyenne mobile pour mieux visualiser la tendance globale au fil du temps (Figure 8Panel B). La concentration de glutamate basale moyenne a été calculée à 4,61 ± 0,02 µM et est demeurée relativement stable au cours de l’exposition anesthésique. L’activité transitoire glutamatergique a été identifiée chez un animal en analysant les crêtes du signal qui n’étaient pas corrélées avec le signal de la sentinelle (R2 < 0,5) et a dépassé un ratio signal-bruit / 3 (Figure 9groupe A). Un total de 116 pics transitoires ont été détectés sur une période de 3,5 h (Figure 10groupe A). L’amplitude des pics transitoires qui en résulte a été généralement observé pour être comprise entre 1 µM (Figure 10groupe B). Afin de quantifier la durée de chaque transitoire, le temps (t80) requis pour chaque valeur de crête à la pourriture 80 % a été obtenu (Figure 9groupe B). La moyenne t80 de tous glutamate transitoires au cours de la période d’enregistrement de 3,5 h était 4,68 ± 0,82 s (Figure 10groupe C). Ces résultats démontrent qu’il est possible de mesurer avec précision les deux activité de neurotransmetteur transitoire et prolongée dans une région sous-corticales du cerveau anesthésié porcelet.

Figure 1 : comparaison visuelle des types de tableaux de microélectrodes SG-2. SG-2 tableaux contiennent deux sites sensibles au glutamate et deux sentinelles glutamate insensible (150 µm x 20 µm par site). ()A) un arbre flexible microélectrodes apparaît sur la gauche. L’arbre rigide microélectrodes a été conçu pour une utilisation en porcelets et permis l’implantation plus profonde chez les grands animaux. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
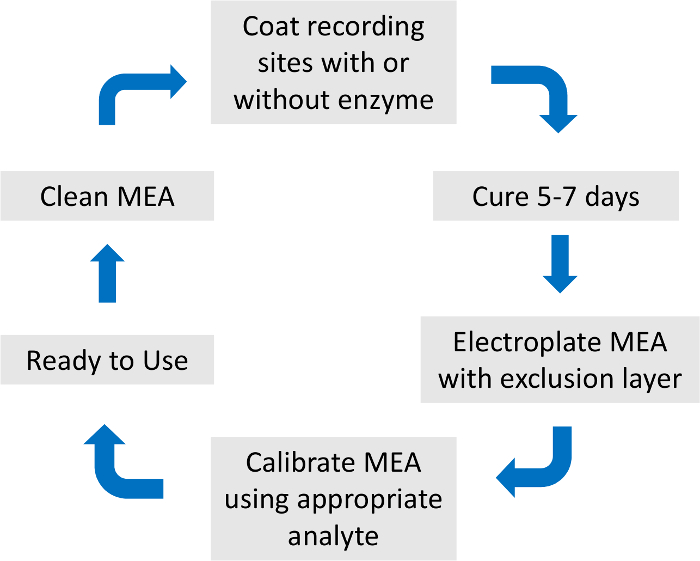
Figure 2 : vue d’ensemble du processus de préparation et d’étalonnage tableau microélectrode. La préparation de MEA totale et l’étalonnage durent environ une semaine. Le revêtement enzyme, couche d’exclusion et d’étalonnage analytes sont spécifiques à la neurotransmetteur d’intérêt. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
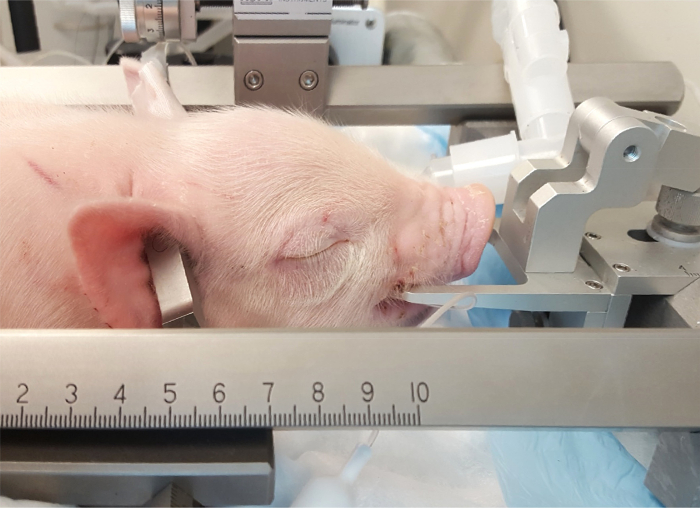
Figure 3 : Placement des porcelets dans l’appareil stéréotaxique. La bouche de porcelet est placée sur la barre de la bouche directement derrière les canines. Les barres d’oreilles pénétrants sont insérées dans les conduits auditifs pour garantir l’extrémité postérieure du crâne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
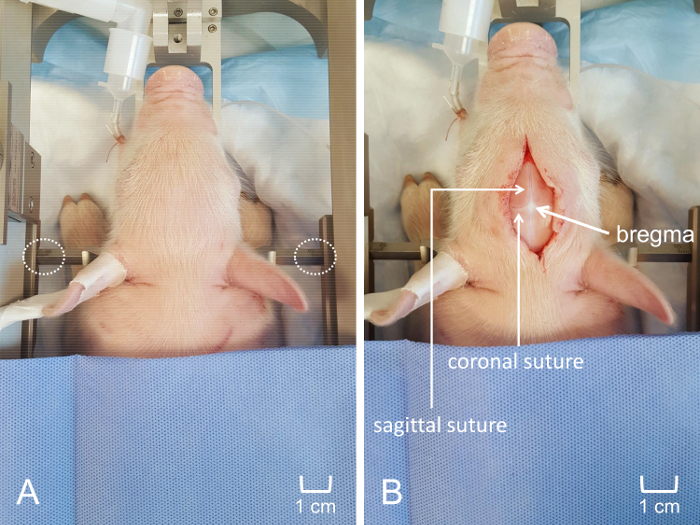
Figure 4 : Placement du porcelet dans l’appareil stéréotaxique pour craniotomie. (A) le porcelet de dessus est solidement fixé dans le cadre stéréotaxique personnalisé, assurer la mise en place cohérente de l’Ame. Placement équidistant des barres d’oreilles pénétrante est visible. (B) incision antéro-postérieur de la ligne médiane le long du cuir chevelu. Notation du crâne a été évitée pour visualiser des sutures coronales et sagittales et optimiser la visualisation du bregma. La barre d’échelle est indiquée pour montrer l’importance relative de l’incision et l’emplacement de la fenêtre de craniotomie. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
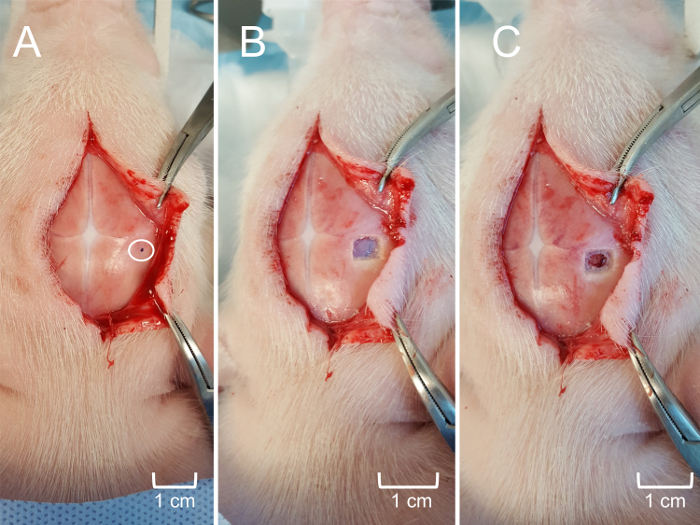
Figure 5 : craniotomie pour l’accès à l’hippocampe. (A), le cuir chevelu encore reflétée d’exposer l’emplacement approximatif de l’insertion de la MEA selon coordonnées stéréotaxiques. La zone encerclée est marquée (point noir) pour guider la craniotomie. Poitrine (B) la fenêtre de la craniotomie (0,25 cm2) avec un crâne pour exposer la dure-mère sous-jacente. (C) les méninges soigneusement retirés pour exposer le cortex cérébral superficiel sans traumatisme tissulaire. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
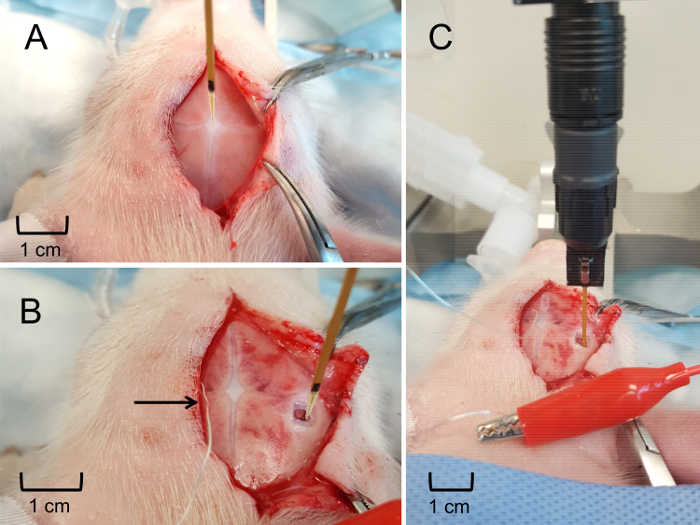
Figure 6 : MEA de positionnement et de l’insertion dans l’hippocampe. (A) mise en place de MEA au bregma pour déterminer un emplacement stéréotaxique relatif de l’hippocampe. (B) placement stéréotaxiques de l’AEM à la surface du cerveau, pour déterminer la profondeur d’insertion hippocampe. Électrode de Pseudo-référence argent placé solidement sous le cuir chevelu (indiqué par la flèche). (C), la MEA a inséré à la profondeur appropriée afin d’obtenir en temps réel, en vivo Mensurations de glutamate extracellulaire dans l’hippocampe. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
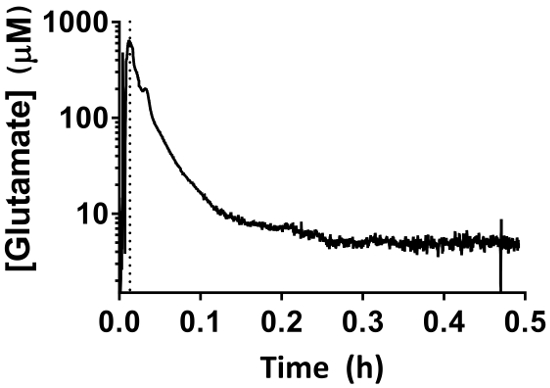
Figure 7 : comportement MEA pendant la période de référentiels du projet 30 min. L’augmentation rapide initiale correspond à la descente de l’Ame dans l’hippocampe en utilisant le micromanipulateur. La période de référence commence une fois que la MEA a atteint la profondeur appropriée (en pointillé). Les mesures de glutamate extracellulaire diminuent sur une période de 30 min et ne doivent pas être interprétées comme lectures physiologiques. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
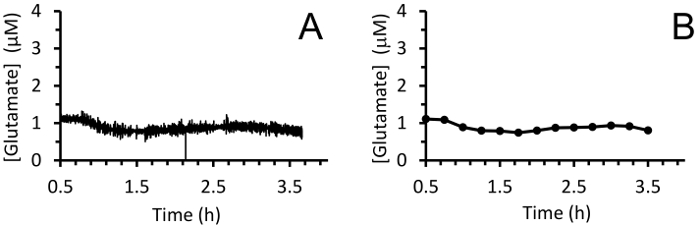
Figure 8 : mesures en temps réel de glutamate extracellulaire dans le hippocampe de porcs nouveau-nés sous anesthésie sévoflurane. (A) le déplacement moyenne de la concentration de glutamate dans l’hippocampe de plusieurs porcs nouveau-nés sous anesthésie sévoflurane (à l’aide de 10 points de données). On a mesuré à 4Hz pendant 3 h après une période de référentiels du projet bref 30 min. Lissage (B) des mesures de glutamate à l’aide d’une moyenne mobile de 100 points toutes les 15 min pour mieux visualiser la tendance. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
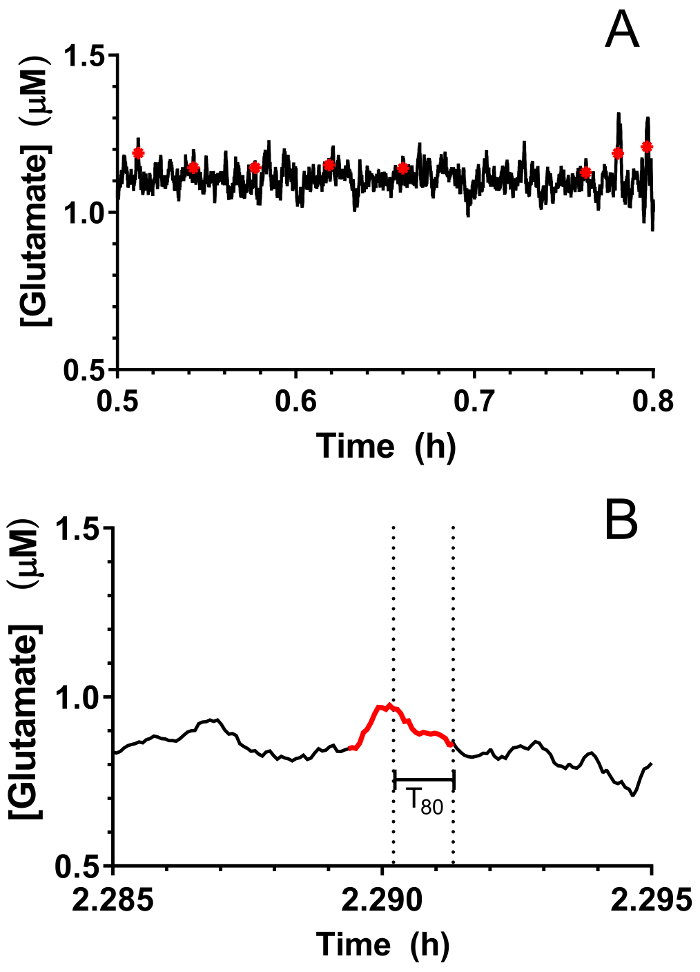
Figure 9 : Identification de l’activité de la transitoire de glutamate dans l’hippocampe de porcs nouveau-nés sous anesthésie sévoflurane. (A) des pics de glutamate transitoire (en rouge) sont indiqués sur le suivi en temps réel de glutamate. Des pics ont été considérées significatives lorsque le rapport signal sur bruit dépassé 3 et leur signal n’était pas corrélée avec le signal de la sentinelle (R2 < 0,5). (B) un pic transitoire représentatif indiquée dans la Figure 9le groupe A. Les lignes pointillées indiquent la durée totale nécessaire pour le pic à 80 % de désintégration. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
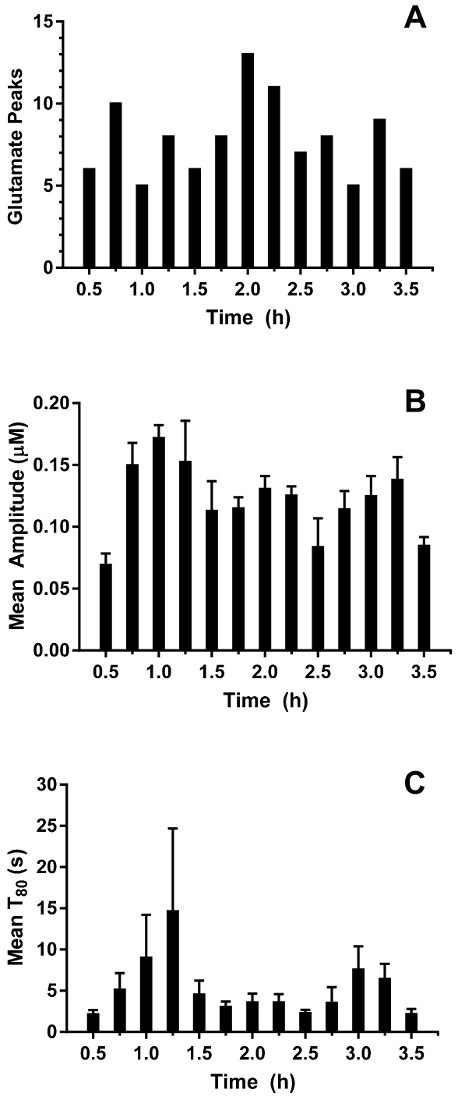
Figure 10 : caractérisation des transitoires de glutamate dans l’hippocampe de porcs nouveau-nés sous anesthésie sévoflurane. (A) A nombre de pics de glutamate transitoire dans des bacs de 15 min. Des pics ont été considérées significatives lorsque le rapport signal sur bruit dépassé 3 et leur signal n’était pas corrélée avec le signal de la sentinelle (R2 < 0,5). (B), l’amplitude du glutamate transitoire pics. Barres d’erreur indiquent l’erreur-type de la moyenne. (C) T veux dire80 des pics transitoires de glutamate. Barres d’erreur indiquent l’erreur-type de la moyenne. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Dès le début de l’expérience, l’homéostasie physiologique du porcelet doit être maintenu tel que décrit dans publication préalable21 de ce laboratoire. Une surveillance minimale doit inclure un oxymètre de pouls, électrocardiographie, Capnographie, la pression artérielle non invasive et la température. Les enquêteurs formés sont nécessaires afin que les perturbations physiologiques (p. ex., hypo/hyperthermie, hypoxie, hypotension, arythmies) peuvent être corrigées de façon appropriée.
Avant induction, in vitro les étalonnages de la MEA sont effectués pour établir la fonctionnalité et la sélectivité de l’Ame dans des conditions connues. L’étalonnage et l’électrodéposition d’ame est essentiel pour une utilisation efficace de la technologie. Il y a beaucoup d’erreurs potentielles qui peut survenir lors de l’étalonnage. Étalonnage peut identifier ces problèmes ainsi que placage incorrecte, ce qui conduit à la mauvaise réponse interferent. Un compte rendu plus détaillé sous forme de tableau d’erreurs qui peuvent survenir à la suite de la MEA a été compilé, le long avec des causes notables et les solutions suggérées, qui devrait s’avérer un instrument utile pour susceptible de dépannage (tableau 1). Il est important de noter qu’avant d’étalonnage et de placage, l’électrode de référence de verre doit être vérifiée pour la présence de bulles d’air ou de décoloration blanche, soit auront un impact négatif fonction MEA et précision d’enregistrement.
| Symptôme | Cause | Action corrective |
| Pas de Signal | Électrode non connecté | Brancher correctement les électrodes au préamplificateur et préamplificateur ampérométrie rapide système. |
| Aucun pouvoir au système rapide ampérométrie | Mettre en marche l’interrupteur situé sur l’arrière du système FAST | |
| Signal bruit | Électrode contaminé par le sang | Irriguer en permanence la surface du cerveau pendant l’insertion de l’électrode |
| Rincer l’électrode à dH2O | ||
| Revêtement de l’enzyme est lâche | Nettoyer et recouvrir l’électrode | |
| Électrode de référence n’était pas insérée ou enduit | Manteau et placer l’électrode de référence plus loin sous le cuir chevelu | |
| Électrode a détecter les mouvements de la surface du cerveau | Survient généralement chez les structures superficielles. Insérer l’électrode plus profonde (1 mm à la fois) si possible | |
| Transport d’animaux | Animal est insuffisamment sécurisé | Déplacer l’animal dans le sens postérieur à earbars mieux sécurisée sur le crâne. Si nécessaire, élever le torse à permettant un meilleur alignement du corps. |
| Animal est mal anesthésié | Vérifier l’intégrité de l’équipement anesthésique. Titrer l’anesthésique à une dose efficace et d’administrer une dose intramusculaire de rocuronium (5 mg/kg) | |
| Placement des électrodes inexactes | Électrode n’est pas correctement aligné | Réajuster l’électrode tout en maintenant une connexion correcte pour le préamplificateur. |
| Coordonnées stéréotaxiques sont inexactes | Veiller à ce que l’atlas de porcelet référencé n’utilise pas un autre point de référence ou de plan d’alignement. | |
| Veillez à ne pas occulter les points de suture en marquant le crâne. |
Tableau 1 : Instructions de dépannage MEA utilisent chez les porcelets. Les causes possibles et les mesures correctives afin d’aider à l’optimisation et le dépannage.
Un atlas stéréotaxique pour le porcelet est utilisé pour déterminer les coordonnées stéréotaxiques de la zone d’intérêt en ce qui concerne un point connu comme bregma18. Barres d’oreilles doivent être correctement fixés pour faire en sorte que le crâne soit complètement immobilisée et de niveau. Il faut au cours de l’incision médiane du cuir chevelu pour éviter de marquer le crâne car cela peut affecter la visualisation des lignes de suture. La fenêtre de craniotomie doit être assez grande pour accueillir la MEA.
Ce protocole présente un certain nombre de défis techniques qui nécessitent une suite d’exploitation bien garnie et une enquêteur/équipe habile dans les aspects chirurgicaux et anesthésiques du protocole. Le modèle présente en outre contraintes financières que le modèle de cochon de lait est plus cher que le modèle de rongeur ; Toutefois, il est nettement moins coûteuse que l’utilisation de primates non humains, qui peut coûter des milliers de dollars. L’utilisation de la technologie de la MEA présente ses propres défis, comme la procédure de revêtement et les électrodes d’électrodéposition manuellement nécessitent un chercheur qualifié ou un adjoint pour assurer la sélectivité suffisante et fonctionnement fiable. Des microélectrodes eux-mêmes sont fragiles, car elles sont en céramique et donc facilement endommagés si mise en garde adéquate n’est pas respecté. Des microélectrodes sont sujette à des interférences d’autres appareils électriques, qui peuvent créer des bruits dans les enregistrements et du sang sur le site du dispositif, qui peut bloquer les sites d’enregistrement. Le besoin d’équipement spécialisé présente une charge supplémentaire, comme un cadre stéréotaxique chirurgical doit être personnalisé conçu pour immobiliser le crâne de porcelet au cours de l’implantation. Le cadre stéréotaxique, oxydase de glutamate et les électrodes elles-mêmes sont tout coûteux. En outre, l’absence d’un atlas de porcelet stéréotaxiques de durant la dernière décennie pose des limitations techniques qui nécessitent une expertise particulière pour déterminer l’emplacement précis des structures profondes du cerveau de porcelet. Développement d’un nouvel atlas stéréotaxique, éventuellement à l’aide d’imagerie par résonance magnétique, renforcerait considérablement la possibilité d’utiliser cette technologie chez les porcelets.
Le porcelet est un modèle cliniquement pertinent pour l’étude de l’AIN en grande partie en raison des parallèles qui existent entre cette espèce et le nouveau-né humain, comme les deux possèdent le développement et la structure du cerveau similaire. Contrairement aux modèles plus couramment utilisés tels que les souris ou les rats, le cochon de lait a une plus grande similarité de CNS à l’homme, qui se prête à la traduisibilité des résultats du modèle. Le modèle de porcelet est en outre moins cher et implique une manipulation moins compliquée que le modèle primate non humain. Le modèle de cochon de lait est destiné à examiner le processus par lequel l’anesthésie pourrait induire la neurotoxicité développementale, évaluer sa contribution à l’atteinte neurologique et combattre la question des dommages causés par les variables confondantes. Par exemple, l’hypoxie peut être mal interprétée pour les dommages causés par les anesthésiques car elle a des effets globaux sur le cerveau. Le cochon de lait est utilisé aux mêmes conditions que celles utilisées en médecine humaine pour s’assurer la fidélité des résultats chirurgicale et anesthésiques.
L’utilisation de base de céramique MEA technologie élimine plusieurs des inconvénients associés à la technique contemporaine de la microdialyse. Microdialyse a limité la résolution temporelle et spatiale par rapport aux méthodes ampérométrique tels que la MEA, qui permet d’enregistrer en continu des événements de glutamate dans plusieurs, régions microscopiques à jusqu'à 10 Hz23. Ce taux d’échantillonnage rapide élimine le facteur de confusion de diffusion de neurotransmetteur localisée qui est inhérente aux méthodes d’échantillonnage lente comme microdialyse24. En outre, la MEA est une méthode moins invasive qu’une sonde de microdialyse, qui peut causer une gliose importante lors de l’insertion et peut modifier l’activité neurotransmetteur à l’insertion site22.
Utilisant une gamme de modèles mammifères, techniques de mesure et des régions du cerveau, des études antérieures ont démontré glutamate basale des niveaux comparables à ceux trouvés à l’aide de cette technique. Ceci suggère que MEA technologie, lorsque adaptée au modèle porcelet, fournit des enregistrements valides en vivo concentration de glutamate (tableau 2).
| Auteur (année) | Technique d’enregistrement | Modèle animal | Age | Région (s) de cerveau | La Concentration basale de Glutamate (µM) moyenne |
| Hascup et coll. (2008)23 | MEA (base d’enzymes) | Rongeur | 20 - 24 semaines | Cortex préfrontal, Striatum | 3.3 ± 1,0 ; 5,0 ± 1.2 |
| Hascup et coll. (2010)25 | MEA (base d’enzymes) | Rongeur | 3 - 6 mois | Hippocampe | 4.7-10.4 |
| Rutherford et al., (2007)9 | MEA (base d’enzymes) | Rongeur | 3 - 6 mois | Cortex préfrontal, Striatum | 44,9 ± 4,7 ; 7,3 ± 0,9 |
| Miele et coll. (1996)26 | Microdialyse (base d’enzymes) | Rongeur | - | Striatum | 3,6 ± 0,5 |
| Jour et coll. (2006)27 | MEA (base d’enzymes) | Rongeur | 3 - 6 mois | Cortex frontal, Striatum | 1,6 ± 0,3 ; 1,4 ± 0,2 |
| Quintero et coll. (2007)28 | MEA (base d’enzymes) | Non - Human primates | 5,3 à 5,5 ans | Cortex prémoteur, Cortex moteur | 3,8 ± 1,7 ; 3,7 ± 0,9 |
| Stephens et al. (2010) 29 | MEA [Spencer-Gerhardt-2 (SG-2)] | Non - Human primates | 11 - 21 ans | Putamen | 8.53 |
| Kodama et al., (2002)30 | Microdialyse (base d’enzymes) | Non - Human primates | - | Cortex préfrontal | 1.29-2.21 |
| Galvan et coll. (2003)31 | Microdialyse (base d’enzymes) | Non - Human primates | Juvénile | Striatum | 28,74 ± 2,73 |
| Au cours et Spencer (1993)32 | Microdialyse (base d’enzymes) | Humaine | 18 - 35 ans | Hippocampe | 20.3 ± 6,6 |
| Reinstrup et coll. (2000)33 | Microdialyse (base d’enzymes) | Humaine | - | Cortex frontal | ± 16 16 |
| Cavus et coll. (2005)34 | Microdialyse (base d’enzymes) | Humaine | 15 - 52 ans | Néocortex | 2,6 ± 0,3 |
Le tableau 2. Comparaison de glutamate extracellulaire basale levelsacross divers modèles animaux. Un examen sélectionné des études établissant des niveaux de glutamate extracellulaire normale chez les animaux sains d’éveillé et anesthésiés à l’aide de la microdialyse ou microélectrodes.
L’utilisation des technologies de la MEA à surveiller en vivo la concentration de glutamate dans le modèle de porcelet permet l’évaluation future de l’anesthésie après résultats neurologiques porcelet. Des expériences de survie ont été prévues, qui seront en outre une compréhension de l’impact à long terme de l’anesthésie sur le neurocognitive bien-être des nouveau-nés humains. Permettront à des expériences de survie pour les essais et la surveillance du glutamate comportementale change longtemps après l’exposition de l’anesthésie. Il est également fréquent pour les enfants à subir une anesthésie dans des conditions où ils peuvent rencontrer un stress physiologique sous la forme d’une intervention chirurgicale. Futures études sur l’influence de la chirurgie en termes de lésion neurologique et augmentation en neurotoxicité permettrait plus précis du milieu clinique commun de modélisation pour les enfants. L’utilisation de modèles animaux remplaçant est également possible, comme c’est l’étude de ces différents modèles par le biais de l’implantation chronique, ce qui nous permet de suivre les changements comportementaux associés à la neurotoxicité. Technologie MEA elle-même est polyvalente et donc future étude ne doit pas être limitée à l’analyse des niveaux de glutamate (p. ex., GABA, choline, lysine, etc. pourraient être analysées).
Déclarations de divulgation
Greg Gerhardt est le principal propriétaire de Quanteon LLC. Jorge Quintero et Jason Burmeister ont servi comme conseillers à Quanteon LLC.
Remerciements
Les auteurs tiennent à souligner les contributions du Centre Université du Kentucky pour la microélectrode technologie (CenMeT) et la Ohio State University laboratoire Animal Resource Centre (ULAR).
matériels
| Name | Company | Catalog Number | Comments |
| Advance Liqui-Wean Pig Milk Replacer | PBS Animal Health | 292-13 | |
| Piglet Anesthesia Face-Cone Mask | VetEquip | 921428 | |
| Integra SL Anesthesia Workstation | DRE Veterinary | 2350 | This anesthesia workstation is chosen to best mimic the clinical monitoring experienced by pediatric patients in the operating room. Any anesthesia machine can be used as long as it allows for sufficient physiologic monitoring and intervention. |
| Sevoflurane | Ultane | 0074-4456-04 | |
| Rocuronium Bromide Injection | Hospira | 0409-9558-05 | |
| Medfusion 4000 IV Infusion | Smiths Medical | ||
| Model 1530 Heavy-Duty Research Model Stereotax | Kopf | custom made | |
| Model 1541 Piglet Adaptor | Kopf | custom made | |
| Infrared Spot Lamp | Amazon | B000HHQ94C | |
| Bair Hugger Torso Blanket | 3M | 540 | |
| Bair Hugger | 3M | 750 | |
| Sterile Alcohol Prep Pad | Fisherbrand | 22-363-750 | |
| Carbon Steel Rib-Back Surgical Blade | Bard-Parker | #10 | |
| Scalpel Handel | Havel's | HAN-G4 | |
| Surgical Scissors | World Precision Instruments | 504615 | |
| Mosquito Forceps | Sklar Surgical Instruments | 17-1225 | |
| Gauze Pads | Fisherbrand | 22-246-069 | |
| Adson Tissue Forceps | Teleflex | 181223 | |
| Dremel 111 Engraving Cutter | Amazon | Dremel 111 | |
| Microelectrode Array | Center for Microelectrdoe Technology, University of Kentucky | S2 4Ch MEA; custom made | |
| Headstage | Quanteon | 2pA/mV | |
| Wire, silver, PFA, .008" Bare, .0110" coated | A-M Systems | 786500 | |
| Fine Micromanipulator | Narishige Scientific Instrument Lab | MO-8 |
Références
- Hall, M. J., DeFrances, C. J., Williams, S. N., Golosinskiy, A., Schwartzman, A. National hospital discharge Survey: 2007 summary. Natl Health Stat Report. (29), 1-24 (2010).
- Ikonomidou, C., et al. Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain. Science. 283 (5398), 70-74 (1999).
- Mattson, M. P. Glutamate and neurotrophic factors in neuronal plasticity and disease. Ann N Y Acad Sci. 1144 (1), 97-112 (2008).
- Atlante, A., et al. Glutamate neurotoxicity, oxidative stress and mitochondria. FEBS Lett. 497 (1), 1-5 (2001).
- Kavitha, J., Durga, P., Ramachandran, G. Inhalational agents in anesthesia induced developmental neurotoxicity - Recent advances. Trends in Anaesthesia and Critical Care. 11 (1), 14-18 (2016).
- Zanghi, C. N., Jevtovic-Todorovic, V. A holistic approach to anesthesia-induced neurotoxicity and its implications for future mechanistic studies. Neurotoxicol Teratol. 60 (2), 24-32 (2017).
- Fan, X., et al. In situ real-time monitoring of glutamate and electrophysiology from cortex to hippocampus in mice based on a microelectrode array. Sensors (Basel). 17 (1), 1-8 (2016).
- Hinzman, J. M., et al. Diffuse brain injury elevates tonic glutamate levels and potassium-evoked glutamate release in discrete brain regions at two days post-injury: an enzyme-based microelectrode array study. J Neurotrauma. 27 (5), 889-899 (2010).
- Rutherford, E. C., Pomerleau, F., Huettl, P., Strömberg, I., Gerhardt, G. A. Chronic second-by-second measures of L-glutamate in the central nervous system of freely moving rats. J Neurochem. 102 (3), 712-722 (2007).
- Benveniste, H. Brain microdialysis. J Neurochem. 52 (6), 1667-1679 (1989).
- Kohno, T., et al. An improved method for the detection of changes in brain extracellular glutamate levels. J Neurosci Methods. 81 (1-2), 199-205 (1998).
- Hascup, K. N., Hascup, E. R. Electrochemical techniques for subsecond neurotransmitter detection in live rodents. Comp Med. 64 (4), 249-255 (2014).
- Rooij, N. F., Koudelka-Hep, M., Frey, O. Biosensor microprobe array for in vivo monitoring of neurotransmitters. EPFL. , (2010).
- Fan, X. T., et al. Cortical glutamate levels decrease in a non-human primate model of dopamine deficiency. Brain Res. 1552, 34-40 (2014).
- Hunsberger, H. C., et al. Using enzyme-based biosensors to measure tonic and phasic glutamate in Alzheimer's mouse models. J Vis Exp. (123), (2017).
- Hill, A. J., Jones, N. A., Williams, C. M., Stephens, G. J., Whalley, B. J. Development of multi-electrode array screening for anticonvulsants in acute rat brain slices. J Neurosci Methods. 185 (2), 246-256 (2010).
- Defranchi, E., et al. Feasibility assessment of micro-electrode chip assay as a method of detecting neurotoxicity in vitro. Front Neuroeng. 4 (6), (2011).
- Whitaker, E. E., et al. Use of a piglet model for the study of anesthetic-induced developmental neurotoxicity (AIDN): A translational neuroscience approach. J Vis Exp. (124), (2017).
- Kilkenny, C., et al. Animal research: reporting in vivo experiments: the ARRIVE guidelines. Br J Pharmacol. 160 (7), 1577-1579 (2010).
- Salinas-Zeballos, M., Ceballos, G., Gootman, P. . A stereotaxic atlas of the developing swine (Sus scrofa) forebrain. , 887-906 (1986).
- Whitaker, E. E., et al. A novel, clinically relevant use of a piglet model to study the effects of anesthetics on the developing brain. Clin Transl Med. 5 (1), (2016).
- Hascup, E. R., et al. Histological studies of the effects of chronic implantation of ceramic-based microelectrode arrays and microdialysis probes in rat prefrontal cortex. Brain Res. , 12-20 (2009).
- Hascup, K. N., Hascup, E. R., Pomerleau, F., Huettl, P., Gerhardt, G. A. Second-by-second measures of L-Glutamate and other neurotransmitters using enzyme-based microelectrode arrays. The Journal of pharmacology and experimental therapeutics. 324 (2), 725-731 (2008).
- Rice, M. E., Cragg, S. J. Dopamine spillover after quantal release: rethinking dopamine transmission in the nigrostriatal pathway. Brain Res Rev. 58 (2), 303-313 (2008).
- Hascup, E. R., et al. Rapid microelectrode measurements and the origin and regulation of extracellular glutamate in rat prefrontal cortex. Journal of Neurochemistry. 115 (6), 1608-1620 (2010).
- Miele, M., Boutelle, M. G., Fillenz, M. The source of physiologically stimulated glutamate efflux from the striatum of conscious rats. J Physiol. 497 (Pt 3), 745-751 (1996).
- Day, B. K., Pomerleau, F., Burmeister, J. J., Huettl, P., Gerhardt, G. A. Microelectrode array studies of basal and potassium-evoked release of L-glutamate in the anesthetized rat brain. J Neurochem. 96 (6), 1626-1635 (2006).
- Quintero, J. E., et al. Amperometric measures of age-related changes in glutamate regulation in the cortex of rhesus monkeys. Exp Neurol. 208 (2), 238-246 (2007).
- Stephens, M. L., Pomerleau, F., Huettl, P., Gerhardt, G. A., Zhang, Z. Real-time glutamate measurements in the putamen of awake rhesus monkeys using an enzyme-based human microelectrode array prototype. J Neurosci Methods. 185 (2), 264-272 (2010).
- Kodama, T., Hikosaka, K., Watanabe, M. Differential changes in glutamate concentration in the primate prefrontal cortex during spatial delayed alternation and sensory-guided tasks. Exp Brain Res. 145 (2), 133-141 (2002).
- Galvan, A., Smith, Y., Wichmann, T. Continuous monitoring of intracerebral glutamate levels in awake monkeys using microdialysis and enzyme fluorometric detection. J Neurosci Methods. 126 (2), 175-185 (2003).
- During, M. J., Spencer, D. D. Extracellular hippocampal glutamate and spontaneous seizure in the conscious human brain. Lancet. 341 (8861), 1607-1610 (1993).
- Reinstrup, P., et al. Intracerebral microdialysis in clinical practice: baseline values for chemical markers during wakefulness, anesthesia, and neurosurgery. Neurosurgery. 47 (3), 701-710 (2000).
- Cavus, I., et al. Extracellular metabolites in the cortex and hippocampus of epileptic patients. Ann Neurol. 57 (2), 226-235 (2005).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon