Method Article
Adaptación de la tecnología de matriz de microelectrodos para el estudio de la neurotoxicidad inducida por la anestesia en el cerebro intacto cochinillo
* Estos autores han contribuido por igual
En este artículo
Resumen
Este estudio explora el uso nuevo de base enzimática microelectrodo (MEA) tecnología para monitorear en vivo la actividad de neurotransmisores en lechones. La hipótesis fue que dysregulation de glutamato contribuye al mecanismo de la neurotoxicidad del anestésico. Aquí, presentamos un protocolo para adaptar tecnología MEA para estudiar el mecanismo de la neurotoxicidad inducida por la anestesia.
Resumen
Cada año, millones de niños se someten a anestesia para una multitud de procedimientos. Sin embargo, estudios en animales y humanos han cuestionado la seguridad de la anestesia en los niños, implicando anestésicos como potencialmente tóxicos para el cerebro en desarrollo. Hasta la fecha, ningún estudio con éxito ha aclarado los mecanismos que la anestesia puede ser neurotóxico. Estudios en animales permiten investigación de tales mecanismos, y lechones neonatales representan un excelente modelo para el estudio de estos efectos debido a sus semejanzas llamativas del desarrollo del cerebro humano.
Este protocolo adapta el uso de tecnología basados en la enzima microelectrodo (MEA) como una forma novedosa para el estudio de los mecanismos de la neurotoxicidad inducida por la anestesia (AIN). MEAs permiten el monitoreo en tiempo real de la actividad de neurotransmisores en vivo y ofrecen excepcional resolución temporal y espacial. Se presume que neurotoxicidad anestésica es causada en parte por glutamato dysregulation y MEAs ofrecen un método para medir el glutamato. La aplicación novedosa de tecnología MEA en un modelo de lechón presenta una oportunidad única para el estudio de AIN.
Introducción
Cada año, millones de niños se someten a anestesia para procedimientos invasivos y no invasivos en los Estados Unidos1. Durante años, proveedores de anestesia han tranquilizado a los padres la seguridad de los anestésicos, incluso en niños pequeños y recién nacidos. Sin embargo, en 1999 se encontró que transitorio bloqueo del subtipo N-metil-D-Aspartato (NMDA) receptores de glutamato durante la vida temprana puede causar apoptosis neuronal generalizada en ratas2. Recientemente, la FDA publicó una comunicación de seguridad de medicamentos que se requiere las etiquetas de los fármacos anestésicos para incluir una advertencia acerca de los anestésicos generales y su potencial efecto negativo sobre el cerebro en desarrollo de los niños menores de 3 años de edad (alimentos de Estados Unidos y Drug Administration, 2017). Sin embargo, todavía hay una necesidad de dilucidar los mecanismos posibles y potenciales medidas neuroprotectoras.
Actividad normal de los neurotransmisores como glutamato y gamma-amino butírico (GABA) son cruciales para el desarrollo neurológico normal que ocurra. Aunque la mayoría de las vías implicadas en AIN son todavía elusiva, sistemas de neurotransmisores están muy probables que estar involucrados ya que los anestésicos se saben que modulan estas vías para producir inconsciencia. En particular, el neurotransmisor excitatorio glutamato provoca excitotoxicidad cuando su actividad se altera. Este neurotransmisor participa normalmente en neurogénesis, plasticidad neuronal, crecimiento neuronal y sináptico y un número de otras funciones del cerebro muy importante. Sin embargo, puede causar activación prolongada de los receptores de glutamato excitotoxicidad y apoptosis neuronal, particularmente bajo condiciones de estrés como cirugía, privación de oxígeno y de la disponibilidad de energía3. Unión de glutamato a la NMDA receptor ha demostrado causar Na+ y Cl− afluencia. La posterior despolarización se piensa para conducir a la apertura de canal de Ca2 + y liberación de Ca intracelular2 + almacena4. Esta probable disfunción conduce a una cascada de derangements metabólicos que eventualmente disminuir proliferación neuronal, aumentar la inflamación y conducir a la muerte neuronal. A pesar de estas hipótesis, los verdaderos mecanismos de AIN siguen claro5. Debido a su papel en la apoptosis, dysregulation de glutamato representa una vía nueva que puede contribuir al mecanismo de apoptosis neuronal previamente documentada, una característica de la AIN.
Uno de los obstáculos en el estudio de procesos neuronales es su alta complejidad, especialmente en el entorno de desarrollo neuronal. Los primeros meses de vida son el período de máxima vulnerabilidad a las lesiones, durante el cual la mayoría de las etapas importantes del desarrollo neuronal como apoptosis fisiológica (poda neuronal), gliogenesis y sinaptogénesis y mielinización toman lugar6 . Dada la naturaleza compleja de la comunicación neuronal y la dificultad de estudiar estos procesos sin alterar la función normal de la CNS, las nuevas tecnologías se han desarrollado que tienen como objetivo la en vivo detección y cuantificación de elementos importantes de la comunicación neuronal.
Enzima-ligado MEA tecnología fue utilizada en este estudio como una forma novedosa para el estudio de los mecanismos de la AIN en un modelo de cochinillo clínicamente relevantes. Esta tecnología puede utilizarse para estudiar complejo en vivo procesos electroquímicos del cerebro, incluyendo glutamato dysregulation. Los sitios de platino de 4 canales incorporado de la AMMA (2 sitios sensibles a glutamato y sitios centinela 2) permiten la referencia, que contribuye a la precisión de detección. Además, una capa de exclusión se aplica a los electrodos, que confiere selectividad mediante la prevención de otras moléculas que interfieren detectaron7. Por otra parte, el diseño de bajo perfil del MEA permite trauma mínima del tejido respecto a tecnologías anteriores. Esta misma característica confiere MEAs una resolución espacial más alta, que facilita el estudio de regiones microscópicas en el cerebro. Por ejemplo, regiones discretas del hipocampo (giro dentado, CA1, CA2) pueden ser específicamente estudiado8. Detalles específicos sobre la funcionalidad de los AMUMA han sido previamente descritos9.
En comparación con la electroquímica de la MEA, microdialysis incorpora una membrana situada entre la solución de interés y una solución de composición similar, que permiten la detección de líquido extracelular cambia10. Aunque microdiálisis es uno de los pilares de la neuroquímica y ha sido utilizada para la detección de los neurotransmisores, tiene la desventaja del tiempo baja resolución, tardía detección de cambio de glutamato y tejido significativo trauma11.
MEAs pueden detectar indirectamente neurotransmisores como el glutamato, la acetilcolina y la colina, utilizando enzimas oxidasa apropiado que producen electroactivos reportero moléculas tales como H2O2 o O212,13 .
Tecnología MEA ha sido ampliamente utilizada en ratas y primates no humanos para el estudio de la neurotoxicidad en el contexto de procesos fisiopatológicos distintos AIN7,14. Entre algunos de estos procesos fisiopatológicos, MEA tecnología ha sido utilizada para el estudio de la enfermedad de Alzheimer, epilepsia, traumatismo craneoencefálico y el efecto de compuestos farmacológicos en la comunicación sináptica8,15 , 16 , 17. aunque MEAs se han utilizado para estudiar estas patologías en ratas y primates no humanos, la alta similitud de desarrollo entre los seres humanos y los cerebros de cochinillo hace la adaptación de la tecnología MEA en lechones de una técnica muy adecuada para el estudio de mecanismos AIN18.
Protocolo
Cerdos (Sus scrofa) se reciben a través de una granja local aprobada por la Universidad de estatal de Ohio (OSU) institucional Animal Care y Comité uso (IACUC). Tras la aprobación del Protocolo, se realizan experimentaciones animales según política IACUC.
1. lechones y manejo de lechones
- Utilizar lechones machos y hembras de una manera sistemática y al azar para eliminar cualquier sexo basado en factores de confusión potenciales según directrices de llegada19.
Nota: Dado que el período de crecimiento cerebral máxima es entre 3-5 días del nacimiento de lechones, experimentación se realiza únicamente con lechones de 3-5 días de edad. - Garantizar lechones llegan en el vivero al menos 24 h antes de experimentación para permitir la aclimatación al medio ambiente.
Nota: El personal veterinario proporciona cuidado rutinario de los animales. Los lechones se mantienen en jaulas individualmente temperatura permanente y continuamente vigilados y reciban un replacer de leche nutricionalmente completa ad libitum para evitar la hipoglucemia. Los lechones se mantienen también sin reemplazo de la leche (nil por sistema operativo), durante al menos 3 horas antes de la anestesia y están provistos de mantas y juguetes para niveles normales de estimulación. Si es posible, mantener los cochinillos múltiples en la misma jaula para permitir socialización.
2. desarrollo y adaptación de medidas para los estudios de la AIN en un modelo de cochinillo
Nota: Esta tecnología utiliza MEAs base enzimática cubiertos primero con enzima y electrochapados con m-fenilendiamina dihidrocloruro (mPD). Los electrodos fueron personalizados diseñado con un eje rígido de 40 mm y fabricado para su uso en lechones (figura 1).
- Para evitar la redundancia, por favor vea la descripción detallada de MEA preparación y calibrado como describió anteriormente15 (figura 2).
3. anestesia y uso de aparatos estereotáctica personalizados para el cochinillo
- Anestesiar los animales utilizando una estación de trabajo de anestesia con un ventilador apropiado y dispositivos de control y monitor de parámetros fisiológicos como la oximetría de pulso, presión arterial no invasiva, Electrocardiografía y temperatura a lo largo de la totalidad del experimento como describió anteriormente19. Intubar y ventilar los lechones y administre anestesia de sevoflurano a 1 concentración alveolar mínima (MAC) (aproximadamente 2.5-3%) de 3,5 h. asegurarse de que personal del laboratorio capacitado integran actualmente para estos experimentos. La piel que recubre que el área quirúrgico se extrae usando cortauñas eléctricos antes de la preparación de la piel.
Nota: La concentración y la duración del anestésico utilizado permite el experimento simular la duración de la exposición real de la anestesia durante un procedimiento quirúrgico. Además, el sevoflurano es más comúnmente utilizaron anestesia general en la población pediátrica que la investigación que rodea su seguridad de suma importancia. - Antes de la colocación en el bastidor estereotáxicas, iniciar un rocuronio de carga dosis de 2,5 mg/kg y una infusión de 1,5 mg/kg/h para prevenir el movimiento animal y asegurado en el marco.
- Colocar el cochinillo en el marco de específicas de cochinillo estereotáxicas confirmando una adecuada profundidad de la anestesia del dedo del pie-pizca.
- Proporcionar acolchado adecuado marco estereotáxicas colocando el cochinillo en una almohadilla de calentamiento de aire forzado con el acolchado adicional (p. ej., posicionador fluidizado) para prevenir las úlceras por presión.
- Coloque los dientes de la mandíbula superior sobre los dientes de la barra (figura 3).
Nota: La barra del diente debe ser a un nivel suficiente para sostener el cráneo muy firmemente en su lugar. - Fijar y apretar las barras oído penetrante dentro de las orejas, teniendo cuidado para que el cochinillo esté en la posición de la línea media. Posición de las puntas puntiagudas de los laterales tiene en el canal auditivo e insertar el oído bares firmemente bastante para oír el sonido "pop" asociado con la penetración de la membrana timpánica. Firmemente conectar las barras del oído en el cráneo e insertar a igual profundidad a cada lado para evitar el movimiento del cráneo durante el experimento (figura 4Panel A).
Nota: Es de vital importancia mantener caliente el cochinillo (~ 37,8-38,6 ° C) y monitorear la temperatura durante todo el procedimiento para el mantenimiento de la normotermia. Esto puede ser logrado a través de una manta o una lámpara de calor. Asegúrese de colocar la lámpara de calor a una distancia apropiada para evitar la quema de la piel del animal.
- Crear una incisión de línea media 4-6 cm a lo largo del cráneo con precaución para evitar marcar el cráneo con el bisturí. Una vez hecha la incisión, utilizar retracción suave y disección Roma para elevar el cuero cabelludo del cráneo. Frote suavemente el cráneo con una gasa para retirar cualquier tejido conectivo y exponer las líneas de sutura (figura 4Panel B).
Nota: No es necesario mantener la esterilidad durante experimentos de no supervivencia. Sin embargo, se debe mantener la esterilidad durante los experimentos de supervivencia. - Reflejan más el cuero cabelludo, si es necesario, para exponer el área de interés y determinar la ubicación deseada para la craneotomía (figura 5Panel A). Usar un taladro quirúrgico para crear una ventana de craneotomía de aproximadamente 0,25 cm2 (puede ser mayor o menor dependiendo de los objetivos experimentales) que cubre la estructura de interés, con precaución de no para lesionar la duramadre o cerebro subyacente (figura 5 , Panel B). Utilice tijeras quirúrgicas finas para suprimir la duramadre que cubre el tejido cerebral (figura 5Panel C).
- Coloque el electrodo verticalmente como sea posible sobre el bregma asegurando el brazo metálico de la headstage para el instrumental quirúrgico de la stereotax de cochinillo. Bajar el electrodo tanto como sea posible sin tocar la superficie del cráneo. Registrar las coordenadas del vértice (figura 6Panel A).
- Determinar la antero-posterior y medial-lateral coordenadas así como la profundidad de la estructura de interés en relación con el bregma. Determinar las coordenadas estereotáxicas utilizando un atlas estereotáxicas apropiados para la edad y especie. En este caso, usa un atlas estereotáxicas desarrollado específicamente para lechones20.
- Vuelva a colocar el electrodo para que tenga la ubicación antero-posterior y medial-lateral adecuada, asegurando que el microelectrodo y el aparato es perpendicular a la superficie. Coloque el electrodo de referencia pseudo debajo del cuero cabelludo, asegurando un contacto con el animal (figura 6Panel B).
- Lenta y suavemente, bajar el electrodo hasta la profundidad apropiada en el cerebro el brazo estereotáctica. Para el final de 2 mm, utilizar un microdrive hidráulico para conducir el electrodo a la ubicación exacta (figura 6Panel C).
Nota: La colocación de los electrodos debe cubren la ventana de la craneotomía. La profundidad del electrodo varía dependiendo de la estructura cerebral de interés. No es necesario cerrar la incisión sobre la terminación de la recolección de datos en experimentos de supervivencia no.
4. medición del glutamato extracelular bajo anestesia de sevoflurano
- Asegúrese de que el cochinillo está bajo monitorización fisiológica continua a lo largo de la totalidad de este procedimiento. Lechones son anestesiados inhalationally (mediante cono de cara) en preparación para el procedimiento.
- Después de la implantación de la MEA, espere 30 minutos para que el electrodo llegar a línea de fondo para garantizar la obtención de medida correcta para 3 h (figura 7).
- bupivacaína 0.25% (1 mL/kg) se administra por vía subcutánea en el sitio de la cirugía para el tratamiento del dolor postoperatorio. Además, liberación sostenida buprenorfina se administra por vía subcutánea q72h según sea necesario.
5. perfusión y sacrificio
- Realizar la perfusión y procedimientos de recogida de tejido de cerebro como describieron anteriormente21. Para las cirugías sin supervivencia, los animales son sacrificados inmediatamente después de la experimentación mientras que aún bajo anestesia general.
- Tomar brutos cortes transversales del cerebro cochinillo fijo y usar microscopía óptica para visualizar la pista del electrodo como se describió anteriormente22 para permitir la verificación de la colocación de la MEA, asegurando la colocación correcta de la zona de interés.
Resultados
Este estudio de prueba de concepto con enzima cerámica MEA la tecnología basada en un modelo de lechones puede proporcionar un conocimiento excepcional en la dinámica de glutamato que AIN. Este estudio además demuestra que tecnología MEA enzima puede ser adaptada con éxito en el modelo de cochinillo para medir los cambios fisiológicos y asociada a la anestesia en la actividad de neurotransmisores con alta sensibilidad y su altura espacial y temporal resolución. Homeostasis fisiológica se mantuvo a lo largo de nuestros experimentos utilizando estándares y métodos clínicamente relevantes, y ningún lechón exhibió signos de perturbaciones fisiológicas.
Los datos obtenidos indican la capacidad de los AMUMA para precisamente y espacialmente resolver medidas de neurotransmisor en las estructuras corticales y subcorticales del cerebro. El uso de un aparato estereotáctica permite identificación clara de una estructura de superficie de referencia (bregma) para localizar constantemente la región de interés, independientemente de las diferencias individuales en la anatomía y tamaño de lechones. Visualización clara de las suturas facilita colocación regional consistente de la MEA con precisión en la gama del micrómetro (figura 4). Obtener acceso a la superficie cortical del cerebro es mínimamente traumática con sangrado insignificante, asegurando que cualquier dinámica de glutamato en vivo no es debido a la accidental insulto sistémico o local (figura 5). La MEA personalizado, rígido entonces se alinea perpendicular al plano frontal del lechón (figura 6). No alinear correctamente el MEA antes de la inserción puede prevenir registro espacial exacto de la región de destinada, especialmente para regiones subcorticales.
Se tomaron en tiempo real en vivo mediciones de glutamato en el hipocampo de lechones viejo 3-4 días (n = 4) bajo anestesia de sevoflurano 2.5-3% (aproximadamente 1 MAC). Amperometría mediciones fueron registradas a 4 Hz y convertidas a concentración mediante una regresión lineal basada en los parámetros de calibrado (figura 8Panel A). Para cada punto del tiempo, las señales de los dos sitios sensibles a glutamato fueron hechas un promedio antes de restar la señal de centinela promedio para producir una señal corregida glutamato. Estas mediciones continuas fueron suavizadas mediante la aplicación de una media móvil para visualizar mejor la tendencia general en el tiempo (figura 8Panel B). La concentración de glutamato basal promedio fue calculada 4.61 ± 0.02 μm y se mantuvo relativamente estable a lo largo de la exposición anestésica. Actividad glutamatérgica transitoria fue identificado en un animal mediante el análisis de picos en la señal de que no se correlacionaron con la señal de Centinela (R2 < 0.5) y una relación señal a ruido de 3 (figura 9Panel A). Un total de 116 picos transitorios fueron detectados en un periodo de 3,5 h (figura 10Panel A). La amplitud de los picos transitorios resultantes generalmente se observó que del rango 1 μm (figura 10Panel B). Para cuantificar la duración de cada transeúnte, se obtuvo el tiempo (t80) requerido para que cada valor de pico máximo a la descomposición de 80% (figura 9Panel B). Media t80 de los transitorios de glutamato durante el período de grabación de 3,5 h fue de 4.68 ± 0.82 s (figura 10Panel C). Estos datos demuestran que es posible medir con precisión tanto actividad del neurotransmisor transitoria y prolongada en una región subcortical del cerebro anestesiado cochinillo.

Figura 1: comparación Visual de los tipos de matrices microelectrodo SG-2. SG-2 matrices contienen dos sitios sensibles a glutamato y dos sitios centinela glutamato-insensible (150 μm μm x 20 por sitio). (A) se muestra una matriz de microelectrodos de eje flexible en la izquierda. La matriz rígida eje microelectrodo fue diseñado para su uso en lechones y permisos más profunda implantación en grandes animales. Haga clic aquí para ver una versión más grande de esta figura.
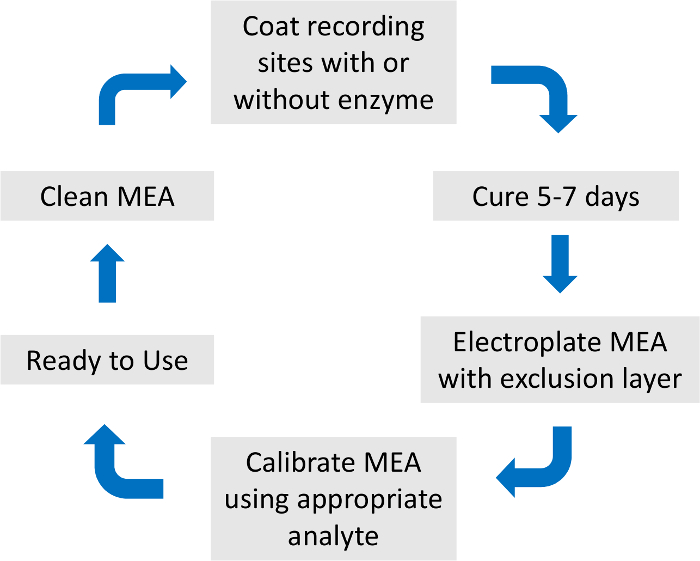
Figura 2: Resumen del proceso de preparación y calibración de matriz microelectrodo. La preparación total de MEA y calibración duran aproximadamente una semana. La enzima de la capa, capa de exclusión y calibración analitos son específicos para el neurotransmisor de interés. Haga clic aquí para ver una versión más grande de esta figura.
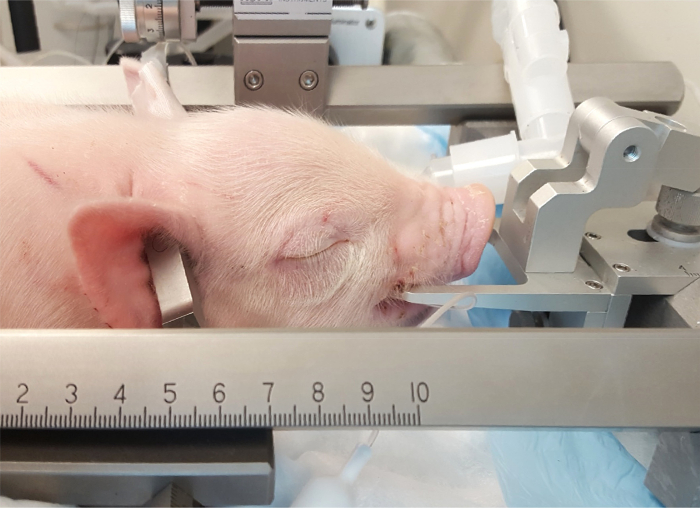
Figura 3: colocación de lechones en el aparato estereotáxicas. La boca del lechón se coloca en la barra de boca directamente posterior a los dientes caninos. Las barras penetrante de oído se insertan en los canales de oído para sujetar la punta posterior del cráneo. Haga clic aquí para ver una versión más grande de esta figura.
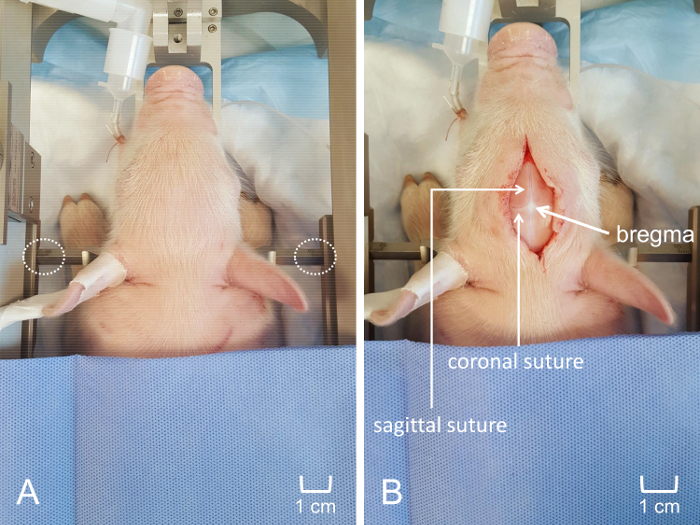
Figura 4: colocación de lechones en el aparato estereotáctica para craneotomía. (A) el cochinillo de cabeza está asegurada firmemente dentro del marco estereotáctica personalizado, asegurando la colocación coherente de la MEA. Colocación equidistante de barras penetrante de oído es visible. (B) incisión de línea media antero-posterior a lo largo del cuero cabelludo. Puntuación del cráneo fue evitada para visualizar las suturas coronales y sagitales y optimizar la visualización de bregma. La barra de escala se muestra para indicar el tamaño relativo de la incisión y la ubicación de ventana de craneotomía. Haga clic aquí para ver una versión más grande de esta figura.
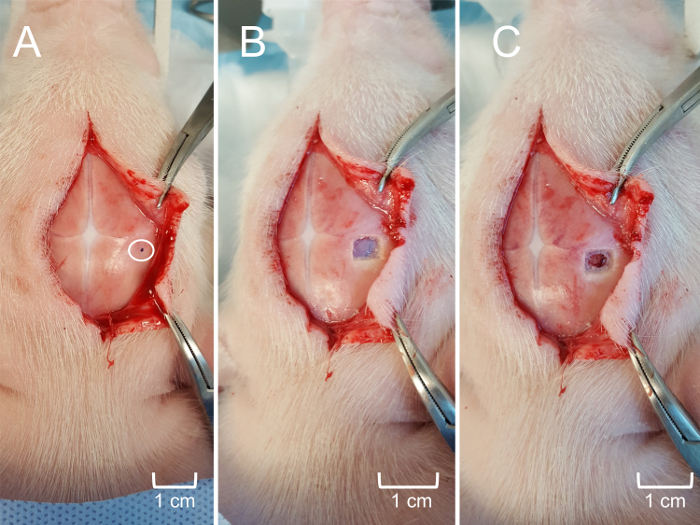
Figura 5: craneotomía para acceder al hipocampo. (A) del cuero cabelludo refleja más exponer la ubicación aproximada de la inserción de MEA según coordenadas estereotáxicas. El área dentro de un círculo está marcado (punto negro) para guiar la craneotomía. (B) la ventana de la craneotomía (0,25 cm2) con el cráneo colgajo removido para exponer la duramadre subyacente. (C) las meninges cuidadosamente removido para exponer la corteza cerebral superficial sin trauma tisular. Haga clic aquí para ver una versión más grande de esta figura.
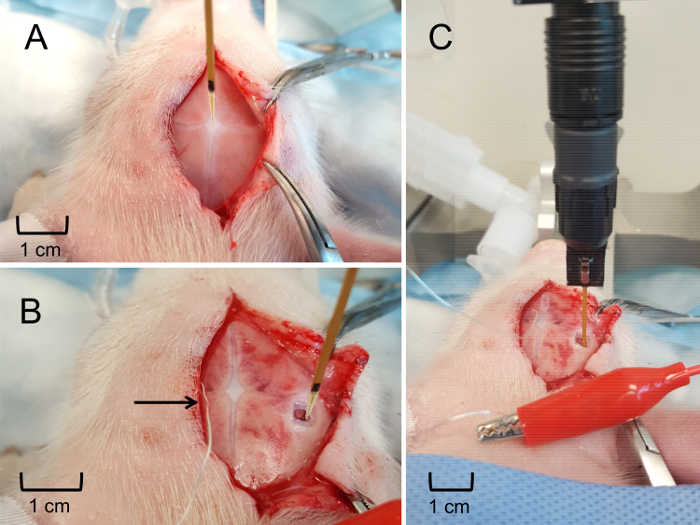
Figura 6: MEA posicionamiento e inserción en el hipocampo. (A) colocación de MEA en el vértice para determinar una relativa localización estereotáctica del hipocampo. (B) colocación estereotáctica de la MEA en la superficie del cerebro para determinar la profundidad de inserción del hipocampo. Electrodo de referencia plata de pseudo firmemente colocado debajo del cuero cabelludo (indicado por flecha). (C) el MEA había insertado a la profundidad adecuada para obtener en tiempo real, en vivo las mediciones de glutamato extracelular en el hipocampo. Haga clic aquí para ver una versión más grande de esta figura.
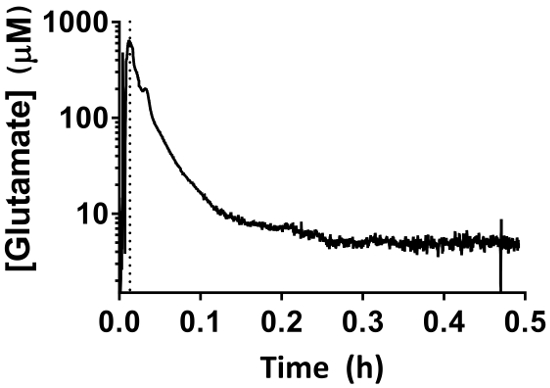
Figura 7: comportamiento MEA durante el período de 30 min base. El rápido aumento inicial corresponde a la pendiente de la MEA en el hipocampo con el micromanipulador. El período de línea de base comienza una vez que la MEA ha llegado a la profundidad adecuada (línea punteada). Mediciones de glutamato extracelular disminuyen durante un período de 30 min y no deben interpretarse como lecturas fisiológicas. Haga clic aquí para ver una versión más grande de esta figura.
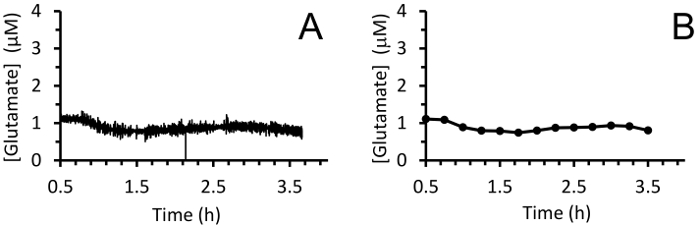
Figura 8: mediciones de glutamato extracelular en tiempo real en el hipocampo de un cerdo neonatal bajo anestesia de sevoflurane. (A) el movimiento promedio de la concentración de glutamato en el hipocampo de un cerdo neonatal bajo anestesia de sevoflurano (con 10 puntos de datos). Las mediciones se realizaron en 4Hz durante 3 horas después de un período base de breve de 30 minutos. (B) atenuación de glutamato mediciones usando una media móvil de 100 puntos cada 15 min para visualizar mejor la tendencia. Haga clic aquí para ver una versión más grande de esta figura.
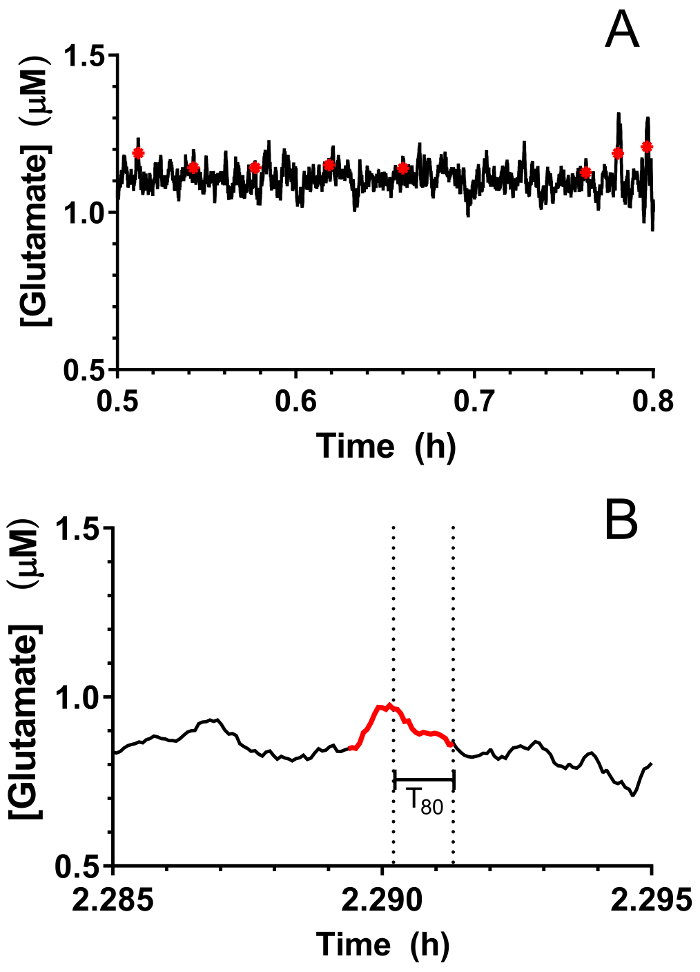
Figura 9: identificación de actividad transitoria de glutamato en el hipocampo de un cerdo neonatal bajo anestesia de sevoflurane. Picos de transitorios de glutamato (A) (en rojo) se indican en el trazo de glutamato en tiempo real. Picos se consideraron significativos cuando la relación señal a ruido supera 3 y su señal no se correlacionó con la señal de Centinela (R2 < 0.5). (B) un representante transitorio pico identificado en la figura 9Panel A. Las líneas punteadas indican la duración total necesaria para que el pico al 80% del decaimiento. Haga clic aquí para ver una versión más grande de esta figura.
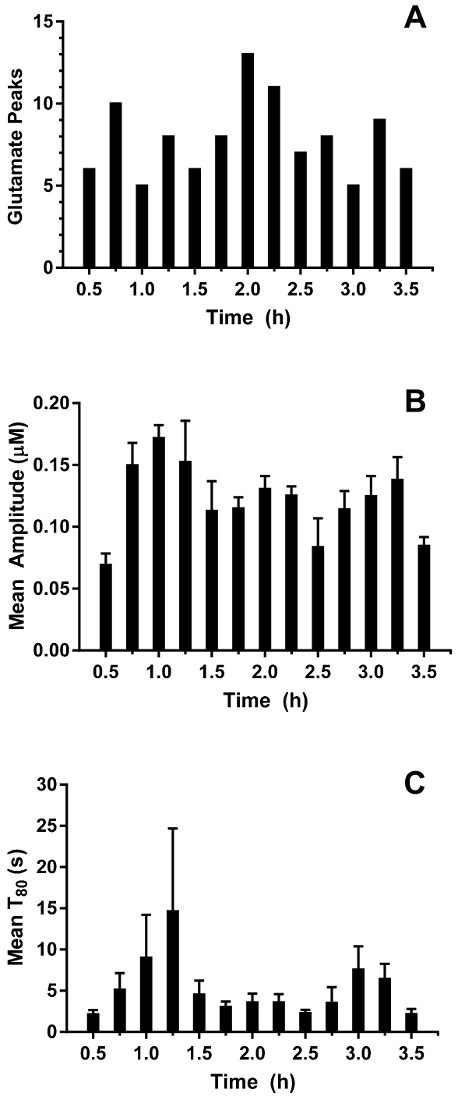
Figura 10: caracterización de transitorios de glutamato en el hipocampo de un cerdo neonatal bajo anestesia de sevoflurane. (A) A número de picos transitorios de glutamato en contenedores de 15 minutos. Picos se consideraron significativos cuando la relación señal a ruido supera 3 y su señal no se correlacionó con la señal de Centinela (R2 < 0.5). (B) la amplitud del glutamato transitorio picos. Barras de error indican el error estándar de la media. (C) significa T80 de picos transitorios de glutamato. Barras de error indican el error estándar de la media. Haga clic aquí para ver una versión más grande de esta figura.
Discusión
Desde el inicio del experimento, se debe mantener la homeostasis fisiológica del lechón como se describe en publicación previa21 de este laboratorio. Monitorización mínima debe incluir oximetría de pulso, Electrocardiografía, capnografía, presión arterial no invasiva y temperatura. Investigadores entrenados son necesarios para que las perturbaciones fisiológicas (por ejemplo, hipo/hipertermia, hipoxia, hipotensión, arritmia) pueden ser corregidas adecuadamente.
Antes de la inducción, calibraciones de MEA en vitro se realizan para establecer la funcionalidad y la selectividad del MEA bajo condiciones conocidas. La calibración y la galjanoplastia de AMMA es fundamental para el buen uso de la tecnología. Hay muchos errores potenciales que pueden surgir durante la calibración. Calibración puede identificar estos temas, así como placas incorrecto, que conduce a la respuesta incorrecta de interferencias. Una cuenta más detallada de tabular de errores que pueden ocurrir en respuesta MEA ha sido compilada, a lo largo de notables causas y soluciones sugeridas, que resulta un instrumento útil para la probable solución de problemas (tabla 1). Es importante tener en cuenta que antes de la calibración y chapado en el electrodo de referencia de cristal debe comprobarse la presencia de burbujas de aire o descoloración blanca, como tampoco impactara negativamente la función MEA y exactitud de la grabación.
| Síntoma | Causa | Acción correctiva |
| No hay señal | Electrodo no conectado | Conectar correctamente el electrodo para headstage y headstage al sistema rápido Amperometría. |
| Ninguna energía al sistema rápido Amperometría | Gire el interruptor en la parte posterior del sistema FAST | |
| Señal ruido | Electrodos contaminados por sangre | Regar continuamente la superficie del cerebro durante la inserción del electrodo |
| Enjuague el electrodo inmediatamente en dH2O | ||
| Capa de enzima está suelta | Limpieza y secado del electrodo | |
| Electrodo de referencia no fue insertado o cubierto | Cubrir y colocar el electrodo de referencia más lejos debajo del cuero cabelludo | |
| Electrodo es detectar el movimiento de la superficie del cerebro | Ocurre generalmente en estructuras superficiales. Insertar el electrodo profundo (1 mm a la vez) si es posible | |
| Movimiento animal | Animal está asegurado | Hacia el animal en la dirección posterior mejor seguro earbars en el cráneo. Si fuera necesario, elevar el torso para permitir la mejor alineación del cuerpo. |
| Animal está anestesiado adecuadamente | Verificar la integridad del equipo anestésico. Valorar la anestesia a una dosis efectiva y administrar una dosis de rocuronio intramuscular (5 mg/kg) | |
| Colocación del electrodo incorrecta | Electrodo no está correctamente alineado | Vuelva a ajustar el electrodo mientras se mantiene una conexión apropiada a la headstage. |
| Coordenadas estereotáxicas son inexactos | Asegúrese de que el atlas de lechón que se hace referencia no utiliza otro punto de referencia o plano de alineación. | |
| Tenga cuidado de no ocultar las marcas de sutura marcando el cráneo. |
Tabla 1: instrucciones para la solución de problemas MEA uso en lechones. Las posibles causas y acciones correctivas para ayudar con la optimización y solución de problemas.
Un atlas estereotáctica para los lechones se utiliza para determinar las coordenadas estereotáxicas de la zona de interés con respecto a un punto conocido como vértice18. Barras de oído deben estar asegurados adecuadamente para asegurarse de que el cráneo es plano y completamente inmovilizada. Debe tenerse cuidado durante la incisión de la línea media del cuero cabelludo para evitar marcar el cráneo ya que esto puede afectar la visualización de las líneas de sutura. La ventana de la craneotomía debe ser lo suficientemente grande para acomodar el MEA.
Este protocolo presenta una serie de desafíos técnicos que requieren un funcionamiento bien surtida y un equipo investigador especializado en los aspectos quirúrgicos y anestésicos del protocolo. El modelo presenta además limitaciones financieras en que el modelo de lechones es más caro que el modelo de roedor; sin embargo, es significativamente menos costosa que el uso de primates no humanos, que pueden costar miles de dólares. El uso de la tecnología MEA presenta sus propios desafíos, como el procedimiento de recubrimiento y revestimiento de los electrodos manualmente requieren un experto investigador o auxiliar para asegurar suficiente selectividad y la función confiable. Los microelectrodos se son frágiles, ya que son de cerámica y así pueden dañarse fácilmente si no se observa el cuidado adecuado. Microelectrodos están sujetos a interferencias de otros dispositivos eléctricos, que pueden crear ruido en las grabaciones y de sangre en el sitio quirúrgico, que puede ocluir los sitios de grabación. La necesidad de equipo especializado presenta una carga adicional como un marco de cirugía estereotáctica debe ser personalizado para inmovilizar el cráneo de lechones durante la implantación. El marco estereotáxicas, glutamato oxidasa y los electrodos ellos mismos son todas costosos. Además, la falta de un atlas estereotáxicas de lechones desde dentro de la última década presenta limitaciones técnicas que requieran conocimientos particulares para determinar la ubicación específica de estructuras profundas en el cerebro del cochinillo. Desarrollo de un nuevo atlas estereotáxicas, tal vez usando proyección de imagen de resonancia magnética, mejorará la habilidad de usar esta tecnología en lechones.
El cochinillo es un modelo clínico relevante para el estudio de AIN en gran parte debido a los paralelismos que existen entre esta especie y el humano recién nacido, ambos poseen similar estructura de cerebro y desarrollo. A diferencia de los modelos más comúnmente usados como ratones o ratas, el lechón tiene una mayor similitud de la CNS a los seres humanos, que presta a la traducibilidad de los resultados del modelo. El modelo de lechones es además más barato e implica menos complicado manejo de un modelo de primates no humanos. El modelo de cochinillo está destinado a examinar el proceso por que la anestesia puede inducir neurotoxicidad del desarrollo, medir su contribución al daño neurológico y combatir el problema de los daños causados por variables de confusión. Por ejemplo, la hipoxia puede ser inventada por daños causados por los anestésicos, ya que tiene efectos globales en el cerebro. El cochinillo se utiliza con las mismas condiciones quirúrgicas y anestésicas utilizados en medicina humana para asegurar la fidelidad de los resultados.
El uso de tecnología MEA de cerámica elimina varios de los inconvenientes asociados a la técnica contemporánea de microdiálisis. Microdiálisis limitada resolución temporal y espacial en comparación con métodos amperométricos como el MEA, que continuamente se puede grabar eventos de glutamato en múltiples, regiones microscópicas hasta 10 Hz23. Esta tarifa de muestreo rápida elimina el factor de confusión de la difusión del neurotransmisor localizado que es inherente a los métodos de muestreo lenta como microdiálisis24. Además, la MEA es un método menos invasivo que una sonda de microdiálisis, que puede causar gliosis significativa durante la inserción y puede alterar la actividad del neurotransmisor en el sitio de inserción22.
Estudios anteriores utilizando una gama de modelos mamíferos, técnicas de medición y las regiones del cerebro, han demostrado glutamato basal niveles comparables a los que se encuentran utilizando esta técnica. Esto sugiere que la tecnología MEA, adaptado al modelo de cochinillo, proporciona válidas grabaciones en vivo de la concentración de glutamato (tabla 2).
| Autor (año) | Técnica de grabación | Modelo animal | Edad | Regiones del cerebro | Concentración (μm) de glutamato Basal media |
| Hascup et al (2008)23 | MEA (enzima-basado) | Roedor | 20 - 24 semanas | Corteza prefrontal, estriado | 3.3 ± 1.0; ± 5.0 1.2 |
| Hascup et al (2010)25 | MEA (enzima-basado) | Roedor | 3 - 6 meses | Hipocampo | 4.7-10.4 |
| Rutherford et al., (2007)9 | MEA (enzima-basado) | Roedor | 3 - 6 meses | Corteza prefrontal, estriado | 44.9 ± 4.7; 7.3 ± 0.9 |
| Miele et al (1996)26 | Microdiálisis (enzima-basado) | Roedor | - | Cuerpo estriado | 3.6 ± 0.5 |
| De día et al (2006)27 | MEA (enzima-basado) | Roedor | 3 - 6 meses | Corteza frontal, cuerpo estriado | 1.6 ± 0.3; 1,4 ± 0,2 |
| Quintero et al (2007)28 | MEA (enzima-basado) | No humanos primates | 5.3-5.5 años | Corteza premotora, corteza motora | 3,8 ± 1.7; 3.7 ± 0.9 |
| Stephens et al. (2010) 29 | MEA [Spencer-Gerhardt-2 (SG-2)] | No humanos primates | 11 - 21 años | Putamen | 8.53 |
| Kodama et al., (2002)30 | Microdiálisis (enzima-basado) | No humanos primates | - | Corteza prefrontal | 1.29-2.21 |
| GALVAN et al (2003)31 | Microdiálisis (enzima-basado) | No humanos primates | Juvenil | Cuerpo estriado | 28.74 ± 2,73 |
| Durante y Spencer (1993)32 | Microdiálisis (enzima-basado) | Humano | 18 - 35 años | Hipocampo | 20.3 ± 6.6 |
| Reinstrup et al (2000)33 | Microdiálisis (enzima-basado) | Humano | - | Corteza frontal | ± 16 16 |
| Pie cavo et al (2005)34 | Microdiálisis (enzima-basado) | Humano | 15 - 52 años | Neocortex | 2.6 ± 0.3 |
Tabla 2. Comparación de glutamato extracelular basal levelsacross varios modelos animales. Una revisión seleccionada de estudios estableciendo niveles normales de glutamato extracelular en animales sanos despiertos y anestesiados mediante microdiálisis o microelectrodos.
El uso de la tecnología MEA para monitorear en vivo las concentraciones de glutamato en el modelo de cochinillo puede permitir la futura evaluación de anestesia después de los resultados neurológicos de cochinillo. Experimentos de supervivencia han sido planeados, que será más una comprensión del impacto a largo plazo de la anestesia en el bienestar neurocognitivas de los recién nacidos humanos. Experimentos de supervivencia permitirá monitoreo de glutamato y pruebas de comportamiento cambia mucho después de la exposición de la anestesia. También es común para que los niños se someten a anestesia en condiciones donde puede experimentar estrés fisiológico en la forma de intervención quirúrgica. Futuros estudios abordar la influencia de la cirugía en términos de lesión neurológica y aumento de la neurotoxicidad permitiría más exactos modelado de un ajuste clínico común para los niños. El uso de modelos animales alternativos también es factible, como es el estudio de estos distintos modelos a través de la implantación crónica, lo que nos permite seguir los cambios conductuales asociados con neurotoxicidad. Propia tecnología MEA es versátil, por lo que estudio no necesita ser limitada al análisis de los niveles de glutamato (p. ej., GABA, colina, lisina, etc. podrían analizarse).
Divulgaciones
Greg Gerhardt es el principal propietario de Quanteon LLC. Jorge Quintero y Jason Burmeister han servido como asesores de Quanteon LLC.
Agradecimientos
Los autores quisieran agradecer las contribuciones del Universidad de Kentucky Centro tecnología de microelectrodo (CenMeT) y el Ohio estado Universidad laboratorio Animal Resource Center (ULAR).
Materiales
| Name | Company | Catalog Number | Comments |
| Advance Liqui-Wean Pig Milk Replacer | PBS Animal Health | 292-13 | |
| Piglet Anesthesia Face-Cone Mask | VetEquip | 921428 | |
| Integra SL Anesthesia Workstation | DRE Veterinary | 2350 | This anesthesia workstation is chosen to best mimic the clinical monitoring experienced by pediatric patients in the operating room. Any anesthesia machine can be used as long as it allows for sufficient physiologic monitoring and intervention. |
| Sevoflurane | Ultane | 0074-4456-04 | |
| Rocuronium Bromide Injection | Hospira | 0409-9558-05 | |
| Medfusion 4000 IV Infusion | Smiths Medical | ||
| Model 1530 Heavy-Duty Research Model Stereotax | Kopf | custom made | |
| Model 1541 Piglet Adaptor | Kopf | custom made | |
| Infrared Spot Lamp | Amazon | B000HHQ94C | |
| Bair Hugger Torso Blanket | 3M | 540 | |
| Bair Hugger | 3M | 750 | |
| Sterile Alcohol Prep Pad | Fisherbrand | 22-363-750 | |
| Carbon Steel Rib-Back Surgical Blade | Bard-Parker | #10 | |
| Scalpel Handel | Havel's | HAN-G4 | |
| Surgical Scissors | World Precision Instruments | 504615 | |
| Mosquito Forceps | Sklar Surgical Instruments | 17-1225 | |
| Gauze Pads | Fisherbrand | 22-246-069 | |
| Adson Tissue Forceps | Teleflex | 181223 | |
| Dremel 111 Engraving Cutter | Amazon | Dremel 111 | |
| Microelectrode Array | Center for Microelectrdoe Technology, University of Kentucky | S2 4Ch MEA; custom made | |
| Headstage | Quanteon | 2pA/mV | |
| Wire, silver, PFA, .008" Bare, .0110" coated | A-M Systems | 786500 | |
| Fine Micromanipulator | Narishige Scientific Instrument Lab | MO-8 |
Referencias
- Hall, M. J., DeFrances, C. J., Williams, S. N., Golosinskiy, A., Schwartzman, A. National hospital discharge Survey: 2007 summary. Natl Health Stat Report. (29), 1-24 (2010).
- Ikonomidou, C., et al. Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain. Science. 283 (5398), 70-74 (1999).
- Mattson, M. P. Glutamate and neurotrophic factors in neuronal plasticity and disease. Ann N Y Acad Sci. 1144 (1), 97-112 (2008).
- Atlante, A., et al. Glutamate neurotoxicity, oxidative stress and mitochondria. FEBS Lett. 497 (1), 1-5 (2001).
- Kavitha, J., Durga, P., Ramachandran, G. Inhalational agents in anesthesia induced developmental neurotoxicity - Recent advances. Trends in Anaesthesia and Critical Care. 11 (1), 14-18 (2016).
- Zanghi, C. N., Jevtovic-Todorovic, V. A holistic approach to anesthesia-induced neurotoxicity and its implications for future mechanistic studies. Neurotoxicol Teratol. 60 (2), 24-32 (2017).
- Fan, X., et al. In situ real-time monitoring of glutamate and electrophysiology from cortex to hippocampus in mice based on a microelectrode array. Sensors (Basel). 17 (1), 1-8 (2016).
- Hinzman, J. M., et al. Diffuse brain injury elevates tonic glutamate levels and potassium-evoked glutamate release in discrete brain regions at two days post-injury: an enzyme-based microelectrode array study. J Neurotrauma. 27 (5), 889-899 (2010).
- Rutherford, E. C., Pomerleau, F., Huettl, P., Strömberg, I., Gerhardt, G. A. Chronic second-by-second measures of L-glutamate in the central nervous system of freely moving rats. J Neurochem. 102 (3), 712-722 (2007).
- Benveniste, H. Brain microdialysis. J Neurochem. 52 (6), 1667-1679 (1989).
- Kohno, T., et al. An improved method for the detection of changes in brain extracellular glutamate levels. J Neurosci Methods. 81 (1-2), 199-205 (1998).
- Hascup, K. N., Hascup, E. R. Electrochemical techniques for subsecond neurotransmitter detection in live rodents. Comp Med. 64 (4), 249-255 (2014).
- Rooij, N. F., Koudelka-Hep, M., Frey, O. Biosensor microprobe array for in vivo monitoring of neurotransmitters. EPFL. , (2010).
- Fan, X. T., et al. Cortical glutamate levels decrease in a non-human primate model of dopamine deficiency. Brain Res. 1552, 34-40 (2014).
- Hunsberger, H. C., et al. Using enzyme-based biosensors to measure tonic and phasic glutamate in Alzheimer's mouse models. J Vis Exp. (123), (2017).
- Hill, A. J., Jones, N. A., Williams, C. M., Stephens, G. J., Whalley, B. J. Development of multi-electrode array screening for anticonvulsants in acute rat brain slices. J Neurosci Methods. 185 (2), 246-256 (2010).
- Defranchi, E., et al. Feasibility assessment of micro-electrode chip assay as a method of detecting neurotoxicity in vitro. Front Neuroeng. 4 (6), (2011).
- Whitaker, E. E., et al. Use of a piglet model for the study of anesthetic-induced developmental neurotoxicity (AIDN): A translational neuroscience approach. J Vis Exp. (124), (2017).
- Kilkenny, C., et al. Animal research: reporting in vivo experiments: the ARRIVE guidelines. Br J Pharmacol. 160 (7), 1577-1579 (2010).
- Salinas-Zeballos, M., Ceballos, G., Gootman, P. . A stereotaxic atlas of the developing swine (Sus scrofa) forebrain. , 887-906 (1986).
- Whitaker, E. E., et al. A novel, clinically relevant use of a piglet model to study the effects of anesthetics on the developing brain. Clin Transl Med. 5 (1), (2016).
- Hascup, E. R., et al. Histological studies of the effects of chronic implantation of ceramic-based microelectrode arrays and microdialysis probes in rat prefrontal cortex. Brain Res. , 12-20 (2009).
- Hascup, K. N., Hascup, E. R., Pomerleau, F., Huettl, P., Gerhardt, G. A. Second-by-second measures of L-Glutamate and other neurotransmitters using enzyme-based microelectrode arrays. The Journal of pharmacology and experimental therapeutics. 324 (2), 725-731 (2008).
- Rice, M. E., Cragg, S. J. Dopamine spillover after quantal release: rethinking dopamine transmission in the nigrostriatal pathway. Brain Res Rev. 58 (2), 303-313 (2008).
- Hascup, E. R., et al. Rapid microelectrode measurements and the origin and regulation of extracellular glutamate in rat prefrontal cortex. Journal of Neurochemistry. 115 (6), 1608-1620 (2010).
- Miele, M., Boutelle, M. G., Fillenz, M. The source of physiologically stimulated glutamate efflux from the striatum of conscious rats. J Physiol. 497 (Pt 3), 745-751 (1996).
- Day, B. K., Pomerleau, F., Burmeister, J. J., Huettl, P., Gerhardt, G. A. Microelectrode array studies of basal and potassium-evoked release of L-glutamate in the anesthetized rat brain. J Neurochem. 96 (6), 1626-1635 (2006).
- Quintero, J. E., et al. Amperometric measures of age-related changes in glutamate regulation in the cortex of rhesus monkeys. Exp Neurol. 208 (2), 238-246 (2007).
- Stephens, M. L., Pomerleau, F., Huettl, P., Gerhardt, G. A., Zhang, Z. Real-time glutamate measurements in the putamen of awake rhesus monkeys using an enzyme-based human microelectrode array prototype. J Neurosci Methods. 185 (2), 264-272 (2010).
- Kodama, T., Hikosaka, K., Watanabe, M. Differential changes in glutamate concentration in the primate prefrontal cortex during spatial delayed alternation and sensory-guided tasks. Exp Brain Res. 145 (2), 133-141 (2002).
- Galvan, A., Smith, Y., Wichmann, T. Continuous monitoring of intracerebral glutamate levels in awake monkeys using microdialysis and enzyme fluorometric detection. J Neurosci Methods. 126 (2), 175-185 (2003).
- During, M. J., Spencer, D. D. Extracellular hippocampal glutamate and spontaneous seizure in the conscious human brain. Lancet. 341 (8861), 1607-1610 (1993).
- Reinstrup, P., et al. Intracerebral microdialysis in clinical practice: baseline values for chemical markers during wakefulness, anesthesia, and neurosurgery. Neurosurgery. 47 (3), 701-710 (2000).
- Cavus, I., et al. Extracellular metabolites in the cortex and hippocampus of epileptic patients. Ann Neurol. 57 (2), 226-235 (2005).
Reimpresiones y Permisos
Solicitar permiso para reutilizar el texto o las figuras de este JoVE artículos
Solicitar permisoThis article has been published
Video Coming Soon
ACERCA DE JoVE
Copyright © 2025 MyJoVE Corporation. Todos los derechos reservados