Method Article
Adattamento della tecnologia Array microelettrodo per lo studio di neurotossicità indotta da anestesia nel cervello intatto Piglet
* Questi autori hanno contribuito in egual misura
In questo articolo
Riepilogo
Questo studio esplora l'uso novello del microelettrodo basati su enzima matrice (MEA) tecnologia per monitorare l'attività del neurotrasmettitore in vivo nei suinetti. L'ipotesi era che quella dysregulation di glutammato contribuisce al meccanismo di neurotossicità anestetico. Qui, presentiamo un protocollo per adattare la tecnologia MEA per studiare il meccanismo di neurotossicità indotta da anestesia.
Abstract
Ogni anno, milioni di bambini subiscono l'anestesia per una moltitudine di procedure. Tuttavia, gli studi negli animali e nell'uomo hanno messo in dubbio la sicurezza dell'anestesia nei bambini, implicando anestetici come potenzialmente tossici per il cervello in via di sviluppo. Ad oggi, non esistono studi con successo hanno chiarito i meccanismi da cui l'anestesia può essere neurotossico. Gli studi sugli animali consentono di indagine di tali meccanismi e suinetti neonatali rappresentano un eccellente modello per studiare questi effetti a causa di loro somiglianze inerente allo sviluppo al cervello umano.
Questo protocollo si adatta l'uso della tecnologia di base di enzima microelettrodo array (MEA) come un nuovo modo di studiare i meccanismi di neurotossicità indotta da anestesia (AIN). MEAs abilitare il monitoraggio in tempo reale di in vivo attività del neurotrasmettitore e offrono una eccezionale risoluzione temporale e spaziale. È supposto che anestetico neurotossicità è causato in parte da disregolazione del glutammato e MEAs offre un metodo per misurare il glutammato. Il romanzo implementazione della tecnologia MEA in un modello di porcellino presenta un'opportunità unica per lo studio dell'AIN.
Introduzione
Ogni anno, milioni di bambini subiscono l'anestesia per procedure sia invasive e non invasiva in Stati Uniti d'America1. Per anni, i fornitori di anestesia tranquillizzato i genitori sulla sicurezza degli anestetici, anche nei bambini piccoli e neonati. Tuttavia, nel 1999 è stato trovato che transitori bloccaggio del sottotipo del N-metilico-D-aspartato (NMDA) dei recettori del glutammato durante i primi anni di vita potrebbe causare diffusa apoptosi neuronale in ratti2. Recentemente, la FDA ha pubblicato una comunicazione di sicurezza di droga che richiederà le etichette delle droghe anestetiche per includere un avvertimento circa anestetici generali e sui possibili effetti negativi sul cervello in via di sviluppo dei bambini di età inferiore ai 3 anni (US Food e Drug Administration, 2017). Tuttavia, c'è ancora una necessità di delucidare i meccanismi possibili e potenziali misure di neuroprotective.
Normale attività di neurotrasmettitori come il glutammato e acido gamma-amino butirrico (GABA) sono critici per sviluppo neurologico normale che si verifichi. Anche se la maggior parte delle vie coinvolte in AIN sono ancora da chiarire, sistemi del neurotrasmettitore sono molto suscettibili di essere coinvolti poiché gli anestetici sono conosciuti per modulare le vie per produrre uno stato di incoscienza. In particolare, il glutammato, un neurotrasmettitore eccitatorio causa excitotoxicity, quando la sua attività è dysregulated. Questo neurotrasmettitore è normalmente coinvolto nella neurogenesi, plasticità neurale, crescita sinaptica e neurale e un numero di altre funzioni cerebrali criticamente importante. Tuttavia, attivazione prolungata dei recettori del glutammato può causare excitotoxicity e apoptosi neuronale, particolarmente in condizioni di stress quali chirurgia, privazione dell'ossigeno ed energia ridotta disponibilità3. Associazione di glutammato per il NMDA receptor è stato indicato per causare Na+ e Cl− afflusso. La depolarizzazione successiva è pensata per portare a foro canale per Ca2 + e rilascio di Ca intracellulare2 + memorizza4. Questa disfunzione probabile conduce ad una cascata di derangements metabolici che finalmente fare diminuire la proliferazione neuronale, aumentare l'infiammazione e portare alla morte neuronale. Nonostante queste ipotesi, i meccanismi veri di AIN rimangono poco chiari5. A causa del suo ruolo nell'apoptosi, disregolazione di glutammato rappresenta una via novella che può contribuire al meccanismo dell'apoptosi neuronale precedentemente documentati, una caratteristica di AIN.
Uno dei ostacoli sullo studio dei processi neuronali è la loro elevata complessità, particolarmente nella regolazione dello sviluppo neuronale. I primi mesi di vita sono il periodo di massima vulnerabilità al danno, durante cui la maggior parte dei passi importanti di sviluppo neuronale come apoptosi fisiologica (potatura neuronale), sinaptogenesi, gliogenesis e myelination prendere posto6 . Data la natura complessa della comunicazione di un neurone e la difficoltà di studiare questi processi senza interrompere la normale funzione di CNS, nuove tecnologie sono state sviluppate che mirano a in vivo rilevazione e quantificazione degli elementi importanti di comunicazione di un neurone.
Enzima-collegata MEA tecnologia è stata utilizzata in questo studio come un nuovo modo di studiare i meccanismi di AIN in un modello di porcellino clinicamente rilevante. Questa tecnologia può essere utilizzata per studiare processi di complessi in vivo elettrochimica del cervello, tra cui disregolazione di glutammato. I siti di registrazione platino 4 canali incorporato di MEAs (2 siti sensibili al glutammato e sentinella 2) consentono autoreferenziali, che contribuisce alla precisione di rilevamento. Inoltre, un livello di esclusione viene applicato a ciascun elettrodo, che conferisce selettività di impedire altre molecole interferenti rilevato7. Inoltre, il design a basso profilo di MEA permette per il trauma tissutale minima rispetto alle tecnologie precedenti. Questa stessa caratteristica conferisce a MEAs una maggiore risoluzione spaziale, che facilita lo studio delle regioni microscopiche nel cervello. Ad esempio, discrete regioni dell'ippocampo (gyrus dentate, CA1, CA2) possono essere specificamente studiati8. Dettagli specifici sulla funzionalità del MEAs sono stati descritti in precedenza9.
Rispetto a elettrochimica MEA, microdialisi incorpora una membrana posizionata tra la soluzione di interesse e una soluzione di composizione simile, permettendo la rilevazione di liquido extracellulare cambia10. Sebbene il microdialysis è un pilastro della neurochimica ed è stato a lungo utilizzato per la rilevazione dei neurotrasmettitori, ha lo svantaggio di risoluzione di tempo basso, rilevazione ritardata del cambiamento di glutammato e significativa del tessuto trauma11.
MEAs è in grado di rilevare indirettamente neurotrasmettitori come il glutammato, acetilcolina e la colina, utilizzando enzimi ossidasi appropriato che producono molecole reporter elettroattivi ad esempio H2O2 o O212,13 .
Tecnologia MEA è stato ampiamente utilizzata nei ratti e primati non umani per lo studio di neurotossicità nel contesto di processi patofisiologici diverso da AIN7,14. Tra alcuni di questi processi patofisiologici, MEA tecnologia è stata utilizzata per lo studio del morbo di Alzheimer, epilessia, lesioni cerebrali traumatiche e l'effetto di composti farmacologici sulla comunicazione sinaptica8,15 , 16 , 17. anche se MEAs sono stati utilizzati per lo studio di queste patologie nei ratti e primati non umani, l'alta somiglianza inerente allo sviluppo tra esseri umani e porcellino cervello rende l'adattamento della tecnologia MEA nei suinetti una tecnica particolarmente indicata per lo studio di AIN meccanismi18.
Protocollo
Suinetti (scrofa di Sus) vengono ricevuti tramite una fattoria locale pre-approvata da The Ohio State University (OSU) istituzionale Animal Care ed uso Committee (IACUC). A seguito dell'approvazione del protocollo, sperimentazioni animali sono fatte in conformità alla politica IACUC.
1. porcellini e Piglet movimentazione
- Utilizzare suinetti maschili e femminili in modo sistematico e randomizzato per eliminare qualsiasi i confounders potenziali basati sul sesso ai sensi dell'arrivo linee guida19.
Nota: Poiché il periodo di crescita massima del cervello è entro 3-5 giorni dalla nascita di porcellino, sperimentazione avviene esclusivamente con i porcellini vecchio 3-5 giorni. - Garantire i suinetti arrivano in Vivario almeno 24 ore prima della sperimentazione per consentire di acclimatazione per l'ambiente.
Nota: Addestrato personale veterinario fornisce cure di routine degli animali. I suinetti sono tenuti in gabbie individualmente temperatura-mantenuta, continuamente monitorate e ricevano un latte nutrizionalmente completo sostituto ad libitum per prevenire l'ipoglicemia. I suinetti sono inoltre tenuti senza sostituzione del latte (nil per os), per almeno 3 ore prima dell'anestesia e sono dotati di coperte e giocattoli per garantire i livelli normali di stimolazione. Se possibile, mantenere più suinetti nella stessa gabbia per permettere la socializzazione.
2. sviluppo e personalizzazione di MEAs per gli studi AIN in un modello di porcellino
Nota: Questa tecnologia utilizza MEAs basato su enzimi che sono pre-rivestiti con enzima ed elettrolitico con m-fenilendiammina dicloridrato (mPD). Gli elettrodi sono stati personalizzati progettati con un fusto rigido di 40 mm e fabbricati per uso nei suinetti (Figura 1).
- Per evitare la ridondanza, si prega di vedere che la descrizione dettagliata della preparazione di MEA e taratura come descritto in precedenza15 (Figura 2).
3. anestesia e l'uso di apparecchiatura stereotassica personalizzato per il maialino
- Anestetizzare gli animali utilizzando una workstation di anestesia con un opportuno ventilatore e dispositivi di monitoraggio e monitorare i parametri fisiologici come la pulsossimetria, pressione arteriosa non invasiva, elettrocardiografia e temperatura in tutta la interezza dell'esperimento come precedentemente descritto19. Intubare e ventilare i suinetti e somministrare un anestetico sevoflurano a 1 concentrazione minima alveolare (MAC) (2.5-3% circa) per 3,5 h. Assicurarsi che il personale di laboratorio addestrato membri sono presenti per questi esperimenti. Pelliccia che ricopre l'area chirurgica viene rimosso utilizzando tagliatori elettrici prima della preparazione della pelle.
Nota: La concentrazione e la durata di anestetico utilizzato consente l'esperimento simulare la lunghezza di tempo di esposizione effettivo anestesia durante un intervento chirurgico. Inoltre, sevoflurano è più comunemente utilizzato anestetico generale nella popolazione pediatrica rendendo l'inchiesta che circondano la sicurezza della massima importanza. - Prima del posizionamento nella cornice stereotassica, avviare un rocuronio caricamento dose di 2,5 mg/kg e un'infusione di 1,5 mg/kg/h per impedire il movimento degli animali mentre fissato nel telaio.
- Posizionare il maialino nella cornice stereotassica porcellino specifico una volta un'adeguata profondità di anestesia è confermata da punta-pizzico.
- Fornire adeguata imbottitura all'interno della cornice stereotassica mettendo il maialino su una rampa di riscaldamento ad aria forzata con imbottitura supplementare (ad es., posizionatore fluidizzato) per prevenire le ulcere da pressione.
- Posizionare i denti della mandibola superiore sopra il dente (Figura 3).
Nota: La barra del dente deve essere ad un livello sufficiente per tenere il cranio molto saldamente in posizione. - Fissare e serrare le barre di orecchio penetrante all'interno le orecchie, avendo cura di assicurare che il maialino è nella posizione del midline. Posizione le punte delle laterali detiene all'interno del canale uditivo e inserire l'orecchio bar abbastanza saldamente per ascoltare il suono "pop" connesso con la penetrazione della membrana timpanica. Saldamente montare le barre dell'orecchio al cranio e inserire a profondità uguale su ogni lato al fine di evitare qualsiasi movimento del cranio durante l'esperimento (Figura 4Pannello A).
Nota: È estremamente importante mantenere caldo il maialino (~ 37,8-38,6 ° C) e monitorare continuamente la temperatura durante l'intera procedura di manutenzione del normothermia. Ciò può essere compiuta tramite una coperta e/o una lampada di calore. Accertarsi di posizionare la lampada di calore ad una distanza appropriata per evitare il bruciore della pelle dell'animale.
- Creare un'incisione mediana di 4-6 cm lungo il cranio con cautela per evitare segnando il cranio con il bisturi. Una volta fatta l'incisione, è possibile utilizzare ritrazione delicata e dissezione smussa per elevare il cuoio capelluto dal cranio. Pulire delicatamente il cranio con un tampone di garza per rimuovere tutto il tessuto connettivo ed esporre le linee di sutura (Figura 4Pannello B).
Nota: Non è necessario mantenere la sterilità durante gli esperimenti non-sopravvivenza. Tuttavia, la sterilità deve essere mantenuta durante gli esperimenti di sopravvivenza. - Riflettere ulteriormente il cuoio capelluto, se necessario, per esporre l'area di interesse e determinare la posizione desiderata per il craniotomy (Figura 5Pannello A). Utilizzare un trapano chirurgico per creare una finestra di craniotomia di circa 0,25 cm2 (può essere maggiore o minore a seconda degli obiettivi sperimentali) che ricopre la struttura d'interesse, prestando attenzione a non per ferire il dura o il cervello sottostante (Figura 5 , Pannello B). Utilizzare bene forbici chirurgiche per asportare il dura che ricopre il tessuto cerebrale (Figura 5Pannello C).
- Posizionare l'elettrodo in verticale come possibile sopra il bregma fissando il braccio di metallo di headstage per il micromanipolatore del stereotax di porcellino. Abbassare l'elettrodo per quanto possibile senza toccare la superficie del cranio. Registrare le coordinate il bregma (Figura 6Pannello A).
- Determinare l'antero-posteriore e mediale-laterale coordina oltre la profondità della struttura di interesse che riguardano il bregma. Determinare le coordinate stereotassiche utilizzando una specie e l'Atlante stereotassiche adatti alla loro età. In questo caso, utilizzare un Atlante stereotassica sviluppato specificamente per suinetti20.
- Riposizionare l'elettrodo in modo che si ha la corretta posizione antero-posteriore e mediale-laterale, assicurando che sia il microelettrodo e l'apparecchio sia perpendicolare alla superficie. Posizionare l'elettrodo di pseudo-riferimento sotto il cuoio capelluto, assicurando un contatto con l'animale (Figura 6Pannello B).
- Lentamente e delicatamente, abbassare l'elettrodo alla profondità appropriata nel cervello usando il braccio stereotassica. Per la finale 2 mm, è necessario utilizzare un microdrive idraulico per ulteriore unità l'elettrodo nella posizione esatta (Figura 6Pannello C).
Nota: La posizione dell'elettrodo dovrebbe overlie la finestra di craniotomia. La profondità dell'elettrodo varia a seconda della struttura del cervello di interesse. Non è necessario chiudere l'incisione al completamento della raccolta dei dati negli esperimenti non-sopravvivenza.
4. misurazione del glutammato extracellulare sotto anestesia del Sevoflurane
- Garantire che il maialino è sotto continuo monitoraggio fisiologico in tutta l'interezza di questa procedura. Suinetti sono anestetizzati inhalationally (via cono viso) in preparazione per la procedura.
- Dopo l'impianto di MEA, attendere 30 min per consentire l'elettrodo raggiungere la linea di base per garantire che la misura corretta si otterranno per 3 h (Figura 7).
- bupivacaina 0,25% (1 mL/kg) è somministrato per via sottocutanea nel sito della chirurgia per il trattamento del dolore postoperatorio. Inoltre, rilascio prolungato buprenorfina è somministrata per via sottocutanea q72h come necessario.
5. perfusione e sacrificio
- Eseguire le procedure di raccolta dei tessuti aspersione e cervello come descritto in precedenza21. Per interventi chirurgici non-sopravvivenza, gli animali sono euthanized immediatamente dopo una sperimentazione mentre ancora sotto anestesia generale.
- Prendere lordi sezioni del cervello fisso porcellino e usare microscopia per visualizzare la traccia dell'elettrodo come descritto in precedenza22 per consentire la verifica del posizionamento di MEA, garantendo il corretto posizionamento nella zona di interesse.
Risultati
Questo studio di proof-of-concept con tecnologia ceramica basata su enzima MEA in un modello di porcellino può fornire eccezionale spaccato le dinamiche di glutammato sottostante AIN. Questo studio inoltre dimostra che tecnologia MEA basata su enzima può essere adattata con successo nel modello porcellino per misurare i cambiamenti fisiologici e anestesia-collegato nell'attività del neurotrasmettitore con alta sensibilità e alta spaziale e temporale ad alta risoluzione. L'omeostasi fisiologica è stata mantenuta durante i nostri esperimenti utilizzando standard e metodi clinicamente rilevanti, e nessun porcellino ha esibito i segni delle perturbazioni fisiologiche.
I dati ottenuti indicano la capacità di MEAs precisamente nello spazio e nel risolvere le misure del neurotrasmettitore in strutture cerebrali corticali e sottocorticali. L'uso di un apparato stereotassica consente un'identificazione chiara di una struttura di superficie di riferimento (bregma) al fine di individuare costantemente la regione di interesse, indipendentemente dalle differenze individuali nella dimensione del porcellino e anatomia. Chiara visualizzazione delle suture facilita il posizionamento coerenza regionale della MEA con precisione nella gamma micrometro (Figura 4). Come ottenere l'accesso alla superficie corticale del cervello è minimamente traumatico con sanguinamento trascurabile, assicurando che qualsiasi dinamica di glutammato in vivo non è dovuto insulto non intenzionale sistemica o locale (Figura 5). Il MEA personalizzato, rigido è quindi allineato perpendicolare al piano frontale del porcellino (Figura 6). Fallimento per allineare correttamente il MEA prima dell'inserimento può impedire la registrazione accurata spaziale della regione di destinazione, soprattutto per le regioni subcortical.
In tempo reale in vivo del glutammato misurazioni sono state effettuate negli ippocampi di suinetti vecchi 3-4 giorni (n = 4) sotto anestesia del sevoflurane 2,5-3% (circa 1 MAC). Amperometria misurazioni sono state registrate a 4 Hz e convertiti in concentrazione utilizzando una regressione lineare basata su parametri di calibrazione (Figura 8Pannello A). Per ogni punto di tempo, i segnali dai due siti sensibili al glutammato erano in media prima di sottrarre il segnale di media sentinella per produrre un segnale corretto glutammato. Queste misurazioni continue sono state levigate applicando una media mobile per visualizzare meglio l'andamento complessivo nel tempo (Figura 8Pannello B). La concentrazione di glutammato basale medio era calcolata al 4,61 ± 0,02 µM ed è rimasto relativamente stabile nel corso dell'esposizione anestetico. Attività glutamatergic transitoria è stata identificata in un animale analizzando i picchi del segnale che non sono stati correlati con il segnale di sentinella (R2 < 0,5) e superato un rapporto segnale-rumore di 3 (Figura 9Pannello A). Un totale di 116 picchi transitori sono stati rilevati in un periodo di 3,5 h (Figura 10Pannello A). L'ampiezza dei picchi transitori risultanti è stato generalmente osservato per essere all'interno della gamma µM 1 (Figura 10Pannello B). Al fine di quantificare la durata di ogni transitorio, il tempo (t80) richiesto per ogni valore di picco massimo a decadere l'80% è stato ottenuto (Figura 9Pannello B). Il media t80 tutti glutammato transitori durante il periodo di 3,5 ore di registrazione era 4,68 s ± 0,82 (Figura 10Pannello C). Questi dati dimostrano che è possibile misurare con precisione sia attività di neurotrasmettitore prolungata e transitori in una regione subcortical del cervello anestetizzato porcellino.

Figura 1: confronto visivo di tipi di matrice di microelettrodi SG-2. SG-2 matrici contengono due siti sensibili al glutammato e due siti di glutammato-insensibile sentinella (150 µm x 20 µm per ogni sito). (A) una matrice di microelettrodi albero flessibile è mostrata a sinistra. La matrice di microelettrodi asta rigida è stata appositamente per uso in suinetti e permessi l'impianto più profondo in grandi animali. Clicca qui per visualizzare una versione più grande di questa figura.
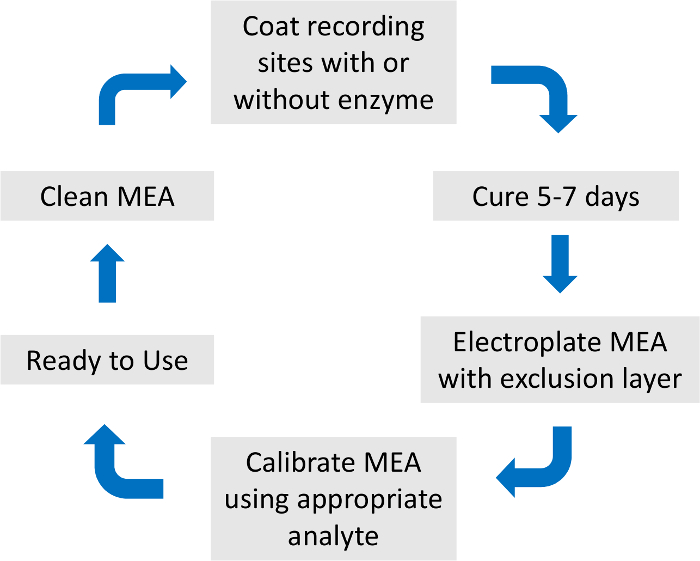
Figura 2: Panoramica del processo di preparazione e taratura di matrice di microelettrodi. La preparazione totale MEA e calibrazione durare circa una settimana. Il rivestimento enzima, strato di esclusione e calibrazione analiti sono specifici per il neurotrasmettitore di interesse. Clicca qui per visualizzare una versione più grande di questa figura.
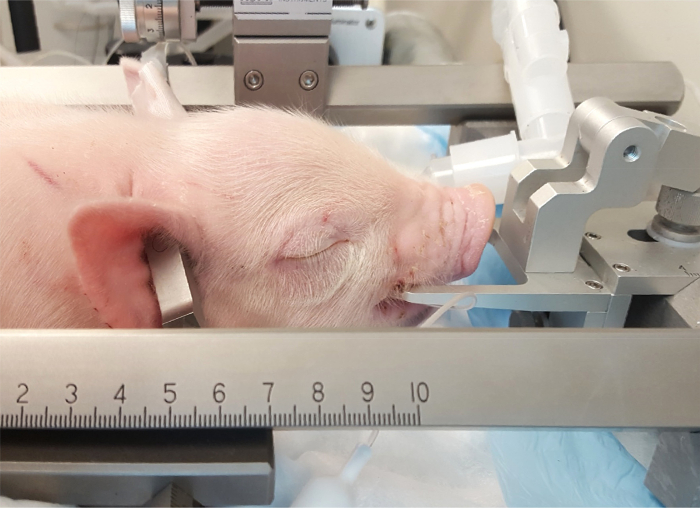
Figura 3: posizionamento del porcellino nell'apparato stereotassica. La bocca del porcellino è posizionata sulla barra di bocca direttamente posteriore per i canini. Le barre di orecchio penetrante sono inserite nel canale uditivo a fissare l'estremità posteriore del cranio. Clicca qui per visualizzare una versione più grande di questa figura.
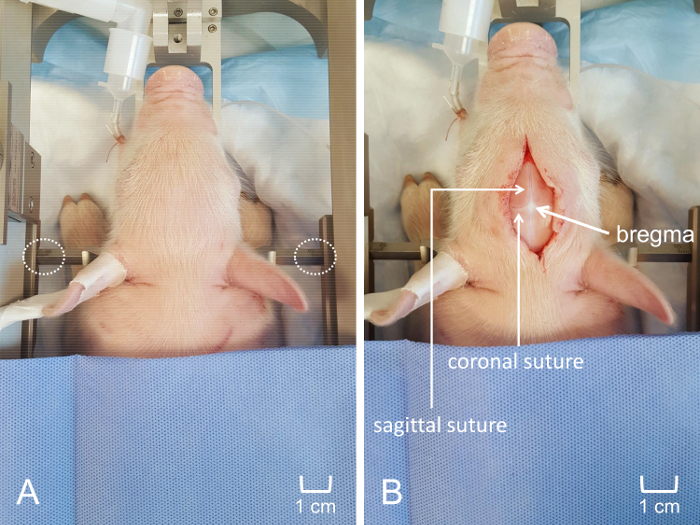
Figura 4: posizionamento del porcellino nell'apparato stereotassica per craniotomia. (A) il porcellino di testa sia correttamente inserito all'interno della cornice stereotassica personalizzata, garantendo il posizionamento coerenza di MEA. Posizionamento equidistante dei bar orecchio penetrante è visibile. (B) incisione antero-posteriore del Midline lungo il cuoio capelluto. Punteggio del cranio è stato evitato per visualizzare suture coronale e sagittali ed ottimizzare la visualizzazione di bregma. La barra della scala è indicata per indicare la dimensione relativa dell'incisione e la posizione della finestra di craniotomia. Clicca qui per visualizzare una versione più grande di questa figura.
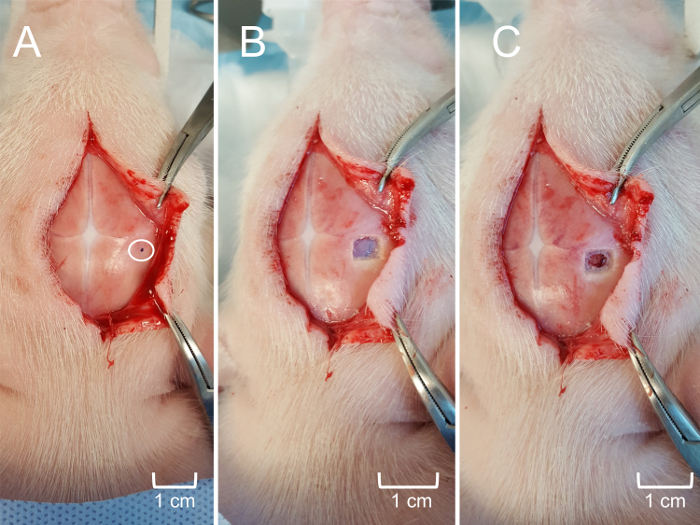
Figura 5: Craniotomy per accesso all'ippocampo. (A), il cuoio capelluto ulteriormente riflessa per esporre la posizione approssimativa dell'inserzione MEA secondo coordinate stereotassiche. L'area cerchiata è contrassegnato (puntino nero) per guidare il craniotomy. (B), la finestra di craniotomia (0,25 cm2) con il cranio lembo rimosso per esporre il mater di dura sottostante. (C) le meningi accuratamente rimosso per esporre la corteccia cerebrale superficiale senza trauma dei tessuti. Clicca qui per visualizzare una versione più grande di questa figura.
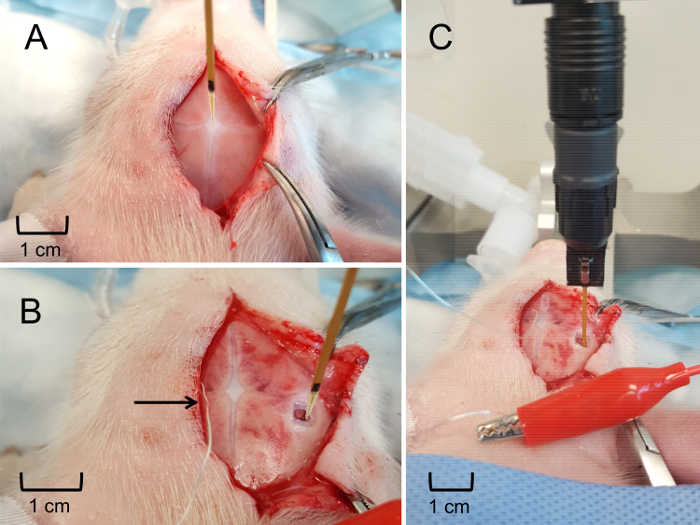
Figura 6: MEA posizionamento e inserimento nell'ippocampo. (A) posizionamento di MEA presso il bregma per determinare una posizione relativa di stereotassica dell'ippocampo. (B) posizionamento stereotassica di MEA alla superficie del cervello per determinare la profondità di inserimento di ippocampo. Elettrodo di pseudo-riferimento di argento saldamente collocato sotto il cuoio capelluto (indicato dalla freccia). (C) la MEA inserito alla profondità adeguata per ottenere in tempo reale, in vivo misure di glutammato extracellulare nell'ippocampo. Clicca qui per visualizzare una versione più grande di questa figura.
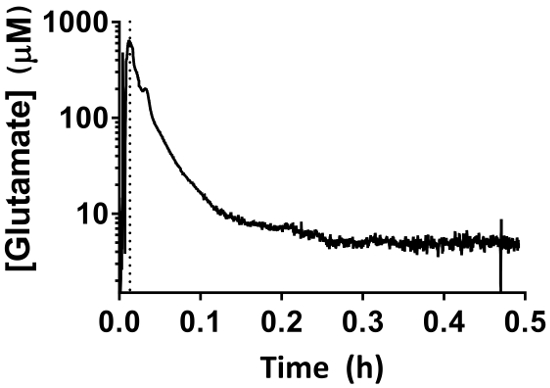
Figura 7: comportamento MEA durante il periodo di riferimento 30-min. Il rapido aumento iniziale corrisponde alla discesa della MEA nell'ippocampo utilizzando il micromanipolatore. Il periodo di riferimento inizia una volta la MEA ha raggiunto la profondità appropriata (linea tratteggiata). Misurazioni di glutammato extracellulare diminuiranno per un periodo di 30 min e non devono essere interpretate come fisiologiche letture. Clicca qui per visualizzare una versione più grande di questa figura.
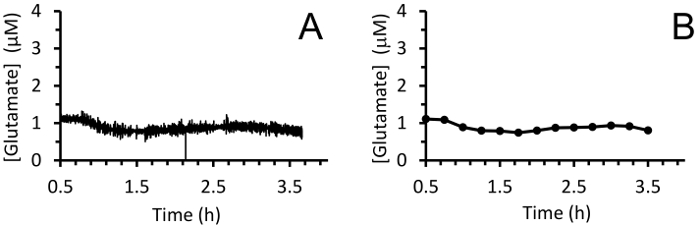
Figura 8: misurazioni in tempo reale del glutammato extracellulare nell'ippocampo di un porco neonatale sotto anestesia del sevoflurane. (A) lo spostamento medio della concentrazione di glutammato nell'ippocampo di un maiale neonatale sotto anestesia del sevoflurane (con 10 punti di dati). Misure sono state prese a 4Hz per 3 h dopo un periodo di riferimento breve 30 min. (B) Smoothing di glutammato misurazioni utilizzando una media mobile di 100 punti ogni 15 min per visualizzare meglio la tendenza. Clicca qui per visualizzare una versione più grande di questa figura.
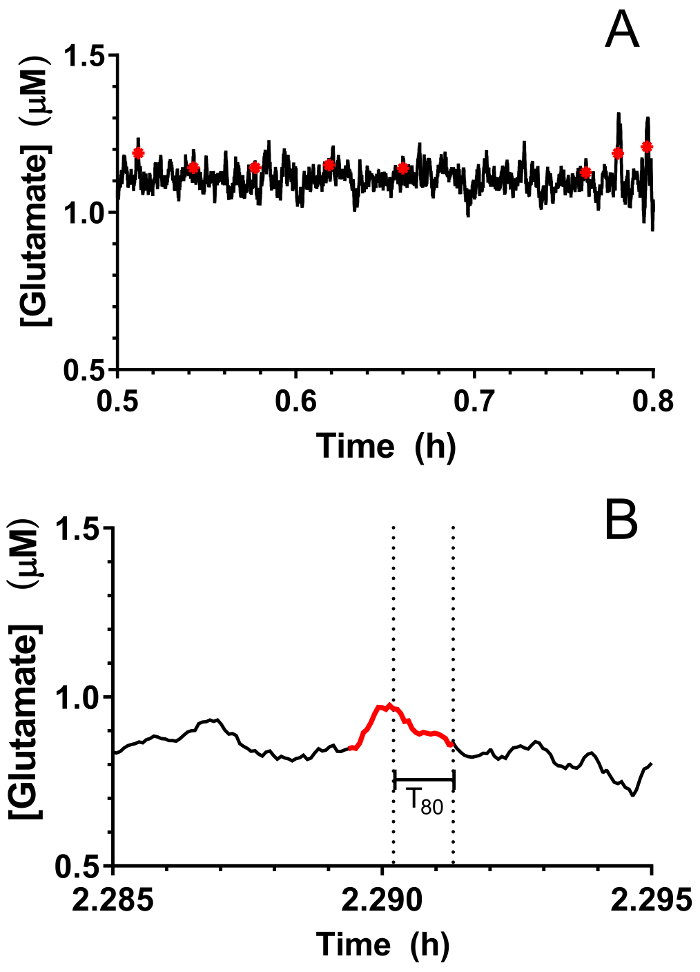
Figura 9: identificazione delle attività del glutammato transitoria nell'ippocampo di un porco neonatale sotto anestesia del sevoflurane. Picchi transitori glutammato (A) (in rosso) sono indicati sul tracciato del glutammato in tempo reale. Picchi sono stati considerati significativi quando il rapporto segnale-rumore superato il 3 e il segnale non è stato correlato con il segnale di sentinella (R2 < 0,5). (B) un rappresentanza picco transitorio identificato in Figura 9Pannello A. Linee tratteggiate indicano la durata totale richiesta per il picco di decadimento di 80%. Clicca qui per visualizzare una versione più grande di questa figura.
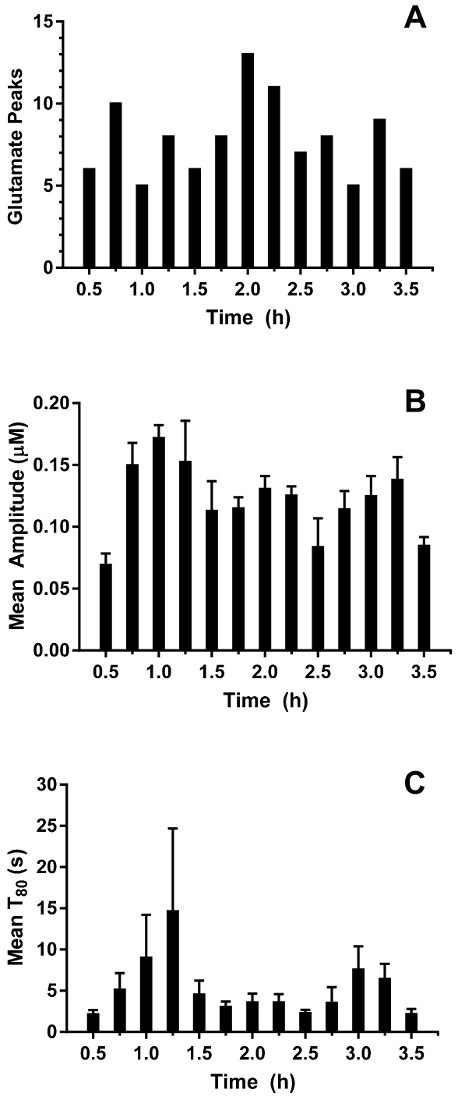
Figura 10: caratterizzazione sperimentale di glutammato nell'ippocampo di un porco neonatale sotto anestesia del sevoflurane. (A), A numero di picchi transitori glutammato in bidoni di 15 min. Picchi sono stati considerati significativi quando il rapporto segnale-rumore superato il 3 e il segnale non è stato correlato con il segnale di sentinella (R2 < 0,5). (B) l'ampiezza del glutammato transitorio picchi. Barre di errore indicano l'errore standard della media. (C) dire T80 dei picchi transitori di glutammato. Barre di errore indicano l'errore standard della media. Clicca qui per visualizzare una versione più grande di questa figura.
Discussione
Dall'inizio dell'esperimento, omeostasi fisiologica di quest'ultima deve essere mantenuta come descritto in previa pubblicazione21 questo laboratorio. Monitoraggio minimo dovrebbe includere pulsossimetria, elettrocardiografia, capnografia, pressione sanguigna non invasiva e temperatura. Gli investigatori addestrati sono necessari affinché perturbazioni fisiologiche (ad es., IPO/ipertermia, ipossia, ipotensione, aritmie) possono essere corretti in modo appropriato.
Prima di induzione, in vitro MEA tarature sono eseguite per stabilire la funzionalità e la selettività di MEA sotto condizioni note. La taratura e la placcatura di MEAs è fondamentale per un uso efficace della tecnologia. Ci sono molti dei potenziali errori che possono verificarsi durante la calibrazione. Calibrazione può identificare questi problemi così come la placcatura improprio, che conduce alla risposta errata interferent. È stato compilato un resoconto più dettagliato tabulare di errori che possono verificarsi in risposta MEA, lungo con notevole cause e le soluzioni suggerite, che dovrebbe rivelarsi un utile strumento per la risoluzione dei problemi probabile (tabella 1). È importante notare che prima della calibrazione e la placcatura, l'elettrodo di riferimento di vetro dovrebbe essere controllato per la presenza di bolle d'aria o alterazione di colore bianco, come uno avrà un impatto negativo funzione MEA e registrazione di precisione.
| Sintomo | Causa | Azione correttiva |
| Nessun segnale | Elettrodo non collegato | Collegamento elettrodo headstage e headstage al sistema amperometria veloce. |
| Nessun potere al sistema amperometria veloce | Accendere interruttore di accensione sul retro del sistema FAST | |
| Segnale rumore | Elettrodo contaminato da sangue | Irrigare continuamente la superficie del cervello durante l'inserimento dell'elettrodo |
| Sciacquare l'elettrodo immediatamente in dH2O | ||
| Rivestimento di enzima è allentato | Pulire e ricopra l'elettrodo | |
| Elettrodo di riferimento non è stata inserita o rivestito | Cappotto e posizionare l'elettrodo di riferimento più lontano sotto il cuoio capelluto | |
| Elettrodo è rilevare il movimento della superficie del cervello | Si verifica in genere in strutture superficiali. Inserire l'elettrodo più profondo (1 mm alla volta) se possibile | |
| Movimentazione degli animali | Animale è insufficientemente protetto | Spostare l'animale in direzione posteriore per proteggere meglio earbars sul cranio. Se necessario, elevare il busto per consentire migliore allineamento del corpo. |
| Animale è non adeguatamente anestetizzato | Verificare l'integrità dell'apparecchiatura anestetica. Titolo l'anestetico per una dose efficace e somministrare una dose intramuscolare rocuronio (5 mg/kg) | |
| Posizionamento elettrodo imprecise | Elettrodo non è correttamente allineato. | Regolare di nuovo l'elettrodo mantenendo il corretto collegamento del headstage. |
| Coordinate stereotassiche sono imprecise | Assicurarsi che l'Atlante di maialino fatto riferimento non utilizza un altro punto di riferimento o un piano di allineamento. | |
| Fare attenzione a non oscurare i segni di sutura segnando il cranio. |
Tabella 1: istruzioni per la risoluzione dei MEA uso nei suinetti. Possibili cause e azioni correttive per assistere con ottimizzazione e risoluzione dei problemi.
Un Atlante stereotassica per il maialino è utilizzato per determinare le coordinate stereotassiche dell'area di interesse rispetto ad un punto noto come bregma18. Bar orecchio dovrebbe essere correttamente protetti per assicurare che il cranio sia a livello e completamente immobilizzato. Prestare attenzione durante l'incisione del midline del cuoio capelluto per evitare segnando il cranio come questo potrebbe influire sulla visualizzazione delle linee di sutura. La finestra di craniotomia dovrebbe essere abbastanza grande da ospitare il MEA.
Questo protocollo presenta una serie di sfide tecniche che richiedono una suite operativa ben fornita e un investigatore/team specializzato negli aspetti chirurgici e anestetici del protocollo. Il modello inoltre presenta limitazioni finanziarie, in quanto il modello di porcellino è più costoso rispetto al modello del roditore; Tuttavia, è significativamente meno costosa che l'uso di primati non umani, che possono costare migliaia di dollari. L'uso della tecnologia MEA presenta le proprie sfide, come la procedura di rivestimento e placcatura manualmente gli elettrodi richiedono un abile investigatore o assistente per garantire sufficiente selettività e un funzionamento affidabile. Microelettrodi stessi sono fragili, come sono in ceramica e così facilmente danneggiati se adeguata cautela non è osservata. Microelettrodi sono soggetti a interferenze da altri dispositivi elettrici, che possono creare rumore nelle registrazioni e dal sangue al luogo attivo, che possa occludere i siti di registrazione. La necessità di attrezzature specializzate presenta un onere supplementare come una cornice stereotassica chirurgica deve essere personalizzata per immobilizzare il cranio di porcellino durante l'impianto. La cornice stereotassica, glutammato ossidasi e gli elettrodi stessi sono tutti costosi. Inoltre, la mancanza di un Atlante stereotassiche porcellino nell'ultimo decennio pone limitazioni tecniche che richiedono una particolare competenza per determinare la posizione specifica delle strutture profonde del cervello di porcellino. Sviluppo di un nuovo Atlante stereotassica, forse usando la formazione immagine a risonanza magnetica, sarebbe di migliorare notevolmente la capacità di utilizzare questa tecnologia nei suinetti.
Il maialino è un modello clinicamente rilevante per lo studio di AIN in gran parte dovuto le analogie esistenti tra questa specie e il neonato umano, come entrambi possiedono lo sviluppo e la struttura del cervello simili. A differenza dei modelli più comunemente usati come topi o ratti, il maialino ha una maggiore somiglianza di CNS agli esseri umani, che si presta per la traducibilità dei risultati del modello. Il modello di porcellino è inoltre più poco costoso e comporta meno complicato trattamento rispetto a un modello di primati non umani. Il modello di porcellino è destinato per esaminare il processo dal quale anestesia potrebbe indurre neurotossicità dello sviluppo, misurare il suo contributo al danno neurologico e combattere il problema dei danni causati da variabili di confondimento. Per esempio, ipossia potrebbe essere frainteso per danni causati da anestetici in quanto ha effetti globali sul cervello. Il maialino è utilizzato con le stesse condizioni di anestetiche e chirurgiche come quelli utilizzati in medicina umana per garantire la fedeltà dei risultati.
L'utilizzo di tecnologia basata su ceramica MEA Elimina molti degli svantaggi connessi con la contemporanea tecnica della microdialisi. Microdialisi ha limitato la risoluzione temporale e spaziale rispetto a metodi amperometrico come la MEA, che può registrare continuamente eventi di glutammato in multiplo, regioni microscopiche fino a 10 Hz23. Questa frequenza di campionamento rapido Elimina il fattore di confondimento di diffusione del neurotrasmettitore localizzata che è inerente a metodi di campionamento lento come microdialysis24. Inoltre, la MEA è un metodo meno invasivo rispetto a una sonda per microdialisi, che può causare il gliosis significativo durante l'inserimento e può alterare l'attività del neurotrasmettitore nel sito di inserimento22.
Utilizzando una gamma di modelli mammiferi, tecniche di misurazione e le regioni del cervello, gli studi precedenti hanno dimostrato glutammato basale livelli paragonabili a quelli trovati utilizzando questa tecnica. Ciò suggerisce che la tecnologia MEA, quando adattato al modello porcellino, fornisce valide registrazioni di concentrazione di glutammato in vivo (tabella 2).
| Autore (anno) | Tecnica di registrazione | Modello animale | Età | Regioni del cervello | Significa concentrazione basale del glutammato (µM) |
| Hascup et al (2008)23 | MEA (a base di enzima) | Roditore | 20 - 24 settimane | Corteccia prefrontale, striato | 3,3 ± 1.0; 5,0 ± 1.2 |
| Hascup et al (2010)25 | MEA (a base di enzima) | Roditore | 3 - 6 mesi | Ippocampo | 4.7-10.4 |
| Rutherford et al (2007)9 | MEA (a base di enzima) | Roditore | 3 - 6 mesi | Corteccia prefrontale, striato | 44,9 ± 4.7; 7,3 ± 0,9 |
| 26 di miele et al (1996) | Microdialisi (a base di enzima) | Roditore | - | Corpo striato | 3,6 ± 0,5 |
| Giorno et al (2006)27 | MEA (a base di enzima) | Roditore | 3 - 6 mesi | Corteccia frontale, corpo striato | 1,6 ± 0,3; 1,4 ± 0,2 |
| Quintero et al (2007)28 | MEA (a base di enzima) | Primate non - umano | 5.3-5.5 anni | Corteccia di premotor, corteccia motoria | 3,8 ± 1.7; 3,7 ± 0,9 |
| Stephens et al. (2010) 29 | MEA [Spencer-Gerhardt-2 (SG-2)] | Primate non - umano | 11 - 21 anni | Putamen | 8,53 |
| Kodama et al (2002)30 | Microdialisi (a base di enzima) | Primate non - umano | - | Corteccia prefrontale | 1.29-2,21 |
| Galvan et al (2003)31 | Microdialisi (a base di enzima) | Primate non - umano | Juvenile | Corpo striato | 28.74 ± 2.73 |
| Durante e Spencer (1993)32 | Microdialisi (a base di enzima) | Umano | 18 - 35 anni | Ippocampo | 20,3 ± 6,6 |
| Reinstrup et al (2000)33 | Microdialisi (a base di enzima) | Umano | - | Corteccia frontale | 16 ± 16 |
| Cavus et al (2005)34 | Microdialisi (a base di enzima) | Umano | 15 - 52 anni | Neocorteccia | 2,6 ± 0,3 |
Tabella 2. Confronto di glutammato extracellulare basale levelsacross vari modelli animali. Una selezionata rassegna di studi che stabilisce i livelli normali del glutammato extracellulare in animali sani svegli e anestetizzati mediante microdialisi o microelettrodi.
L'uso della tecnologia MEA per monitorare in vivo concentrazioni di glutammato nel modello piglet può consentire una valutazione futura di post-anestesia di porcellino risultati neurologici. Gli esperimenti di sopravvivenza sono stati pianificati, che saranno ulteriormente la comprensione dell'impatto a lungo termine dell'anestesia sul benessere neurocognitive dei neonati umani. Gli esperimenti di sopravvivenza verranno permetterà per test comportamentali e il monitoraggio di glutammato cambia molto tempo dopo l'esposizione di anestesia. È anche comune per i bambini a subire l'anestesia in condizioni dove potrebbero verificarsi stress fisiologico sotto forma di intervento chirurgico. Gli studi futuri affrontare l'influenza della chirurgia in termini di lesione neurologica e aumento nella neurotossicità consentirebbe più accurati modellazione di una regolazione clinica comune per i bambini. L'uso di modelli animali alternativi è anche fattibile, così come lo studio di questi diversi modelli attraverso l'impianto cronico, che ci permette di tenere traccia delle modifiche del comportamento associate neurotossicità. Stessa tecnologia MEA è versatile, così lo studio futuro non deve essere limitato all'analisi dei livelli di glutammato (ad es., GABA, colina, lisina, ecc. potrebbe essere analizzato).
Divulgazioni
Greg Gerhardt è il principale proprietario di Quanteon LLC. Jorge Quintero e Jason Burmeister hanno servito come consulenti di Quanteon LLC.
Riconoscimenti
Gli autori si desidera ringraziare i contributi della University of Kentucky Center for microelettrodo Technology (CenMeT) e Ohio State University laboratorio animale Resource Center (ULAR).
Materiali
| Name | Company | Catalog Number | Comments |
| Advance Liqui-Wean Pig Milk Replacer | PBS Animal Health | 292-13 | |
| Piglet Anesthesia Face-Cone Mask | VetEquip | 921428 | |
| Integra SL Anesthesia Workstation | DRE Veterinary | 2350 | This anesthesia workstation is chosen to best mimic the clinical monitoring experienced by pediatric patients in the operating room. Any anesthesia machine can be used as long as it allows for sufficient physiologic monitoring and intervention. |
| Sevoflurane | Ultane | 0074-4456-04 | |
| Rocuronium Bromide Injection | Hospira | 0409-9558-05 | |
| Medfusion 4000 IV Infusion | Smiths Medical | ||
| Model 1530 Heavy-Duty Research Model Stereotax | Kopf | custom made | |
| Model 1541 Piglet Adaptor | Kopf | custom made | |
| Infrared Spot Lamp | Amazon | B000HHQ94C | |
| Bair Hugger Torso Blanket | 3M | 540 | |
| Bair Hugger | 3M | 750 | |
| Sterile Alcohol Prep Pad | Fisherbrand | 22-363-750 | |
| Carbon Steel Rib-Back Surgical Blade | Bard-Parker | #10 | |
| Scalpel Handel | Havel's | HAN-G4 | |
| Surgical Scissors | World Precision Instruments | 504615 | |
| Mosquito Forceps | Sklar Surgical Instruments | 17-1225 | |
| Gauze Pads | Fisherbrand | 22-246-069 | |
| Adson Tissue Forceps | Teleflex | 181223 | |
| Dremel 111 Engraving Cutter | Amazon | Dremel 111 | |
| Microelectrode Array | Center for Microelectrdoe Technology, University of Kentucky | S2 4Ch MEA; custom made | |
| Headstage | Quanteon | 2pA/mV | |
| Wire, silver, PFA, .008" Bare, .0110" coated | A-M Systems | 786500 | |
| Fine Micromanipulator | Narishige Scientific Instrument Lab | MO-8 |
Riferimenti
- Hall, M. J., DeFrances, C. J., Williams, S. N., Golosinskiy, A., Schwartzman, A. National hospital discharge Survey: 2007 summary. Natl Health Stat Report. (29), 1-24 (2010).
- Ikonomidou, C., et al. Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain. Science. 283 (5398), 70-74 (1999).
- Mattson, M. P. Glutamate and neurotrophic factors in neuronal plasticity and disease. Ann N Y Acad Sci. 1144 (1), 97-112 (2008).
- Atlante, A., et al. Glutamate neurotoxicity, oxidative stress and mitochondria. FEBS Lett. 497 (1), 1-5 (2001).
- Kavitha, J., Durga, P., Ramachandran, G. Inhalational agents in anesthesia induced developmental neurotoxicity - Recent advances. Trends in Anaesthesia and Critical Care. 11 (1), 14-18 (2016).
- Zanghi, C. N., Jevtovic-Todorovic, V. A holistic approach to anesthesia-induced neurotoxicity and its implications for future mechanistic studies. Neurotoxicol Teratol. 60 (2), 24-32 (2017).
- Fan, X., et al. In situ real-time monitoring of glutamate and electrophysiology from cortex to hippocampus in mice based on a microelectrode array. Sensors (Basel). 17 (1), 1-8 (2016).
- Hinzman, J. M., et al. Diffuse brain injury elevates tonic glutamate levels and potassium-evoked glutamate release in discrete brain regions at two days post-injury: an enzyme-based microelectrode array study. J Neurotrauma. 27 (5), 889-899 (2010).
- Rutherford, E. C., Pomerleau, F., Huettl, P., Strömberg, I., Gerhardt, G. A. Chronic second-by-second measures of L-glutamate in the central nervous system of freely moving rats. J Neurochem. 102 (3), 712-722 (2007).
- Benveniste, H. Brain microdialysis. J Neurochem. 52 (6), 1667-1679 (1989).
- Kohno, T., et al. An improved method for the detection of changes in brain extracellular glutamate levels. J Neurosci Methods. 81 (1-2), 199-205 (1998).
- Hascup, K. N., Hascup, E. R. Electrochemical techniques for subsecond neurotransmitter detection in live rodents. Comp Med. 64 (4), 249-255 (2014).
- Rooij, N. F., Koudelka-Hep, M., Frey, O. Biosensor microprobe array for in vivo monitoring of neurotransmitters. EPFL. , (2010).
- Fan, X. T., et al. Cortical glutamate levels decrease in a non-human primate model of dopamine deficiency. Brain Res. 1552, 34-40 (2014).
- Hunsberger, H. C., et al. Using enzyme-based biosensors to measure tonic and phasic glutamate in Alzheimer's mouse models. J Vis Exp. (123), (2017).
- Hill, A. J., Jones, N. A., Williams, C. M., Stephens, G. J., Whalley, B. J. Development of multi-electrode array screening for anticonvulsants in acute rat brain slices. J Neurosci Methods. 185 (2), 246-256 (2010).
- Defranchi, E., et al. Feasibility assessment of micro-electrode chip assay as a method of detecting neurotoxicity in vitro. Front Neuroeng. 4 (6), (2011).
- Whitaker, E. E., et al. Use of a piglet model for the study of anesthetic-induced developmental neurotoxicity (AIDN): A translational neuroscience approach. J Vis Exp. (124), (2017).
- Kilkenny, C., et al. Animal research: reporting in vivo experiments: the ARRIVE guidelines. Br J Pharmacol. 160 (7), 1577-1579 (2010).
- Salinas-Zeballos, M., Ceballos, G., Gootman, P. . A stereotaxic atlas of the developing swine (Sus scrofa) forebrain. , 887-906 (1986).
- Whitaker, E. E., et al. A novel, clinically relevant use of a piglet model to study the effects of anesthetics on the developing brain. Clin Transl Med. 5 (1), (2016).
- Hascup, E. R., et al. Histological studies of the effects of chronic implantation of ceramic-based microelectrode arrays and microdialysis probes in rat prefrontal cortex. Brain Res. , 12-20 (2009).
- Hascup, K. N., Hascup, E. R., Pomerleau, F., Huettl, P., Gerhardt, G. A. Second-by-second measures of L-Glutamate and other neurotransmitters using enzyme-based microelectrode arrays. The Journal of pharmacology and experimental therapeutics. 324 (2), 725-731 (2008).
- Rice, M. E., Cragg, S. J. Dopamine spillover after quantal release: rethinking dopamine transmission in the nigrostriatal pathway. Brain Res Rev. 58 (2), 303-313 (2008).
- Hascup, E. R., et al. Rapid microelectrode measurements and the origin and regulation of extracellular glutamate in rat prefrontal cortex. Journal of Neurochemistry. 115 (6), 1608-1620 (2010).
- Miele, M., Boutelle, M. G., Fillenz, M. The source of physiologically stimulated glutamate efflux from the striatum of conscious rats. J Physiol. 497 (Pt 3), 745-751 (1996).
- Day, B. K., Pomerleau, F., Burmeister, J. J., Huettl, P., Gerhardt, G. A. Microelectrode array studies of basal and potassium-evoked release of L-glutamate in the anesthetized rat brain. J Neurochem. 96 (6), 1626-1635 (2006).
- Quintero, J. E., et al. Amperometric measures of age-related changes in glutamate regulation in the cortex of rhesus monkeys. Exp Neurol. 208 (2), 238-246 (2007).
- Stephens, M. L., Pomerleau, F., Huettl, P., Gerhardt, G. A., Zhang, Z. Real-time glutamate measurements in the putamen of awake rhesus monkeys using an enzyme-based human microelectrode array prototype. J Neurosci Methods. 185 (2), 264-272 (2010).
- Kodama, T., Hikosaka, K., Watanabe, M. Differential changes in glutamate concentration in the primate prefrontal cortex during spatial delayed alternation and sensory-guided tasks. Exp Brain Res. 145 (2), 133-141 (2002).
- Galvan, A., Smith, Y., Wichmann, T. Continuous monitoring of intracerebral glutamate levels in awake monkeys using microdialysis and enzyme fluorometric detection. J Neurosci Methods. 126 (2), 175-185 (2003).
- During, M. J., Spencer, D. D. Extracellular hippocampal glutamate and spontaneous seizure in the conscious human brain. Lancet. 341 (8861), 1607-1610 (1993).
- Reinstrup, P., et al. Intracerebral microdialysis in clinical practice: baseline values for chemical markers during wakefulness, anesthesia, and neurosurgery. Neurosurgery. 47 (3), 701-710 (2000).
- Cavus, I., et al. Extracellular metabolites in the cortex and hippocampus of epileptic patients. Ann Neurol. 57 (2), 226-235 (2005).
Ristampe e Autorizzazioni
Richiedi autorizzazione per utilizzare il testo o le figure di questo articolo JoVE
Richiedi AutorizzazioneThis article has been published
Video Coming Soon