Method Article
Mesure des Stolons et Rhizomes de Turfgrasses à l’aide d’un système d’analyse des images numériques
Dans cet article
Résumé
Un système d’analyse image logicielle fournit une autre méthode pour étudier la morphologie des espèces stolonifères et rhizomateuses. Ce protocole permet de mesurer de la longueur et le diamètre des stolons et rhizomes et peut être appliqué à des échantillons avec une grande quantité de biomasse et à une grande variété d’espèces.
Résumé
Longueur et diamètre des stolons ou rhizomes sont habituellement mesurés à l’aide des étriers et des règles simples. Cette procédure est lente et laborieuse, il est souvent utilisé sur un nombre limité de stolons ou de rhizomes. Pour cette raison, ces traits sont limités dans leur utilisation pour la caractérisation morphologique des plantes. L’utilisation des technologies de logiciel analyse l’image numérique peut surmonter les erreurs de mesure due à des erreurs humaines, qui ont tendance à augmenter car le nombre et la taille des échantillons aussi augmentent. Le protocole peut être utilisé pour tout type de culture, mais est particulièrement adapté aux plantes fourragères ou de graminées, où les plantes sont petites et nombreuses. Des échantillons de gazon se composent de la biomasse aérienne et une couche de terre supérieure à la profondeur du développement de rhizome maximale, selon l’espèce d’intérêt. Dans les études, les échantillons sont lavés dans le sol et stolons/rhizomes sont nettoyés à la main avant l’analyse par logiciel d’analyse des images numériques. Les échantillons sont séchés davantage dans un laboratoire de chauffage du four pour mesurer le poids sec ; par conséquent, pour chaque échantillon, les données résultantes sont de longueur totale, poids sec total et le diamètre moyen. Images numérisées peuvent être corrigées avant l’analyse, en excluant les éléments visibles, tels que le restant des racines ou des feuilles ne pas enlevés avec le processus de nettoyage. En effet, ces fragments ont normalement beaucoup plus petits diamètres que les stolons ou de rhizomes, donc ils peuvent être facilement exclus de l’analyse en fixant le diamètre minimal au-dessous duquel les objets ne sont pas considérés. Stolon ou rhizome densité surfacique peut alors être calculée basé sur la taille de l’échantillon. L’avantage de cette méthode est rapide et efficace de mesure de la longueur et le diamètre moyen des numéros de grands échantillons de rhizomes ou de stolons.
Introduction
L’étude de la morphologie de la plante est largement abordée dans toutes les disciplines des sciences de plantes y compris écologie, agronomie, biologie et physiologie. Le système de racine de plante est largement étudié pour son importance dans la tolérance au stress, la stabilité des sols, la croissance des plantes et la productivité. Stolons et rhizomes sont également largement étudiés pour leur rôle dans les stratégies de multiplication de plantes, régénérabilité et stockage des glucides. Stolons et rhizomes sont des tiges modifiées qui poussent horizontalement, soit au-dessus du sol (stolons) ou souterraines (rhizomes). Stolons et rhizomes contiennent également des nœuds régulièrement espacés et entrenoeuds, ainsi que méristématiques nœuds qui sont capables de faire naître de nouvelles racines et pousses1. Il y a eu un grand nombre d’études sur différents sujets, enquête sur les racines, stolons et rhizomes de diverses plantes2,3,4,5,6,7, 8. Système racinaire, stolons et rhizomes de turfgrasses sont étudiés en raison de leur importance dans le gazon qualité9, verdissement printemps après l’hiver dormance10et la tolérance d’usure et régénérabilité11. En outre, ces organes sont également étudiés dans d’autres cultures, turfgrasses tels que le riz12,4de soja, maïs13et pâturages où les tiges latérales jouent un rôle clé dans l’érosion de sol commande5.
La densité des racines longueur (longueur de racine par volume de sol) et le diamètre moyen sont couramment mesurées au moyen de balayage logiciel3,4,5,9,14,15, 16,17,18. À l’inverse, la longueur et le diamètre des stolons ou rhizomes sont habituellement mesurés avec une règle et d’étrier de19,3,20 et nécessitent beaucoup de temps et du travail21,22 , 23 , 24. par conséquent, ils sont souvent mesurés dans un nombre restreint de stolons ou rhizomes11,20,25 et se limitent souvent à la caractérisation morphologique des plantes uniquement. L’étude des traits de stolons et rhizomes dans une verrière mature implique d’échantillonnage d’une grande quantité de biomasse afin qu’habituellement seulement stolons et rhizomes poids sec densité (poids sec par unité de surface) sont déterminés7,11, 26 , 27. la masse sèche de stolons, en fait, peut être plus facilement mesurables que stolon longueur et le diamètre par échantillons dans une étuve de séchage. Toutefois, la longueur de stolon est une espèce importante et caractère variétal qui n’est pas bien lié à la masse sèche. Une étude récente sur le ray-grass anglais (Lolium perenne) a démontré qu’échantillons avec densité linéaire haute stolon n’avaient pas nécessairement stolon haute densité de poids6.
Analyse d’images systèmes permettent l’analyse des racines plus rapide28,29, plus précises et moins sujettes à l’erreur humaine30,21 que les méthodes manuelles traditionnelles31,32, 33. en outre, ces systèmes fournissent la grande flexibilité et outils facile à utiliser, y compris la lumière, configuration optique et la résolution, qui sont souvent calibré pour chaque scannés image34. Pornaro et al. 24 a démontré que le système de WinRHIZO, un système d’analyse image spécialement conçu pour la mesure des racines lavées, peut fournir une autre méthode pour analyser les traits de stolons et rhizomes plus complètement que les méthodes actuelles en surmontant erreurs de mesure causées par des erreurs humaines. Pour une description morphologique et des informations quantitatives sur la croissance des stolons et rhizomes, systèmes d’analyse d’images permet d’analyser un grand nombre d’échantillons rapidement, même avec une grande quantité de biomasse, ce qui permet d’augmenter la précision statistique. Par conséquent, progiciels de racine analyse fournissent une méthode de rechange, fiable et rapide pour l’étude de la croissance et la morphologie des stolons et rhizomes de plantes différentes espèces24.
Nous présentons une expérience menée en Italie du Nord-est pour étudier le développement de stolons et rhizomes de quatre cultivars d’observé (Cynodon SPP.). L’étude visait à accroître les connaissances sur le développement des stolons et rhizomes dans épépiné (« LaPaloma » et « Yukon ») et végétatives cultivars (« Patriot » et « Tifway ») d’observé. L’expérience a été établie en mai 2013 et gazon échantillons ont été prélevés sur trois dates d’échantillonnage par an, de l’automne 2013 à l’été 2015 [mars (avant la place verte), juillet (pleine saison) et octobre (avant la dormance hivernale)]. Pour la description et l’explication de cette méthode, nous avons utilisé des échantillons prélevés durant l’été de la deuxième saison de croissance (juillet 2014), dont l’importante biomasse des échantillons en ce moment a justifié la nécessité d’une analyse rapide. Le WinRHIZO, un outil de logiciel d’analyse d’images numériques spécialement conçu pour les mesures de la racine lavée, a servi à déterminer la densité de stolon longueur et diamètre moyen.
Protocole
1. prélèvement d’échantillons de la biomasse
- Prélever des échantillons, y compris la biomasse au-dessus du sol et une couche de sol à une profondeur appropriée selon les espèces (pour les espèces de gazon, une profondeur de 15 cm est généralement suffisante) d’assurer la perception des stolons et rhizomes.
Remarque : Dans l’ensemble taille du tracé doit être considérée avant d’entreprendre l’étude, puisque les échantillons destructrices seront prises. En général, plus l’expérience est menée, plus la taille du tracé nécessaire. - Vérifier les conditions du sol avant le prélèvement de l’échantillon : si le sol est trop sec, surtout dans les sols lourds, il peut être difficile de recueillir des échantillons. Dans ce cas, irriguer les terrains avant le prélèvement pour adoucir les couches de l’échantillon.
- Prélever des échantillons à l’aide d’un échantillonneur de noyau de sol (≥ 8 cm de diamètre) ou définir la zone de surface pour collecter avec un cadre (≥ 10 x 10 cm) et de recueillir les échantillons avec une bêche. Étiquetez chaque échantillon avec du ruban adhésif de laboratoire.
- Rassembler plusieurs échantillons aléatoires par parcelle pour qu’ils soient représentatifs de la population de la plante.
- Utiliser l’échantillonneur de même pour l’expérience entière et enregistrer la zone qui chaque échantillon représente pour calculer la densité de stolons et rhizomes.
Remarque : Le protocole peut être suspendu ici, et les échantillons peuvent être stockés dans des sacs en plastique et conservées à une température inférieure à-18 ° C.
2. nettoyage de la biomasse des échantillons
- Placer l’échantillon dans un grand tamis avec 0,5 à 1,5 mm ouvertures selon taille stolon ou rhizome. Les ouvertures doivent être suffisamment petits pour conserver tous les stolons et rhizomes, mais assez grand pour permettre aux particules de sol à enlever. Pour les sols sableux, deux tamis avec des ouvertures différentes, placés l’un au-dessus de l’autre, peuvent permettre pour une meilleure précision et efficacité.
- Nettoyer les échantillons avec un jet d’eau avec assez de puissance pour éliminer les saletés sans endommager les plantes.
- Récupérer les échantillons nettoyés et les placer dans un plateau avec des serviettes en papier, en prenant soin d’étiqueter les plateaux correctement.
Remarque : Le protocole peut être suspendu ici, et les échantillons peuvent être stockés dans des sacs en plastique et conservées à une température inférieure à-18 ° C. - De plus, nettoyer les échantillons en enlevant les racines et les feuilles avec des ciseaux. Au cours de ce processus, séparer les stolons et rhizomes, si nécessaire et enregistrer des informations supplémentaires telles que le nombre de plantes, motoculteurs et stolons par plante.
Remarque : Enlever tous les tissus de racines et de feuilles de stolons et rhizomes améliorera la précision. Les radicelles sont difficiles à enlever ; Cependant, grâce à l’analyse de l’image numérique, il est possible de les omettre dans l’analyse à l’aide d’une application logicielle qui exclut les organes ayant un diamètre inférieur à une valeur choisie (voir étape 5.1), qui est défini des observations assez précisément sur la base d’images reproduit à l’écran. - Lieu de stolons et rhizomes en papier étiqueté sacs.
Remarque : Le protocole peut être suspendu ici, et les échantillons peuvent être stockés dans des sacs en plastique et conservées à une température inférieure à-18 ° C.
3. détection et analyse des échantillons d’images
- Placer l’échantillon sur un plateau en plastique transparent de la norme WinRHIZO équipement de balayage. Placer manuellement les stolons et rhizomes à l’aide de pinces de laboratoire afin de minimiser le chevauchement. Grands échantillons doive être divisé en sous-échantillons.
- Ne pas ajouter de l’eau à la barre d’État (tel que recommandé pour les racines), parce que les stolons et les rhizomes ont une rigidité suffisante pour éviter la proximité excessive des organes qui peuvent entraîner des erreurs de lecture, ce qui se produit généralement avec les racines fines.
- Placer le plat sur la surface de scanne.
- Allumer le scanner et démarrer le programme en cours d’exécution.
- Vérifier les dpi image dans le menu Image , commande de paramètre acquisition d’Image, d’un contrôle supplémentaire possible dans l’image enregistrée.
- Vérifier le seuil en analyse, commande Root & Distinction de fond, pour le bon classement de pixel appartenant aux organes numérisées.
- Vérifiez que la surface du plateau entier sera analysée dans le menu Image , commande de paramètre acquisition d’Image.
- Vérifier la classe de diamètre affiché pour la distribution d’organes par le diamètre, dans la zone graphique au-dessus de l’image numérisée. Sélectionner les 20 classes de largeur égale avec des intervalles de 0,1 mm en cliquant sur l’axe horizontal du graphique. Cette fonction permet l’exclusion des données appartenant aux racines ou petits organes, quand les stolons ou rhizomes n’étaient pas parfaitement nettoyés. La littérature rapporte que la plupart des racines des espèces de gazon ont inférieure à 0,2 mm de diamètre.
Remarque : Largeur et nombre de catégories peuvent être modifiés en tenant compte du diamètre moyen des stolons et rhizomes pour les échantillons analysés et la variabilité autour de cette moyenne. Un contrôle devrait être effectué dans certains échantillons pour déterminer le diamètre minimal à exclure. - Exécutez la première numérisation d’échantillon et vérifiez que l’edit permet une bonne analyse.
- Suivez les instructions du logiciel pour l’enregistrement de l’image et traité d’analyse. Étiquette de l’image et l’analyse avec l’étiquette de l’échantillon.
- Procéder à la numérisation de tous les échantillons.
Remarque : Le protocole peut être suspendu ici, et les échantillons peuvent être stockés dans des sacs en plastique et conservées à une température inférieure à-18 ° C.
4. mesure de poids sec
- À l’aide d’une balance électronique de précise, placer les échantillons numérisés dans un plateau en aluminium taré.
- Répétez l’étape 4.1 pour tous les échantillons analysés.
- Insérez tous les échantillons dans un four réglé à 105 ° C et les faire sécher pendant 24 h.
- Enlever les échantillons et attendre jusqu'à ce que le poids du tissu s’est stabilisée.
- Peser tous les échantillons avec leur tare.
- Soustraire la tare du poids enregistré pour obtenir le poids net de chaque échantillon.
5. la correction des données et le calcul de la longueur et la densité de poids
- Correction de la longueur et le diamètre en moyenne
- Convertissez le fichier .txt résultant de l’analyse avec WinRHIZO dans un fichier .csv.
- Les résultats groupés pour les classes de diamètre permet d’exclure les données d’organes inférieurs à 0,2 mm (racines, partie des feuilles, ou des rayures sur le plateau).
- Pour chaque WinRHIZO lecture somme (lignes de fichier .txt) toutes les longueurs inscrit aux classes de diamètre supérieurs à 0,2 mm. La longueur calculée avec cette correction est la longueur efficace à utiliser pour le traitement des données.
- Pour chaque lecture de WinRHIZO, somme les zones de projection enregistrées pour le diamètre des classes plus de 0,2 mm. La proportion entre la longueur et de projection donne le diamètre moyen corrigé pour l’exclusion des organes d’un diamètre inférieur à 0,2 mm.
- Si l’échantillon a été divisé en sous-échantillons, calculer la longueur finale comme étant la somme de toutes les longueurs de sous-échantillon et calculer le diamètre moyen final tant que la proportion entre la somme de toutes les longueurs de sous-échantillon et la somme de toutes les zones de projection sous-échantillon.
- Lorsque cela est nécessaire, calculez la longueur et le poids de la densité par unité de surface selon la taille de l’échantillon.
- Utiliser les données obtenues pour l’analyse statistique.
Résultats
Une expérience sur le terrain a été créée à l’automne 2013 pour comparer le développement de stolons et rhizomes de quatre cultivars observé, notamment deux types de semis (« LaPaloma » et « Yukon ») et deux hybrides stériles de végétatives (« Patriot » et « Tifway »). Le dispositif expérimental était un dispositif en blocs aléatoire complet avec trois répétitions, pour un total de 12 parcelles (2 x 2 m).
Quatorze des stolons et quatorze rhizomes de chaque cultivar de gazon et de l’observé sauvages ont été prélevés au hasard dans les parcelles, ainsi que des plantes sauvages observé de plus en plus près les parcelles, pour un total de 70 stolons et 70 rhizomes. Tous les stolons et les rhizomes ont été nettoyés comme décrit dans le protocole (étape 2) avant outre mesure. Longueur et le diamètre de l’entre-nœud ont été mesurées avec un pied à coulisse et le dirigeant, respectivement, et le nombre de nœuds a été compté pour chaque stolon ou rhizome. Les temps nécessaires pour nettoyer et mesurer des échantillons de stolons et rhizomes avec la règle et l’étrier ont également été enregistrées. Diamètres de stolons et rhizomes ont été calculés comme le moyen de tous les diamètres d’entre-nœud mesurés. Stolon total et des longueurs totales de rhizome ont été calculés comme la somme de toutes les longueurs de l’entre-nœud. Par ailleurs, total numérisés des longueurs et diamètres numérisées de chaque stolon et rhizome ont été mesurées à l’aide d’un système d’analyse des images numériques, comme indiqué aux paragraphes 3 et 5. Les temps nécessaires pour mesurer les caractéristiques de stolons et rhizomes par le système d’analyse numérique ont été enregistrés. Chaque stolon et les rhizomes ont été ensuite couper avec des ciseaux pour séparer les entre-nœuds des nœuds et les entrenoeuds ont servi à estimer le diamètre de l’entre-nœud numérisés comme décrit aux étapes 3 et 5. Les coefficients de corrélation de Pearson ont été calculés pour les stolons et rhizomes (n = 70 stolons, n = 70 rhizomes) entre mesuré et scanné les longueurs, mesuré et scanné les diamètres et nombre de nœuds, la valeur absolue de la différence entre la mesure et diamètres numérisées et diamètres mesurés et diamètres entre-nœud numérisée. Les longueurs mesurées avec le souverain ont été utilisés pour calibrer les longueurs estimées par le système d’analyse des images numériques.
L’analyse de régression indique une forte corrélation entre la longueur de stolon scanné et longueur mesurée (Figure 1 a), avec une pente de 1,03 et l’intersection de-4.22, ainsi qu’entre longueur rhizome scanné et longueur mesurée (Figure 1 b), avec un pente de 1,03 et l’intersection de 4,22. Nettoyage à la main, 14 stolons et 14 rhizomes a pris un temps moyen de 21 min et 24 s et 11 min et 12 s, respectivement. Le temps moyen pour mesurer la longueur, le diamètre et un étrier et souverain était de 14 min et 6 s de stolons et 13 min et 35 s de rhizomes. L’analyse de logiciels et numérisation des échantillons à l’aide de WinRHIZO a eu une moyenne de 11 min pour les stolons et 12 min et 4 s de rhizomes.
Mesurée et diamètres numérisées sont également significativement corrélées dans les stolons et rhizomes. Les relations entre le diamètre mesuré et analysé étaient proche de 1:1, ce qui indique un bon ajustement des données (Figure 2 a et 2 b). Cependant, le point d’intersection a indiqué que le système d’analyse des images numériques surestimé diamètre mesuré, surtout pour des valeurs plus faibles, et que des valeurs plus élevées de diamètre de rhizome ont été sous-estimés. Cette surestimation peut être due à des nœuds de stolons qui sont analysés par le logiciel, qui touchent la surface de projection total qui sert à calculer le diamètre (rapport entre la surface de projection total et total longueur) et au contraire sont exclues lorsque les mesures sont empreint de l’étrier. La corrélation entre le nombre de nœuds et différence entre les valeurs de diamètre obtenues par les deux méthodes (mesurés et analysés) n’est significative que dans les stolons (Figure 3 a) ; aussi, les variations dans le nombre de nœuds a expliqué qu’une petite partie de la variation de cette différence (R2 = 14 %). La corrélation observée entre scanné diamètre entre-nœud et mesuré le diamètre (pentes de 1,01 et 0,98 pour stolons et rhizomes, respectivement ; intercepte de presque zéro) (Figure 4 a et 4 b) illustre ce diamètre de l’entre-nœud peut être avec précision estimée à travers le système d’analyse des images numériques aussi longtemps que les nœuds sont supprimés. Par conséquent, stolon total longueur moyenne diamètre et d’échantillons composé de nombreux stolons ou rhizomes peut être facilement et précisément quantifié en utilisant le système d’analyse des images numériques.
Dans le cadre d’une expérience en cours, un échantillon de gazon (20 x 20 x 15 cm de profondeur) a été recueilli dans chaque parcelle selon les saisons de l’automne 2013 à 2015 de l’été et a été traité comme décrit dans le protocole. La longueur de stolons et rhizomes par unité de surface (densité de longueur) et le poids par unité de surface (densité de poids) des échantillons prélevés en juillet 2014 sont présentés dans la Figure 5. Différences de densité de stolon longueur ont été observées entre les cultivars multipliées par voie végétative (« Patriot » et « Tifway ») et graines (« La Paloma » et « Yukon »). « Patriot » affiche la plus forte densité de longueur de rhizome, suivie de « Tifway » et les cultivars ensemencés. La densité de poids stolon était différente pour tous les cultivars, avec « Patriot », montrant la valeur la plus élevée, suivie par « Tifway », « La Paloma » et « Yukon ». Les cultivars végétative a également affichent des densités plus élevées de poids de rhizome que les cultivars à graines. Le développement des stolons et rhizomes longueur par unité de surface (densité de longueur) et le poids par unité de surface (densité de poids) du cultivar Patriot tout au long de la période d’étude sont rapportés à la Figure 6. Densité linéaire stolon affiche une augmentation de 2014 de mars à juillet 2014, et il n’a pas varié depuis juillet 2014 jusqu’en juillet 2015. Seulement quelques rhizomes trouvées dans des échantillons prélevés en octobre 2013 et en mars 2014. Densité de longueur de rhizome a augmenté en juillet 2104, atteignant ses valeurs les plus élevées, mais une baisse à nouveau en octobre 2014. Densité de poids stolon légèrement augmentée, de mars à juillet 2014 ; Cependant, une augmentation plus rapide a été observée de juillet à octobre 2014, avec une diminution subséquente en mars 2015. Densité de poids rhizome a une tendance similaire à densité de longueur de rhizome, avec sa valeur la plus élevée en juillet 2014.
Le logiciel inclut dans l’analyse de tous les objets dans l’image numérisée. Un exemple d’une disposition de l’analyse d’image numérique de WinRHIZO software est présenté (Figure 7), où les lignes de couleur différente superposer des objets (stolons) de diamètre variable pour calculer la longueur totale par classe de diamètre. Nous pouvons observer que l’analyse prend en fragments de compte des racines ou feuilles. Tel que décrit à l’étape 3.9, il est possible de limiter la largeur et le nombre de classes de diamètre qui sont analysés. L’histogramme montre la distribution des longueurs en classes de diamètre sélectionné (Figure 7). Cet histogramme peut servir à évaluer les classes de diamètre minimal à exclure. Une observation visuelle de ce graphique dans la partie supérieure de l’écran image souligne que la longueur a une distribution normale autour d’une moyenne moyenne classe de diamètre, à l’exception des deux premières classes qui montrent des valeurs plus élevées que celles montage normal aire de répartition. Même si les échantillons ont été soigneusement nettoyées, y compris ces plus petites classes, analyse de données peut affecter les résultats, surestimant la densité linéaire et de sous-estimer le diamètre moyen. Nos résultats montrent que la longueur des classes plus petites (diamètre < 0,2 mm) représentaient 13 à 32 % des valeurs de longueur de rhizome total résultant de l’analyse de logiciels (tableau 1). Par ailleurs, le diamètre moyen a été sous-estimé de 2 à 17 % (tableau 1).
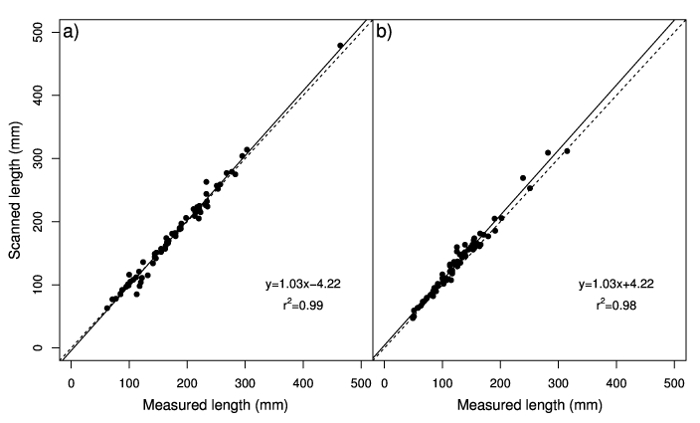
Figure 1 : Analyse de régression des valeurs de longueur mesurée avec la règle contre les valeurs estimées avec le système d’analyse numérique image d’observé stolons24 a et) rhizomes b. La ligne pointillée représente un ratio de 1:1. Groupe A a été modifié par Pornaro et al. 24. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
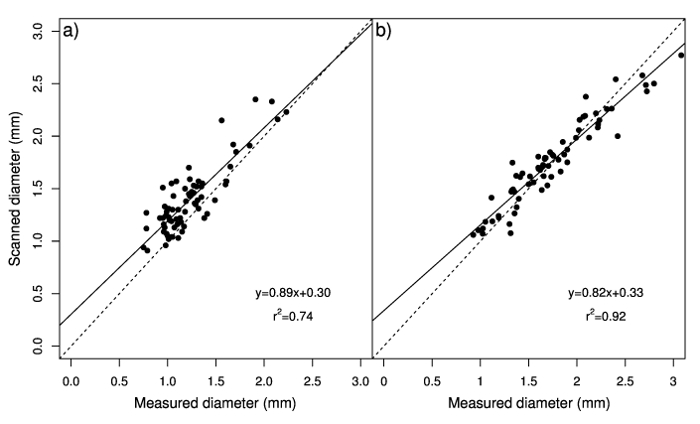
Figure 2 : Analyse de régression des valeurs de diamètre mesuré avec l’étrier aux valeurs estimées avec le système d’analyse des images numériques d’observé stolons24 b et rhizomes (b). La ligne pointillée représente un ratio de 1:1. Groupe A a été modifié par Pornaro et al. 24. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
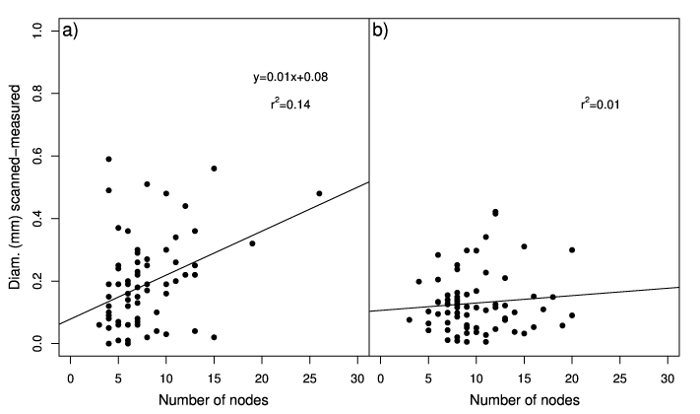
Figure 3 : Analyse de la régression du nombre de nœuds d’observé stolons24 b et rhizomes (b) contre les valeurs absolues de la différence entre le diamètre estimé avec le système d’analyse des images numériques et mesurée à l’aide de la pince. La ligne pointillée représente un ratio de 1:1. Groupe A a été modifié par Pornaro et al. 24. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
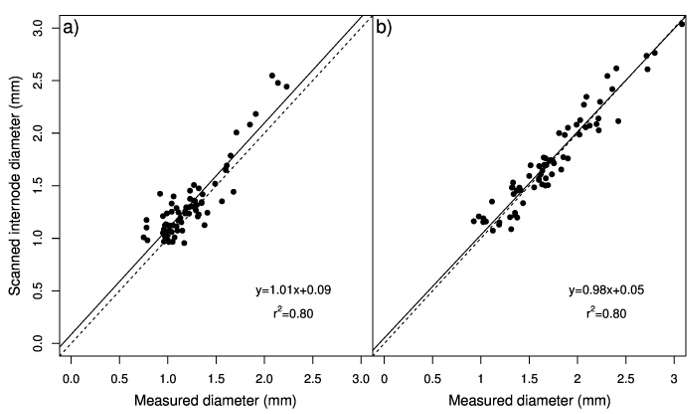
Figure 4 : Analyse de régression des valeurs de diamètre mesuré avec l’étrier aux valeurs estimées avec le système d’analyse numérique image observé stolons24 b et rhizomes (b) pour les entre-noeuds seulement. La ligne pointillée représente un ratio de 1:1. Groupe A a été modifié par Pornaro et al. 24. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 5 : résultats d’exemple de densité de longueur et le poids des stolons et rhizomes d’un essai sur le terrain en comparant quatre cultivars observé de gazon (Patriot, Tifway, La Paloma, Yukon). Stolon longueur densité (a), rhizome densité (b) de longueur, stolon poids densité (c) et rhizome poids densité (d). Barres verticales représentent les erreurs-types de six réplicats. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
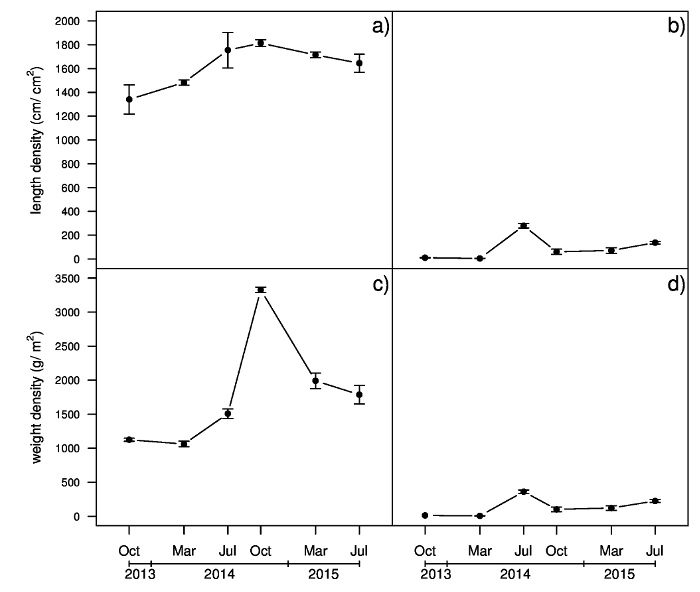
Figure 6 : résultats d’exemple de densité de longueur et le poids des stolons et rhizomes d’un essai de terrain montrant des stolons et rhizomes développement du cultivar observé Patriot. Stolon longueur densité (a), rhizome densité (b) de longueur, stolon poids densité (c) et rhizome poids densité (d). Barres verticales représentent les erreurs-types de six réplicats. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
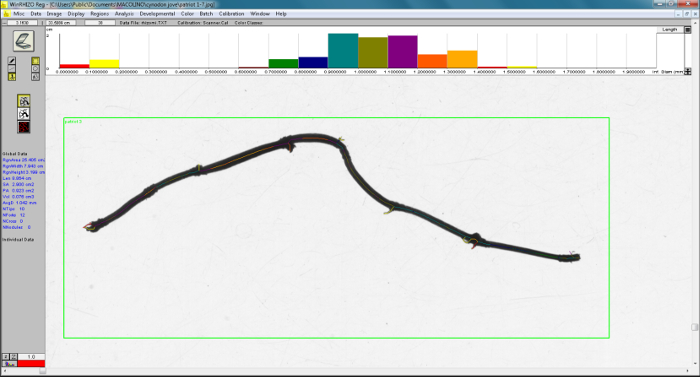
Figure 7 : mise en page d’exemple d’analyse d’image numérique de logiciel de WinRHIZO. L’image numérisée à l’avant-plan et les graphiques à barres dans la partie supérieure de l’image de l’écran présentent la distribution de longueur dans les classes de diamètre sélectionnés. Les lignes de couleur indiquent l’analyse d’image, et chaque couleur correspond aux couleurs des classes de diamètre indiqués dans les graphiques à barres. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
| Cultivar | Bloc | Longueur de rhizome (cm/dm2) | Diamètre moyen (mm) | ||||
| < 0,2 mm | total | rapport entreun | < 0,2 mm | total | rapportb | ||
| Patriote | 1 | 231 | 278 | 16,9 | 1.637846 | 1.5994 | 97,7 |
| Patriote | 2 | 304 | 349 | 12,8 | 1.620667 | 1.588371 | 98,0 |
| Patriote | 3 | 304 | 366 | 16,8 | 1.649918 | 1.621367 | 98.3 |
| Tifway | 1 | 184 | 231 | 20,6 | 2.149745 | 1.9951 | 92,8 |
| Tifway | 2 | 155 | 193 | 19,9 | 1.866253 | 1.76605 | 94,6 |
| Tifway | 3 | 119 | 150 | 20,9 | 1.877386 | 1.75865 | 93,7 |
| La Paloma | 1 | 17 | 23 | 24,4 | 2.139019 | 1.8904 | 88.4 |
| La Paloma | 2 | 26 | 38 | 31,6 | 2.101385 | 1.7455 | 83,1 |
| La Paloma | 3 | 34 | 47 | 27,5 | 2.033729 | 1.7354 | 85,3 |
| Yukon | 1 | 32 | 44 | 28,0 | 1.700155 | 1.4945 | 87,9 |
| Yukon | 2 | 17 | 25 | 33.2 | 1.68339 | 1.4284 | 84,9 |
| Yukon | 3 | 67 | 87 | 23,6 | 1.844721 | 1.6774 | 90,9 |
| une longueur de classes ≤0. 2 mm/total length | |||||||
| b diamètre/diamètre Total des classes ≤0. 2 mm | |||||||
Tableau 1 : densité de Rhizome longueur et diamètre moyen de rhizome avec et sans des classes de diamètre plus petits. Densité de longueur avec et sans inclure des classes de diamètre inférieures à 0,2 mm et leur démultiplication (longueur de classes ≤ 0,2 mm/total length) ; et le diamètre moyen avec et sans inclure des classes de diamètre inférieures à 0,2 mm et leurs rapports (y compris les classes de diamètre < 0,2/diamètre sans inclure diamètre classes < 0,2 mm).
Discussion
Le protocole décrit ici a été conçu et évalué pour l’étude des turfgrasses. Toutefois, il peut être utilisé sur un éventail d’espèces stolonifères ou rhizomateuses, avec les adaptations nécessaires selon leurs caractéristiques morphologiques, des conditions environnementales et échantillon nettoyage de précision.
Le diamètre moyen estimé par le présent protocole ne peut pas être comparé au diamètre entre-nœud mesuré avec un pied à coulisse. L’analyse d’image numérique comprend des nœuds et entrenoeuds dans le calcul du diamètre moyen, qui est le rapport entre la surface de projection total et total longueur. Tel que discuté par Pornaro et al. 24du diamètre moyen obtenu pour les stolons observé avec WinRHIZO système surestimé diamètre moyen valeurs mesurées avec l’étrier à l’entre-noeud. Diamètre du stolon est généralement utilisé pour décrire le diamètre des entrenœuds stolon et est un paramètre commun utilisé pour la description botanique18,25. Pour cette raison, Pornaro et al. 24 a souligné que diamètre moyen estimé par le biais de système de WinRHIZO et le diamètre de l’entre-nœud mesurée manuellement décrire deux aspects de la morphologie différente.
Le temps nécessaire pour effectuer ce protocole reste un facteur limitant pour l’analyse de routine. La plus longue phase est le nettoyage des échantillons (étape 2,4). Basé sur notre expérience, un échantillon de pelouse avec une grande quantité de biomasse de nettoyage (c'est-à-dire, 20 x 20 cm) nécessite environ trois personnes travaillant pour 2 à 4 heures. Comme décrit dans le protocole, le processus de nettoyage est nécessaire pour les deux le système d’analyse numérique et lors de l’utilisation de l’étrier et le souverain. Lorsque les échantillons sont constitués d’un nombre limité de stolons/rhizomes, le temps nécessaire pour recueillir des données avec les deux méthodes est semblable. Cependant, comme la taille de l’échantillon est augmentée, la méthode informatisée n’a pas un moment ultérieur augmenter, comme le seul facteur limitant est la surface du scanner. Au contraire, le temps nécessaire pour mesurer les organes avec la règle et l’étrier augmente avec le nombre des stolons ou rhizomes composant l’échantillon.
L’étude des traits de stolons et rhizomes dans turfgrasses mature a toujours été basée sur la mesure de la longueur de l’entre-nœud et le diamètre et la masse sèche poids7,11,26,27. En raison du grand temps nécessaire pour traiter les échantillons et la diminution de précision avec l’augmentation de la taille de l’échantillon, les mesures manuelles devraient se limiter à un petit nombre de stolons ou rhizomes11,20,25. Par conséquent, ils ne peuvent être appropriés pour les expériences de single-plante. L’avantage d’un système d’analyse image par rapport aux méthodes traditionnelles est qu’il qui permet de mesurer la longueur du grand stolon ou rhizome échantillons et calculer la densité de longueur et poids spécifique (rapport poids-longueur).
Ce protocole permet la mesure de longueur de stolons et rhizomes et calcul des densités de longueur dans les échantillons avec importante biomasse (pour lesquelles stolon ou rhizome poids est actuellement le seul paramètre utilisé pour la description de la morphologie). Longueur de stolon ou rhizome peut être un paramètre important dans de nombreuses études qui ne peut pas être estimée avec les techniques actuelles. Des études récentes sur gazon différentes espèces6 ont démontré que les densités de poids et de longueur stolon ne sont pas toujours corrélées, indiquant qu’il pourrait être souhaitable de mesurer plusieurs paramètres pour évaluer adéquatement le système stolons et rhizomes. Cette méthode devrait être particulièrement adapté pour le cultivar ou culturel comparaison des pratiques de gestion.
Plusieurs étapes dans le protocole sont essentiels pour une estimation réussie de longueur et un diamètre moyen de stolons et rhizomes. En raison de la forte variabilité de la morphologie de la plante sous des conditions environnementales différentes, le nombre d’échantillons (taille de l’échantillon) et zone de sol dimensions qui doivent être échantillonnés (dimension de l’échantillon) devraient être évalués avec soin et être aussi représentatif que possible de la population afin de réduire la variabilité des données. En outre, nettoyage racines et les feuilles des stolons avant que l’analyse est méticuleux travail nécessitant une attention particulière afin d’éviter des surestimations. Enfin, avant de traiter les images, il est recommandé de choisir soigneusement la largeur des classes et minimum diamètre en utilisant les options d’exclure tout ce qui n’est pas un stolon ou le rhizome de l’analyse. Chaque expérience requiert la sélection d’un diamètre minimum, comme le diamètre varie avec les espèces et les conditions environnementales, y compris les pratiques culturelles.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Aucun.
matériels
| Name | Company | Catalog Number | Comments |
| laboratory tape | Any | NA | Tags may be used to label samples |
| plastic bags | Any | NA | Any plastic bag can be used to keep samples until they have been cleened |
| paper bags | Any | NA | Any paper bag can be used to keep cleaned samples to avoid mold formation |
| paper towels | Any | NA | After samples have been washed with water and before to clean them with scissors it is helpful to put them on a paper towel to absorb water |
| scissor | Any | NA | Any scissor with fine tips |
| aluminium box | Any | NA | Any aluminium box large enough to contain the sample |
| trays | Any | NA | It is helpful to use plastic tray to hold samples during the cleaning process |
| sieve with 0.5-1.5 mm openings | Any | NA | Any sieve |
| soil core sampler | Any | NA | We use core sampler for soil collection with diameter of at least 8 cm |
| squared frame | Any | NA | To collect large samples we use squared frame (10 x 10 cm, or 15 x 15 cm, or 20 x 20 cm) |
| spade | Any | NA | We use spade to pull out samples delimited with squared frame |
| precision electronic balance | Any | NA | Any precision electronic balance |
| laboratory oven | Any | NA | Any laboratory oven |
| freezer | Any | NA | Any freezer |
| WinRHIZO software | Regent Instruments Inc., Quebec | NA | Excluded the "basic" version |
| WinRHIZO scanner | Regent Instruments Inc., Quebec | NA | WinRHIZO system includes a scanner calibrated for the software |
| WinRHIZO scanner accessories | Regent Instruments Inc., Quebec | NA | WinRHIZO system includes accessories, as plastic tray and positioner, to be used with the scanner |
Références
- Beard, J. B. . Beard's turfgrass encyclopedia for golf courses, grounds, lawns, sports fields. , (2004).
- Anderson, J. A., Taliaferro, C. M., Wu, Y. Q. Freeze tolerance of seed- and vegetatively propagated bermudagrasses compared with standard cultivars. Applied Turfgrass Science. , (2007).
- Gennaro, P., Piazzi, L. The indirect role of nutrients in enhancing the invasion of Caulerpa racemosa var cylindracea. Biological Invasions. 16 (8), 1709-1717 (2014).
- Ortiz-Ribbing, L. M., Eastburn, D. M. Evaluation of digital image acquisition methods for determining soybean root characteristics. Crop Management. , (2003).
- Pornaro, C., Schneider, M. K., Leinauer, B., Macolino, S. Above-and belowground patterns in a subalpine grassland-shrub mosaic. Plant Biosystems. 151 (3), 493-503 (2017).
- Pornaro, C., Menegon, A., Macolino, S. Stolon development in four turf-type perennial ryegrass cultivars. Agronomy Journal. , (2018).
- Rimi, F., Macolino, S., Richardson, M. D., Karcher, D. E., Leinauer, B. Influence of three nitrogen fertilization schedules on bermudagrass and seashore paspalum: II. Carbohydrates and crude protein in stolons. Crop Science. 53, 1168-1178 (2013).
- Schiavon, M., Macolino, S., Leinauer, B., Ziliotto, U. Seasonal changes in carbohydrate and protein content of seeded bermudagrasses and their effect on spring green-up. Journal of Agronomy and Crop Science. 202 (2), 151-160 (2016).
- Macolino, S., Ziliotto, U. Comparison of Turf Performance and Root Systems of Bermudagrass Cultivars and Companion Zoysiagrass. Acta Horticulturae. 938, 185-190 (2012).
- Giolo, M., Macolino, S., Barolo, E., Rimi, F. Stolons reserves and spring green-up of seeded bermudagrass cultivars in a transition zone environment. HortScience. 48 (6), 780-784 (2013).
- Lulli, F., et al. Physiological and morphological factors influencing wear resistance and recovery in C3 and C4 turfgrass species. Functional Plant Biology. 39, 214-221 (2012).
- Ramalingam, P., Kamoshita, A., Deshmukh, V., Yaginuma, S., Uga, Y. Association between root growth angle and root length density of a near-isogenic line of IR64 rice with DEEPER ROOTING 1 under different levels of soil compaction. Plant Production Science. 20 (2), 162-175 (2017).
- Qin, R., Noulas, C., Herrera, J. M. Morphology and Distribution of Wheat and Maize Roots as Affected by Tillage Systems and Soil Physical Parameters in Temperate Climates: An Overview. Archives of Agronomy and Soil Science. , 1-16 (2017).
- Barnes, B. D., Kopecký, D., Lukaszewski, A. J., Baird, J. H. Evaluation of turf-type interspecific hybrids of meadow fescue with perennial ryegrass for improved stress tolerance. Crop Science. 54, 355-365 (2014).
- Biernacki, M., Bruton, B. D. Quantitative response of Cucumis melo inoculated with root rot pathogens. Plant Disease. 85, 65-70 (2001).
- Bouma, T. J., Nielsen, K. L., Koutstaal, B. Sample preparation and scanning protocol for computersied analysis of root length and diameter. Plant and Soil. 218, 185-196 (2001).
- Kraft, J. M., Boge, W. Root characteristics of pea in relation to compaction and Fusarium root rot. Plant Disease. 85, 936-940 (2000).
- Rimi, F. . Performance of warm season turfgrasses as affected by various management practices in a transition zone environment. , (2012).
- Burgess, P., Huang, B. Growth and physiological responses of creeping bentgrass (Agrostis stolonifera) to elevated carbon dioxide concentrations. Horticulture Research. 1, 14021 (2014).
- Volterrani, M., et al. The Effect of Increasing Application Rates of Nine Plant Growth Regulators on the Turf and Stolon Characteristics of Pot-grown 'Patriot' Hybrid Bermudagrass. HortTechnology. 25 (3), 397-404 (2015).
- Böhm, W. Methods of studying root systems. Ecological studies: Analysis and synthesis. , 64-71 (1979).
- Box, J. E. Modern methods for root investigations. Plant Roots: The Hidden Half. , 193-237 (1996).
- Dowdy, R. H., Nater, E. A., Dolan, M. S. Quantification of the length and diameter of root segments with public domain software. Communications in Soil Science and Plant Analysis. 26, 459-468 (1995).
- Pornaro, C., Macolino, S., Menegon, A., Richardson, M. WinRHIZO Technology for Measuring Morphological Traits of Bermudagrass Stolons. Agronomy Journal. 109 (6), 3007-3010 (2017).
- Taliaferro, C. M., Martin, D. L., Anderson, J. A., Anderson, M. P. Patriot turf bermudagrass. United States Plant Patent. , (2006).
- Munshaw, G. C., Williams, D. W., Cornelius, P. L. Management strategies during the establishment year enhance production and fitness of seeded bermudagrass stolons. Crop Science. 41, 1558-1564 (2001).
- Rimi, F., Macolino, S., Richardson, M. D., Karcher, D. E., Leinauer, B. Influence of three nitrogen fertilization schedules on bermudagrass and seashore paspalum: I. Spring green-up and fall color retention. Crop Science. 53, 1161-1167 (2013).
- Murphy, S. L., Smucker, A. J. M. Evaluation of video image analysis and line-intercept methods for measuring root systems of alfalfa and ryegrass. Agronomy Journal. 87, 865-868 (1995).
- Wright, S. R., Jennette, M. W., Coble, H. D., Rufty, T. W. Root morphology of young Glycine max, Senna obtusifolia, and Amaranthus palmeri. Weed Science. 47, 706-711 (1999).
- Nilsson, H. E. Remote sensing and image analysis in plant pathology. Annual Review of Phytopathology. 15, 489-527 (1995).
- Ottman, M. J., Timm, H. Measurement of viable plant roots with the image analyzing computer. Agronomy Journal. 76, 1018-1020 (1984).
- Newman, E. I. A method of estimating the total length of roots in a sample. Journal of Applied Ecology. 3, 139-145 (1966).
- Tennant, D. A test of a modified line intersect method of estimating root length. Journal of Ecology. 63, 995-1001 (1975).
- Arsenault, J. L., Pouleur, S., Messier, C., Guay, R. WinRHIZO™, a root-measuring system with a unique overlap correction method. HortScience. 30, 906 (1995).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon