Method Article
Évaluation des réponses de cellules T spécifiques du Virus Zika dans les organes Immunoprivileged des Ifnar1 infecté les souris- / -
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Un protocole pour évaluer les réponses de cellules T spécifiques de l’antigène dans les organes d’immunoprivileged du Ifnar1- / - modèle murin pour l’infection de virus (ZIKV) de Zika est décrite. Cette méthode est essentielle pour étudier les mécanismes cellulaires de la protection et immunopathogenèse des vaccins ZIKV et est également précieuse pour leur évaluation de l’efficacité.
Résumé
Le virus Zika (ZIKV) peuvent induire une inflammation dans les organes d’immunoprivileged (par exemple, le cerveau et les testicules), entraînant le syndrome de Guillain-Barré et endommageant les testicules. Lors d’une infection avec le ZIKV, les cellules immunitaires ont démontré à s’infiltrer dans les tissus. Cependant, les mécanismes cellulaires qui définissent la protection et/ou l’immunopathogenèse de ces cellules immunitaires au cours d’une infection ZIKV sont encore largement inconnus. Ici, nous décrivons des méthodes pour évaluer les fonctionnalités de lymphocytes T spécifiques du virus dans ces organes immunoprivileged des souris infectées par le ZIKV. Ces méthodes incluent un) une infection ZIKV et l’inoculation du vaccin à Ifnar1 souris- / - ; b) histopathologie, immunofluorescence et immunohistochimie des tests pour détecter l’infection par le virus et l’inflammation dans le cerveau, les testicules et rate ; c) la préparation d’un tétramère d’épitopes de lymphocytes dérivé de ZIKV ; d) la détection des cellules T spécifiques ZIKV dans les monocytes isolées du cerveau, les testicules et la rate. En utilisant ces approches, il est possible de détecter les cellules de T antigène-spécifiques qui ont infiltré dans les organes d’immunoprivileged et d’évaluer les fonctions de ces cellules T au cours de l’infection : potentiel protection immunitaire via virus dégagement et immunopathogenèse et/ou d’aggraver l’inflammation. Ces résultats peuvent aussi aider à clarifier la contribution des cellules T induite par la vaccination contre la ZIKV.
Introduction
Le ZIKV est un flavivirus transmise par les moustiques qui a été isolé en 1947 en Ouganda d’un macaque rhésus fébrile. Récemment, la ZIKV est devenue une urgence de santé publique, en raison de sa diffusion rapide dans les Amériques et son lien inattendu avec microcéphalie et syndrome de Guillain-Barré pour1,2,3. Des données épidémiologiques, le ZIKV a été soupçonné d’être la cause du syndrome Guillain-Barré chez environ 1 par 4 000 infectés adultes4. En outre, une corrélation entre l’infection/dommages ZIKV et testicules chez la souris a été démontrée, ce qui suggère que l’infection de ZIKV, dans certaines circonstances, peut contourner la barrière sang-testicule et éventuellement conduire à une infertilité masculine5 . Ces résultats soulignent l’importance de comprendre complètement l’induction des réponses immunitaires protectrices ou pathologiques au cours d’une infection ZIKV.
Il reste encore beaucoup à apprendre au sujet de la réponse immunitaire cellulaire à la ZIKV. CD4+ et CD8+ lymphocytes réponses à la capside et enveloppe les protéines non structurales 1 (NS1) ont été observés chez infectés par ZIKV singes et les humains6,7,8. Chez la souris, plusieurs études ont montré que CD8+ T cellules jouent un rôle protecteur dans le contrôle de la ZIKV réplication9,10,11. Ce qui est important, Jurado et coll. ont démontré qu’une infection de ZIKV se traduit par la rupture de la barrière hémato - encéphalique et infiltration périvasculaire de CD8+ cellules effectrices T dans les testicules des souris- / - de Ifnar1. En outre, ils ont montré que CD8+ T cellules fomenter la paralysie associée à ZIKV et semblent jouer un rôle dans l’immunopathologie du cerveau néonatal. Dans une étude précédente, nous avons préparé le tétramère de294-302 ZIKV-E et a montré que CD8 spécifiques ZIKV+ T cellules existent dans le cerveau et la moelle épinière des souris- / - Ifnar1 infectées par le ZIKV, qui peuvent avoir des implications importantes pour la conception et le développement de vaccins ZIKV10.
En réponse à la nécessité urgente pour la vaccination prévenir l’infection ZIKV, plusieurs vaccins sont aux stades précliniques de développement, y compris les vaccins, vaccins recombinants vectoriel et vaccins sous-unité protéique purifié RNA. Le vaccin à ADN plasmidique est dans la phase des essais cliniques 112. L’évaluation de l’innocuité et l’efficacité des vaccins ZIKV sont donc importantes. Un des avantages des vaccins sont leur capacité à obtenir des réponses de lymphocytes spécifiques, qui peuvent être importantes pour la protection contre la ZIKV. À l’aide de tétramères axés sur l’épitope de lymphocytes dérivé de ZIKV, l’immunoréactivité de lymphocytes induite par un adénovirus-vecteur-vaccin basé sur les ZIKV pouvait être détectée chez les souris immunisées et glycoprotéines M et E se sont avérés induire robuste spécifique de l’antigène CD8+ Lymphocytes immunoréactivité13.
Au cours d’une infection par le virus, la reconnaissance des antigènes de peptide présenté par des molécules majeur d’histocompatibilité (MHC) complexes pour le récepteur des cellules T (TCR) est un mécanisme important de T-cell-mediated pour protéger l' hôte14. Basé sur cette théorie, la technologie tétramère est un outil unique pour élucider les rôles que jouent les cellules T antigène-spécifiques dans la régulation des réponses immunitaires15. Ce protocole décrit la mise en place de la modèle de souris Ifnar1- / - pour les infections ZIKV et la détection des cellules de T réactives dans la rate, le cerveau et les testicules des souris en utilisant la technologie tétramère. En outre, nous avons utilisé le tétramère de294-302 ZIKV-E de détecter et d’évaluer l’immunoréactivité de lymphocytes induite par un vaccin ZIKV (AdC7-M/F) chez les souris immunisées. Cette étude fournit des lignes directrices pour l’étude des réponses de cellules T dans les organes immunoprivileged et fournit une référence pour les applications potentielles dans le placenta ou le cerveau foetal.
Protocole
Des expérimentations animales ont été approuvées par le Comité d’Institut National de l’emploi et d’institutionnels animalier Viral Disease Control and Prevention, CDC Chine. Toutes les expériences ont été effectuées après l’animalier institutionnel et approuvé par Comité de l’utilisation des protocoles animales.
1. infection par le virus
- Gardez adulte (6 à 8 semaines) Ifnar1- / - (50 % d’hommes et 50 % de femmes) souris/standard exempts de micro-organismes pathogènes (SPF) des prescriptions spéciales et leur permettre un accès régulier à l’eau et de nourriture.
- Infecter les Ifnar1- / - souris avec le ZIKV via une inoculation de rétro-orbitaire de 100 µL de ZIKV dans un tampon phosphate salin (PBS) mémoire tampon contenant 1 x 104 focus formant des unités (FFUs) du virus. De même, fournissent des souris témoins avec un volume égal de PBS.
ATTENTION : Infecter les souris dans des conditions ABSL2 et exécuter ces procédures sur des souris infectées par le virus dans la prévention des risques biotechnologiques du cabinet. - Surveiller le poids et les signes cliniques (tremblements, quinconce mars, patte flasque bilatérale) des souris par jour pendant 15 jours.
2. la vaccination avec le vaccin ZIKV
- Utilisez Ifnar1 souris- / - (50 % d’hommes et 50 % de femmes) entre 6 et 8 semaines d’âge. Gardez les souris dans des conditions standard de SPF de 18 à 29 ° C et un cycle lumière/obscurité de 12 h avec accès à la nourriture et l’eau.
- Vacciner les Ifnar1- / - souris avec le vaccin ZIKV : injecter 100 µL de AdC7-M/E [4 x 1010 (particules virales)] dans du PBS tampon via une injection intramusculaire (voie i.m.) à l’aide d’une seringue de 1 mL avec une aiguille 23-G.
- De même, injecter des souris témoins avec un volume égal de PBS.
3. isoler les Monocytes de la rate
Remarque : L’isolement des monocytes de la rate est décrit comme mentionné plus haut16.
- Anesthésier la souris immunisées et infectées par le ZIKV 7D après l’inoculation, à l’aide d’un 5 % isoflurane concentrationin 100 % d’oxygène (avec un débit de 1 L/min). Euthanasier les souris par dislocation cervicale. Puis, immédiatement tremper la souris toute en éthanol 75 %.
ATTENTION : d’à partir de cette étape, toutes les procédures expérimentales doivent être effectuées aseptiquement dans une armoire de sécurité biologique. - À l’aide d’aiguilles, fixer les branches des souris (euthanasiés, précédemment infectés/immunisés) sur la plaque de mousse avec l’abdomen vers le haut.
- Couper la peau le long de la ligne médiane abdominale au thorax avec un scalpel stérile, couper les muscles abdominaux avec des ciseaux, exposition de la cavité abdominale et retirer délicatement le foie.
Remarque : L’orgue longue, rouge foncé à gauche de l’estomac est la rate. - Enlever la rate, le rincer 3 fois dans du PBS pour enlever le sang et placez-le dans 1,5 mL de milieu glacé de Roswell Park Memorial Institute (RPMI). Garder la rate sur la glace.
- Pour générer une suspension de cellules individuelles de la rate, placez l’organe ou les organes sur un tamis de cellule stérile maille de 40 µm-au sommet d’un tube de 50 mL et ajouter 2 mL de glacé RPMI moyen contenant 10 % foetale de sérum bovin (FBS). En utilisant le piston d’une seringue de 5 mL, mécaniquement écraser l’organe ou les organes et ajouter le support jusqu'à ce que l’orgue a été entièrement au sol à travers les mailles.
- Transférer la suspension de cellules dans un tube de 15 mL et il centrifuger à 600 x g pendant 5 min à 4 ° C. Retirez le surnageant.
- Remettre en suspension les cellules avec 5 mL d’un tampon de lyse des globules rouges (GR) (NH4Cl, Na2EDTA et KHCO3; Voir la Table des matières) et incuber la réaction de lyse à température ambiante pendant 5 à 6 min.
- Arrêter la lyse de RBC avec 10 mL de glacee milieu RPMI/FBS et centrifuger le tube à 600 x g pendant 5 min à 4 ° C. Retirez le surnageant.
- Remettre en suspension les cellules avec 10 mL de milieu RPMI complet (RPMI avec 10 % vol/vol FBS et 100 U/mL de pénicilline-streptomycine). Transférer 10 µL de la suspension cellulaire à un petit tube, mélangez-le avec 10 µL de 0,4 % wt/vol bleu trypan et compter le nombre de cellules à l’aide d’un hémocytomètre.
4. isolement des Monocytes du cerveau et des testicules
- Anesthésier la souris mâles infectés par ZIKV 7D après l’inoculation, à l’aide de 5 % ilexistedansl 100 % d’oxygène (avec un débit de 1 L/min). Euthanasier les souris par dislocation cervicale. Puis, immédiatement tremper la souris toute en éthanol 75 %.
ATTENTION : De partir de cette étape, toutes les procédures expérimentales doivent être effectuées stérilement dans une armoire de sécurité biologique. L’isolement des monocytes du cerveau et les testicules est décrite comme mentionné plus haut17. - Immobiliser une souris mâle (euthanasiée, précédemment infectée) en position couchée sur une planche à découper.
- Fixer le cuir chevelu avec une pince de 1 x 2 dents droites et utiliser des ciseaux Iris de faire une incision médiane sur le cuir chevelu pour exposer le crâne.
- Serrez les deux côtés des orbites avec pince à épiler pointu et fixer le cerveau. Placer une pointe de ciseaux pointus de Iris dans le trou occipital et coupez latéralement dans le crâne. Répétez cette étape pour l’autre côté.
- Utilisez un pointu Iris ciseaux pour couper avec précaution de la cavité même, jusqu'à la ligne médiane, vers le nez. Essayez de garder la fin des ciseaux aussi superficiel que possible pour ne pas blesser le cerveau.
- Soulever le cerveau avec une pince et se servir des ciseaux pointus de Iris à disséquer attentivement les fibres de nerf crânien. Enlever le cerveau avec une pince et le placer dans un tube de 15 mL contenant 5 mL de milieu de FBS RPMI/10% glacée.
- Prenez la peau abdominale avec une pince et ciseaux pointus de Iris permet de faire une incision longitudinale à travers le tégument et la paroi abdominale et exposer la partie la plus basse de l’abdomen. Poussez les testicules jusqu'à l’incision. Doucement, retirer la couche de graisse avec des pincettes et exposer un testicule globulaire des deux côtés.
- Utilisation forte Iris ciseaux pour disséquer soigneusement la couche de graisse et de l’épididyme. Placer les testicules dans un tube de 15 mL contenant 5 mL de milieu de FBS RPMI/10% glacée avec une pince.
- Pour générer une suspension de cellules individuelles dans le cerveau ou les testicules, placer l’orgue sur un tamis de cellule stérile avec une maille de 100 µm au sommet d’un tube de 50 mL et ajouter 2 mL de milieu de FBS RPMI/10% glacée. En utilisant le piston d’une seringue de 5 mL, écraser l’orgue et ajouter moyen jusqu'à ce que l’orgue a été entièrement au sol à travers les mailles.
- Transférer la suspension de cellules dans un tube de 15 mL et il centrifuger à 600 x g pendant 5 min à 4 ° C. Retirez le surnageant.
- Remettre en suspension les cellules avec 5 mL de milieu gradient de densité 30 % et, ensuite, ajouter très lentement à 2 mL de milieu de gradient de densité 70 % dans un tube de 15 mL.
- Couper le frein et centrifuger les tubes à 4 ° C à 800 g pendant 30 min. obtenir les lymphocytes de la couche intermédiaire.
- Transférer l’interphase dans un nouveau tube de 15 mL, ajouter 10 mL de milieu de FBS RPMI/10% froid et centrifuger le tube à 300 x g pendant 10 min à 4 ° C. Retirez le surnageant.
- Remettre en suspension les cellules avec 10 mL de glacee milieu RPMI/FBS et eux centrifuger à 600 x g pendant 5 min à 4 ° C. Retirez le surnageant.
- Remettre en suspension les cellules avec 10 mL de milieu RPMI complet et compter le nombre de cellules comme à l’étape 3.9.
5. tétramère préparation
- Construire des plasmides exprimant les domaines extracellulaires de H-2Db avec un tag de site biotinylé sur l’extrémité C-terminale du domaine α3 et la β2m en utilisant le vecteur de pET28a avec une restriction site Ndel et XohI18.
- Express et préparer les corps d’inclusion de H-2Db et β2m comme décrit plus haut20.
-
Rature et purifier le MHC/peptide complexe H-2Db-E294-302.
- Préparez 200 mL d’une solution de repliement [100 mM Tris-HCl (pH 8,0), 400 mM de L-arginine, 2 mM, EDTA sodique, 5 GSG et 0,5 mM GSSG]. Ajouter des inhibiteurs de la protéase : 2 mL de fluorure de sulfonyle (PMSF, stock 100 mM), 100 µL de pepstatine (stock 2 mg/mL) et 100 µL de leupeptine (stock 2 mg/mL). Cool le tampon à 4 ° C pendant 30 min.
- Ajoutez H-2Db, β2m et peptide à la solution de repliement.
- Injecter 500 µL de β2m dissoute dans une solution de guanidine (stock de 30 mg/mL) à l’aide d’une seringue. Pour ce faire, utilisez une aiguille 23 G avec une seringue de 5 mL et injecter la β2m dans la solution de repliement goutte à goutte. Conserver la solution constamment et lentement en remuant à 150 tr/min à 4 ° C.
- Après que β2m a été dissous dans la solution de repliement, résoudre 2 mg de peptide294-302 E dans 200 µL de DMSO et injecter rapidement dans la solution de repliement à l’aide d’une pipette. Incorporer lentement la solution à 150 tr/min à 4 ° C pendant 15 min.
- Injecter 1,5 mL de H-2Db dissous dans une solution de guanidine. Garder l’émoi bar tournant à 150 tr/min pour le repliement de la H-2Db à 4 ° C pendant 8 à 10 h.
Remarque : La solution a été placée dans une boîte fermée dans une chambre froide.
- Concentrer la protéine replissée dans une chambre pressurisée avec une membrane kDa 10. Échange de la mémoire tampon [20 mM Tris-HCl (pH8.0), 50 mM NaCl] à la chambre et il se concentrer pour un volume final de 30 à 50 mL.
- Transférer la solution repliement dans un tube à centrifuger et faire tourner à 2 500 g pendant 15 min à 4 ° C.
- Transvaser avec soin le surnageant à un filtre centrifuge à 10 kDa et concentrer davantage pour un volume final de 500 µL à 2 500 g pendant 30 min.
- Transférer le surnageant dans un nouveau tube et faire tourner à 12 000 g pendant 15 min. purifier la protéine avec S200 10/300 GL de chromatographie de filtration sur gel.
- Recueillir le pic complex MHC et concentrer pour un volume final de 350 µL.
- Pour générer un volume réactionnel de 500 µL pour biotinylation, ajouter les régents dans l’ordre suivant : 100 µL de la solution A [0. 5 m bicine (pH 8,3)], 100 µL de solution B (ATP, 100 mM, MgOAc, 200 biotine µΜ 100 mM), 100 µL d’appoint d-biotine (biotine de 500 µΜ) , 20 µL d’enzyme BirA (60 µg), 0,5 µL de pepstatine (2 mg/mL) et 0,5 µL de leupeptine (2 mg/mL). Incuber le tube de réaction pendant une nuit à 4 ° C.
ATTENTION : N’ajoutez pas de n’importe quel EDTA à la réaction de biotinylating. - Purifier le MHC utilisant un S200 colonne de filtration sur gel 10/300 GL pour supprimer toute biotine supplémentaire.
-
Déterminer l’efficacité de biotinylating avec un dosage de streptavidine-MAJ18.
- Préparer les trois échantillons, A, B et C, sur la glace pendant 30 min. Ensuite, analyser les résultats d’un 10 % SDS-PAGE. Échantillon A se compose de 8 µL de molécules du CMH biotinylé et 2 µL de tampon d’échange, échantillon B 8 µL de molécules du CMH biotinylé et 2 µL de streptavidine (20 mg/mL) et échantillon C 2 µl de streptavidine (20 mg/mL) et 8 µL de tampon de change.
ATTENTION : Ne pas faire bouillir l’échantillon.
- Préparer les trois échantillons, A, B et C, sur la glace pendant 30 min. Ensuite, analyser les résultats d’un 10 % SDS-PAGE. Échantillon A se compose de 8 µL de molécules du CMH biotinylé et 2 µL de tampon d’échange, échantillon B 8 µL de molécules du CMH biotinylé et 2 µL de streptavidine (20 mg/mL) et échantillon C 2 µl de streptavidine (20 mg/mL) et 8 µL de tampon de change.
-
Former des multimères des biotinylées MHC.
- Produire tétramère en mélangeant le biotinylé E294-302 peptide-H2Db complexe streptavidine marquée phycoérythrine à un rapport molaire de 1:5 pour assurer une liaison complète de toutes les molécules du CMH biotinylé.
- Calculer la quantité de conjugué streptavidine-nécessaire pour tétramérisation.
- Déterminer les taupes des complexes MHC/peptide représente la concentration de protéines et la masse molaire (exemple : 1,8 mg de protéine totale = 40 nmol).
- Calculer les taupes du besoin en divisant les taupes du MHC/peptide par 5-conjugué streptavidine (exemple : 40/5 = 8 nmol de streptavidine-conjugué).
- Calculer le montant de streptavidine (en µg) selon le conjugué streptavidine (exemple : streptavidine-PE [300 000 g/M] → 8 nmol nécessaire = 2 400 g).
- Divisons 10 échantillons de streptavidine-phycoérythrine. Ajouter chaque échantillon dans un tube contenant le biotinylé E294-302 peptide-H2Db complexe, à un intervalle de 20 min. Après avoir chargé le dernier échantillon, incuber le tube de réaction à 4 ° C durant la nuit dans l’obscurité.
- Appliquer les réactifs multimerized dans un tube de spin de 100 kDa et concentrer par centrifugation à 2 000 x g à 4 ° C pour un volume de < 100 µL.
- Diluer l’échantillon dans le tube de spin à 4 mL à l’aide de PBS (pH 8,0) et concentrer encore < 100 µL.
- Répétez l’étape l’échange de la mémoire tampon dans du PBS (pH 8,0) x 4.
- Remplir le volume total de plus de 500 µL à l’aide de PBS (pH 8,0). Concentrer l’échantillon à une concentration estimée de 2 à 2,5 mg/mL à 2 000 x g à 4 ° C. Conserver l’échantillon dans l’obscurité à 4 ° C.
6. cytométrie en flux
- Incuber les suspensions cellulaires (de l’étape 3,9 et/ou étape 4.15) à 4 ° C 0.1 µl de réactif de blocage de récepteurs Fc-CD16/CD32 anti-murin par 20 µL (dilution facteur 1 : 200) pendant 10 min, pour éviter toute liaison non-spécifique.
- Centrifuger le tube de tétramère à 20 000 x g pendant au moins 15 min à 4 ° C.
- Ajouter 20 µL de la suspension cellulaire à un 96 puits platecontaining 1 x 106 cellules chaque puits.
- Préparer un volume suffisant du mix E294-302 tétramère de colorer tous les tubes expérimentales. Préparer un excès de 15 % du volume total de ce mélange au compte pour les erreurs de pipetage. Diluer les tétramères de294-302 E (2 mg/mL, 1 µL/test) dans un tampon de FACS (PBS, 0,5 % FBS) afin que 20 µL du mélange E294-302 tétramère est ajoutée à chaque test.
- Ajouter 20 µL du mélange tétramère294-302 E à la plaque à 96 puits. À la fin de cette étape, le volume final de chaque puits devrait être 40 µL.Incubate la plaque dans l’obscurité à température ambiante pendant 30 min.
- Ajouter des anticorps primaires (conjugué FITC ou APC conjugué anti-CD3 (0,2 mg/mL), PerCP-conjugué anti-CD8 (0,2 mg/mL)) à 1 µL/test à la suspension cellulaire et, ensuite, incuber il à 4 ° C pendant 30 min à l’obscurité.
- Laver les cellules 2 x avec 2 mL de tampon de FACS et centrifuger à 600 x g pendant 5 min. soigneusement aspirer le surnageant et remettre en suspension les cellules avec 200 µL de tampon de FACS.
- Stocker les échantillons temporairement à 4 ° C dans l’obscurité jusqu'à ce que la cytométrie.
-
Utilisez la stratégie de blocage suivante pour la cytométrie.
- Créez un portail sur les maillots en diagonale en cluster en traçant une zone de diffusion (SSC) forward scatter (FSC) versus le côté.
- Puis, porte sur le CD3+ cellules de côté diffusion (SSC) versus CD3 ; Ensuite, porte sur le CD3+ CD8+ cellules ; Enfin, exposer brièvement CD8+ tetrámeras+ cellules19.
7. histopathologie, Immunofluorescence et dosage de l’immunohistochimie
-
Dosage de l’histopathologie
- Recueillir les tissus de cerveau et les testicules de la Ifnar1 infectées par le ZIKV- / - souris 7D après l’inoculation et fixez-les en formaldéhyde tampon neutre à 4 %.
ATTENTION : paraformaldéhyde est toxique ; porter un équipement de protection individuelle approprié. - Incorporer le tissu à la paraffine.
- Section de tissu à 5 mm à l’aide d’un vibratome.
- Tacher le tissu à l’hématoxyline et éosine (H & E).
- Recueillir les tissus de cerveau et les testicules de la Ifnar1 infectées par le ZIKV- / - souris 7D après l’inoculation et fixez-les en formaldéhyde tampon neutre à 4 %.
-
Dosage de l’immunohistochimie
- Déparaffiner, s’hydrater et antigène-récupérer le tissu sections, basées sur des procédures décrites précédemment21.
- Traiter les sections de tissu avec 3 % H2O2 dans du PBS (pH 7,6) pendant 10 min et les bloquer avec 1 % sérum d’albumine bovine (BSA) pendant 10 min.
- Incuber les sections de tissu avec des anticorps CD3 de rat anti-souris (dilution : 1/1 000) pendant 8 h à température ambiante et, ensuite, les incuber à 4 ° C jusqu’au lendemain.
- Rincer les tissus avec du PBS et, ensuite, les incuber avec 3 gouttes de secondaire biotinylé (dilution : 1/1 000) pendant 2 h à température ambiante, puis 3 gouttes de l’avidine-biotine-peroxydase (dilution : 1/200) à température ambiante pendant 30 min.
- Lier, avec 3 gouttes de 30, 30-diaminobenzidine tétrahydrochlorure (dilution : 1/1 000), comme décrit plus haut22.
- Contre-coloration les coupes de tissus avec l’hématoxyline de Mayer.
-
Test d’immunofluorescence
- Sécher les sections de testicules gelés (6 mm) pendant 10 min à température ambiante.
- Fixez-les à l’acétone glacée pendant 10 min.
- Laver les sections avec PBS pour x 3 et les bloquer avec un tampon de blocage (1 % de BSA, 0,3 % Triton, solution 1 PBS x) à 37 ° C pendant 30 min.
- Incuber les coupes de tissus avec de l’anticorps primaire (Z6) (20 µg/mL) à 4 ° C la nuit.
- Rincer les tissus avec du PBS et appliquer l’anticorps secondaire (facteur de dilution : 1/200) pendant 1 h à 37 ° C.
- Laver les sections de tissu avec du PBS et eux contre-coloration pour les noyaux à l’aide de 4', 6-diamidino-2-phénylindole (DAPI) (facteur de dilution : 1/1 000), suivant les instructions du fabricant.
Résultats
Suite à ces méthodes, nous avons développé un modèle murin pour les infections ZIKV. 1 x 104 unités de formation de focus (FFU) ont contracté Ifnar1 souris- / - 6-8 semaines d’âge de la ZIKV par injection retroorbital. Symptômes pathologiques et signes (Figure 1A), ainsi que les changements de poids (Figure 1B), ont été observés chez les souris de Ifnar1- / - après une infection par le ZIKV. Le cerveau murin a montré évident œdème et hyperhémie (Figure 1C). Pendant ce temps, les testicules ont diminué progressivement (Figure 1D). En outre, des changements pathologiques et la destruction des tissus ont été trouvés dans le cerveau et les testicules (Figure 2A). Nous avons effectué un test d’immunofluorescence pour détecter le ZIKV dans le cerveau et les testicules (Figure 2B). Les charges virales élevées ont été détectées dans le cerveau et les testicules par immunomarquage (Figure 2B). L’immunohistochimie montre une infiltration robuste du CD3+ T des cellules dans le cerveau de souris après l’infection par le ZIKV (Figure 2C).
Pour détecter et évaluer les réponses des lymphocytes-T de ZIKV spécifiques, nous avons préparé une souris MHC-j’ai tétramère de H-2Db-E294-302 . Le peptide E294-302 peut aider la rature deb H-2D correctement et produisent une grande quantité de MHC soluble-je (Figure 3A). Dans l’analyse de décalage, une grande efficacité dans la biotinylation pu être observée (Figure 3B). Par la suite, trois streptavidine fluorescence (APC, PE et BV421) - tag SPHL - j’ai tétramères ont été produits pour détecter les cellules T spécifiques ZIKV (Figure 3C). Le tétramère marqués au PE avait une efficacité supérieure pour détecter le CD8 spécifiques+ des lymphocytes T par rapport à l’APC - et BV421-étiqueté tétramères, bien que la différence n’était pas statistiquement significative.
En utilisant le tétramère de294-302 E, nous avons détecté des lymphocytes T spécifiques ZIKV dans la rate des souris infectées par cytométrie à 7 jours après l’inoculation de la ZIKV (3,49 ± 0,45 %). En outre, semblable à la méthode décrite à l’article 3 du présent protocole, à la vaccination après 4 semaines de vaccin AdC7-M/E, lymphocytes T spécifiques ZIKV ont été détectés dans la rate (6,89 ± 1,36 %) (Figure 4).
En outre, nous avons détecté les lymphocytes que se sont infiltrés dans les organes immunoprivileged, comme le cerveau et les testicules, après l’infection ZIKV. Les portes ont été fixés pour sélectionner pour CD3+CD8+ T des cellules dans les lymphocytes totaux du cerveau et des testicules. Un taux élevé de lymphocytes T E294-302 tétramère spécifiques pouvait être détecté dans le cerveau (42,2 % en CD3+CD8+ T cellules) et les testicules (26,4 % en CD3+CD8+ T cellules) lymphocytes (Figure 5).
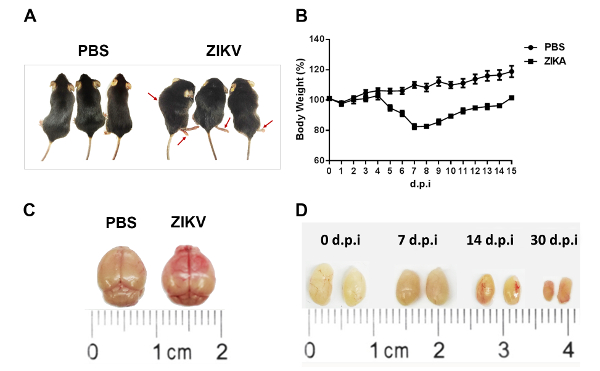
Figure 1 : Caractérisation de l’infection ZIKV chez les souris- / - Ifnar1. Ifnar1 souris- / - 6-8 semaines d’âge étaient infectés par 10 unités de formation de mise au point4 (FFU) de la ZIKV par injection de retroorbital, et souris injectées avec du PBS ont été utilisés comme témoins non infectés. Ont suivi la morphologie (A) et (B) des changements de poids des souris infectées de Ifnar1- / . Les flèches rouges indiquent Ifnar1- / - souris présentées myeloparalysis et paraparésie moteur après l’infection. (C) cerveau à post-inoculation 7D et les testicules (D) à 0, 7, 14 et 30 jours après l’inoculation ont été récoltés. Des images représentatives du cerveau et les testicules des souris sont affichées avec une règle pour indiquer les tailles. Les barres d’erreur représentent la moyenne ± SEM. n = 10 souris par groupe et par l’expérience. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
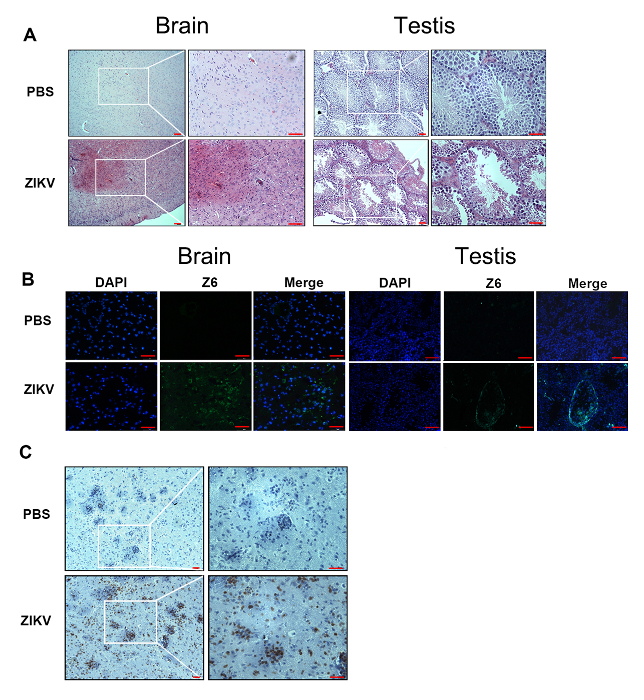
Figure 2 : Détection de le ZIKV et de lymphocytes dans le cerveau et les testicules des souris- / - de ZIKV-infecté Ifnar1. (A), ce panneau montre les changements histopathologiques dans le cerveau et les testicules des souris infectées par le ZIKV par rapport à des témoins négatifs à post-inoculation 7D. Echelle = 25 µm (panneau de gauche) et 50 µm (panneau de droite). (B) une immunofluorescence analyse a été réalisée avec l’anticorps de Z6 anti-ZIKV (vert). Tous les échantillons de tissus ont été prélevés de souris infectées par ZIKV à post-inoculation 7D. Les noyaux ont été colorés au DAPI (bleus). Echelle = 50 µm. (C) l’immunohistochimie montre une infiltration robuste du CD3+ T des cellules dans le cerveau et les testicules. Echelle = 25 µm (panneau de gauche) et 50 µm (panneau de droite). Purple indique l’hématoxyline, brown représente l’anticorps CD3. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
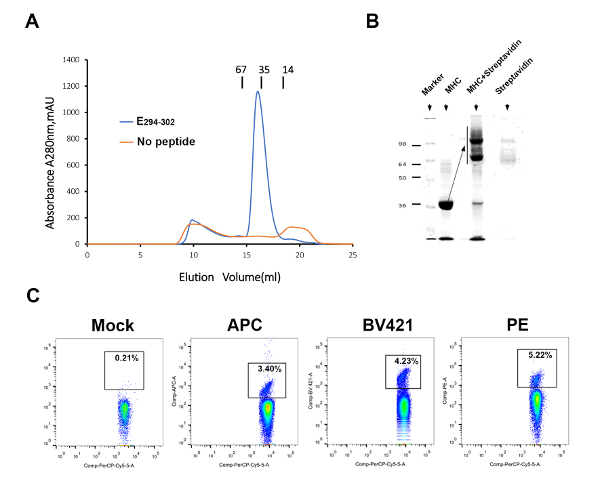
Figure 3 : Préparation de ZIKV spécifiques SPHL-j’ai tétramères. (A), la liaison de la294-302 de E à H-2Db est élucidée par un repliement in vitro . Le bleu indique la protéine H-2Db-E294-302 . Orange représente le contrôle négatif sans peptide. (B), ce panneau indique l’analyse de décalage H-2Db-E294-302 . (C), le simulacre représente un contrôle de PBS. Trois streptavidine fluorescence (APC, PE et BV421) - tag SPHL - j’ai tétramères ont été utilisés pour détecter les cellules T spécifiques ZIKV. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
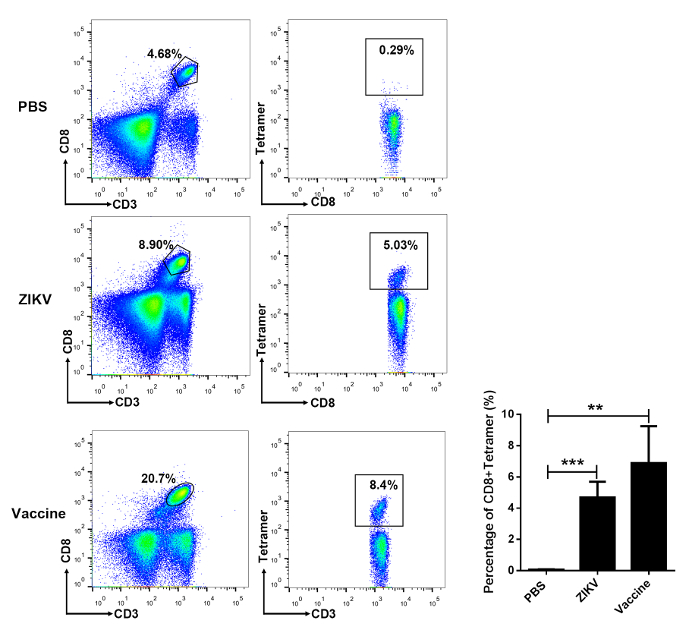
Figure 4 : Analyse par cytométrie en flux de CD8 spécifiques du virus d’écoulement + Des lymphocytes T dans la rate des souris infectées par le ZIKV et vaccin immunisés. Ifnar1 souris- / - 6-8 semaines d’âge étaient atteints soit de 10 unités de formation de mise au point4 (FFU) de ZIKV ou a reçu une dose unique de 4 x 1010 particules virales AdC7-M/E ou PBS comme témoin négatif. Après 7 jours après l’infection ou la vaccination après 4 semaines, splénocytes de souris ont été récoltés et analysés par cytométrie en flux. Les données sont indiquées comme moyenne ± SD. statistique analyse a été effectuée à l’aide de ANOVA à (non significative : P > 0,05 ; *P < 0,05 ; **P < 0,01 ; ***P < 0,001 ; ***P < 0,0001). S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
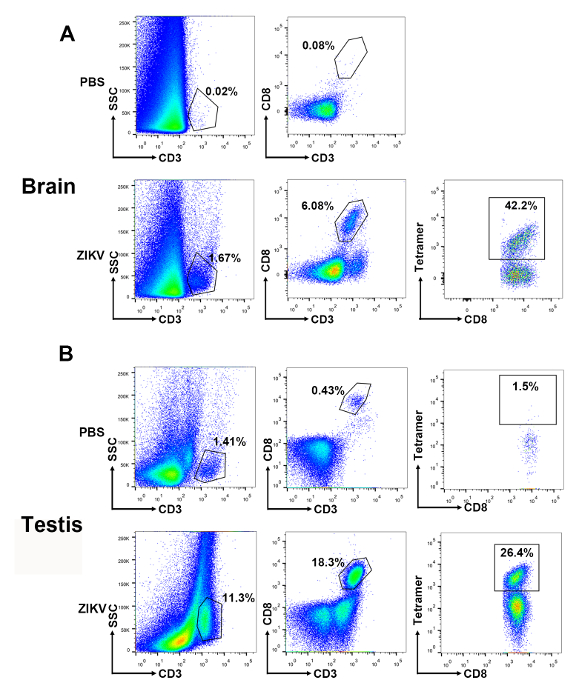
Figure 5 : + T gating stratégie et représentant les résultats des CD8 spécifiques du virus des cellules dans le cerveau et les testicules des souris infectées par le ZIKV. Des emplacements représentatifs sont indiqués pour les lymphocytes infiltrés dans (A) le cerveau et (B), les testicules. Une succession de portes a la valeur sélectionnez lymphoïdes-scatter+ et CD3+ événements. Parmi ceux-ci, CD8+ événements sont bloquées pour l’analyse des cellules T spécifiques d’épitope. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Discussion
Épitope immunogène de T-cellule joue un rôle important dans l’immunité cellulaire contre les agents pathogènes23. Ainsi, la détection des cellules T spécifiques ZIKV dans les organes d’immunoprivileged est une méthode critique pour comprendre les réponses des lymphocytes contre l’infection naturelle de ZIKV. Pendant ce temps, détection de réponse des lymphocytes T est un excellent outil pour étudier l’efficacité du vaccin viral. Ici, nous montrons un protocole complet pour visualiser les expériences, notamment l’isolement des lymphocytes de la rate, le cerveau et les testicules des souris infectées par le ZIKV, la préparation du E d’épitope immunodominant294-302 tétramère, ainsi que la reconnaissance des CD8 spécifiques ZIKV+ T des cellules dans les organes immunoprivileged des souris infectées par le ZIKV.
Une étude antérieure a montré qu’un ZIKV direct ou son ARN peut être détecté dans le sperme des patients de sexe masculin, qui indique que le ZIKV peut contourner la barrière sang-testicule et se répliquer dans le système reproducteur24. Auparavant, les auteurs montrent également que la ZIKV peut endommager les testicules et conduire à une infertilité masculine en souris25. ZIKV infection peut entraîner une virémie chez les singes rhésus et l’ARN viral peut être détectée dans le système nerveux central (CNS), ainsi que dans les organes viscéraux. L’immunohistochimie a révélé que les antigènes spécifiques de ZIKV ont été présentées dans le système nerveux central ainsi que les multiples organes périphériques26. Aussi, dans les modèles murins, infection ZIKV peut induire une robuste CD8 antiviral+ réponse des lymphocytes de la rate et le CNS26.
Par rapport aux travaux antérieurs, cette étude établit des méthodes systématiques pour détecter les CD8 spécifiques ZIKV+ lymphocytes réponses dans le cerveau et les testicules, qui sont des sites d’immunoprivileged. Il est important d’évaluer la fonctionnalité des cellules T spécifiques du virus dans les organes immunoprivileged des souris infectées par le ZIKV. L’utilisation de tétramères pour détecter les CD8 spécifiques ZIKV+ lymphocytes réponses dans les organes immunoprivileged renforcerait considérablement notre compréhension des infections ZIKV et leurs réactions immunitaire de l’hôte. À l’aide de tétramère294-302 E, lymphocytes T spécifiques du virus dans le cerveau et les testicules peuvent être isolés par cytométrie en flux, pour étudier les mécanismes cellulaires de la protection et l’immunopathogenèse au cours d’une infection ZIKV. Pendant ce temps, il est utile pour les chercheurs de poursuivre l’enquête les fonctions de la CD8+ T cells pour contrôler la ZIKV, ou pour améliorer l’immunopathogenèse dans ces organes au cours de l’infection ZIKV.
Pour analyser le CD8 murins spécifiques de l’antigène+ lymphocytes réponses dans les organes immunoprivileged, nous avons préparé tétramère de294-302 - E H-2Dbet détecté le CD8+ T des cellules par cytométrie en flux. Tétramères sont un outil puissant pour détecter les cellules T spécifiques de l’antigène. Ici, trois types de fluorochrome conjugué streptavidine (APC, PE et BV421) ont été générés. Bien qu’il n’y a aucune différence statistiquement significative dans l’APC, BV421 et tétramères marqués au PE pour détecter les cellules T spécifiques de l’antigène, SPHL marqués au PE-j’ai tétramères a donné les meilleurs résultats. Par conséquent, le tétramère marqués au PE a été utilisé tout au long de cette étude. Fait intéressant, basé sur le tétramère de294-302 - E PE marquée H-2Db, nous avons détecté des rapports élevés de cellules T antigène-spécifiques dans le cerveau et les testicules, qui indiquent la capacité de migration des cellules T spécifiques du virus dans le sang à organes immunoprivileged.
Cependant, il existe certaines limitations du protocole. Le tétramère de294-302 - E H-2Dbn’est pas utile pour la détection de cellules T humaine, car détection tétramère est tributaire de la restriction MHC. La projection des peptides de restriction HLA immunodominant est encore nécessaire. En outre, rétro-orbitaire infection est efficace pour une infection ZIKV mais peut être pas une opération commode pour certains chercheurs. Ainsi, les autres voies d’infection, y compris la péritonéale, sous-cutanée ou intraveineuse, sont également recommandés.
Dans le protocole décrit ici, une étape essentielle est l’isolement des monocytes du cerveau et les testicules. Il est important d’acquérir des lymphocytes de grande qualité ; ainsi, il est important de faire attention à, par exemple, la vitesse centrifuge, la force du tissu meulage et la dissection du tissu de cerveau et les testicules. D’ailleurs, pour la préparation du tétramère, inhibiteurs de la protéase (PMSF, pepstatine, leupeptine) sont utiles quand une protéine protégeant de dégradés. Par conséquent, il est logique d’ajouter un inhibiteur de la protéase au tampon de repliement et d’échanger le tampon pendant le processus de la préparation du tétramère.
En conclusion, nous présentons des méthodes de dépistage des réponses de cellules T spécifiques de l’antigène dans les organes immunoprivileged du- / - modèle souris Ifnar1 pour une infection ZIKV. Cette plate-forme peut être largement appliquée pour étudier les mécanismes immunitaires de ré-émergentes et les virus qui peuvent contourner les barrières entre le sang et les organes d’immunoprivileged. En outre, cette étude pourrait ouvrir la voie pour le développement de vaccins et d’immunothérapies.
Déclarations de divulgation
Les auteurs n’ont rien à déclarer.
Remerciements
Les auteurs remercient Gary Wong pour la révision anglaise. Ce travail a été soutenu par la National Key Research and Development Programme of China (2017YFC1200202 de concession), les grands projets de l’extraordinaire pour recherche de maladie infectieuses de Chine (subvention 2016ZX10004222-003). George F. Gao est chercheur principal leader du National Natural Science Foundation de Chine innovantes Research Group (fief 81621091).
matériels
| Name | Company | Catalog Number | Comments |
| Z6 | our lab | Ma W, Li S, Ma S, et al. Zika virus causes testis damage and leads to male infertility in mice. Cell, 2016, 167: 1511-1524 e1510 | |
| CD3 | Santa Cruz | sc-1127; RRID: AB_631128 | |
| Fluorescein-Conjuated Affinipure Goat anti-human IgG(H+L) | ZSGB-BIO | ZF-0308 | |
| Rabbit Anti-Goat IgG, FITC Conjugated | CWBIO | CW0115 | |
| FITC anti-mouse CD3 | Biolegend | 17A2 | |
| APC anti-mouse CD3 | Biolegend | 100236 | |
| PerCP anti-mouse CD8a | Biolegend | 100732 | |
| Percoll | GE Healthcare | P8370 | |
| PMSF | Ameresco | 0754-5G | Toxic and corrosive reagent. Handle with care |
| Streptadivin | BD | S4762-FZ | Gives a clear solution at 10mg/ml in PBS and stored at -20 °C |
| Pepstatin | Sigma | P4265-5MG | 5 mg in 2.5 mL DMSO, aliquots stored at -20 ºC |
| Leupeptin | Sigma | L8511 | 5 mg in 2.5 mL dH2O, aliquots stored at - 20 ºC |
| Peptides | Scilight-peptide | Must be resuspended in DMSO and stored at -20 °C | |
| RPMI 1640 | Hyclone | SH30809.01 | Must be stored at 4 °C |
| DMSO | MP | 219605590 | Store at room temperature. |
| APC-Streptadivin | BD | 554067 | Must be stored and maintained at 4 °C. Do not freeze. |
| FITC-Streptadivin | BD | 554060 | Must be stored and maintained at 4 °C. Do not freeze. |
| PE-Streptadivin | BD | 554061 | Must be stored and maintained at 4 °C. Do not freeze. |
| BV421-Streptadivin | BD | 563259 | Must be stored and maintained at 4 °C. Do not freeze. |
| PageRuler Unstained Protein Ladder | Thermo Fisher Scientific | 26614 | Must be stored at 4 °C |
| Cell Strainers | BF | BF10-5040 | Store at room temperature. |
| Amicon Ultra 100 kDa | Millipore | UFC510024 | Store at room temperature. |
| Ultracentrifuge | Thermo Fisher Scientific | ||
| FACS Cantol | Flow cytometer must contain lasers and filters that are compatible with the staining panel used. | ||
| Superdex 200 Increase 10/300 GL | GE healthcare | 28990944 | |
| AKTA PURE | GE healthcare | ||
| red blood cell lysis buffer | Solarbio | R1010 | Store at 4 °C. |
Références
- Dick, G. W., Kitchen, S. F., Haddow, A. J. Zika virus. I. Isolations and serological specificity. Transactions of the Royal Society of Tropical Medicine and Hygiene. 46 (5), 509-520 (1952).
- Hazin, A. N., et al. Computed Tomographic Findings in Microcephaly Associated with Zika Virus. The New England Journal of Medicine. 374 (22), 2193-2195 (2016).
- Zhang, Y., et al. Highly diversified Zika viruses imported to China, 2016. Protein & Cell. 7 (6), 461-464 (2016).
- Cauchemez, S., et al. Association between Zika virus and microcephaly in French Polynesia, 2013-15: a retrospective study. The Lancet. 387 (10033), 2125-2132 (2016).
- Turtle, L., et al. Human T cell responses to Japanese encephalitis virus in health and disease. The Journal of Experimental Medicine. 213 (7), 1331-1352 (2016).
- Dudley, D. M., et al. A rhesus macaque model of Asian-lineage Zika virus infection. Nature Communications. 7, 12204(2016).
- Osuna, C. E., et al. Zika viral dynamics and shedding in rhesus and cynomolgus macaques. Nature Medicine. 22 (12), 1448-1455 (2016).
- Stettler, K., et al. cross-reactivity, and function of antibodies elicited by Zika virus infection. Science. 353 (6301), 823-826 (2016).
- Zhao, M., Zhang, H., Liu, K., Gao, G. F., Liu, W. J. Human T-cell immunity against the emerging and re-emerging viruses. Science China Life Sciences. 60 (12), 1307-1316 (2017).
- Huang, H., et al. CD8+ T Cell Immune Response in Immunocompetent Mice during Zika Virus Infection. Journal of Virology. 91 (22), 00900-00917 (2017).
- Elong Ngono, A., et al. Mapping and Role of the CD8+ T Cell Response During Primary Zika Virus Infection in Mice. Cell Host & Microbe. 21 (1), 35-46 (2017).
- Marques, E. T. A., Burke, D. S. Tradition and innovation in development of a Zika vaccine. The Lancet. 391 (10120), 516-517 (2017).
- Xu, K., et al. Recombinant Chimpanzee Adenovirus Vaccine AdC7-M/E Protects against Zika Virus Infection and Testis Damage. Journal of Virology. , 01722-01817 (2018).
- Jama, B. P., Morris, G. P. Generation of human alloantigen-specific T cells from peripheral blood. Journal of Visualized Experiments. (93), e52257(2014).
- Legoux, F. P., Moon, J. J. Peptide:MHC tetramer-based enrichment of epitope-specific T cells. Journal of Visualized Experiments. (68), e4420(2012).
- Govindarajan, S., Elewaut, D., Drennan, M. An Optimized Method for Isolating and Expanding Invariant Natural Killer T Cells from Mouse Spleen. Journal of Visualized Experiments. (105), e53256(2015).
- Posel, C., Moller, K., Boltze, J., Wagner, D. C., Weise, G. Isolation and Flow Cytometric Analysis of Immune Cells from the Ischemic Mouse Brain. Journal of Visualized Experiments. (108), e53658(2016).
- Altman, J. ohnD., et al. Phenotypic Analysis of Antigen-Specific T Lymphocytes. Science. 274, 94-96 (1996).
- Li, H., Zhou, M., Han, J., Zhu, X., Dong, T., Gao, G. F., Tien, P. Generation of murine CTL by a hepatitis B virus-specific peptide and evaluation of the adjuvant effect of heat shock protein glycoprotein 96 and its terminal fragments. J Immunol. 174 (1), 195-204 (2005).
- Valkenburg, S. A., et al. Preemptive priming readily overcomes structure-based mechanisms of virus escape. Proceedings of the National Academy of Sciences of the United States of America. 110 (14), 5570-5575 (2013).
- Shang, T., et al. Toll-like receptor-initiated testicular innate immune responses in mouse Leydig cells. Endocrinology. 152 (7), 2827-2836 (2011).
- Evilsizor, M. N., Ray-Jones, H. F., Lifshitz, J., Ziebell, J. Primer for immunohistochemistry on cryosectioned rat brain tissue: example staining for microglia and neurons. Journal of Visualized Experiments. (99), e52293(2015).
- Zhou, M., et al. Screening and identification of severe acute respiratory syndrome-associated coronavirus-specific CTL epitopes. The Journal of Immunology. 177 (4), 2138-2145 (2006).
- Barzon, L., Lavezzo, E., Palu, G. Zika virus infection in semen: effect on human reproduction. The Lancet Infectious Diseases. 17 (11), 1107-1109 (2017).
- Ma, W., et al. Zika Virus Causes Testis Damage and Leads to Male Infertility in Mice. Cell. 167 (6), 1511-1524 (2016).
- Li, X. F., et al. Characterization of a 2016 Clinical Isolate of Zika Virus in Non-human Primates. EBioMedicine. 12, 170-177 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon