Method Article
Test d’absorption LDL cholestérol analyse avec cellule d’imagerie de cellules vivantes surveillance sanitaire
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
Ce protocole prévoit une approche efficace pour mesurer l’absorption de cholestérol LDL avec des taux de flux en temps réel à l’aide d’un système dans divers types de cellules d’imagerie de cellules vivantes. Cette technique fournit une plate-forme pour l’activité pharmacologique de composés affectant les afflux de LDL tout en surveillant pour la morphologie cellulaire et cytotoxicité donc potentielle de l’écran.
Résumé
La régulation de l’absorption de cholestérol LDL par endocytose LDLR est un important domaine d’étude dans diverses pathologies majeures, y compris les troubles métaboliques, les maladies cardiovasculaires et maladies rénales. Il n’existe actuellement aucune méthode disponible pour évaluer l’absorption LDL tout en surveillant simultanément pour la santé des cellules. Cette étude présente un protocole, à l’aide d’un système d’analyse d’imagerie de cellules vivantes, d’acquérir des mesures en série des afflux de LDL avec surveillance simultanées pour la santé de la cellule. Cette nouvelle technique a été testée dans trois lignées cellulaires humaines (cellules endothéliales hépatiques, rénales tubulaires épithéliaux et coronaire artère) sur un parcours de quatre heures de temps. En outre, la sensibilité de cette technique est validée bien connu inhibiteurs de l’absorption de LDL, Dynasore et recombinant protein PCSK9, ainsi que par un promoteur d’absorption de LDL, simvastatine. Pris ensemble, cette méthode fournit une plate-forme de milieu de gamme à haut débit pour simultanément criblage pharmacologique ainsi que le suivi de la morphologie cellulaire, d'où la cytotoxicité des composés régulation importations de LDL. L’analyse peut être utilisé avec différents systèmes d’imagerie et des logiciels d’analyse.
Introduction
L’endocytose des LDL induite par la faible densité de lipoprotéines récepteur LDLR est un important domaine d’étude puisque le taux de cholestérol des LDL circulantes est au cœur des maladies cardiovasculaires1, de la maladie de rein2 ainsi que divers inflammatoires 3 de la maladies et troubles génétiques présentant des mutations dans le cholestérol transport gènes4,5,6,7. Études influx de cholestérol induite par le gène LDLR ont abouti à l’identification de plusieurs outils de recherche, tels que les inhibiteurs de la dynamine y compris chimiques Dynasore8,9,10, et le régulateur de LDL protéines comme la proprotéine Convertase subtilisine/Kexin type 9 (PCSK9)11,12.
La voie de l’endocytose des LDL-LDLR commence avec séquestrant le complexe LDLR-LDL à la surface cellulaire enrobées de clathrine fosses13. Les vésicules sont ensuite formés par invagination de la membrane de surface cellulaire internaliser le complexe de LDL-LDLR dans les vacuoles des transports à l’intérieur de la cellule. Comme la vésicule formée mûrit dans les endosomes précoces et tardifs alors, le pH chute à l’intérieur de l’endosome fin, provoquant la dissociation de la LDL de son récepteur14. Dans le passé, les méthodes de quantification de l’afflux de LDL dépendaient de radio-marqués 125-LDL co incubation avec des cellules et une extraction ultérieure de la protéine radiomarqué de cellules pour la quantification,15. Cela a été ensuite remplacé par l’utilisation des protéines fluorescent marquées de LDL comme DiI-LDL et immunostaining ultérieure ou l’extraction de la protéine fluorescente lectures à l’aide d’un spectrophotomètre ou plaque lecteur15,16. Étiquetés fluorescent LDL a également servi dans la cellule activée par Fluorescence triant (FACS) pour l’analyse de l’internalisation de LDL et de liaison des LDL surface cellulaire17. Tandis que ces méthodes permettent la collecte de données après le traitement, la surveillance de la viabilité des cellules pendant le traitement n’est pas possible.
Le pH acide de l’endosome tardif permet l’utilisation d’une sonde pH-activé fluorescente LDL tels que pHrodo rouge LDL qui émet une fluorescence après internalisation18,19. Cette propriété permet à un cours de temps continu d’évaluation de l’absorption de LDL dans des cellules vivantes. Par conséquent, ce protocole utilise pHrodo rouge-LDL imagerie de fluorescence dans une analyse de cellules vivantes à l’adoption en série des mesure LDL avec surveillance simultanées pour la santé de la cellule. Les résultats indiquent la fiabilité de cette nouvelle technique qu’il est testé sur un parcours de quatre heures en trois lignées cellulaires humaines, cellules de carcinome hépatique humain (HepG2), cellules épithéliales rénales humaines de (HK2) et des cellules endothéliales artérielles coronaires (HCAEC ). Ces lignées cellulaires sont cliniquement significatives de LDL clairance20,21,22,23,24,25,26,27 , rein maladie28,29,30,31et cardiopathie32,33, respectivement. Outre la surveillance de l’afflux de LDL, ce protocole intègre un traitement avec deux inhibiteurs connus LDL, Hydrate de Dynasore et la protéine recombinante de PCSK9 ainsi un statine inducteur de LDLR expression et captation des LDL, simvastatine. Dynasore et recombinant PCSK9 chaque travail par le biais de différentes voies pour réduire l’absorption de LDL.
Dynasore est un inhibiteur de la petite molécule de dynamines10 et réduit l’absorption LDL en bloquant l’endocytose clathrine dépendant de LDL-LDLR complexe10,34. PCSK9 recombinante, en revanche, est membre de peptidase famille S8 qui se lie à LDLR et inhibe leur recyclage à la surface de la cellule après avoir relâché les LDL du complexe intériorisé en bloquant les nécessaires changements conformationnels35,36 . Une diminution des cellules surfacique LDLR mène finalement à une absorption réduite LDL par la cellule. Statines, tout en bloquant directement la 3-hydroxy-3-méthylglutaryl-coenzyme (HMG-CoA) réductase, enzyme et donc la biosynthèse du cholestérol, sont également connus pour réguler positivement l’expression de gène LDLR25,38 , conduisant à l’absorption accrue de LDL. La sensibilité de ce protocole est validée en détectant des réductions significatives des influx de LDL dans les lignées cellulaires humaines cliniquement trois, HK2, HepG2 et HCAECs, par Dynasore ou recombinant PCSK9, et une augmentation marquée de la captation des LDL dans les cellules HepG2 par Simvastatin dans un cours de quatre heures avec surveillance pour cellule morphologie/santé. Pris ensemble, cette méthode fournit une plate-forme de milieu de gamme à haut débit pour le dépistage simultanément l’activité pharmacologique et la cytotoxicité des composés réglementant la captation des LDL dans des cellules vivantes.
Protocole
1. ensemencement de cellules dans une plaque 24 puits
- Aspirer les médias hors des cellules, laver les cellules avec 5 mL de Phosphate Buffered Saline de Dubelco (SPD) et aspirer le SPD. Pour les cellules HepG2 dans un plat de 100 mm, utiliser 1,5 mL de 0,25 % trypsine/EDTA, et pour HK2 cellules ou HCAECs utiliser 1,5 mL de solution de trypsine/EDTA 0,05 % pour détacher les cellules.
- Incuber la plaque dans un incubateur à 37 ° C pendant 4 minutes ou jusqu'à ce que les cellules sont détachent. Neutraliser la trypsine après une incubation de 4 minutes en ajoutant 3 mL de support complet pour HepG2 et HK2 ou 3 mL de trypsine neutralisant la solution, le SPD avec 5 % sérum fœtal (SVF), pour les cellules HCAEC.
- Les cellules de transfert dans des tubes coniques 15 mL et centrifuger à 250 x g pendant 5 min, aspirer les médias et Resuspendre le culot dans les médias.
- Filtrer la suspension cellulaire doucement à travers un tamis de maille de 40 μm à briser les agrégats cellulaires. Ne pas laver les cellules par l’intermédiaire de la crépine.
- Compter les cellules et leur plaque à une densité optimisée. Par exemple, 5 000 cellules / puits de cellules HepG2 ou 10 000 cellules par puits de cellules HK2 ou HCAECs dans une plaque 24 puits conduisent à des résultats optimaux.
- Incuber la plaque pendant une nuit à 37 ° C pour permettre d’attacher des cellules.
- Le lendemain, changer les milieux cellulaires à la base des médias pour la lignée cellulaire (sans FBS) majoré de 5 % déficient de Lipo-protéines sériques (DFP) ou faible (2 %) Médias FBS selon le traitement (voir 1.7). Ensuite, poursuivre l’incubation pendant 24 heures afin d’affamer les cellules. Utilisez 500 μL de médias totales / puits dans une plaque 24 puits.
- Traiter les cellules dans l’une des trois façons suivantes : ajouter 10 µg/mL de rPCSK9 (ou véhicule) et renvoyer les cellules dans l’incubateur de 37 ° C pendant pour 1 heure, ajouter 40 µM d’Hydrate de Dynasore (ou véhicule, du diméthylsulfoxyde) et retourner les cellules dans l’incubateur à 37 ° C pendant 10 minutes , ou ajoutez 1 µM simvastatine (ou véhicule, du diméthylsulfoxyde) et retourner les cellules dans l’incubateur à 37 ° C pendant 12, 18 ou 24 heures. Utiliser les médias avec 5 % DFP pour rPCSK9 ou des traitements de Dynasore. Utilisation faible (2 %) Médias FBS ou avec des traitements de DFP Simvastatin 5 %.
Remarque : Traitant les cellules avec les composés désirés peut s’effectuer lors de changement de support pour famine lipoprotéine (étape 1.6) pour des expériences à long terme, ou avant l’analyse des expériences de courte durée. Alternativement, temps de traitement sur mesure peuvent être choisis selon le type et le but des expériences. - Ensuite, ajouter 5 µL de pHrodo marqué au rouge LDL (1 mg/mL de bouillon) dans chaque puits pour obtenir une concentration finale de 10 µg/mL. Ensuite, retirez soigneusement les bulles des puits.
2. vivre la cellule analyse
- Immédiatement après l’ajout du LDL marquée, placer la plaque dans l’incubateur de système de l’analyse de cellules vivantes (voir Table des matières) et laissez la plaque s’équilibrer pendant 15 minutes pour réduire la condensation dans la plaque.
- En attendant, ouvrez le logiciel et les planifier l’analyse en ajoutant le navire qui maintiennent la plaque. Images d’image 16 / puits à intervalles de 1 heure à 10 X 4 heures en utilisant les canaux rouge et la phase.
- Créer une carte de plaques à utiliser pour le traitement des données.
- Cliquez sur l’onglet Propriétés choisir la carte de la plaque. Saisir le type de cellule et les traitements dans onglet composés .
- Cliquez sur l’onglet régions , sélectionnez chaque ensemble de répétitions et enregistrez en tant que région.
3. définir les paramètres d’analyse
- Une fois une série expérimentale est terminée, créez un ensemble d’images dans le logiciel pour former l’ordinateur pour quantifier chaque paramètre inclus dans le jeu de comptage.
- Dans le logiciel, ouvrez la vue de la plaque, puis dans la zone d’Analyse emploi utilitaires , choisissez créer ou ajouter à la Collection de l’Image.
- Sélectionnez Nouvelle Collection d’images, tapez un nom pour la collection d’images, puis choisissez les canaux rouge et Phase en cochant les cases en regard des canaux.
- Sélectionnez plus de 5 photos et ajouter à la collection d’images en ajoutant à la collection de l’image actuelle.
- Créer une définition de traitement pour les cellules. Tableau 1 inclut les paramètres de la cellule HepG2, HK2 et HCAE traitement des définitions de ce protocole d’afflux de LDL.
- Dans la zone d’Analyse emploi utilitaires , choisissez Nouvelle définition traitement. Choisissez la Collection Image nommé à l’étape 2.1.2 dans le menu déroulant. Les paramètres pour le type de cellules du tableau 1de l’entrée.
- Dans la zone Aperçu, utilisez le menu déroulant pour sélectionner Tout prévisualiser.
- Dans la zone Masque de l’analyse , contrôler le Masque de la Confluence et les cases Rouges objet masque pour afficher la zone comprise dans l’analyse de la définition de la transformation. Voir la Figure 1.
- Parcourez la collection d’images pour s’assurer que les cellules et les LDL sont inclus dans le masque. Sélectionnez le fichier et Enregistrez la définition de la transformation.
- Analyser l’ensemble des images de la course expérimentale.
- Ouvrez l’expérience en vue de la plaque. Dans la zone d’Analyse emploi utilitaires , choisissez Lancer nouvelle tâche d’analyse. Sélectionnez la définition de traitement enregistrées.
- Nommez la tâche d’analyse, choisissez la plage horaire pour l’analyse et mettre en évidence les puits expérimentales à analyser. Cliquez sur le bouton lancer .
4. analyse et traitement des données
- Une fois que la tâche de l’analyse est terminée, exporter les données :
- L’analyse terminée et cliquez sur affichage. Dans le menu utilitaires , choisissez Métrique/graphique à l’exportation.
- Dans le menu régions , sélectionnez Tous les puitset dans le menu de groupe , pour obtenir les valeurs moyennes pour chaque ensemble de puits en tant que groupe choisissent réplique et pour exporter les valeurs individuelles pour chaque puits choisissent aucun.
- Dans le menu objet rouge métrique , choisissez l' Objet Total du Red intensité intégrée (UCR x µm2/image). Ce paramètre indique la somme des temps intensité (RCU) signal rouge de la zone du signal rouge (en µm2) dans toutes les images dans chaque puits, ce qui correspond à l’absorption totale des LDL par les cellules.
- Cliquez sur le bouton Data Export . Vérifier les données se décomposent en images individuelles. Les données sont automatiquement copiées sur une planchette et peuvent être collées dans un nouveau fichier de feuille de calcul.
- Dans le menu objet Phase métrique , choisissez la Confluence (pour cent). Vérifier les données se décomposent en images individuelles. Cliquez sur le bouton Data Export . Les données sont automatiquement copiées sur une planchette et peuvent être copiées dans le fichier de feuille de calcul contenant les données de Total rouge objet intensité intégrée.
- S’appliquent à la conversion de la confluence du pourcentage de superficie totale avec l’équation suivante.
Superficie de Phase (µm2/image) Confluence (%) × (hauteur de l’Image (Pixels) résolution) × (largeur de l’Image (Pixels) résolution)
Remarque : le paramètre de la confluence (%) indique la confluence pour cent de la superficie de phase par l’image qui correspond à la zone des cellules dans chaque puits. Cette mesure devrait être transformée en zone de phase total pour chaque individu image une fois exporté. Les spécifications d’image pour le canal de phase (hauteur, largeur et résolution) pour être utilisé avec la formule ci-dessus pour chaque navire expérimental se trouvent en se référant aux Propriétés de bateau dans les Canaux de l’Image. - Normaliser le Total rouge objet intensité intégrée à la superficie totale de Phase calculé en 4.1.6 en utilisant la formule suivante pour chaque image pour éliminer la variabilité de la densité cellulaire dans les puits.
- Diviser les valeurs Rouge objet intégré intensité totale (UCR x µm2/image) de chaque image par sa correspondante Superficie totale de Phase (µm2/image) pour obtenir des valeurs de LDL absorption (RCU) par image.
- Puis, en moyenne les données de Captation des LDL (RCU) de toutes les images de chaque puits pour obtenir l’absorption moyenne de LDL dans chaque puits et moyenne puis les valeurs de captation des LDL de tous les puits répétées pour obtenir les moyens du groupe. Ces données sont les valeurs finales de captation des LDL et peuvent être utilisées pour l’illustration et l’analyse statistique en utilisant le logiciel de choix.
Résultats
Vivre la cellule imagerie permet une surveillance fiable de la cellule santé durant les études afflux cholestérol en trois lignées cellulaires humaines
Nous avons validé notre essai en trois lignées cellulaires humaines dont cholestérol règlement homéostasie joue un rôle physiopathologique majeur, y compris les cellules de carcinome hépatique humain (HepG2), cellules épithéliales rénales humaines de (HK2) et les cellules endothéliales de l’artère coronaire humaine (HCAECs). Nous avons utilisé un système d’imagerie de cellules vivantes pour effectuer le test de captation des LDL dans une évolution temporelle de 4 h avec mesures en série à intervalles de 1 h. Nos résultats indiquent que tous les types de cellules testées étaient compatibles avec cette nouvelle technique et le résultat en courbes indiquant l’absorption LDL continue pendant la durée de l’étude d’afflux avec 4,33 h comme le point de terminaison finale (Figure 2). Les données afflux illustrées à la Figure 2 ont été obtenues en normalisant le pHrodo total de fluorescence rouge marqué LDL (total objet rouge intégré intensité par image dans x µm2 UCR/image) à la zone totale de cellules dans chaque image de chaque puits (phase objet surface / image en µ m2/image) pour éliminer la variabilité de la densité cellulaire dans les puits. En outre, nous avons utilisé pour valider la sensibilité du test de l’afflux de LDL dans le but de criblage de composés qui affectent l’absorption de cholestérol LDL, deux contrôles positifs connus pour inhiber la LDL afflux, Dynasore et rPCSK9 et un contrôle positif connu pour induire des LDL absorption, simvastatine. Tels que validés par nos résultats, après un traitement avec Dynasore et rPCSK9, tous trois testés des lignées de cellules humaines (HepG2, HK2 et HCAEC) ont montré une réduction significative afflux de LDL sur une durée de 4 h (Figure 2A-C). Par exemple, la Figure 2A montre que l’afflux de LDL est réduite dans les cellules HepG2 avec traitement de le Dynasore au cours de temps, par rapport aux cellules traitées avec le DMSO ; alors que le DMSO comme le contrôle du véhicule pour Dynasore contrôle n’eu aucun effet significatif sur l’afflux de LDL comparativement au groupe témoin non traité. En outre, nos résultats ont montré une augmentation marquée de captation des LDL par les cellules HepG2 après le traitement par la simvastatine (Figure 3), soutenant la sensibilité de cette méthode pour détecter des changements significatifs dans l’afflux de LDL. À autour du point de temps de 4,5 h, qui est un point de temps typique dans les études d’absorption de LDL, l’afflux de LDL est considérablement réduite avec traitement Dynasore ou rPCSK9 et augmenté de Simvastatin traitement (Figure 4).
Un avantage majeur à l’utilisation de cellules vivantes d’imagerie pour les études d’absorption de LDL, c’est que ce système fournit des images en temps réel des cellules dans chaque puits qui pourrait servir à surveiller la cytotoxicité potentielle des composés examinés. Figures 5-7 illustrent des images représentatives des lignées trois cellulaires étudiées à l’instant initial (0,33 h) et le final point de terminaison (4,33 h) comme référence visuelle pour l’afflux net de LDL. Les images confirment la morphologie normale des cellules après traitements Dynasore ou rPCSK9, indiquant l’efficacité et l’innocuité de ces composés.
Mesures d’afflux de cellules vivantes analyse donne cholestérol Quantitative série fiable avec divers traitements
Un avantage majeur de l’utilisation de ce protocole avec un système d’imagerie de cellules vivantes est la capacité de recueillir des données tout au long de l’évolution temporelle et afflux de LDL à plusieurs points dans le temps plutôt qu’à un seul point dans le temps final traditionnellement fait de comparer. Utilisant ce protocole, nous sommes en mesure de calculer le pourcentage reductionin LDL afflux au point terminal de temps ainsi qu’à 1 h d’intervalle tout au long de l’évolution temporelle. Le tableau 2 résume la réduction de l’apport de LDL en trois lignes cellulaires humaines testées après 10 min avant le traitement avec 40 µM Dynasore ou prétraitement 1 h avec 10 µg/mL rPCSK9. À 4,33 h comme le point final de l’étude, le traitement avec Dynasore à 40 µM considérablement réduit des afflux de LDL dans les cellules HepG2, HK2 cellules et HCAECs de 53 %, 68 % et 54 %, respectivement (Tableau 2 a-C) et traitement par rPCSK9 à 10 µg/mL a entraîné la réduction de 55 % dans les LDL afflux de HK2 cellules (tableau 2 b). En plus de quantifier le point terminal de temps comme dans les épreuves traditionnelles, nous sommes en mesure d’effectuer une analyse quantitative dans la réduction de l’afflux de LDL due au traitement à chaque moment de l’expérience. Tableau 2 b par exemple, indique que le traitement avec rPCSK9 en HK2 cellules a entraîné une réduction de l’absorption de LDL par 79 % à 1,33 h, 67 % à 2,33 h, 59 % à 3,33 h post traitement par rapport aux cellules non traitées. Ce protocole fournit une méthode fiable pour l’analyse quantitative des afflux de LDL après le traitement.
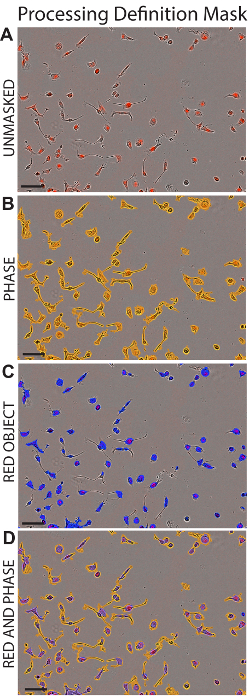
Figure 1 : Traitement définition masque. Les images représentant des cellules HK2 sont représentés après l’application de la définition de traitements appropriés (détaillée dans le tableau 1). Montre areHK2 cellules sans masquer (A), avec la Phase Maskapplied (B), avec rouge objet masque appliqué (C), ou avec des masques de Phase tant l’objet rouge appliquées (D). Echelle = 100 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
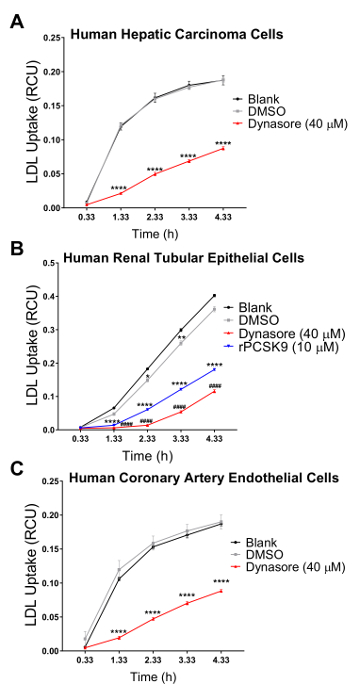
Figure 2 : Réduction de l’absorption de LDL en direct utilisant cellule système d’imagerie sur un parcours de temps 4,33 h. Vivre l’analyse cellulaire système sert à mesurer l’afflux de LDL dans les cellules de carcinome hépatique humain (HEPG2) (A), humains cellules tubulaires rénales épithéliales (HK2) (B) et artère coronaire humaine des cellules endothéliales (HCAE) (C). Les cellules ont été traitées avec Dynasore (10 min avant la course) ou rPCSK9 (1 h avant la course) comme témoins positifs. DMSO a été utilisé comme un véhicule pour les traitements de Dynasore. Les témoins positifs diminue significativement l’afflux de LDL dans les lignées cellulaires 3. LDL afflux valeurs ont été obtenues en normalisant l’intensité totale objet rouge intégré (RCUxµm2/image) à la zone de l’objet total phase (µm2/image). Les données sont ±SEM. N = 6 puits/groupe. Données sont représentatives de 2 ou 3 expériences indépendantes. p < 0,0001 vs vierges, et ###p < 0,0001 vs DMSO, en utilisant deux voies ANOVA. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
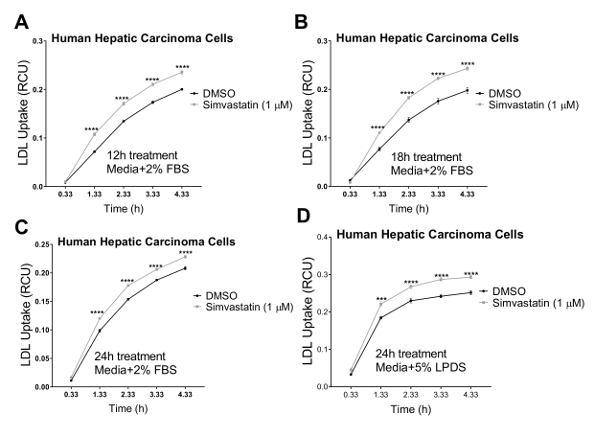
Figure 3 . Augmentation de la captation de LDL à l’aide de cellules vivantes, système d’imagerie sur un parcours de temps 4,33 h. Vivre l’analyse cellulaire système sert à mesurer l’afflux de LDL dans les cellules de carcinome hépatique humain (HEPG2). Absorption de LDL augmente significativement après traitement par simvastatine pendant 12 h (A), 18 h (B) ou 24 h (C) à l’aide de médias contenant 2 % FBS. Le point de temps de 24h a également été réalisé avec un milieu contenant 5 % DFP (sans FBS). DMSO a été utilisé comme contrôle négatif. LDL afflux valeurs ont été obtenues en normalisant l’intensité totale objet rouge intégré (UCR x µm2/image) à la zone de l’objet total phase (µm2/image). Les données sont ±SEM. N = 6 puits/groupe. Données sont représentatives d’une des expériences indépendantes. p < 0,0001 vs DMSO, en utilisant le test t de Student. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
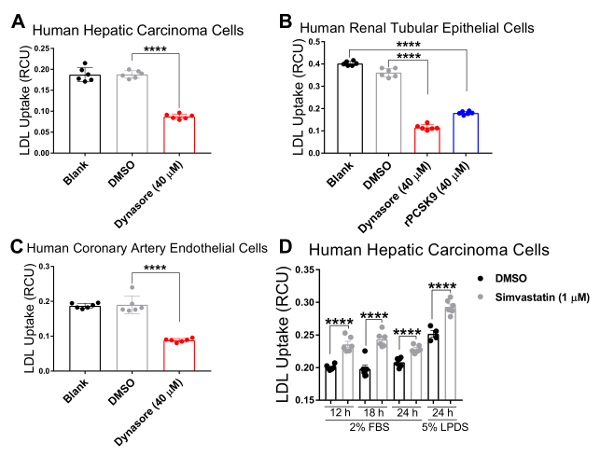
Figure 4 . Réduction significative d’afflux de LDL par agents abaissant la captation de LDL le moment 4,3 h. Afflux de LDL est significativement réduite dans les cellules de carcinome hépatique humain (HepG2) (A) humaine tubulaire (HK2) les cellules épithéliales rénales (B) et artère coronaire humaine (HCAE) les cellules endothéliales (C) après le traitement par absorption de LDL inhibiteurs de la Dynasore pour 10 min ou rPCSK9 pendant 1 heure. Afflux de LDL est augmentée par la simvastatine chez les cellules HepG2 après des traitements 12, 18 ou 24 h (D). Les données sont ±SEM. N = 6 puits/groupe. Données sont représentatives de 2 ou 3 expériences indépendantes. p < 0,0001 en utilisant deux voies ANOVA. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
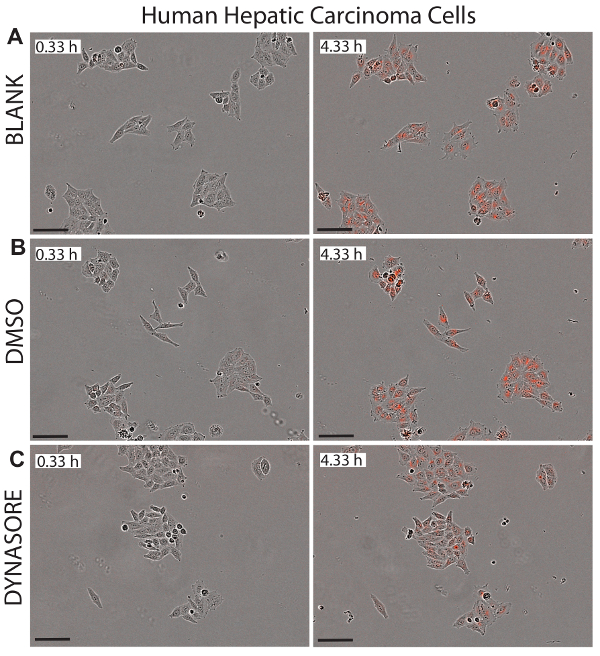
Figure 5 . Réduit l’afflux de LDL dans les cellules (HepG2) le carcinome hépatocellulaire par l’agent de capture-abaissement de LDL, Dynasore. Des images représentatives de l’objet de la phase et les objet rouge pour les cellules HepG2 sont représentés à 0,33 h (panneaux de gauche) et le point de terminaison de 4,33 h (panneaux de droite) affiche l’état sain des cellules. 40 µM Dynasore, connu pour réduire l’absorption de cholestérol LDL, a été utilisée comme témoin positif (C). Des images ont été prises à un grossissement de 10 X. Echelle = 100 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.

Figure 6 . Réduit l’apport de LDL en humains cellules tubulaires rénales épithéliales (HK2) par LDL agents abaissant la captation, Dynasore et rPCSK9. Images représentatives de l’objet de la phase et l’objet rouge pour cellules HK2 représenté à 0,33 h (panneaux de gauche) et le point de terminaison de 4,33 h (panneaux de droite) afficher l’état de santé des cellules. 40 µM Dynasore (C), ou 10 µg/mL rPCSK9 (D), connu pour réduire l’absorption de cholestérol LDL, ont été utilisés comme contrôle positif. Les images sont prises à un grossissement de 10 X. Echelle = 100 µm. s’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
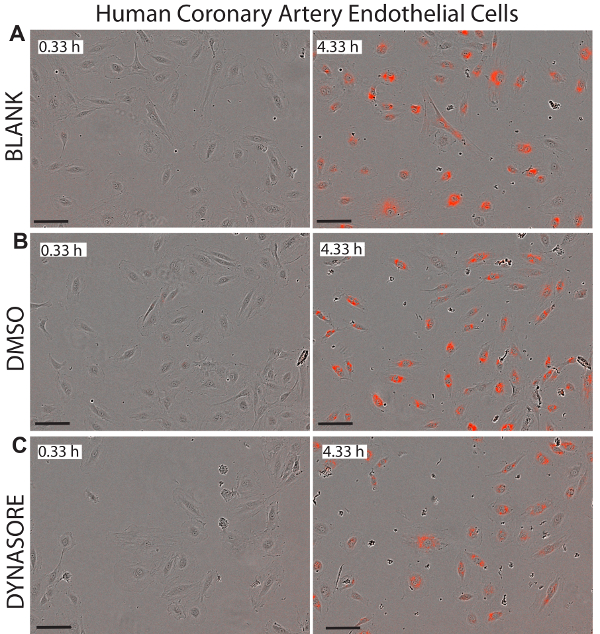
Figure 7 . Réduit l’afflux de LDL dans les cellules endothéliales humaines coronarienne (HCAECs) par l’agent de capture-abaissement de LDL, Dynasore. Images représentatives de l’objet de la phase et l’objet rouge pour HCAECs représenté à 0,33 h (panneaux de gauche) et le point de terminaison de 4,33 h (panneaux de droite) afficher l’état de santé des cellules. 40 µM Dynasore, connu pour réduire l’absorption de cholestérol LDL, a été utilisée comme témoin positif (C). Des images ont été prises à un grossissement de 10 X. Echelle = 100 µm. les données sont ±SEM. N = 6 puits/groupe. Données sont représentatives de 2 ou 3 expériences indépendantes. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
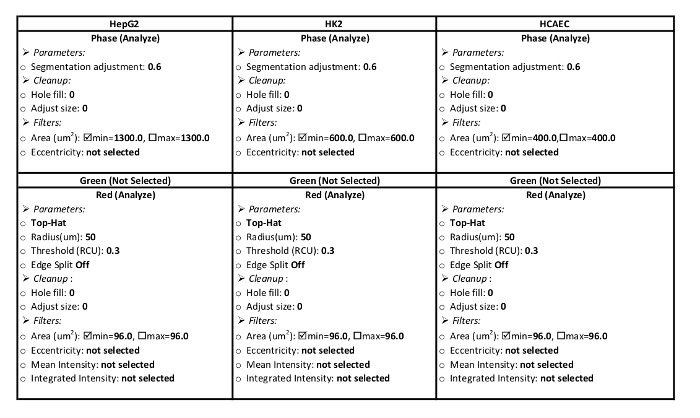
Tableau 1 : définition de paramètres de traitement. Ces paramètres sont spécifiques pour le système d’analyse utilisé dans le présent protocole. Paramètres devraient être mis en place pour analyser la zone rouge dans le canal rouge et la zone de la cellule dans le canal de phase. Paramètres pour HepG2, HK2, lignées de cellules HCAE sont présentées.
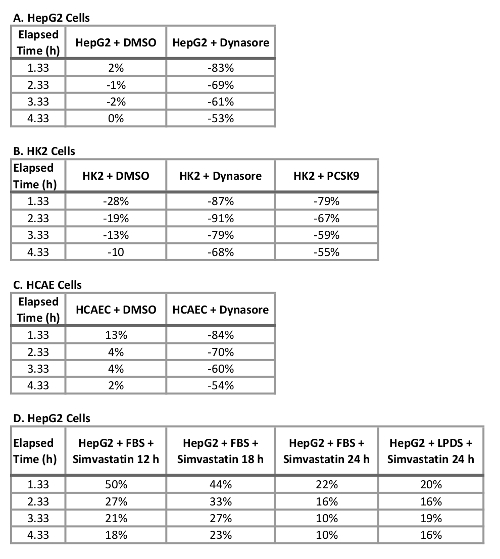
Tableau 2 : variation en pourcentage dans l’afflux de LDL dans les cellules HepG2, HK2 et HCAE traités avec Dynasore, rPCSK9 ou simvastatine à 4,3 h. (A) HepG2 cellules, cellules HK2 (B), (C) HCAE cellules et les cellules HepG2 (D).
Discussion
Dans le protocole actuel, nous démontrons l’utilisation de l’imagerie de cellules vivantes comme une nouvelle méthode plus efficace pour mesurer les temps réel LDL absorption sur une évolution temporelle dans diverses lignées cellulaires humaines. Les cellules de carcinome hépatique humain (HepG2) sont couramment utilisés dans les études de dépistage pour les hypocholestérolémiants therapeutics21,22,23,24,25,26, 39,40. Par conséquent, nous avons choisi ce type de cellule pour tester la capacité d’un système d’imagerie de cellules vivantes pour études d’afflux de LDL. Nos résultats indiquent que les cellules HepG2 sont compatibles avec cette nouvelle technique et se traduire par une courbe sigmoïde comme indiquant l’absorption LDL continue pendant la durée de l’essai de l’afflux jusqu'à 4,33 h comme le point de terminaison finale (Figure 2 a et Figure 3 ).
L’homéostasie du cholestérol joue un rôle majeur dans la physiopathologie des néphropathies divers. En effet, l’accumulation de cholestérol dans le tissu rénal est un contributeur majeur à la fibrose rénale conduisant à une néphropathie chronique et est une pathologie majeure chez divers néphropathies28,29,30,31. Par conséquent, nous avons examiné notre méthode dans les cellules épithéliales rénales humaines de (HK2) comme une lignée de cellules populaire et fiable, utilisée dans le domaine de la néphrologie. Nos données a également appuyé la faisabilité du système d’imagerie de cellules vivantes pour mesurer les afflux de LDL dans les cellules HK2. Comme le montre la Figure 2B, cellules HK2 reprit LDL cholestérol linéairement pendant toute la durée de l’étude de l’afflux (4 heures).
En raison de l’importance du métabolisme de cholestérol dans le développement et la progression de l’athérosclérose32,33,41, la principale cause de maladies cardiovasculaires, qui à son tour sont le tueur numéro un dans le monde entier 42, visait à valider notre méthode dans un type de cellules propres à l’athérosclérose. Nous avons utilisé des cellules endothéliales artérielles coronaires (HCAECs), car celles-ci sont l’un des premiers types cellulaires d’être exposés à une insulte de cholestérol dans la lumière de l’artère coronaire d’un patient de l’athérosclérose. Nos données illustrées à la Figure 2C indiquent que cette méthode d’afflux de LDL collabore efficacement avec HCAECs. Le graphique qui en résulte est une courbe sigmoïde comme semblable à celle des cellules HepG2.
Pour tester la validité et la sensibilité de ce test d’afflux LDL améliorée pour criblage de composés qui affectent l’absorption de cholestérol-LDL, nous avons utilisé trois contrôles, agents d’abaissant la captation des LDL Dynasore et rPCSK9 et LDL afflux activateur Simvastatin. Ici, nous avons traité ci-dessus mentionné les lignées cellulaires (HepG2, HK2 et HCAECs) avec des concentrations optimisées de Dynasore ou rPCSK9 avant le test de l’afflux. Nos résultats ont montré que tous les trois lignées testées ont répondu aux traitements avec des réductions importantes des afflux de LDL sur un parcours de 4 heures (Figure 2). Par exemple, à 4,33 h comme le point de la dernière fois, le traitement avec Dynasore à 40 µM considérablement réduit des afflux de LDL dans les cellules HepG2, HK2 cellules et HCAECs de 53 %, 68 % et 54 %, respectivement (p < 0,0001 ; Figure 2 A-C et Tableau 2 a-C). En outre, rPCSK9 à 10 µg/mL a provoqué une nette réduction de 55 % dans afflux de LDL dans les cellules HK2 (p < 0,0001 ; Figure 2 B et 2 b). En outre, nos résultats ont montré que traiter les cellules HepG2 avec la simvastatine a entraîné une augmentation marquée de la captation des LDL (Figure 3), soutenant la sensibilité de cette méthode pour détecter des changements significatifs dans l’afflux de LDL. Études de traitement avec rPCSK9 dans les cellules HepG2 et HCAEC ne sont pas inclus dans le présent protocole, comme rPCSK9 est utilisé comme un traitement de contrôle supplémentaires avec des résultats bien documentés, mais il est coûteux à acheter en petites quantités. Par conséquent, rPCSK9 n’était utilisé que pour valider ce protocole dans les cellules HK2.
Vivre la cellule imagerie analyse, ainsi que la mesure fonctionnelle et en temps opportun des afflux de LDL, autorisé pour la surveillance continue de la santé et la morphologie des cellules. Cet avantage peut détecter efficacement une cytotoxicité potentielle des composés appliquées, ce qui rend cette méthode une technique idéale pour surveiller simultanément la cytotoxicité et activité pharmacologique. Figures 5-7 illustrent des images représentatives des trois lignées cellulaires testées au point de terminaison finale (4,33 h) comme référence visuelle pour l’effet des traitements sur l’afflux net de LDL et montre également la morphologie saine des cellules suite à l’essai traitements. Nous recommandons une inspection visuelle de toutes les images de chaque puits pour assurer la morphologie heathy des cellules pendant la durée de l’étude. Par exemple, en données non présentées, quand les images de cellules HepG2 traitement avec 80 μM Dynasore ont été inspectés, nous avons observé des indications du détachement de la cellule, comme les bords des cellules semblent être soulever la plaque, ce qui suggère de détachement cellulaire à des concentrations plus élevées de Dynasore. De plus, des concentrations élevées de simvastatine (3-10 μM) a également conduit à une morphologie altérée indiquant induisaient l’apoptose comme indiqué pour les fortes doses de statines,45. Ce protocole a été utilisé pour effectuer un titrage du traitement Dynasore à 20-80 μM et simvastatine à une concentration de 0,5 à 10 μM, après quoi les images de la cellule ont été utilisées pour analyser la santé des cellules et déterminer les ctotoxicity potentiel des traitements à différentes concentrations. Les résultats suggèrent l’utilisation de 40 μM pour Dyansore et 1 μM pour la simvastatine comme concentrations optimales.
Enfin, nous vous suggérons d’effectuer une étude de titrage de densité cellulaire si une autre lignée cellulaire doit être testé avec cette méthode afin de déterminer le nombre optimal de cellules / puits afin d’obtenir des résultats cohérents. Notre étude d’optimisation de la densité cellulaire a montré que 10 000 cellules/puits dans une plaque 24 puits aboutir à des résultats d’afflux de LDL cohérentes pour les cellules HK2 et HCAE. Il est important de noter qu’avec ce test d’afflux de LDL à l’aide du système d’imagerie de cellules vivantes, une monocouche de cellules non-anastomosé répartis uniformément sur les puits est souhaitable que les amas de cellules peuvent donner lieu à des erreurs dans les valeurs finales des afflux normalisées de LDL. La raison en est que pour la normalisation des données afflux, la zone objet de phase est utilisée comme mesure de la densité cellulaire et ce paramètre peut être affecté négativement lorsque sont forment des amas de cellules. Nous avons observé que les cellules HepG2 ont tendance à forme de touffes quand ensemencé à des densités supérieures à 5 000 cellules/puits provoquant des résultats incohérents afflux ; par conséquent, nous avons utilisé 5 000 cellules / puits dans une plaque 24 puits comme densité optimale pour les cellules HepG2.
Collectivement, notre méthode fournit une plate-forme de milieu de gamme à haut débit pour le dépistage de l’activité pharmacologique et la cytotoxicité des composés régulation des importations de LDL simultanément. Cette méthode peut être facilement adaptée pour être utilisé avec d’autres ligands marqués fluorescent qui entrent dans le compartiment lysosomal afin d’évaluer l’absorption ligand en temps réel. Alors que ce protocole offre spécifications pour InCucyte vivent d’imagerie et système d’analyse, le protocole peut être adapté pour d’autres systèmes d’imagerie comme Cellomics.
Déclarations de divulgation
Les auteurs déclarent qu’ils n’ont aucun intérêt financier concurrentes.
Remerciements
Ce travail a été soutenu par les subventions suivantes à LAS : National Institute of Health (R56HL132209 et 1R01HL140468) et l’Institut de recherche de coeur de Miami. KY est un lauréat de l’American Heart Association pré-doctoral Fellowship (18PRE33960070). Les cellules HepG2 ont été gracieusement fournis par Dr. Emmanuel Thomas, Université de Miami-Miller School of Medicine46,47,,48.
matériels
| Name | Company | Catalog Number | Comments |
| pHrodo Red-LDL | ThermoFisher Scientific | L34356 | |
| HepG2 cells | E. Thomas Lab, U. Miami | HB-8065 | |
| MEM | Sigma | M0325 | |
| Sodium Pyruvate | Sigma | P5280 | |
| L-Glutamine 200 mM solution | Sigma | G7513 | |
| FBS | Atlas Biologicals | FP-0500-A | |
| HK2 cells | ATCC | CRL-2190 | |
| Keratinocyte SFM media kit | Gibco | 17005-042 | |
| Primary Coronary Artery Endothelial Cells | ATCC | PCS-100-020 | |
| Vascular Cell Basal Medium | ATCC | PCS-100-030 | |
| Endothelial Cell Growth Kit-VEGF | ATCC | PCS-100-041 | |
| Human Lipoprotein Deficient Serum | Millipore | LP4 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Trypsin-EDTA (0.05%) | Gemini Bio-Products | 400-150 | |
| Trypsin Neutralizing Solution | ATCC | PCS-999-004 | |
| 24 well plate | Falcon | 353226 | |
| 40 μM mesh cell strainer | VWR | 10199-654 | |
| 15 mL conical tubes | VWR | 89039-666 | |
| 50 mL conical tubes | VWR | 89039-658 | |
| Trypan Blue Staining (0.4%) | Life Technologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Incucyte Zoom | Sartorius | Zoom | Imaging and analysis platform |
| Dynasore Hydrate | Sigma | D7693 | |
| PCSK9 Recombinant Protein | Cayman Chemicals | 20631 |
Références
- Baigent, C., et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 366 (9493), 1267-1278 (2005).
- Trevisan, R., Dodesini, A. R., Lepore, G. Lipids and renal disease. Journal of the American Society of Nephrology. 17 (4), 145-147 (2006).
- Tall, A. R., Yvan-Charvet, L. Cholesterol, inflammation and innate immunity. Nature Reviews Immunology. 15 (2), 104 (2015).
- Dedoussis, G. V., Schmidt, H., Genschel, J. LDL-receptor mutations in Europe. Human Mutation. 24 (6), 443-459 (2004).
- Sasaki, K., et al. ATP-binding cassette transporter A subfamily 8 is a sinusoidal efflux transporter for cholesterol and taurocholate in mouse and human liver. Molecular Pharmaceutics. , (2018).
- Storch, J., Xu, Z. Niemann-Pick C2 (NPC2) and intracellular cholesterol trafficking. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1791 (7), 671-678 (2009).
- Jansen, P. J., et al. Absence of ApoE upregulates murine brain ApoD and ABCA1 levels, but does not affect brain sterol levels, while human ApoE3 and human ApoE4 upregulate brain cholesterol precursor levels. Journal of Alzheimer's Disease. 18 (2), 319-329 (2009).
- Girard, E., et al. The dynamin chemical inhibitor dynasore impairs cholesterol trafficking and sterol-sensitive genes transcription in human HeLa cells and macrophages. PLoS One. 6 (12), 29042 (2011).
- Robinet, P., et al. Dynamin is involved in endolysosomal cholesterol delivery to the endoplasmic reticulum: role in cholesterol homeostasis. Traffic. 7 (7), 811-823 (2006).
- Macia, E., et al. Dynasore, a cell-permeable inhibitor of dynamin. Developmental Cell. 10 (6), 839-850 (2006).
- Benjannet, S., et al. NARC-1/PCSK9 and its natural mutants: zymogen cleavage and effects on the LDLR and LDL-cholesterol. Journal of Biological Chemistry. , (2004).
- Qian, Y. -. W., et al. Secreted PCSK9 downregulates low density lipoprotein receptor through receptor-mediated endocytosis. Journal of Lipid Research. 48 (7), 1488-1498 (2007).
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Goldstein, J. L., Brown, M. S. History of discovery: the LDL receptor. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (4), 431 (2009).
- Stephan, Z. F., Yurachek, E. C. Rapid fluorometric assay of LDL receptor activity by DiI-labeled LDL. Journal of Lipid Research. 34 (2), 325-330 (1993).
- Fisher, T. S., et al. Effects of pH and low density lipoprotein (LDL) on PCSK9-dependent LDL receptor regulation. Journal of Biological Chemistry. 282 (28), 20502-20512 (2007).
- Atrahimovich, D., Khatib, S., Sela, S., Vaya, J., Samson, A. O. Punicalagin induces serum low-density lipoprotein influx to macrophages. Oxidative Medicine and Cellular Longevity. 2016, (2016).
- Xu, M., et al. δ-Tocopherol reduces lipid accumulation in Niemann-Pick type C1 and Wolman cholesterol storage disorders. Journal of Biological Chemistry. 112, (2012).
- Bonilla, D. L., et al. Autophagy regulates phagocytosis by modulating the expression of scavenger receptors. Immunity. 39 (3), 537-547 (2013).
- Guo, M., et al. Apelin-13 Decreases Lipid Storage in Hypertrophic Adipocytes In vitro Through the Upregulation of AQP7 Expression by the PI3K Signaling Pathway. Medical Science Monitor : International Medical Journal of Experimental and Clinical Research. 20, 1345-1352 (2014).
- Guillemot, J., Asselin, M. C., Susan-Resiga, D., Essalmani, R., Seidah, N. G. Deferoxamine stimulates LDLR expression and LDL uptake in HepG2 cells. Molecular Nutrition & Food Research. 60 (3), 600-608 (2016).
- Javitt, N. B. Hep G2 cells as a resource for metabolic studies: lipoprotein, cholesterol, and bile acids. The FASEB Journal. 4 (2), 161-168 (1990).
- Mullen, P. J., Lüscher, B., Scharnagl, H., Krähenbühl, S., Brecht, K. Effect of simvastatin on cholesterol metabolism in C2C12 myotubes and HepG2 cells, and consequences for statin-induced myopathy. Biochemical Pharmacology. 79 (8), 1200-1209 (2010).
- McNutt, M. C., et al. Antagonism of secreted PCSK9 increases low density lipoprotein receptor expression in HepG2 cells. Journal of Biological Chemistry. 284 (16), 10561-10570 (2009).
- Scharnagl, H., et al. Effect of atorvastatin, simvastatin, and lovastatin on the metabolism of cholesterol and triacylglycerides in HepG2 cells. Biochemical Pharmacology. 62 (11), 1545-1555 (2001).
- Scharnagl, H., et al. The effects of lifibrol (K12. 148) on the cholesterol metabolism of cultured cells: evidence for sterol independent stimulation of the LDL receptor pathway. Atherosclerosis. 153 (1), 69-80 (2000).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences. 106 (24), 9820-9825 (2009).
- Ding, W., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Herman-Edelstein, M., Scherzer, P., Tobar, A., Levi, M., Gafter, U. Altered renal lipid metabolism and renal lipid accumulation in human diabetic nephropathy. Journal of Lipid Research. 55 (3), 561-572 (2014).
- Su, H., et al. Lipid Deposition in Kidney Diseases: Interplay Among Redox, Lipid Mediators, and Renal Impairment. Antioxidants & Redox Signaling. 28 (10), 1027-1043 (2018).
- Agrawal, S., Zaritsky, J. J., Fornoni, A., Smoyer, W. E. Dyslipidaemia in nephrotic syndrome: mechanisms and treatment. Nature Reviews Nephrology. 14 (1), 57 (2018).
- Babiak, J., Rudel, L. L. Lipoproteins and atherosclerosis. Baillieres Clinical Endocrinology and Metabolism. 1 (3), 515-550 (1987).
- Wang, H. H., Garruti, G., Liu, M., Portincasa, P., Wang, D. Cholesterol and Lipoprotein Metabolism and Atherosclerosis: Recent Advances in Reverse Cholesterol Transport. Annals of Hepatology. 16 (1), 28-42 (2018).
- Preta, G., Cronin, J. G., Sheldon, I. M. Dynasore-not just a dynamin inhibitor. Cell Communication and Signaling. 13 (1), 24 (2015).
- Horton, J. D., Cohen, J. C., Hobbs, H. H. Molecular biology of PCSK9: its role in LDL metabolism. Trends in Biochemical Sciences. 32 (2), 71-77 (2007).
- Abifadel, M., et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nature Genetics. 34 (2), 154 (2003).
- Goldstein, J. L., Brown, M. S. Regulation of the mevalonate pathway. Nature. 343 (6257), 425 (1990).
- Dong, B., Wu, M., Cao, A., Li, H., Liu, J. Suppression of Idol expression is an additional mechanism underlying statin-induced up-regulation of hepatic LDL receptor expression. International Journal of Molecular Medicine. 27 (1), 103-110 (2011).
- Song, K. H., Kim, Y. H., Im, A. -. R., Kim, Y. H. Black Raspberry Extract Enhances LDL Uptake in HepG2 Cells by Suppressing PCSK9 Expression to Upregulate LDLR Expression. Journal of Medicinal Food. , (2018).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences of the United States of America. 106 (24), 9820-9825 (2009).
- Tabas, I., Williams, K. J., Borén, J. Subendothelial lipoprotein retention as the initiating process in atherosclerosis: update and therapeutic implications. Circulation. 116 (16), 1832-1844 (2007).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2017 update: a report from the American Heart Association. Circulation. 135 (10), 146-603 (2017).
- Brown, M. S., Goldstein, J. L. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell. 89 (3), 331-340 (1997).
- Horton, J. D., Goldstein, J. L., Brown, M. S. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. The Journal of Clinical Investigation. 109 (9), 1125-1131 (2002).
- Tavintharan, S., et al. Reduced mitochondrial coenzyme Q10 levels in HepG2 cells treated with high-dose simvastatin: A possible role in statin-induced hepatotoxicity. Toxicology and Applied Pharmacology. 223 (2), 173-179 (2007).
- Thomas, E., et al. HCV infection induces a unique hepatic innate immune response associated with robust production of type III interferons. Gastroenterology. 142 (4), 978-988 (2012).
- Thomas, E., Liang, T. J. Experimental models of hepatitis B and C-new insights and progress. Nature Reviews Gastroenterology & Hepatology. 13 (6), 362 (2016).
- Yoneda, M., et al. Hepatitis B Virus and DNA Stimulation Trigger a Rapid Innate Immune Response through NF-κB. The Journal of Immunology. , 1502677 (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon