Method Article
Ensaio de absorção de LDL colesterol usando célula viva análise com célula de imagem monitoramento de integridade
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
Este protocolo fornece uma abordagem eficiente para medir a absorção de colesterol LDL com taxas de fluxo em tempo real usando uma célula viva, sistema em vários tipos de células de imagem. Esta técnica fornece uma plataforma para a atividade farmacológica de compostos afetando o influxo de LDL enquanto monitora para morfologia celular e citotoxicidade, portanto, potencial de tela.
Resumo
A regulação da absorção de colesterol LDL através de endocitose mediada por LDLR é uma importante área de estudo em várias patologias principais, incluindo a doença metabólica, doença cardiovascular e doença renal. Atualmente, não há nenhum método disponível para avaliar a captação de LDL enquanto monitora simultaneamente para a saúde das células. O estudo atual apresenta um protocolo, usando um sistema de análise de imagens da célula viva, para adquirir o seriais medições de afluxo de LDL com monitoramento simultâneo para a saúde da célula. Esta nova técnica é testada em três linhas de células humanas (células endoteliais de hepática, renal tubular epiteliais e coronária artéria) um longo tempo de quatro horas. Além disso, a sensibilidade desta técnica é validada com conhecidos LDL inibidores de captação, Dynasore e recombinante PCSK9 proteína, assim como por um promotor de absorção de LDL, sinvastatina. Tomados em conjunto, este método fornece uma plataforma de médio a alto throughput para simultaneamente atividade farmacológica de triagem, bem como a monitorização da morfologia celular, portanto, citotoxicidade de compostos regulando o influxo de LDL. A análise pode ser usada com diferentes sistemas de imagem e software analítico.
Introdução
A endocitose mediada por baixa densidade da lipoproteína Receptor LDLR LDL é uma importante área de estudo, desde que os níveis de colesterol LDL circulante estão no cerne da doença cardiovascular1, doença de rim2 , bem como uma variedade de inflamatória doenças3 e desordens genéticas com mutações em colesterol transporte genes4,5,6,7. Estudos no influxo de colesterol mediada por LDLR levaram à identificação de várias ferramentas de pesquisa, tais como inibidores de Dinamina, incluindo a química Dynasore8,9,10, bem como LDL-regulação as proteínas tais como Proprotein Convertase subtilisina/Kexin digite 9 (PCSK9)11,12.
Via endocitose LDL-LDLR começa com o sequestro do LDL-LDLR complexo na superfície da célula em Poços revestidos por Clatrina13. Vesículas são então formadas por invaginação da membrana celular superfície internalização do complexo LDL-LDLR em vacúolos para transporte dentro da célula. Como a vesícula formada amadurece em endossomos cedo e tarde então, o pH cai dentro do endossomo tarde, causando dissociação de LDL de seu receptor14. No passado, os métodos de quantificação de afluxo de LDL dependiam de incubação co de rádio-rotulado 125eu-LDL com células e posterior extração da proteína marcado de células para quantificação de15. Isso foi então substituído pelo uso de proteínas de LDL fluorescente rotulados como DiI-LDL e imunocoloração subsequente ou extração da proteína fluorescente leituras usando um espectrofotômetro ou placa leitor15,16. Fluorescente com rótulo LDL também tem sido usado em fluorescência-ativado da pilha (FACS) de classificação para análise de internalização da LDL e vinculação de LDL de superfície celular17. Enquanto estes métodos permitem para coleta de dados após o tratamento, a viabilidade das células de monitoramento durante o tratamento não é possível.
O pH ácido no endossomo tarde permite o uso de uma sonda de pH-ativado fluorescente LDL como pHrodo LDL vermelho fluorescente após internalização18,19. Esta propriedade permite que um curso de tempo contínuo de avaliação de captação de LDL em células vivas. Portanto, este protocolo utiliza imagens de fluorescência pHrodo vermelho-LDL em uma análise de células vivas para captação de medida LDL serialmente com monitoramento simultâneo para a saúde da célula. Os resultados indicam a confiabilidade desta técnica de romance como testado ao longo de um curso de quatro horas em três linhas diferentes de células humanas, células de carcinoma hepático humano (HepG2), células humanas renais (HK2) epiteliais e humanas pilhas endothelial arteriais coronarianas (HCAEC ). Estas linhas de célula são clinicamente significativas para LDL apuramento20,21,22,23,24,25,26,27 , rim doença28,29,30,31e doença cardíaca32,33, respectivamente. Além de monitorar o influxo de LDL, este protocolo incorpora tratamento com dois conhecidos inibidores de captação de LDL, hidrato de Dynasore e proteína recombinante PCSK9, bem como um indutor de estatina de expressão LDLR e captação de LDL, sinvastatina. Dynasore e recombinante PCSK9 cada trabalho através de diferentes caminhos para reduzir a captação de LDL.
Dynasore é um inibidor de pequena molécula de Dynamins10 e reduz a captação de LDL, bloqueando a endocitose dependente de Clatrina de LDL-LDLR complexo10,34. PCSK9 recombinante, por outro lado, é um membro de peptidase família S8 que vincula a LDLR e inibe sua reciclagem à superfície da célula após liberar LDL do complexo interiorizado, bloqueando as necessárias mudanças conformacionais35,36 . Célula de diminuição da densidade de superfície LDLR, eventualmente, leva a captação de LDL reduzida pela célula. Estatinas, enquanto bloqueia diretamente a enzima do 3-hidroxi-3-metilglutaril-coenzima (HMG-CoA) redutase e, portanto, a biossíntese do colesterol, também são conhecidas para upregulate a expressão de LDLR25,38 , levando ao aumento da absorção LDL. A sensibilidade do presente protocolo é validada através da detecção de reduções significativas no influxo de LDL em linhas de três células humanas clinicamente relevantes, HK2, HepG2 e HCAECs, por Dynasore e/ou de recombinação PCSK9 e um aumento na captação de LDL nas células HepG2 por Sinvastatina em um curso de tempo de quatro horas, com monitoramento por celular morfologia/saúde. Tomados em conjunto, este método fornece uma plataforma de médio a alto throughput para triagem simultaneamente a atividade farmacológica e citotoxicidade de compostos que regulamenta a captação de LDL em células vivas.
Protocolo
1. semeadura de células em uma placa de 24
- Aspire a mídia fora das células, lavam-se as células com 5 mL de fosfato Buffered Saline do Dubelco (dPBS) e aspire o dPBS. Para as células HepG2 um prato de 100 mm, usar 1,5 mL de 0,25% tripsina/EDTA, e para HK2 células ou HCAECs usar 1,5 mL da solução de tripsina/EDTA 0,05% para separar as células.
- Incube a placa em uma incubadora de 37 ° C por 4 minutos ou até que as células são desanexadas. Neutralize a tripsina após uma incubação de 4 minutos adicionando-se 3 mL de mídia completa para HepG2 e HK2 ou 3 mL de tripsina neutralizando a solução, dPBS mais 5% de soro fetal bovino (FBS), para as células HCAEC.
- Transferir as células para tubos cônico de 15 mL e centrifugar a 250 x g por 5 min, aspirar a mídia e ressuspender o pellet de células nos meios de comunicação completos.
- Filtre a suspensão de eritrócitos suavemente através de um filtro de malha 40 μm para separar grupos de célula. Não lave as células através do filtro.
- Contar as células e placa-los em uma densidade otimizada. Por exemplo, 5.000 células por poço das células HepG2 ou 10.000 células por poço de células HK2 ou HCAECs em uma placa de 24 levam a resultados óptimos.
- Incube a placa durante a noite a 37 ° C, para permitir que as células anexar.
- No dia seguinte, mudar a mídia celular à base de mídia para a linha de celular (sem FBS) acrescido de 5% da Lipo-proteína deficiente soro (semi-submersíveis) ou baixa (2%) Mídia FBS dependendo do tratamento (ver 1.7). Em seguida, continue a incubação por 24 h para as células de fome. Use 500 μL de mídia total por alvéolo em uma placa de 24.
- Tratar as células de três maneiras: adicionar 10 µ g/mL de rPCSK9 (ou veículo) e retorno das células para a incubadora de 37 ° C por 1 hora, adicionar 40 µM de hidrato de Dynasore (ou veículo, dimetilsulfóxido) e regressar as células incubadora a 37 ° C por 10 minutos , ou adicionar Simvastatin 1 µM (ou veículo, dimetilsulfóxido) e retornar as células para a incubadora de 37 ° C por 12, 18 ou 24 horas. Use mídia com 5% semi-submersíveis para tratamentos de Dynasore ou rPCSK9. Uso baixo (2%) FBS mídia ou mídia com tratamentos de semi-submersíveis sinvastatina 5%.
Nota: Tratar as células com compostos desejadas pode ser feito no momento da mudança de mídia por inanição de lipoproteína (passo 1.6) para experiências a longo prazo, ou antes da análise para experimentos de curto prazo. Alternativamente, tempos de tratamento personalizado podem ser escolhidos com base no tipo e o propósito dos experimentos. - Em seguida, adicione 5 µ l de pHrodo com rótulo vermelho LDL (estoque de 1 mg/mL) a cada poço para obter uma concentração final de 10 µ g/mL. Então, cuidadosamente remova quaisquer bolhas dos poços.
2. célula de análise ao vivo
- Imediatamente após a adição do LDL rotulado, coloque a placa na incubadora de sistema de análise de células vivas (ver Tabela de materiais) e deixar a placa equilibrar durante 15 minutos para reduzir a condensação na placa.
- Entretanto, o software aberto e agendar a verificação adicionando o vaso segurando o prato. Imagem 16 imagens por alvéolo em intervalos de 1 hora em 10 X 4 horas usando os canais vermelho e fase.
- Crie um mapa de chapa a ser usado para processamento de dados.
- Clique na guia Propriedades escolha o mapa de placa. Entrada do tipo de célula e tratamentos em guia de compostos .
- Clique na guia de regiões , selecione cada conjunto de réplicas e salve como regiões.
3. configurar parâmetros de análise
- Uma vez concluída uma execução experimental, crie uma imagem definida no software para treinar o computador para quantificar cada parâmetro incluído no conjunto de contagem.
- No software, abra a visualização da placa e, em seguida, na caixa de Utilitários de trabalho de análise , escolha criar ou adicionar à coleção de imagens.
- Selecione a Nova coleção de imagem, digite um nome para a coleção de imagens e escolher os canais vermelho e fase , marcando as caixas ao lado dos canais.
- Selecione mais 5 fotos e adicionar à coleção de imagens, adicionando à coleção de imagem atual.
- Crie uma definição de processamento para as células. A tabela 1 inclui os parâmetros para a célula HepG2, HK2 e HCAE processamento definições para este protocolo de influxo de LDL.
- Na caixa de Utilitários de trabalho de análise , escolha Nova definição de processamento. Escolha a coleção de imagem chamada etapa 2.1.2 do menu drop-down. Os parâmetros para o tipo de células de tabela 1de entrada.
- Na caixa de visualização, use o menu drop-down para selecionar a Visualização de todos.
- Na caixa Máscara de análise , verificar a Máscara de confluência e as caixas de Red Mask de objeto para exibir a área incluída na análise para a definição de processamento. Veja a Figura 1.
- Percorrer a coleção de imagens para garantir que as células e LDL estão incluídos na máscara. Selecione o arquivo e salvar a definição de processamento.
- Analise o conjunto de imagens da execução experimental.
- Abra o experimento na visualização do prato. Na caixa de Utilitários de trabalho de análise , escolha Lançar novo trabalho de análise. Seleccione a definição de processamento salvo.
- O trabalho de análise o nome, escolher o intervalo de tempo para análise e destacar os poços experimentais para analisar. Clique no botão Iniciar .
4. análise e processamento de dados
- Concluído o trabalho de análise, exporte os dados:
- Selecione a análise concluída e clique em Exibir. No menu utilitários , escolha Exportar métrica/gráfico.
- No menu de regiões , escolha Todos os poçose no menu de grupo , para obter os valores médios para cada conjunto de poços em grupo escolha Replica e para exportar os valores individuais para cada poço escolher nenhum.
- No menu objeto vermelho métrica , escolha o Total vermelho objeto intensidade integrada (RCU x µm2/image). Este parâmetro indica a soma dos tempos de intensidade (na RCU) sinal vermelho a área do sinal vermelho (em µm2) em todas as imagens em cada poço, o que corresponde a absorção total de LDL pelas células.
- Clique no botão Exportar dados . Verifica dados se dividem em imagens individuais. Os dados são copiados automaticamente em uma prancheta e podem ser colados em um novo arquivo de planilha.
- No menu objeto fase métrica , escolha a confluência (por cento). Verifica dados se dividem em imagens individuais. Clique no botão Exportar dados . Os dados são copiados automaticamente em uma prancheta e podem ser copiados para o arquivo de planilha que contém dados de Total intensidade integrada objeto de vermelho.
- Aplica a conversão da confluência porcentagem de área total, com a seguinte equação.
Área de fase (µm2/image) total = confluência (%) × (altura da imagem (Pixels) × resolução) × × (largura da imagem (Pixels) resolução)
Nota: O parâmetro de confluência (%) indica a confluência por cento da área de fase por imagem que corresponde à área das células em cada poço. Esta métrica deve ser convertida em área total de fase para cada indivíduo imagem exportada de uma vez. As especificações de imagem para o canal de fase (imagem altura, largura e resolução) para ser usado com a fórmula acima para cada navio experimental podem ser encontradas por se referir a Propriedades do navio sob Canais de imagem. - Normalize o objeto vermelho Total intensidade de integrada à área de fase Total calculado em 4.1.6 usando a seguinte fórmula para cada imagem individual para eliminar a variabilidade da densidade celular através dos poços.
- Divida os valores Total vermelho objeto intensidade integrada (RCU x µm2/image) de cada imagem por sua correspondente Área Total de fase (/image de2µm) para obter valores de LDL absorção (RCU) por imagem.
- Em seguida, média os Captação de LDL (RCU) dados de todas as imagens de cada poço para obter a absorção média de LDL em cada poço e em seguida a média os valores de captação de LDL de todos os poços de replicar para obter meios de grupo. Estes dados são os valores finais de captação de LDL e podem ser usados para ilustração e análise estatística utilizando o software de escolha.
Resultados
Live Cell Imaging permite o monitoramento confiável da célula de saúde durante os estudos de influxo de colesterol em três linhas de células humanas
Nós validado o nosso ensaio em três linhas de células humanas em qual colesterol Regulamento homeostase desempenha um importante papel fisiopatológico, incluindo células de carcinoma hepático humano (HepG2), células humanas renais (HK2) epiteliais e células endoteliais humanas de artéria coronária (HCAECs). Usamos um sistema de imagens de células vivas para realizar o ensaio de absorção de LDL em um curso de tempo de 4 h com seriais medições em intervalos de 1 h. Nossos resultados indicam que todos os tipos de células testados eram compatíveis com esta nova técnica e resultado em curvas, indicando absorção contínua de LDL para a duração do estudo influxo com 4,33 h como o ponto de extremidade final (Figura 2). Os dados de fluxo mostrados na Figura 2 obtiveram-se normalizando o total pHrodo fluorescência vermelho-rotulado LDL (total intensidade objeto vermelho integrado por imagem na RCU x µm2/imagem) para a área total da célula em cada imagem de cada poço (área de objeto fase por imagem em µ m2/image) para eliminar a variabilidade da densidade celular através dos poços. Além disso, para validar a sensibilidade do ensaio de influxo do LDL para fins de triagem compostos que afetam a absorção do colesterol LDL, usamos dois controles positivos conhecidos para inibir o influxo de LDL, Dynasore e rPCSK9 e um controlo positivo conhecido por induzir o LDL captação, sinvastatina. Como validado pelos nossos resultados, após o tratamento com Dynasore e rPCSK9, todos os três testaram linhas de células humanas (HepG2, HK2 e HCAEC) mostraram reduções significativas no influxo de LDL, um longo tempo de 4 h (Figura 2A-C). Por exemplo, a Figura 2 mostra que o influxo de LDL é reduzido nas células HepG2 com tratamento de Dynasore ao longo de tempo, em comparação com as células tratadas com DMSO; enquanto o DMSO como o controle do veículo para Dynasore controle não teve nenhum efeito significativo no influxo de LDL em comparação ao grupo controle não tratado. Além disso, nossos resultados mostraram um aumento na captação de LDL por células HepG2 após o tratamento com sinvastatina (Figura 3), apoiando a sensibilidade deste método para detectar alterações significativas no afluxo de LDL. Sobre o momento de 4,5 h, que é um ponto de tempo típicos em estudos de captação de LDL, o afluxo de LDL é significativamente reduzido com tratamento ou Dynasore ou rPCSK9 e aumentou Simvastatin tratamento (Figura 4).
Uma grande vantagem ao uso de células vivas de imagem para estudos de captação de LDL é que este sistema oferece imagens em tempo real das células em cada bem que poderia ser usado para monitorar a citotoxidade potencial dos compostos examinados. Figuras 5 a 7 ilustram imagens representativas das linhas três celulares investigadas no ponto inicial tempo (0,33 h) e ponto de extremidade final (4,33 h) como uma referência visual para o influxo líquido de LDL. As imagens confirmam a morfologia normal das células após tratamentos de Dynasore ou rPCSK9, indicando a eficácia e a segurança destes compostos.
Célula viva análise dá confiança colesterol quantitativa Serial influxo medições com vários tratamentos
Uma grande vantagem de usar esse protocolo com uma célula viva, sistema de imagem é a capacidade de coletar dados ao longo do tempo e comparar o influxo de LDL em vários pontos de tempo ao invés de apenas um ponto do tempo final como tradicionalmente feito. Usando este protocolo, somos capazes de calcular o influxo de reductionin por cento LDL no ponto terminal do tempo, bem como em intervalos de 1 h no decorrer do tempo. A tabela 2 resume a diminuição do afluxo de LDL em três linhas de célula humana testado após 10 min de pré-tratamento com 40 µM Dynasore ou pré-tratamento 1 h com 10 µ g/mL rPCSK9. A 4,33 h como o ponto de extremidade final do estudo, o tratamento com Dynasore em 40 µM reduziu significativamente o influxo de LDL em células HepG2, HK2 células e HCAECs em 53%, 68% e 54%, respectivamente (Tabela 2A-C) e o tratamento com rPCSK9 a 10 µ g/mL resultou em redução de 55% no LDL influxo no HK2 células (tabela 2B). Além de quantificar o ponto terminal de tempo como em ensaios tradicionais, somos capazes de realizar uma análise quantitativa na redução do influxo de LDL devido ao tratamento em cada ponto de tempo do experimento. Por exemplo, tabela 2B mostra que tratamento com rPCSK9 em HK2 células resultaram em uma redução da captação de LDL por 79% a 1,33 h, 67% a 2,33 h, 59% a 3,33 h pós tratamento em comparação com células não tratadas. Este protocolo fornece um método confiável de análise quantitativa de influxo de LDL após o tratamento.
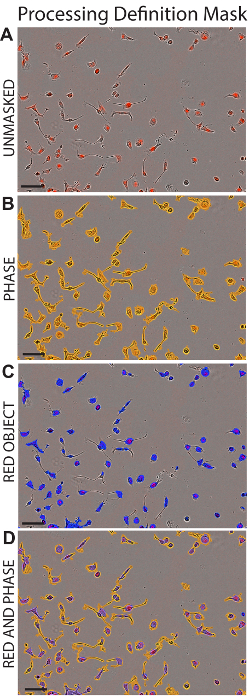
Figura 1 : Máscara de definição de processamento. Imagens representativas de células HK2 são descritas mediante a aplicação da definição de processamento adequado (detalhada na tabela 1). Mostrado areHK2 células sem mascaramento (A), com a fase Maskapplied (B), com máscara objeto vermelho aplicado (C) ou com máscaras fase tanto vermelho objeto aplicadas (D). Barra de escala = 100 µm. clique aqui para ver uma versão maior desta figura.
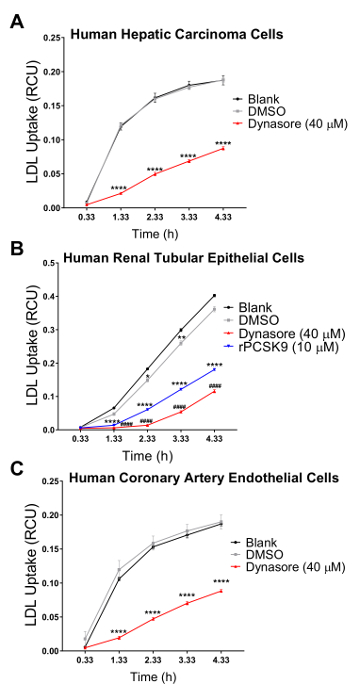
Figura 2 : Redução no LDL captação ao vivo usando celular sistema de imagem ao longo de um curso de tempo 4,33 h. Viver a análise de células sistema é usado para medir o influxo de LDL em células de carcinoma hepático humano (HEPG2) (A) humano renal tubular (HK2) células epiteliais (B) e coronária humana (HCAE) as células endoteliais (C). As células foram tratadas com Dynasore (10 min antes da corrida) ou rPCSK9 (1h antes da corrida) como controlos positivos. DMSO foi usado como um veículo para tratamentos Dynasore. Controles positivos diminuíram significativamente o influxo de LDL em todas as linhas de célula 3. Obtiveram-se valores de influxo de LDL normalizando a intensidade total objeto vermelho integrado (RCUxµm2/image) para a área de objeto total fase (/image de2µm). Os dados são mean±SEM. N = 6 poços/grupo. Dados são representativos de 2 ou 3 experimentos independentes. p < 0,0001 vs em branco, e # # #p < 0,0001 vs DMSO, usando ANOVA de duas vias. Clique aqui para ver uma versão maior desta figura.
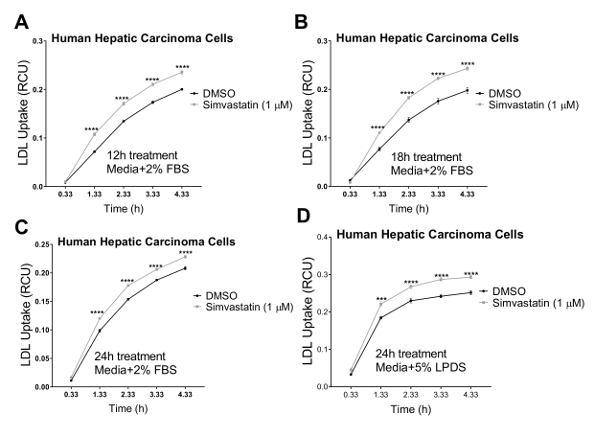
Figura 3 . Aumento na captação de LDL usando a célula viva, sistema de imagem ao longo de um curso de tempo 4,33 h. Viver a análise de células sistema é usado para medir o influxo de LDL nas células de carcinoma hepático humano (HEPG2). Captação de LDL é aumentada significativamente após o tratamento com sinvastatina para 12 h (A), (B) de 18 h ou 24 h (C) usando a mídia contendo 2% FBS. O ponto de tempo de 24 h realizou-se também com a mídia que contém 5% semi-submersíveis (sem FBS). DMSO foi usado como controle negativo. Obtiveram-se valores de influxo de LDL normalizando a intensidade total objeto vermelho integrado (RCU x µm2/image) para a área de objeto total fase (/image de2µm). Os dados são mean±SEM. N = 6 poços/grupo. Dados são representativos de um experimento independente. p < 0,0001 vs DMSO, usando o teste t de Student. Clique aqui para ver uma versão maior desta figura.
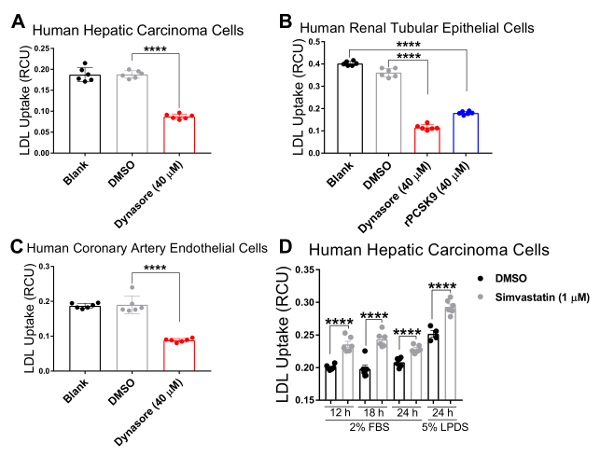
Figura 4 . Redução significativa do influxo LDL por agentes de redução da captação de LDL no momento de 4,3 h. Influxo de LDL é significativamente reduzido em células de carcinoma hepático humano (HepG2) (A) e coronária humana (HCAE) células endoteliais (C) após o tratamento com a captação de LDL humano renal tubular (HK2) células epiteliais (B) inibidores da Dynasore por 10 min ou rPCSK9 por 1 hora. Influxo de LDL é marcadamente aumentado pela sinvastatina em células HepG2 após 12, 18 ou 24 h tratamentos (D). Os dados são mean±SEM. N = 6 poços/grupo. Dados são representativos de 2 ou 3 experimentos independentes. p < 0,0001 usando ANOVA de duas vias. Clique aqui para ver uma versão maior desta figura.
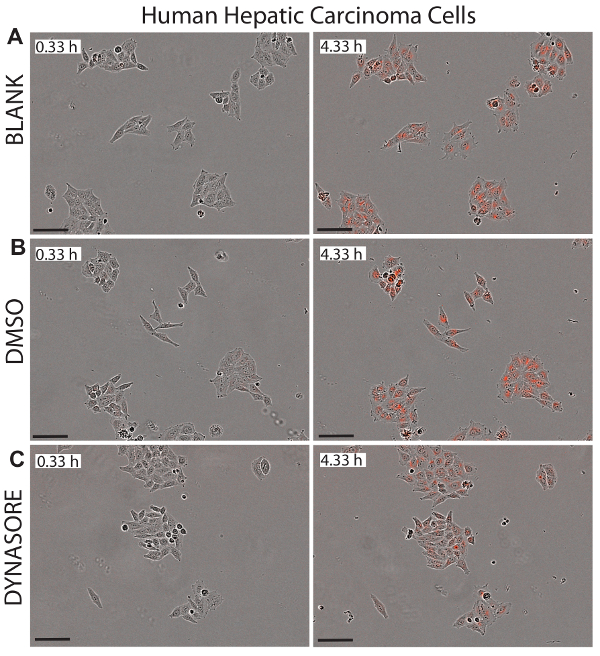
Figura 5 . Reduzido influxo de LDL nas células de carcinoma (HepG2) hepatocelular pelo agente reduzindo a captação de LDL, Dynasore. Imagens representativas do fase objeto e objeto vermelho para células HepG2 figuram a 0,33 h (painéis à esquerda) e o ponto de extremidade 4,33 h (painéis certo) Mostrar status saudável das células. 40 µM Dynasore, conhecido por reduzir a captação de LDL-colesterol, foi usado como controle positivo (C). Imagens foram tiradas na ampliação de 10x. Barra de escala = 100 µm. clique aqui para ver uma versão maior desta figura.

Figura 6 . Reduzido influxo de LDL em humanos renal tubular (HK2) células epiteliais por agentes reduzindo a captação de LDL, Dynasore e rPCSK9. Imagens representativas do fase objeto e objeto vermelho para células HK2 retratado em 0,33 h (painéis à esquerda) e o ponto de extremidade 4,33 h (painéis certo) mostram status saudável das células. 40 µM Dynasore (C), ou 10 µ g/mL rPCSK9 (D), conhecido por reduzir a absorção do colesterol LDL, foram utilizados como controle positivo. Imagens são tiradas em ampliação de 10x. Barra de escala = 100 µm. clique aqui para ver uma versão maior desta figura.
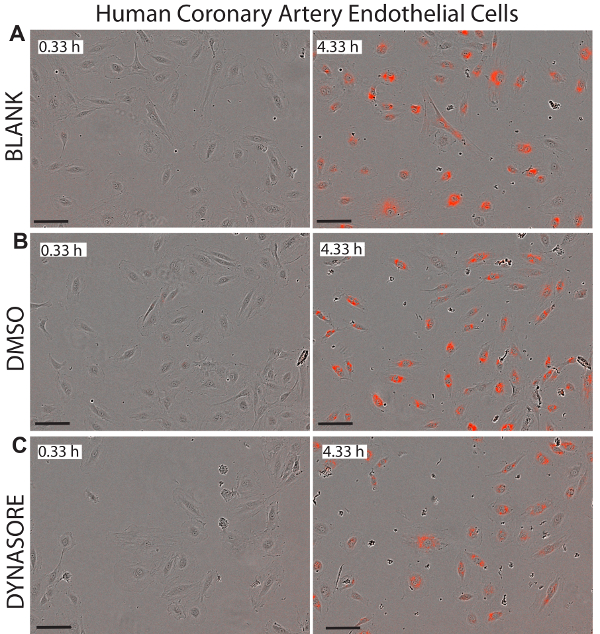
Figura 7 . Reduzido influxo de LDL nas células endoteliais coronarianas humana (HCAECs) pelo agente reduzindo a captação de LDL, Dynasore. Imagens representativas do fase objeto e objeto vermelho para HCAECs retratado em 0,33 h (painéis à esquerda) e o ponto de extremidade 4,33 h (painéis certo) mostram status saudável das células. 40 µM Dynasore, conhecido por reduzir a captação de LDL-colesterol, foi usado como controle positivo (C). Imagens foram tiradas na ampliação de 10x. Barra de escala = 100 µm. dados são mean±SEM. N = 6 poços/grupo. Dados são representativos de 2 ou 3 experimentos independentes. Clique aqui para ver uma versão maior desta figura.
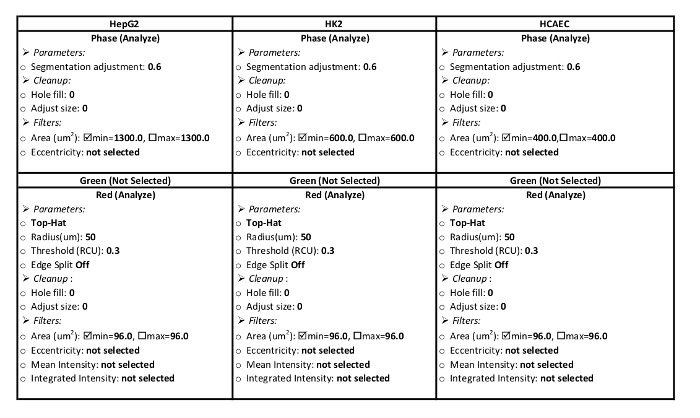
Tabela 1: definição de parâmetros de processamento. Estes parâmetros são específicos para o sistema de análise utilizado no presente protocolo. Parâmetros devem ser configurados para analisar a área em vermelho no canal vermelho e a área da célula no canal de fase. Configurações de parâmetro para HepG2, HK2, linhas de células HCAE são apresentadas.
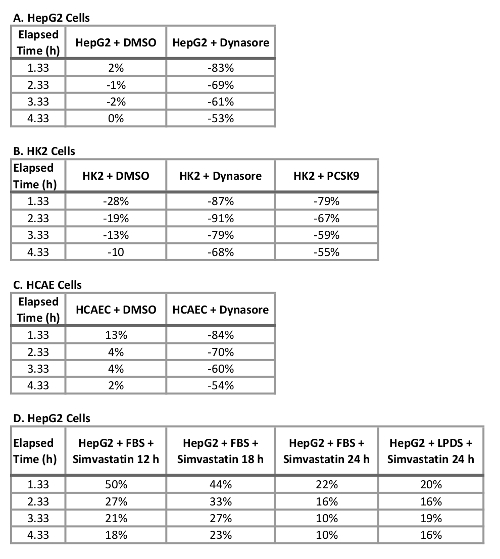
Tabela 2: porcentagem de mudança no influxo de LDL nas células HepG2, HK2 e HCAE tratados com Dynasore, rPCSK9 ou sinvastatina em 4,3 h. (A) HepG2 células, células HK2 (B), HCAE (C) células e células HepG2 (D).
Discussão
No actual protocolo, demonstramos a utilização de imagens de células vivas como um método novo e mais eficaz para medir a captação de LDL em tempo real sobre um curso de tempo em várias linhas de células humanas. Células de carcinoma hepático humano (HepG2) são comumente usadas em estudos de triagem para baixar o colesterol terapêutica21,22,23,24,25,26, 39,40. Portanto, nós escolhemos este tipo de célula para testar a capacidade de um sistema de imagens de células vivas para estudos de influxo de LDL. Nossos resultados indicam que as células HepG2 são compatíveis com esta nova técnica e resultado em uma curva sigmoide, como indicando contínua captação de LDL para a duração do ensaio do influxo até 4,33 h como o ponto de extremidade final (Figura 2A e Figura 3 ).
Homeostase do colesterol desempenha um papel importante na fisiopatologia de várias nephropathies. Com efeito, acúmulo de colesterol no tecido renal é dos principais contribuintes para a fibrose renal levando à doença renal crônica e é uma patologia importante em vários nephropathies28,29,30,31. Daí, nós examinamos nosso método em pilhas epithelial renais humanas do (HK2) como uma linha de celular popular e confiável utilizada no campo da Nefrologia. Nossos dados também apoiou a viabilidade do sistema de imagem para medir o influxo de LDL nas células HK2 célula viva. Como mostrado na Figura 2B, células HK2 assumiram o colesterol LDL linearmente durante toda a duração do estudo influxo (4 horas).
Devido a importância do metabolismo do colesterol no desenvolvimento e progressão da aterosclerose32,33,41, a principal causa de doença cardiovascular, que por sua vez, é o assassino número um em todo o mundo 42, tivemos como objetivo validar nosso método em um tipo de célula relevantes para a aterosclerose. Usamos o humano pilhas Endothelial Arterial Coronariana (HCAECs), como estes são um dos tipos de primeira célula a ser expostos a um insulto de colesterol no lúmen de um paciente de aterosclerose coronariana. Nossos dados mostrados na Figura 2C indicam que esse método de influxo de LDL também funciona de forma eficaz com HCAECs. O gráfico resultante é uma curva sigmoide, como semelhante de células HepG2.
Para testar a validade e a sensibilidade deste teste de influxo de LDL melhorada para a seleção de compostos que afetam a captação de LDL-colesterol, usamos três controles, agentes de redução da captação de LDL Dynasore e rPCSK9 e ativador de influxo de LDL sinvastatina. Aqui, tratamos o acima mencionado linhas celulares (HepG2, HK2 e HCAECs) com concentrações otimizadas de Dynasore ou rPCSK9 antes do ensaio de influxo. Nossos resultados mostraram que todas as linhas de célula testado três responderam aos tratamentos com reduções significativas no influxo de LDL ao longo de um curso de 4 horas (Figura 2). Por exemplo, a 4,33 h como o ponto de tempo final, tratamento com Dynasore em 40 µM significativamente reduzido influxo de LDL em células HepG2, HK2 células e HCAECs em 53%, 68% e 54%, respectivamente (p < 0,0001; Figura 2 A-C e Tabela 2A-C). Além disso, rPCSK9 a 10 µ g/mL causou uma acentuada redução de 55% no influxo de LDL nas células HK2 (p < 0,0001; Figura 2 B e tabela 2B). Além disso, nossos resultados mostraram que tratar células HepG2 com sinvastatina resultou em um aumento na captação de LDL (Figura 3), apoiando a sensibilidade deste método para detectar alterações significativas no afluxo de LDL. Estudos de tratamento com rPCSK9 nas células HepG2 e HCAEC não estão incluídos neste protocolo, como rPCSK9, é usado como um tratamento de controle adicionais com resultados bem documentados, mas é caro para comprar em pequenas quantidades. Portanto, rPCSK9 só foi utilizado para validar este protocolo nas células HK2.
Vivo celular imagem análise, juntamente com a medição funcional e oportuna de afluxo de LDL, permitido para monitoramento contínuo da saúde e da morfologia das células. Esta vantagem pode eficientemente detectar citotoxidade potencial dos compostos aplicados, tornando este método uma técnica ideal para monitorar simultaneamente citotoxicidade e atividade farmacológica. Figuras 5 a 7 ilustram imagens representativas das três linhas celulares testados no ponto de extremidade final (4,33 h) como uma referência visual para o efeito dos tratamentos sobre o influxo líquido de LDL e também mostra a morfologia saudável das células após o testado tratamentos. Recomendamos a inspeção visual de todas as imagens de cada poço, para assegurar a vegetação rasteira morfologia das células para a duração do estudo. Por exemplo, em dados não mostrados, quando imagens de células HepG2 tratadocom com 80 μM Dynasore foram inspecionadas, observamos indicações de desprendimento de células, como as bordas das células apareceram ser levantar a placa, sugerindo descolamento de célula em altas concentrações de Dynasore. Além disso, altas concentrações de sinvastatina (3-10 μM) também levado à morfologia alterada indicando induziram apoptose, conforme relatado por altas doses de estatinas45. Este protocolo foi utilizado para executar uma titulação do tratamento Dynasore em 20-80 μM e sinvastatina em concentração de 0,5-10 μM, após o que as imagens de celular foram usadas para analisar a saúde das células e determinar o potencial ctotoxicity dos tratamentos em várias concentrações. Resultados sugeriram o uso de 40 μM para Dyansore e 1 μM para sinvastatina como concentrações ideais.
Por último, sugerimos realizar um estudo de titulação de densidade celular se outra linhagem celular está a ser testado com esse método, a fim de identificar o número de célula ideal por alvéolo para obter resultados consistentes. Nosso estudo de otimização de densidade celular mostrou que 10.000 células/poço em uma placa de 24 conduzir aos resultados de influxo de LDL consistentes de células HK2 e HCAE. É importante observar que para este ensaio de influxo de LDL usando o sistema de imagens de células vivas, uma monocamada de células não-confluente distribuídos uniformemente sobre os poços é desejável como aglomerados de células podem dar origem a erros nos finais valores normalizados de influxo LDL. A razão para isto é que, para a normalização dos dados influxo, a área objeto de fase é usada como uma medida da densidade celular e este parâmetro pode ser afetado negativamente quando formam-se grupos de células. Observamos que as células HepG2 têm uma tendência a forma touceiras quando semeado em densidades superiores a 5.000 células/poço causando resultados inconsistentes afluxo; Portanto, usamos 5.000 células por poço em uma placa de 24 como densidade ideal para células HepG2.
Coletivamente, nosso método fornece uma plataforma de médio a alto throughput para rastreio a atividade farmacológica e citotoxicidade de compostos regulando simultaneamente o influxo de LDL. Esse método pode ser facilmente adaptado para uso com outros ligantes fluorescente-etiquetadas que insira o compartimento dos lisossomos para avaliar a absorção de ligante em tempo real. Enquanto este protocolo oferece especificações para InCucyte ao vivo de imagens e sistema de análise, o protocolo pode ser adaptado para sistemas alternativos de imagem como Cellomics.
Divulgações
Os autores declaram que eles têm não tem interesses financeiro concorrente.
Agradecimentos
Este trabalho foi apoiado pelas seguintes subvenções para LAS: Instituto Nacional de saúde (R56HL132209 e 1R01HL140468) e Instituto de pesquisa do centro de Miami. KY é um receptor da American coração Associação Predoctoral Fellowship (18PRE33960070). Células HepG2 foram gentilmente cedidas pelo Dr. Emmanuel Thomas, escola da Universidade de Miami-Miller de medicina46,,47,48.
Materiais
| Name | Company | Catalog Number | Comments |
| pHrodo Red-LDL | ThermoFisher Scientific | L34356 | |
| HepG2 cells | E. Thomas Lab, U. Miami | HB-8065 | |
| MEM | Sigma | M0325 | |
| Sodium Pyruvate | Sigma | P5280 | |
| L-Glutamine 200 mM solution | Sigma | G7513 | |
| FBS | Atlas Biologicals | FP-0500-A | |
| HK2 cells | ATCC | CRL-2190 | |
| Keratinocyte SFM media kit | Gibco | 17005-042 | |
| Primary Coronary Artery Endothelial Cells | ATCC | PCS-100-020 | |
| Vascular Cell Basal Medium | ATCC | PCS-100-030 | |
| Endothelial Cell Growth Kit-VEGF | ATCC | PCS-100-041 | |
| Human Lipoprotein Deficient Serum | Millipore | LP4 | |
| PBS | Sigma | D8537 | |
| Trypsin-EDTA (0.25%) | Gibco | 25200056 | |
| Trypsin-EDTA (0.05%) | Gemini Bio-Products | 400-150 | |
| Trypsin Neutralizing Solution | ATCC | PCS-999-004 | |
| 24 well plate | Falcon | 353226 | |
| 40 μM mesh cell strainer | VWR | 10199-654 | |
| 15 mL conical tubes | VWR | 89039-666 | |
| 50 mL conical tubes | VWR | 89039-658 | |
| Trypan Blue Staining (0.4%) | Life Technologies | T10282 | |
| Counting Slides | Bio-Rad | 145-0011 | |
| Incucyte Zoom | Sartorius | Zoom | Imaging and analysis platform |
| Dynasore Hydrate | Sigma | D7693 | |
| PCSK9 Recombinant Protein | Cayman Chemicals | 20631 |
Referências
- Baigent, C., et al. Efficacy and safety of cholesterol-lowering treatment: prospective meta-analysis of data from 90,056 participants in 14 randomised trials of statins. Lancet. 366 (9493), 1267-1278 (2005).
- Trevisan, R., Dodesini, A. R., Lepore, G. Lipids and renal disease. Journal of the American Society of Nephrology. 17 (4), Suppl 2 145-147 (2006).
- Tall, A. R., Yvan-Charvet, L. Cholesterol, inflammation and innate immunity. Nature Reviews Immunology. 15 (2), 104(2015).
- Dedoussis, G. V., Schmidt, H., Genschel, J. LDL-receptor mutations in Europe. Human Mutation. 24 (6), 443-459 (2004).
- Sasaki, K., et al. ATP-binding cassette transporter A subfamily 8 is a sinusoidal efflux transporter for cholesterol and taurocholate in mouse and human liver. Molecular Pharmaceutics. , (2018).
- Storch, J., Xu, Z. Niemann-Pick C2 (NPC2) and intracellular cholesterol trafficking. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids. 1791 (7), 671-678 (2009).
- Jansen, P. J., et al. Absence of ApoE upregulates murine brain ApoD and ABCA1 levels, but does not affect brain sterol levels, while human ApoE3 and human ApoE4 upregulate brain cholesterol precursor levels. Journal of Alzheimer's Disease. 18 (2), 319-329 (2009).
- Girard, E., et al. The dynamin chemical inhibitor dynasore impairs cholesterol trafficking and sterol-sensitive genes transcription in human HeLa cells and macrophages. PLoS One. 6 (12), 29042(2011).
- Robinet, P., et al. Dynamin is involved in endolysosomal cholesterol delivery to the endoplasmic reticulum: role in cholesterol homeostasis. Traffic. 7 (7), 811-823 (2006).
- Macia, E., et al. Dynasore, a cell-permeable inhibitor of dynamin. Developmental Cell. 10 (6), 839-850 (2006).
- Benjannet, S., et al. NARC-1/PCSK9 and its natural mutants: zymogen cleavage and effects on the LDLR and LDL-cholesterol. Journal of Biological Chemistry. , (2004).
- Qian, Y. -W., et al. Secreted PCSK9 downregulates low density lipoprotein receptor through receptor-mediated endocytosis. Journal of Lipid Research. 48 (7), 1488-1498 (2007).
- Brown, M. S., Goldstein, J. L. A receptor-mediated pathway for cholesterol homeostasis. Science. 232 (4746), 34-47 (1986).
- Goldstein, J. L., Brown, M. S. History of discovery: the LDL receptor. Arteriosclerosis, Thrombosis, and Vascular Biology. 29 (4), 431(2009).
- Stephan, Z. F., Yurachek, E. C. Rapid fluorometric assay of LDL receptor activity by DiI-labeled LDL. Journal of Lipid Research. 34 (2), 325-330 (1993).
- Fisher, T. S., et al. Effects of pH and low density lipoprotein (LDL) on PCSK9-dependent LDL receptor regulation. Journal of Biological Chemistry. 282 (28), 20502-20512 (2007).
- Atrahimovich, D., Khatib, S., Sela, S., Vaya, J., Samson, A. O. Punicalagin induces serum low-density lipoprotein influx to macrophages. Oxidative Medicine and Cellular Longevity. 2016, (2016).
- Xu, M., et al. δ-Tocopherol reduces lipid accumulation in Niemann-Pick type C1 and Wolman cholesterol storage disorders. Journal of Biological Chemistry. 112, (2012).
- Bonilla, D. L., et al. Autophagy regulates phagocytosis by modulating the expression of scavenger receptors. Immunity. 39 (3), 537-547 (2013).
- Guo, M., et al. Apelin-13 Decreases Lipid Storage in Hypertrophic Adipocytes In vitro Through the Upregulation of AQP7 Expression by the PI3K Signaling Pathway. Medical Science Monitor : International Medical Journal of Experimental and Clinical Research. 20, 1345-1352 (2014).
- Guillemot, J., Asselin, M. C., Susan-Resiga, D., Essalmani, R., Seidah, N. G. Deferoxamine stimulates LDLR expression and LDL uptake in HepG2 cells. Molecular Nutrition & Food Research. 60 (3), 600-608 (2016).
- Javitt, N. B. Hep G2 cells as a resource for metabolic studies: lipoprotein, cholesterol, and bile acids. The FASEB Journal. 4 (2), 161-168 (1990).
- Mullen, P. J., Lüscher, B., Scharnagl, H., Krähenbühl, S., Brecht, K. Effect of simvastatin on cholesterol metabolism in C2C12 myotubes and HepG2 cells, and consequences for statin-induced myopathy. Biochemical Pharmacology. 79 (8), 1200-1209 (2010).
- McNutt, M. C., et al. Antagonism of secreted PCSK9 increases low density lipoprotein receptor expression in HepG2 cells. Journal of Biological Chemistry. 284 (16), 10561-10570 (2009).
- Scharnagl, H., et al. Effect of atorvastatin, simvastatin, and lovastatin on the metabolism of cholesterol and triacylglycerides in HepG2 cells. Biochemical Pharmacology. 62 (11), 1545-1555 (2001).
- Scharnagl, H., et al. The effects of lifibrol (K12. 148) on the cholesterol metabolism of cultured cells: evidence for sterol independent stimulation of the LDL receptor pathway. Atherosclerosis. 153 (1), 69-80 (2000).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences. 106 (24), 9820-9825 (2009).
- Ding, W., et al. Osteopontin deficiency ameliorates Alport pathology by preventing tubular metabolic deficits. JCI Insight. 3 (6), (2018).
- Herman-Edelstein, M., Scherzer, P., Tobar, A., Levi, M., Gafter, U. Altered renal lipid metabolism and renal lipid accumulation in human diabetic nephropathy. Journal of Lipid Research. 55 (3), 561-572 (2014).
- Su, H., et al. Lipid Deposition in Kidney Diseases: Interplay Among Redox, Lipid Mediators, and Renal Impairment. Antioxidants & Redox Signaling. 28 (10), 1027-1043 (2018).
- Agrawal, S., Zaritsky, J. J., Fornoni, A., Smoyer, W. E. Dyslipidaemia in nephrotic syndrome: mechanisms and treatment. Nature Reviews Nephrology. 14 (1), 57(2018).
- Babiak, J., Rudel, L. L. Lipoproteins and atherosclerosis. Baillieres Clinical Endocrinology and Metabolism. 1 (3), 515-550 (1987).
- Wang, H. H., Garruti, G., Liu, M., Portincasa, P., Wang, D. Cholesterol and Lipoprotein Metabolism and Atherosclerosis: Recent Advances in Reverse Cholesterol Transport. Annals of Hepatology. 16 (1), 28-42 (2018).
- Preta, G., Cronin, J. G., Sheldon, I. M. Dynasore-not just a dynamin inhibitor. Cell Communication and Signaling. 13 (1), 24(2015).
- Horton, J. D., Cohen, J. C., Hobbs, H. H. Molecular biology of PCSK9: its role in LDL metabolism. Trends in Biochemical Sciences. 32 (2), 71-77 (2007).
- Abifadel, M., et al. Mutations in PCSK9 cause autosomal dominant hypercholesterolemia. Nature Genetics. 34 (2), 154(2003).
- Goldstein, J. L., Brown, M. S. Regulation of the mevalonate pathway. Nature. 343 (6257), 425(1990).
- Dong, B., Wu, M., Cao, A., Li, H., Liu, J. Suppression of Idol expression is an additional mechanism underlying statin-induced up-regulation of hepatic LDL receptor expression. International Journal of Molecular Medicine. 27 (1), 103-110 (2011).
- Song, K. H., Kim, Y. H., Im, A. -R., Kim, Y. H. Black Raspberry Extract Enhances LDL Uptake in HepG2 Cells by Suppressing PCSK9 Expression to Upregulate LDLR Expression. Journal of Medicinal Food. , (2018).
- Chan, J. C., et al. A proprotein convertase subtilisin/kexin type 9 neutralizing antibody reduces serum cholesterol in mice and nonhuman primates. Proceedings of the National Academy of Sciences of the United States of America. 106 (24), 9820-9825 (2009).
- Tabas, I., Williams, K. J., Borén, J. Subendothelial lipoprotein retention as the initiating process in atherosclerosis: update and therapeutic implications. Circulation. 116 (16), 1832-1844 (2007).
- Benjamin, E. J., et al. Heart disease and stroke statistics-2017 update: a report from the American Heart Association. Circulation. 135 (10), 146-603 (2017).
- Brown, M. S., Goldstein, J. L. The SREBP pathway: regulation of cholesterol metabolism by proteolysis of a membrane-bound transcription factor. Cell. 89 (3), 331-340 (1997).
- Horton, J. D., Goldstein, J. L., Brown, M. S. SREBPs: activators of the complete program of cholesterol and fatty acid synthesis in the liver. The Journal of Clinical Investigation. 109 (9), 1125-1131 (2002).
- Tavintharan, S., et al. Reduced mitochondrial coenzyme Q10 levels in HepG2 cells treated with high-dose simvastatin: A possible role in statin-induced hepatotoxicity. Toxicology and Applied Pharmacology. 223 (2), 173-179 (2007).
- Thomas, E., et al. HCV infection induces a unique hepatic innate immune response associated with robust production of type III interferons. Gastroenterology. 142 (4), 978-988 (2012).
- Thomas, E., Liang, T. J. Experimental models of hepatitis B and C-new insights and progress. Nature Reviews Gastroenterology & Hepatology. 13 (6), 362(2016).
- Yoneda, M., et al. Hepatitis B Virus and DNA Stimulation Trigger a Rapid Innate Immune Response through NF-κB. The Journal of Immunology. , 1502677(2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados