Method Article
Utilisant le protozoaire Paramecium caudatum comme vecteur d’Infections d’origine alimentaire chez les larves de poisson zèbre
Dans cet article
Résumé
Poisson zèbre (Danio rerio) deviennent un modèle animal vertébré-employé couramment pour la colonisation microbienne et la pathogenèse. Ce protocole décrit l’utilisation du protozoaire Paramecium caudatum comme un véhicule pour des infections transmises par les aliments chez les larves de poisson zèbre. P. caudatum facilement intériorise les bactéries et obtenir repris par zebrafish larvaire par des comportements de prédateurs naturels.
Résumé
En raison de leur transparence, traçabilité génétique et facilité d’entretien, poisson zèbre (Danio rerio) sont devenues un modèle vertébré largement utilisé pour les maladies infectieuses. Poisson zèbre larve se nourrissent naturellement le protozoaire unicellulaire Paramecium caudatum. Ce protocole décrit l’utilisation de P. caudatum comme un véhicule pour les infections transmises par les aliments chez le poisson zèbre larvaire. P. caudatum internaliser un large éventail de bactéries et de cellules bactériennes restent viables pendant plusieurs heures. Poisson zèbre nourrissent ensuite P. caudatum, la charge bactérienne est libérée dans l’intestin après digestion du véhicule paramécie et les bactéries colonisent le tube digestif. Le protocole inclut une description détaillée de l’entretien de paramécie, chargement avec des bactéries, détermination de la dose et de la dégradation bactérienne, ainsi que l’infection du poisson-zèbre en se nourrissant avec paramécies. L’avantage de cette méthode d’infection d’origine alimentaire est qu’il étroitement imite le mode d’infection observé dans la maladie humaine, conduit à une colonisation plus robuste par rapport aux protocoles d’immersion et permet l’étude d’un large éventail d’agents pathogènes. Infections transmises par les aliments dans le modèle de poisson-zèbre peuvent être utilisée pour étudier l’expression des gènes bactériens dans l’hôte, interactions hôte-pathogène et caractéristiques de la pathogénicité, y compris la morbidité, de localisation, de diffusion et de la charge bactérienne.
Introduction
Poisson zèbre part morphologiquement et fonctionnellement conservé caractéristiques des mammifères, y compris les lignées granulocytaire (p. ex., neutrophiles), les cellules de type monocyte/macrophage, récepteurs Toll-like, cytokines pro-inflammatoires et peptides antimicrobiens1 . Le tractus intestinal chez le poisson zèbre est entièrement développé à 6 jours après la fécondation (dpf) et montre la conservation morphologique et fonctionnelle avec le tube digestif chez les mammifères, comme la régulation de la transcription conservée dans les cellules épithéliales intestinales 2. cela fait poisson-zèbre, un excellent modèle pour la colonisation microbienne intestinale et la pathogenèse. Un large éventail de maladies entériques microbes a été étudié dans le modèle de poisson-zèbre, y compris entérohémorragique Escherichia coli3, Vibrio cholerae4,5,6de Salmonella enterica, le poisson zèbre microbiote7,8et le rôle des probiotiques dans l’immunité intestinale9. Un avantage du modèle poisson-zèbre, c’est qu’elle est colonisée par les nombreux microbes sans perturber la microflore endogène, ce qui permet l’étude de comportement microbienne dans le contexte d’une population microbienne mixte3, 6. actuellement, poisson zèbre la plupart des modèles de colonisation gastro-intestinale et la maladie s’appuient sur l’administration de microbes par immersion de bain, où le poisson-zèbre sont incubés dans une suspension bactérienne pour une quantité déterminée de temps10. Cependant, cela rend difficile de déterminer la dose exacte de bactéries administré et conduit à une colonisation limitée à certains microbes, notamment avec des bactéries non pathogènes. Alternativement, une suspension bactérienne est administrée à pêcher par gavage oral11, mais c’est techniquement difficile et limitée à des larves plus âgées et les poissons adultes.
Ce protocole décrit l’utilisation du protozoaire unicellulaire Paramecium caudatum comme un moyen de diffusion de toxi-infection alimentaire des microbes dans le tube digestif des larves de poisson zèbre. Paramécie est faciles et peu coûteux à entretenir et est en mesure de s’alimenter sur une grande variété de microbes, y compris les algues, les champignons et bactéries qui elles intériorisent à travers une rainure orale ciliées12,13,14. Une fois intériorisée, bactéries sont détenus dans des vacuoles, qui finalement s’acidifier et le contenu sont dégradées sur une période de plusieurs heures15. Poisson zèbre larvaire capturer paramécies comme proies naturelles peu après leur éclosion, environ 3 – 4 dpf selon température16et les relever avec une grande efficacité. Le processus de capture des proies emmène en moyenne 1,2 s de détection pour capturer17et paramécie capturés est rapidement digérés dans l’intestin de poisson-zèbre, tels qu’intériorisée de bactéries viables sont libérées dans le tube digestif3. En conséquence, paramécies utilisable comme une méthode rapide et facile pour fournir une dose forte et cohérente des bactéries dans le tube digestif du poisson-zèbre. Les bactéries livrés peuvent soit être transformés pour exprimer une protéine fluorescente, tels que mCherry, comme décrit ici, ou, dans le cas des bactéries génétiquement insolubles, elles peuvent être préalablement teintés avec un colorant fluorescent pour permettre la visualisation au sein de la tractus gastro-intestinal.
Ce protocole décrit la prestation alimentaire des entéropathogène e. coli (entérohémorragique Escherichia coli [EHEC] et adhérentes invasives d' Escherichia coli [AIEC]) et la sous-espèce Salmonella enterica Typhimurium. Les deux pathogène e. coli et Salmonella typhimurium sont transmises par la voie fécale-orale18,19et peuvent être acquise par contamination alimentaire, tels que viandes, légumes et produits laitiers. À l’aide de P. caudatum comme véhicule, e. coli et Salmonella typhimurium colonisent avec succès les larves de poisson zèbre dans 30 à 60 min d’incubation co avec le véhicule de la paramécie. La charge bactérienne atteinte est assez robuste pour visualiser la colonisation et de déterminer la charge en ensemençant des homogénats de tissus.
Protocole
Soins de poisson-zèbre, élevage et expériences décrites ici sont en conformité avec le Guide pour le soin et l’utilisation des animaux de laboratoire et ont été approuvés par la Commission institutionnelle du bien-être Animal de l’Université du Texas Health Science Center, protocole numéro AWC-16-0127.
1. la croissance et le maintien des paramécies
- Obtenir des paramécies live cultures provenant de sources telles que le centre de ressources International (ZIRC) poisson zèbre.
- D’une culture de plus en plus direct, ajouter 1 mL de la culture de la paramécie, 1 mL d’une culture de MG1655 d’e. coli (densité optique OD600 1,0 à 2,0) remis en suspension dans 1 x E3 (0,29 g/L NaCl, 13 mg/L de KCl, 44 mg/L de CaCl2, 81 mg/L MgSO4 HEPES, pH 7.0, stérile de 0,48 g/L) et 8 mL de 1 x E3 dans une fiole de vitroplants de 10 mL. Agiter légèrement et ensuite stocker à 22 ° C.
- Pour maintenir une culture, toutes les deux semaines, passage 1 mL d’une culture de la paramécie dans une fiole 10 mL de culture tissulaire avec 9 mL de milieu x E3 1 frais contenant 108 UFC/mL d’e. coli MG1655 resuspendues dans 1 x E3.
2. détermination de bactérienne Dose administrée au poisson-zèbre
-
Déterminer la demi-vie bactérienne au sein de la paramécie
Remarque : La demi-vie des bactéries au sein de la paramécie est déterminée par électrodéposition viable e. coli provenant de paramécie, tel que décrit ci-dessous.- Après une incubation de 2 h de bactéries (OD600 de 1.0) avec paramécies à 22 ° C, combiner les paramécies et co-culture bactérienne dans un tube conique de 50 mL, laver la paramécie avec 1 x E3 et compte le nombre de paramécies par millilitre (tel que décrit ci-dessous en étapes 3.2.7 et 3.2.8).
- Après avoir compté le nombre de paramécie, enlever 50 µL de la paramécie et co-culture bactérienne toutes les heures (d’après exposition de 6 h) et ajouter chaque échantillon dans un tube frais 1,5 mL.
- Place 950 µL de 1 % de tensioactifs non ioniques (voir Table des matières) en phosphate buffered une solution saline (PBS) dans chacun des tubes de 1,5 mL et vortexer pendant 1 min à lyser les paramécies. Effectuer 01:10 les dilutions de l’échantillon à l’aide de PBS stérile comme un diluant (c.-à-d. 100 µL dans 900 µL).
- Plaque de 100 µL de chaque dilution sur géloses sélectives (milieu LB tet : tryptone 1 g/L, extrait de levure 0,5 g/L, 1 g/L NaCl 30 tétracycline µg/mL) et incuber à 37 ° C pendant 16 h. Le lendemain, compter et noter le nombre de colonies bactériennes sur la plaque (unités formant colonies, UFC) en comptant seulement les colonies individuelles isolées et distinctes. Identifier une plaque avec une dilution qui donne 30 – 300 UFC.
- Déterminer la dilution facteur utilisé. Par exemple, si 1 µL de la culture bactérienne est mélangé avec 99 mL de PBS stérile, c’est une dilution au 1/100 (0,01). Ce numéro sera le nombre d’UFC de la dilution. Effectuez le calcul ci-dessous, pour chaque point dans le temps afin de déterminer l’UFC dans l’échantillon original :
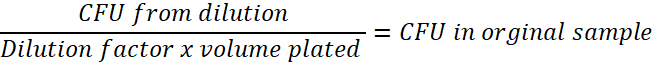
- Calculer et graphique le nombre de viable e.coli/paramécie correspondant aux heures après l’exposition à l’aide de la concentration de la paramécie calculée à l’étape 3.3.1 et déterminer la demi-vie dans la paramécie (Figure 1).
- À l’aide de l’UFC nombre calculé pour chaque point dans le temps de calculer et de graphique le nombre de viable e. coli par la paramécie sur l’axe des ordonnées par rapport à l’incubation de poste des heures sur l’axe x, à l’aide de la concentration de la paramécie calculée à l’étape 3.3.1. Déterminer la demi-vie dans la paramécie.
-
Déterminer bactériennes dosage de demi-vie bactérienne et s’abattent taux.
Remarque : Pour déterminer le dosage bactérien, la demi-vie de la bactérie à l’intérieur de la paramécie et le taux de prédateurs de poissons zèbres sur paramécies (voir l’étape 3.4) doivent être prises en compte.- Utilisez la formule suivante pour déterminer la décomposition bactérienne au sein de la paramécie :
(1)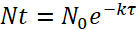
Où N0 représente la quantité initiale de bactéries par paramécie après le 2 h d’incubation, Nt est la quantité restante après le temps t, τ est le temps après lequel a réduit de moitié le nombre de bactéries viables et k est la constante de désintégration. - À partir de l’expérience de dégradation, déterminer la constante de désintégration k à l’aide de la demi-vie bactérienne (c'est-à-dire, le temps après lequel la quantité de bactéries viable/paramécie a diminué de moitié).
(2)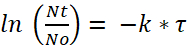
Pour la détermination de Half-Life, le terme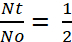 et
et
(3)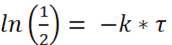 ou
ou
(4)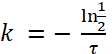
Remarque : Basé sur la Figure 1, la demi-vie d’Escherichia coli dans paramécie est d’environ 2,3 h. Ainsi, à l’aide de la formule (4), le taux de décroissance, k, pour e. coli est :
(5)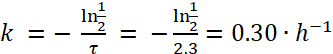
- Déterminer le taux de décomposition (k) à partir de l’expérience de Half-Life pour trouver la dose de bactéries viables (Nt) repris par les larves de poisson zèbre après temps rapace (t), où (P) est le taux de prédateurs ou le nombre des paramécies mangé par un poisson par heure :
(6)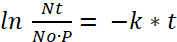 ou
ou
(7)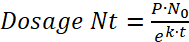
Remarque : Par la Figure 1, la quantité initiale de bactéries par paramécies (N,0), après une incubation de 2 h (t) est de 790 UFC. Par film 1 et 2, le taux de prédateurs (P) est 1539. - À l’aide de ces valeurs à substituer dans l’équation (7), à calculer la dose bactérienne consommée par un poisson zèbre après une incubation de 2 h comme :
(8)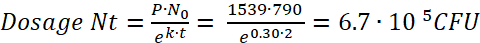
- Utilisez la formule suivante pour déterminer la décomposition bactérienne au sein de la paramécie :
3. toxi-infection alimentaire Infection du poisson-zèbre
- Incuber les bactéries avec des paramécies.
- Préparer une co-culture de paramécies et e. coli MG1655 la nuit avant l’infection. Mélanger 8 mL de médias de l’E3, 1 mL d’une culture de la paramécie en cours et 1 mL d’une culture de MG1655 d’e. coli (OD600 = 1,0) remis en suspension dans 1 x E3 dans des flacons de culture tissulaire T25. Incuber les flacons à température ambiante (RT) jusqu’au lendemain. Pour chaque condition de traitement, préparer deux flacons de paramécies.
- Ensemencer les milieux de croissance bactérienne (LB : tryptone 1 g/L, extrait de levure de 0,5 g/L, 1 g/L de NaCl) avec la souche infectieuse bactérienne, en choisissant une colonie bactérienne individuelle d’une plaque en utilisant une boucle de l’inoculation stérile. Incuber le milieu liquide à 37 ° C et laisser l’agitation à 110 tours par minute (tr/min) pendant la nuit.
Remarque : Il faut porter des équipements de protection individuelle (gants et un manteau de laboratoire) et les installations de sécurité biologique niveau 2 doivent être utilisées lors de la manipulation d’agents infectieux. - Le lendemain, mesurer l' OD600 de la culture au jour le jour. Calculer le volume de la culture nécessaire pour obtenir une OD600 des 1 lorsque resuspendues dans 11 mL de médias.
- Récolter le volume des bactéries de l’étape 3.1.2 par centrifugation à 6 000 x g pendant 5 min, un volume pour chaque fiole des paramécies. Jeter le surnageant et resuspendre le culot bactérien dans 1 mL de médias de l’E3.
- Éventuellement, les tacher les bactéries avec un colorant fluorescent.
- Ajouter 1 µL de la tache bactérienne (5 mg/mL de solution) de 4-64FX FM. Couvrir le tube d’aluminium pour protéger de Photoblanchiment et incuber rotative plus fin à ta pendant 15 min.
- Enlever le colorant excédentaire par un lavage avec 1 x E3 : Pellet bactéries par centrifugation à 6 000 x g pendant 1,5 min, puis resuspendre le culot dans 1 mL de médias de l’E3. Répétez l’étape lavage deux fois.
- Récolter des bactéries colorées par centrifugation à 6 000 x g pendant 5 min. jeter le surnageant et resuspendre le culot bactérien dans 1 mL de médias de l’E3.
- Ajouter 1 mL de la suspension bactérienne à chacun des deux flacons de paramécies fraîches. Incuber à RT pendant 2 h.
Remarque : Si vous travaillez avec des bactéries colorées, incuber dans l’obscurité à RT pendant 2 h.
- Lavage de bactéries/paramécies co-culture.
- Combiner le contenu de deux flacons de co-culture paramécies/bactéries dans un tube conique de 50 mL. Centrifuger les échantillons à 300 x g à 15 ° C pendant 10 min. s’assurer que la centrifugeuse est un refroidissement préalable avant cette étape.
- Prélever environ 10 mL du surnageant à l’aide d’une pipette sérologique E3 et ajouter environ 10 mL de frais 1 x E3 pour le tube à fond conique.
Remarque : Durant toutes les étapes de lavage, il est essentiel d’être très rapide lorsque vous retirez le surnageant, comme la paramécie débuteront à nager hors de la pastille. Spin et éliminer le surnageant d’un tube à la fois pour assurer une manipulation assez rapide à cette étape et éviter la perte des paramécies dans le surnageant. - Tourner les échantillons par centrifugation à 300 x g à 15 ° C pour 5 min. enlever environ 10 mL du surnageant à l’aide d’une pipette sérologique E3 et ajouter environ 10 mL de frais 1 x E3 pour le tube à fond conique. Répéter cette étape deux fois.
- Centrifuger les échantillons à 300 x g à 15 ° C pendant 5 min. Retirez environ 10 mL du surnageant E3, prenant soin de ne pas pour perturber le culot.
- Resuspendre le culot dans les 10 mL restant des médias de l’E3 et transférer 500 µL de la suspension dans un nouveau tube de microtubes de 1,5 mL. Granule le 500 µL de paramécies par centrifugation à 300 x g pendant 5 min compter le nombre des paramécies.
- Éliminer 400 µL de l’E3 surnageant de l’échantillon de 500 µL. Ajouter 20 µL de solution de formaldéhyde de 36,5 % pour le restant de 100 µL de paramécies resuspendre doucement et incuber pendant 5 min à 22 ° C.
Remarque : Cette étape tue la paramécie permettant de compter. - Mesurer le volume total actuel à l’aide de la pipette et le dossier. Diluer la paramécie suspension 1:1 v/v avec une solution de bleu trypan de 0,4 %.
- Utiliser un compteur de cellules ou un hémocytomètre pour compter le nombre de mort paramécies/mL.
Remarque : En raison de l’étape de fixation préalable, la plupart des paramécies sera morts à ce stade, mais ce nombre reflète le nombre des paramécies direct pour l’expérience d’incubation co. Les auteurs n’ont pas trouvé mort paramécies significatif en raison de l’incubation des bactéries, donc cela peut être négligée comme un facteur ici.
- Co incuber les larves paramécies et poisson-zèbre.
- Calculer la concentration des paramécies :

Remarque : Ce calcul donne la concentration des paramécies dans le tube conique de 50 mL de l’étape 3.2.5. - Calculer le volume des paramécies lavés requis pour une concentration de 2 x 105 paramécies/mL dans un volume final de 3 mL de l’E3.
Remarque : La concentration des paramécies peut être réglée selon la dose bactérienne désiré, qui est soumis à l’optimisation. - Anesthésier les poissons zèbres en ajoutant tricaïne en 100 mM Tris pH 8.0 à une concentration finale de 100 mg/L. transfert 10 poissons zèbres dans chaque puits d’une plaque de 6 puits dans un volume total de 3 mL de E3 frais contenant la concentration appropriée des paramécies (calculé à l’étape 3.3.2). Assurez-vous de transférer les larves dans une quantité minimale de liquide, pour s’assurer ils récupèrent de l’anesthésie dans le puits du destinataire.
- Incuber à 30 ° C pendant 2 h dans un incubateur diurne dans des conditions de lumière du jour, à assurer des conditions optimales de foudre s’abattent.
- Laver le poisson-zèbre au moins 5 fois en transférant des poissons dans un nouveau bien contenant 3 mL de E3 frais contenant 100 mg/L tricaïne chaque fois.
Remarque : Ne pas omettre la tricaïne pendant l’étape de lavage. Transfert des larves mobiles sans anesthésie augmente le risque de dommages et de détresse chez l’animal. - Préparer éventuellement, poisson zèbre pour l’imagerie en incorporant le poisson-zèbre dans 3 mL d’agarose à bas point de fusion 1 % dans une plaque de 6 puits de paroi noire : agarose de la bas point de fusion est composé en 1xE3 et chauffé dans un four à micro-ondes. Une fois fondu, ajouter tricaïne à une concentration finale de 160 mg/mL. Poisson de position sous un stéréomicroscope, à l’aide d’un gel écrêté de chargement de pointe, en vous assurant que la tête est sur la gauche et la queue est sur la droite (Figure 3). Attendre 5 minutes pour l’agarose définir, puis superposer le poisson embarqué avec 1 x E3 contenant 160 mg/mL tricaïne pour l’imagerie.
- Calculer la concentration des paramécies :
- Déterminer le taux de prédateurs.
Remarque : Aucune autre expérience ne doit être mis en place pour déterminer le taux de prédateurs. Plutôt, cela peut être fait au cours de l’étape 3.3.4, tel que décrit ci-dessous.- Au cours de l’étape 3.3.4, découvre zebrafish consommait sur un stéréomicroscope et capture des séquences vidéo de la capture de proies.
- Le score de la séquence vidéo. Capture des proies est caractérisée par la suppression du poisson-zèbre vers la proie. Compter chaque grève comme événement de capture une proie, mais ce n’est qu’une approximation (voir Discussion).
- Calculer le nombre moyen d’événements de capture de proies par heure de plusieurs clips vidéo, chacune représentant une larve de poisson-zèbre différent (Figure 2).
Résultats
Paramecium caudatum intègre facilement un large éventail de bactéries dans les vacuoles de stockage. La densité bactérienne intracellulaire dépend de la densité des bactéries et des paramécies dans la co-culture, ainsi que les espèces bactériennes utilisées. Au fil du temps, les vacuoles acidifient et dégradation bactérienne s’ensuit. Le taux de dégradation doit être déterminée individuellement pour toutes les souches utilisées. La densité bactérienne initiale est pathogène e. coli, 790 bactéries /paramécieet les bactéries sont dégradées avec une demi-vie d’environ 2,3 h (Figure 1).
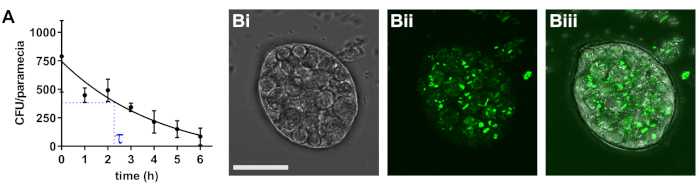
Figure 1 : détermination de la demi-vie bactérienne dans paramécie. (A) suivant 2 h d’incubation co avec infectieuses e. coli, P. caudatum a été lavé et transféré au milieu sans bactéries. Aux points d’heure indiquée, les numéros de viable e. coli cellules ont été déterminées par étalement de dilutions sur une gélose sélective. Les résultats sont moyens ± écart-type de la moyenne (SEM ; n = 3). (B) image typique de la paramécie transportant internalisé des bactéries, avec champ lumineux (Bi), bactéries fluorescentes (Bii) et fusionné des canaux (Biii). Echelle = 20 μm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
En outre, le poisson-zèbre qui profite des taux, c'est-à-dire la vitesse à laquelle zebrafish internaliser des paramécies chargés en bactéries lors de l’incubation co, a été étudiée. Poisson zèbre larve commencent à chasser et capturer des proies vivantes de 5 dpf20, bien qu’il a été constaté que, lorsque déclenché à 30 ° C, le développement larvaire est accéléré et animaux affiche des comportements prédateurs de dpf 4. S’attaquant est accompagné par une caractéristique frappante de comportement20 (Figure 2 a), et la détermination du taux de prédateurs repose sur l’hypothèse que chaque attaque mène à l’intériorisation d’une paramécie, bien que cela ne peut être considérée une approximation (voir Discussion). Basée sur les observations décrites ci-après de la proie des larves de poisson zèbre, le taux d’absorption de la paramécie est environ 1 539 par h (Figure 2 b).
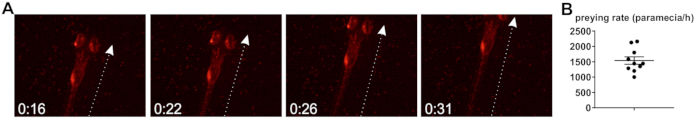
Figure 2 : détermination du taux de prédateurs de poissons zèbres. (A) des images fixes d’une vidéo de rapace, montrant un poisson-zèbre (dpf 5) les larves s’attaquent à la paramécie porteurs de bactéries fluorescentes. Temps en [secondes]. La flèche indique l’axe principal de circulation au cours de la frappe. (B) Quantification du taux de prédateurs (apport de paramécies par heure), basé sur n = 10 vidéos pris en charge le temps de pose complète 2 h. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Après internalisation des paramécies, le poisson-zèbre dégrade efficacement la proie dans l’intestin, libérant les bactéries infectieuses dans le système digestif. Tel que décrit ci-dessus, la dégradation des paramécies procède rapidement et bactéries libres peuvent être détectées dans le tractus intestinal dans les 30 minutes de proie. Exempt de bactéries, puis passer de l’intestin antérieur à l’intestin moyen et postérieur, où ils sont détectés environ 1 à 2 h après le début de l’enveloppe (Figure 3). Persistance de bactéries dans l’intestin dépend des espèces et dose mais varie de plusieurs h à plusieurs jours dans le cas d’e. coli et S. enterica. S. enterica se localise principalement dans la muqueuse intestinale, avec une invasion épithéliale (Figure 3D), menant à l’infiltration de neutrophiles dans l’épithélium (Figure 3).
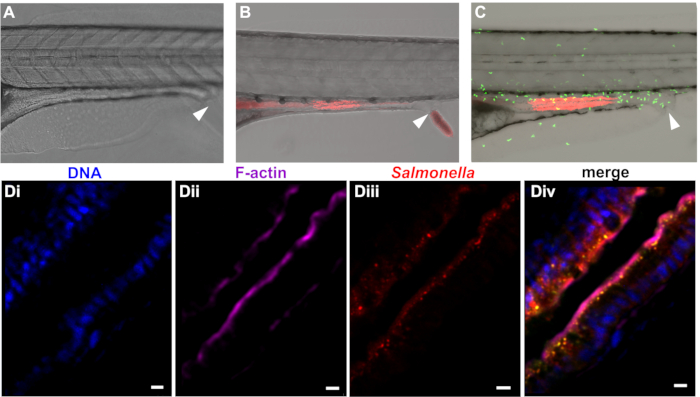
Figure 3 : colonisation du poisson-zèbre avec bactéries. Poisson zèbre à dpf 5 ont été laissés non infectées (A) ou colonisés par mCherry exprimant (B) e. coli ou (C) S. enterica. Expériences d’infection peuvent être pratiqués dans les poissons (A et B) de type sauvage ou lignées transgéniques (par exemple, la ligne Tg (MPO::EGFP) j’ai114 exprimant des neutrophiles fluorescents verts illustrés (C). L’ouverture rectale est marqué par une flèche. Grossissement supérieur (D) de la section intestinale entier-montent des larves embarqués atteintes d’infection à Salmonella enterica . (Di) bleu = Hoechst marquage des noyaux, Violet (Dii) = phalloïdine marquage F-actine, (Diii) rouge = Salmonella, fusion (Div). Echelle = 5 μm. S’il vous plaît cliquez ici pour visionner une version agrandie de cette figure.
Film 1 : les images vidéo de la capture de proies. S’il vous plaît cliquez ici pour télécharger cette vidéo.
Discussion
Le protocole de base décrit ici a été optimisé pour le pathogène e. coliet a été adapté avec succès pour d’autres espèces bactériennes, y compris les Salmonella enterica et Vibrio cholerae. Pour certaines espèces qui ne colonisent pas les l’intestin du poisson-zèbre après immersion de bain, y compris certaines souches de Salmonella enterica et certaines bactéries anaérobies, infection d’origine alimentaire comme décrit ici peut servir à établir avec succès la colonisation. Par rapport à microgavage, qui est également utilisé pour établir la charge bactérienne élevée dans le tractus intestinal larvaire, infection d’origine alimentaire est techniquement moins difficile et nécessite des équipements moins spécialisés. Toutefois, les paramètres critiques doivent être optimisées pour les espèces bactériennes et les souches à utiliser. Ces facteurs comprennent la densité bactérienne et paramécie pour l’étape de culture mixte de bactéries-paramécie : si le nombre de bactéries au sein de la paramécie est faibles, cela pourrait être améliorée en augmentant la densité bactérienne dans l’étape de culture mixte. Certaines espèces bactériennes peut causer des dommages à l’hôte de la paramécie, et cela devrait être évaluée par microscopie.
Un autre facteur important dans le présent protocole est la capture des proies par le poisson-zèbre. Le taux de rapace comme décrit ici est basé sur l’hypothèse que chaque capture des proies grève résultats dans l’ingestion d’une paramécie. Les densités élevées de paramécies par poisson sont utilisées dans le protocole afin d’assurer des taux élevés de prédateurs. Cependant, la capture des proies est tributaire de la densité des paramécies dans le système, et dans des cultures très diluée de paramécie, tarifs prédateurs peuvent être aussi bas que 13 – 15 paramécies par heure21,22. Une limitation est que les taux de capture de proies sont aussi fortement dépendants des conditions d’éclairage et dans l’obscurité, les taux de capture sont 80 % plus faible que dans des conditions de lumière21 et cela devraient être prises en compte lorsque vous configurez des expériences. Si le temps d’exposition à la proie doivent être élargi afin d’optimiser la colonisation, examen doit être donnée à l’exposition secondaire aux bactéries par le biais de matières fécales. Dans les conditions décrites ci-dessus – 2 h de l’exposition de proie –, cette exposition est négligeable, étant donné que les temps de passage du tube digestif des bactéries est plus de 1 h et la concentration de bactéries dans le véhicule est beaucoup plus élevée que dans les fèces. Toutefois, si la durée de l’exposition de proie s’accroît, cela peut devenir un facteur important.
Des contrôles appropriés devraient être inclus dans le présent protocole, y compris la colonisation du poisson-zèbre suite alimenter avec des paramécies contenant non pathogène e. coli MG1655. Si plusieurs souches bactériennes sont comparées pour leur capacité à coloniser l’hôte de poisson-zèbre, il est important de vérifier si leur demi-vie dans paramécie est comparable. Les mutations bactériennes, y compris ceux compromettant l’intégrité de la paroi cellulaire ou la détection de l’acide, peuvent compromettre la stabilité bactérienne au sein des paramécies. Dans ce cas, poisson zèbre d’alimentation doit être rajusté pour tenir compte des différences de dosage.
Le protocole décrit ici peut être utilisé pour étudier la colonisation bactérienne et ses conséquences, notamment par la colonisation bactérienne du poisson-zèbre d’imagerie tel que décrit ci-dessus, ainsi qu’en déterminant l’UFC par le poisson-zèbre de tissu homogénat3, ou enquête sur la mortalité et la morbidité associée à l’infection. Idéalement, pour une visualisation bactérienne, souches bactériennes, exprimant des protéines fluorescentes comme mCherry ou protéine fluorescente rouge (DP) doivent être utilisés. Cela permettra la visualisation de l’accroissement de la population bactérienne. Si la souche bactérienne n’est pas génétiquement tractable ou s’oppose à l’utilisation de l’expression de la protéine fluorescente pour d’autres raisons, bactéries peuvent être teintés avec un colorant fluorescent, tels que FM 4-64FX, avant la co-culture avec des paramécies. Lorsque vous utilisez le protocole décrit ici, co-culture avec des paramécies ne diminue pas la luminosité du colorant et bactéries colorées sont clairement visibles dans l’intestin du poisson-zèbre. Toutefois, le colorant sera dilué au fil du temps si importante prolifération bactérienne se produit au sein de l’hôte de poisson-zèbre. Dans les deux cas, bactéries fluorescentes rouges sont préférables sur bactérie verte fluorescente, puisque le tissu autofluorescence peut être plus élevé dans le vert que dans le canal rouge.
Il a été constaté que ce protocole peut être adapté pour aérobie et espèces de bactéries microaérophiles. Il peut être possible de l’adapter à l’alimentation des spores et des espèces de champignons, même si cela reste à être testée expérimentalement.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Nous tenons à remercier les membres du groupe Krachler pour lecture critique et commentaires sur le manuscrit. Ce travail a été financé par le NIH (R01AI132354) un UT systèmes STAR award et le BBSRC.
matériels
| Name | Company | Catalog Number | Comments |
| Paramecium caudatum, live | Carolina | 131554 | no not store growing cultures below room temperature |
| 0.4% Trypan Blue Solution | Sigma | T8154-20ML | liquid, sterile-filtered, suitable for cell culture; prepared in 0.81% sodium chloride and 0.06% potassium phosphate, dibasic |
| Dimethyl sulfoxide (DMSO) | Sigma | 276855-100ML | store in a solvent safety cabinet |
| Escherichia coli, MG1655 | ATCC | ATCC 700926 | can be replaced by any other non-pathogenic E. coli strain |
| FM 4-64FX stain | Thermo Fisher | F34653 | aliquot and store frozen |
| Formaldehyde | Sigma | F8775-4X25ML | |
| LB Broth | Sigma | L3397-1KG | |
| Phosphate buffered saline tablets | Thermo Fisher | 18912014 | |
| Tetracycline | Sigma | 87128-25G | toxic, irritant |
| Tricaine (Ethyl 3-aminobenzoate methanesulfonate) | Sigma | E10521-10G | |
| Triton X-100 | Sigma | X100-100ML | |
| Trypan Blue Solution, 0.4% | Sigma | 93595-50ML | |
| UltraPure Low Melting Point Agarose | Thermo Fisher | 16520050 | |
| hemocytometer or cell counter | any | ||
| stereomicroscope | any | ||
| table-top centrifuge | |||
| microwave | |||
| rotator wheel | |||
| heated shaking incubator | |||
| aquatics facilities | |||
| breeding tanks |
Références
- Broz, P., Ohlson, M. B., Monack, D. M. Innate immune response to Salmonella Typhimurium, a model enteric pathogen. Gut Microbes. 3 (2), 62-70 (2012).
- Lickwar, C. R., et al. Genomic dissection of conserved transcriptional regulation in intestinal epithelial cells. PLoS Biology. 15 (8), e2002054(2017).
- Stones, D. H., et al. Zebrafish (Danio rerio) as a Vertebrate Model Host To Study Colonization, Pathogenesis, and Transmission of Foodborne Escherichia coli O157. mSphere. 2 (5), (2017).
- Mitchell, K. C., Breen, P., Britton, S., Neely, M. N., Withey, J. H. Quantifying Vibrio cholerae enterotoxicity in a zebrafish infection model. Applied and Environmental Microbiology. , 00783(2017).
- Logan, S. L., et al. The Vibrio cholerae type VI secretion system can modulate host intestinal mechanics to displace gut bacterial symbionts. Proceedings of the National Academy of Sciences of the United States of America. 115 (16), E3779-E3787 (2018).
- Howlader, D. R., et al. Zebrafish as a novel model for non-typhoidal Salmonella pathogenesis, transmission and vaccine efficacy. Vaccine. 34 (42), 5099-5106 (2016).
- Troll, J. V., et al. Microbiota promote secretory cell determination in the intestinal epithelium by modulating host Notch signaling. Development. 145 (4), (2018).
- Wiles, T. J., et al. Host Gut Motility Promotes Competitive Exclusion within a Model Intestinal Microbiota. PLoS Biology. 14 (7), e1002517(2016).
- Rendueles, O., et al. A new zebrafish model of oro-intestinal pathogen colonization reveals a key role for adhesion in protection by probiotic bacteria. PLoS Pathogens. 8 (7), e1002815(2012).
- Varas, M., et al. Salmonella Typhimurium induces cloacitis-like symptomsin zebrafish larvae. Microbial Pathogenesis. 107, 317-320 (2017).
- Runft, D. L., et al. Zebrafish as a natural host model for Vibrio cholerae colonization and transmission. Applied and Environmental Microbiology. 80 (5), 1710-1717 (2014).
- Meier, R., Wiessner, W. Infection of algae-free Paramecium bursaria with symbiotic Chlorella sp. Isolated from green paramecia: I. Effect of the incubation period. European Journal of Protistology. 24 (1), 69-74 (1988).
- Miura, T., Moriya, H., Iwai, S. Assessing phagotrophy in the mixotrophic ciliate Paramecium bursaria using GFP-expressing yeast cells. FEMS Microbiology Letters. 364 (12), (2017).
- Watanabe, K., et al. Ciliate Paramecium is a natural reservoir of Legionella pneumophila. Scientific Reports. 6, 24322(2016).
- Bragg, A. N., Hulpieu, H. A Method of Demonstrating Acidity of Food Vacuoles in Paramecium. Science. 61 (1580), 392(1925).
- Borla, M. A., Palecek, B., Budick, S., O'Malley, D. M. Prey capture by larval zebrafish: evidence for fine axial motor control. Brain, Behavior and Evolution. 60 (4), 207-229 (2002).
- Patterson, B. W., Abraham, A. O., MacIver, M. A., McLean, D. L. Visually guided gradation of prey capture movements in larval zebrafish. Journal of Experimental Biology. 216 (Pt 16), 3071-3083 (2013).
- Megraud, F. Transmission of Helicobacter pylori: faecal-oral versus oral-oral route. Alimentary Pharmacology & Therapeutics. 9 Suppl 2, 85-91 (1995).
- Spears, K. J., Roe, A. J., Gally, D. L. A comparison of enteropathogenic and enterohaemorrhagic Escherichia coli pathogenesis. FEMS Microbiology Letters. 255 (2), 187-202 (2006).
- Bianco, I. H., Kampff, A. R., Engert, F. Prey capture behavior evoked by simple visual stimuli in larval zebrafish. Frontiers in Systems Neuroscience. 5, 101(2011).
- Gahtan, E., Tanger, P., Baier, H. Visual prey capture in larval zebrafish is controlled by identified reticulospinal neurons downstream of the tectum. Journal of Neuroscience. 25 (40), 9294-9303 (2005).
- Westphal, R. E., O'Malley, D. M. Fusion of locomotor maneuvers, and improving sensory capabilities, give rise to the flexible homing strikes of juvenile zebrafish. Frontiers in Neural Circuits. 7, 108(2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon