Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Réduction des émissions de bois de saule par micro-ondes à basse température assistée par hydrothermal carbonisation
Dans cet article
Résumé
Un protocole pour la déplétion des précurseurs d’émissions à partir de la biomasse de faible qualité par un traitement hydrothermale assisté par micro-ondes à basse température est présenté. Ce protocole comprend les paramètres hyperfréquences et l’analyse du produit biocharbon et de l’eau de process.
Résumé
La biomasse est un combustible durable, car ses émissions de CO2 sont réintégrées dans la croissance de la biomasse. Cependant, les précurseurs inorganiques de la biomasse provoquent un impact environnemental négatif et une formation de scories. Le bois de saule à courte rotation (SRC) sélectionné a une teneur élevée en cendres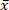 (= 1,96%) et, par conséquent, une teneur élevée en précurseurs d’émissions et de scories. Par conséquent, la réduction des minéraux du bois de saule SRC par la carbonisation hydrothermale assistée par micro-ondes à basse température (MAHC) à 150 ° c, 170 ° c et 185 ° c est étudiée. Un avantage de MAHC sur les réacteurs conventionnels est une conductance de température uniforme dans le milieu de réaction, car les micro-ondes pénètrent le volume entier du réacteur. Cela permet un meilleur contrôle de la température et un temps de recharge plus rapide. Par conséquent, une succession de réactions de dépolymérisation, de transformation et de repolymérisation peut être analysée efficacement. Dans cette étude, l’analyse de la perte de masse, de la teneur en cendres et de la composition, des valeurs de chauffage et des rapports molaires O/C et H/C du bois de saule traité et non traité a montré que la teneur en minéraux du charbon MAHC était réduite et que la valeur de chauffage augmentait. L’eau du processus a montré un pH décroissant et contenait du furfural et du 5-méthylfurfural. Une température de process de 170 ° c a montré la meilleure combinaison d’entrée d’énergie et de réduction des composants de cendres. Le MAHC permet une meilleure compréhension du processus de carbonisation hydrothermale, tandis qu’une application industrielle à grande échelle est peu probable en raison des coûts d’investissement élevés.
(= 1,96%) et, par conséquent, une teneur élevée en précurseurs d’émissions et de scories. Par conséquent, la réduction des minéraux du bois de saule SRC par la carbonisation hydrothermale assistée par micro-ondes à basse température (MAHC) à 150 ° c, 170 ° c et 185 ° c est étudiée. Un avantage de MAHC sur les réacteurs conventionnels est une conductance de température uniforme dans le milieu de réaction, car les micro-ondes pénètrent le volume entier du réacteur. Cela permet un meilleur contrôle de la température et un temps de recharge plus rapide. Par conséquent, une succession de réactions de dépolymérisation, de transformation et de repolymérisation peut être analysée efficacement. Dans cette étude, l’analyse de la perte de masse, de la teneur en cendres et de la composition, des valeurs de chauffage et des rapports molaires O/C et H/C du bois de saule traité et non traité a montré que la teneur en minéraux du charbon MAHC était réduite et que la valeur de chauffage augmentait. L’eau du processus a montré un pH décroissant et contenait du furfural et du 5-méthylfurfural. Une température de process de 170 ° c a montré la meilleure combinaison d’entrée d’énergie et de réduction des composants de cendres. Le MAHC permet une meilleure compréhension du processus de carbonisation hydrothermale, tandis qu’une application industrielle à grande échelle est peu probable en raison des coûts d’investissement élevés.
Introduction
L’application de micro-ondes pour la carbonisation hydrothermale (mahc) a été utilisée pour la transformation thermochimique de composés modèles de biomasse comme le fructose, le glucose1,2 ou la cellulose3, et pour les substrats organiques, de préférence les déchets4,5,6,7,8,9,10. L’utilisation des micro-ondes est avantageuse car elle permet un chauffage uniforme de la biomasse traitée2,10 principalement par des pertes thermiques d’un solvant diélectrique11,12, bien que les micro-ondes ne ne pas transférer suffisamment d’énergie pour briser directement les liaisons chimiques et induire des réactions13. Les micro-ondes pénètrent l’ensemble du volume de réaction du vaisseau du réacteur HTC et transfèrent l’énergie directement au matériau, ce qui n’est pas possible avec un réacteur conventionnel qui montre un taux de chauffage plus lent en raison de la forte capacité de chauffage du manteau en acier et de la échantillon lui-même14. L’excitation même des molécules d’eau de l’échantillon par micro-ondes permet un contrôle de processus amélioré, car la température dans le réacteur à micro-ondes est répartie uniformément11,14,15 et le temps de recharge après la réaction est beaucoup plus rapide. En outre, les réacteurs conventionnels chauffent beaucoup plus lentement et les réactions chimiques survenant pendant le chauffage peuvent fausser les résultats qui sont habituellement assignés à la température finale. L’amélioration du contrôle de processus dans un réacteur MAHC permet une élaboration précise de la dépendance à la température des réactions HTC sélectionnées (par exemple, déshydratation ou décarboxylation). Un autre avantage de la distribution de la température uniforme dans le volume du réacteur HTC est l’adhérence plus faible des particules immobilisées et complètement carbonisées sur la paroi interne du réacteur2. Cependant, l’eau est seulement un solvant absorbant micro-ondes moyen qui montre même la diminution de l’absorbance micro-ondes à des températures plus élevées, ce qui limite la température maximale réalisable. Cet effet négatif est compensé lorsque des acides sont produits pendant le processus HTC ou des catalyseurs (espèces ioniques ou polaires) sont ajoutés avant le traitement. Les réactions induites par micro-ondes montrent des rendements de produits plus élevés en général11,15 et plus précisément du 5-hydroxyméthylfurfural (5-HMF) du fructose par rapport aux réactions catalysées au lit de sable12. Ils ont également un bien meilleur équilibre énergétique, puis les méthodes de chauffage conventionnel15,16.
Le concept chimique fondamental de la carbonisation hydrothermale est la dégradation et la polymérisation successive de la biomasse. Au cours de ces réactions d’interaction complexes, le tissu est épuisé d’oxygène, ce qui augmente la valeur de chauffage. Au début, les polymères hémicellulose et cellulose sont hydrolysés en monomères de sucre17, bien que les basses températures affectent principalement l’hémicellulose18,19,20,21. Dans ce stade précoce des réactions HTC, les acides organiques sont formés à partir de la transformation des aldéhydes de sucre et de la déacétylation de l’hémicellulose. Ces acides peuvent être acétique, lactique, levulinique, acrylique ou acide formique20,21,22 et ils diminuent le pH de l’eau de réaction dans le réacteur. En raison de la dissociation, ils forment des ions négatifs libres qui augmentent le produit ionique dans l’eau du processus. Le produit ionique croissant permet la résolution des cations, qui sont les constituants majeurs des cendres dans la biomasse. Par ce mécanisme, le tissu est épuisé par les précurseurs d’émissions et les formeurs de scories (p. ex. potassium, sodium, calcium, chlore et métaux lourds)23,24.
Les acides organiques formés peuvent soutenir la déshydratation des monomères de sucre en furannes. Un produit commun de déshydratation du sucre est le furfural et le 5-hydroxyméthylfurfural, qui sont des produits réalisables pour l’industrie chimique, car ils servent de produits de plate-forme (par exemple, pour la synthèse des biopolymères). le 5-méthylfurfural peut être formé par des réactions catalysées de la cellulose25,26 ou 5-hydroxyméthylfurfural27. Alors que la synthèse des biopolymères est une repolymérisation artificielle dans des conditions contrôlées, les furannes peuvent également condenser, polymériser et former des structures aromatiques de poids moléculaire élevé dans l’environnement chimique complexe du réacteur MAHC. L’interaction des composés organiques et inorganiques solubilisés avec la matrice modifiée de cellules de bois ajoute à la complexité du système de réaction20. Les voies de réaction de polymérisation de furane emploient la condensation d’aldol ou/et la déshydratation intermoléculaire18,20 et produisent des particules d’hydrochar avec une coquille hydrophobe et un noyau plus hydrophile28. Il n’est pas encore révélé si les particules de biomasse sont complètement décomposées puis repolymérisées ou si les particules de biomasse servent de modèle pour la carbonisation. Cependant, les réactions de dégradation et de repolymérisation comprennent des réactions de déshydratation et de décarboxylation, ainsi que29,30, ce qui induit la chute dans le diagramme de Van Krevelen vers les rapports O/c et H/c du carbone noir.
Alors que d’autres études ont prouvé l’effet de réduction minérale du traitement hydrothermale conventionnel à base de réacteur31, d’un lavage à l’eau avec lessivage mécanique combiné32 ou eau/acétate d’ammonium/lavage d’acide chlorhydrique33, notre les études étudient la lixiviation minérale lors de la carbonisation à basse température avec des micro-ondes pour la première fois. Comme cette étude se concentre sur la lixiviation des précurseurs d’émissions pour la modernisation du combustible, elle étudie le sort du potassium, du sodium, du magnésium, du calcium, du chlore, du soufre, de l’azote et des métaux lourds. Les précurseurs de poussières fines forment des sels volatils (p. ex. KCl ou K2so4) à des températures élevées dans la phase gazeuse. Lorsque ces sels s’accumulent dans les gaz de combustion, les métaux lourds comme le zinc peuvent les récupérer sous forme de particules de nucléation, ce qui conduit à une réaction de la chaîne de croissance des particules. À des températures de combustion inférieures, la condensation du sel déclenche la croissance des particules et entraîne une émission de poussières fines cancerogènes de la cheminée. Ces émissions sont actuellement le principal facteur qui compromet la viabilité des combustibles de la biomasse. Un approvisionnement énergétique durable repose sur leur réduction par des filtres coûteux ou leur réduction des carburants (par exemple, par MAHC). Comme cette étude suit une approche pratique, le bois de saule à courte rotation (SRC) a été choisi comme matière première potentielle de bioénergie avec des taux de croissance élevés. Il peut être cultivé par les agriculteurs sur leurs champs pour une alimentation auto-durable par gazéification, mais aussi pour la production de chaleur par combustion directe. Un inconvénient du saule SRC est sa teneur élevée en écorce en raison d’un ratio faible tige: écorce au stade mûr. L’écorce contient beaucoup de minéraux par rapport au bois34,35,36,37 et donne des quantités plus élevées d’émissions de gaz ou de particules38. La basse température HTC peut améliorer les propriétés de combustion du bois de saule SRC et, par conséquent, contribuer à une alimentation durable de la chaleur et de l’énergie. Un autre paramètre important de la TORSPYD HTC étudiée dans cette étude est sa densité d’énergie, sa température de combustion initiale plus élevée et sa température de combustion finale plus élevée39.
Protocole
1. préparation du matériau de l’échantillon
- Récolter le saule de cinq ans, type clone "tordes" ([Salix schwerinii x s. viminalis] x s. vim.), avec une hauteur de 12 − 14 m et un diamètre de poitrine d’environ 15 cm.
- Écailler le bois et sécher les copeaux dans un séchoir à four pendant 24 h à 105 ° c.
- Coupez les copeaux de bois avec un moulin de coupe et moulez avec un moulin centrifuge à une taille de particule de 0,12 mm.
2. carbonisation hydrothermale assistée par micro-ondes
- Utiliser un four à micro-ondes avec 850 W et une fréquence magnétron de 2 455 MHz.
- Placer 500 mg de matière première à partir de l’étape 1,3 dans un récipient de réaction de polytétrafluoroéthylène (PTFE) de 50 mL avec une spatule. Ajouter 10 mL d’eau déminéralisée. Visser le bouchon du récipient de réaction de sorte que la soupape de pression dans le capuchon soit au même niveau que le bord du capuchon.
- Pour chaque température de traitement, mettre douze vaisseaux de réaction avec des matières premières dans le four à micro-ondes et fermer le four.
- Mettre en place trois programmes de température, avec le micro-ondes pour les trois températures: 150 ° c (rampe + 12,5 ° c min-1, maintenir 60 min, puissance de crête 50%), 170 ° c (rampe + 9,6 ° c min-1, Hold 60 min, puissance de crête 80%) et 185 ° c (rampe + 5,3 ° c min-1 , maintenez 30 min, rampe-1,1 ° c min-1 à 150 ° c, puissance de crête 100%). Démarrez le four à micro-ondes, pour chaque programme unique.
- Une fois le programme terminé, retirez les vaisseaux de réaction, laissez-les refroidir et réactiver. Puis ouvrez-les sous une hotte après avoir relâché la pression à l’intérieur.
- Ajouter 35 mL d’eau distillée deux fois à chaque récipient de réaction. Verser la solution dans chaque récipient à un cylindre de centrifugeuse et centrifuger à 1 714 x g pendant 10 min.
- L’eau de process est drainée dans un autre tube et stockée à-5 ° c pour l’analyse du pH et de la chromatographie en phase gazeuse-spectrométrie de masse (GC-MS).
- Congeler le cylindre de centrifugation avec le résidu de biocharbon restant à-5 ° c. Ensuite, sortez le granule de biocharbon et séchez-le à 105 ° c pendant 24 h. peser le granule de biocharbon et calculer la perte de poids induite par le traitement par le MAHC.
- Répéter les étapes 2.2 − 2.8 quatre fois par température (48 vaisseaux de réaction par température) pour produire suffisamment de biocharbon (environ 22 g) pour l’analyse subséquente.
3. détermination de la teneur en cendres
- Peser 20 plats en céramique vides individuellement. Ajouter dans chaque 1 g d’échantillon (5 x 1 g de matière première et 5 x 1 g de biocharbon à chaque traitement de température).
Remarque: parce que les plats ne peuvent pas être étiquetés, un plan doit être dessiné pour la disposition des récipients dans le four. - Placez les plats en céramique ouverts dans un four à moufle et fermez le four.
- Programmer un programme de température pour le four à moufle (+ 6 ° c min-1 de 25 ° c à 250 ° c, tenir 60 min, + 10 ° c min-1 à 550 ° c, tenir 120 min) et démarrer le programme.
- Une fois le programme terminé, laisser refroidir le four à moufle à 105 ° c. Ensuite, ouvrez le four et sortez les plats en céramique.
- Placer les plats en céramique dans un extracteur (table des matières) rempli d’un agent de séchage composé de gel de silice. Fermez le dessiccateur et séchez-le à l’aide d’une pompe à vide.
- Sortez les plats en céramique après 24 h de refroidissement. Peser le plat en céramique contenant les cendres et calculer le poids en cendres en soustrayant le poids du plat en céramique vide.
- Déterminer la teneur en cendres en pourcentage en divisant le poids en cendres par la masse sèche de la matière première ou du biocharbon.
4. détermination des valeurs de chauffage supérieures et inférieures
- Activer la pompe à eau du calorimètre et ouvrir la soupape à oxygène pour alimenter le calorimètre à 99,5% d’oxygène.
- Peser 1 g de glucose et le placer dans un sac d’échantillon en plastique avec une valeur calorifique définie de 46 479 J/g. Placer le sac de prélèvement dans le creuset de combustion d’une bombe calorimétrique.
- Ajouter 5 mL d’eau désionisée deux fois dans le fond de la bombe et visser la bombe. Mettez la bombe dans le calorimètre et fermez le calorimètre.
- Entrez le poids de l’échantillon et changez les paramètres pour échantillonner la méthode du sac. Démarrez le calorimètre.
- Une fois la mesure terminée, sortez la bombe, tournez-la à l’envers et secouez-la lentement pendant 1 min.
- Dévissez la bombe, enlevez 5 mL d’eau déminéralisée deux fois et rangez-la dans un récipient à bouchon à vis pour l’analyse subséquente de la chromatographie ionique.
- Répétez les étapes 4.2 − 4.6 trois fois pour obtenir la norme d’étalonnage.
- Répétez les étapes 4.2 − 4.6 cinq fois avec chaque TORSPYD mahc (150 ° c, 170 ° c, 185 ° c) et la matière première.
- Calculez la valeur de chauffage inférieure à l’aide de l’équation40suivante:
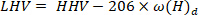
où LHV est la valeur de chauffage inférieure, HHV est la valeur de chauffage plus élevée obtenue à partir du calorimètre à l’étape 4,4, et ω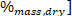 est la teneur en hydrogène [obtenue à partir de l’analyse élémentaire.
est la teneur en hydrogène [obtenue à partir de l’analyse élémentaire.
5. chromatographie ionique pour la quantification du chlore
Remarque: vérifier l’étalonnage du chromatographe ionique avant l’analyse.
- Retirer les 5 mL de solution de l’étape 4,8 et ajouter 45 mL d’eau déminéralisée deux fois dans un masque volumétrique de 50 mL.
- Insérer le tube d’aspiration de l’échantillon dans un récipient d’échantillon et prélever environ 3 mL de l’échantillon avec une seringue dans la pré-colonne. Lancez l’analyse.
- Effectuer les mesures selon les instructions du fabricant.
- Répétez les étapes 5,2 et 5,3 pour chaque échantillon préparé à la section 4.
6. analyse élémentaire pour la détermination des ratios O/C et H/C
- Sélectionnez une méthode appropriée dans le manuel de l’appareil pour les échantillons à mesurer.
- Faites toutes les 20 normes de sulfonamide de mg et les ébauches nécessaires pour calibrer l’appareil.
- Pour préparer un échantillon de matériau, placer 20 mg d’échantillon dans une feuille d’étain sur la micro-balance. Peser l’échantillon sur la feuille d’étain, fermer la feuille autour de l’échantillon et presser l’emballage pour contenir le moins d’air possible. Répétez ensuite ce 5x pour chaque échantillon.
NOTE: afin de pouvoir analyser les échantillons de biochar, la même quantité de trioxyde de tungstène que la quantité de l’échantillon doit être ajoutée dans un rapport de 1:1. Ceci est nécessaire pour compenser l’oxygène manquant dans le biochar pour assurer une combustion complète dans l’analyseur élémentaire. - Insérez les échantillons préparés dans l’échantillonneur automatique de l’analyseur élémentaire.
- Ouvrir la valve d’oxygène et d’hélium pour la chambre de combustion de l’analyseur élémentaire.
- Démarrez l’analyse lorsque l’appareil a atteint la température spécifiée par l’appareil. Dans ce cas, attendre jusqu’à ce que la température atteigne 900 ° c.
- Calculez les taupes de chaque élément dans la norme de sulfonamide par le poids standard de sulfonamide (étape 6,2), et le poids de 1 mole de l’élément respectif.
- Calculer la relation entre les taupes de C, H, S et N dans le sulfonamide, obtenue à partir de l’étape 6,7, et les zones de crête respectives.
- Soustraire la teneur en cendres de l’échantillon, obtenue à partir de l’étape 3,7, du poids total de l’échantillon.
- Comparez la zone de crête de l’élément respectif dans la norme de sulfonamide et l’échantillon, et multipliez par la mole de chaque élément dans le sulfonamide pour obtenir la mole de l’élément dans l’échantillon.
- Calculez le poids de C, H, S et N dans l’échantillon en multipliant la mole de l’élément, obtenue à partir de l’étape 6,10, avec la masse molaire respective de l’élément à partir du tableau périodique.
- Calculer le poids de l’oxygène dans l’échantillon en utilisant la masse de l’échantillon sans cendres, obtenue à partir de l’étape 6,9, et en soustrayant le poids de C, H, N et S, obtenu à partir de l’étape 6,11.
- Calculer les ratios H/C et O/C molaires dans la matière première et les échantillons de biocharbon MAHC.
7. spectroscopie d’émission optique plasmatique couplée induite
- Peser 400 mg de matière première séchée ou de biocharbon MAHC et la mettre dans un récipient de réaction PTFE de 50 mL avec une spatule. Ajouter 3 mL d’acide nitrique à 69% et 9 mL d’acide chlorhydrique à 35%.
- Visser le bouchon du récipient de réaction de sorte que la soupape de pression dans le capuchon soit au même niveau que le bord du capuchon.
- Mettez les récipients de réaction des échantillons à analyser dans le four à micro-ondes et fermez le four.
- Programmer le programme de température pour la dégradation complète de la matière organique: rampe + 15,5 ° c min-1 à 200 ° c, tenir 30 min, refroidir à 180 ° c, maintenir pendant 5 min. Démarrez le four à micro-ondes.
- Une fois le programme terminé, retirez les vaisseaux de réaction, laissez-les refroidir et réactiver. Ensuite, ouvrez les récipients sous une hotte après avoir relâché la pression à l’intérieur.
- Verser les échantillons dans un cylindre d’ampoule de 50 mL. Rincez ensuite soigneusement le récipient de réaction avec de l’eau désionisée deux fois et transférez-le au cylindre de l’ampoule. Faire monter le cylindre à la marque de 50 mL avec de l’eau désionisée deux fois pour assurer une dilution uniforme de tous les échantillons.
- Filtrer l’échantillon à partir de l’étape 7,6 avec du papier filtre à mailles de 150 μm. Remplir le filtrat dans des tubes à centrifuger coniques de 50 mL.
- Placez les échantillons standard dans l’autoinjecteur du ICP-OES. Les échantillons standard sont des concentrations connues (0,0001 ppm, 0,001 ppm, 0,1 ppm, 1 ppm 10 ppm, 20 ppm, 50 ppm) des éléments à quantifier (ca, As, B, be, Fe, se, Zn, AG, al, BA, bi, CD, Co, CR, Cu, GA, K, Li , Mg, MN, Mo, Na, ni, Pb, RB, SR, te, TL, V).
- Placez les échantillons dans l’autoinjecteur du ICP-OES et exécutez l’analyse ICP-OES avec les mêmes paramètres.
- Après l’analyse ICP-OES, obtenir la concentration élémentaire du logiciel, calculée automatiquement en mg/kg, en fonction des courbes d’étalonnage obtenues à partir d’échantillons standard à l’étape 7,8.
- Calculez la réduction de la concentration élémentaire dans le biocharbon produit:
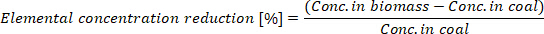
où conc. dans la biomasse est la concentration élémentaire dans la biomasse et conc. Dans le charbon est la concentration élémentaire dans le BioCoal.
8. mesure du pH de l’eau de process HTC
- Remplissez chaque fraction de liquide du traitement MAHC (étape 2,7) de la matière première et des trois biocoals dans quatre béchers respectifs.
- Calibrer la sonde de pH avec des solutions standard.
- Mesurez le pH de la fraction liquide de la matière première et des trois biocoals MAHC.
9. chromatographie en phase gazeuse-spectrométrie de masse
- Filtrer les fractions liquides du traitement MAHC (étape 2,7) avec du papier filtre à mailles de 150 μm. Ajouter 20 mL de méthanol à 1 mL des fractions liquides filtrées.
- Transférer 200 μL dans un flacon d’échantillonneur automatique GC-MS et mettre le flacon dans l’échantillonneur automatique GC-MS.
- Diluer les étalons purs de furfural et de 5-méthylfurfural (qualité analytique) jusqu’à 10-2, 10-3, 10-4et 10-5 avec du méthanol.
- Mettre les normes dans l’échantillonneur automatique GC-MS et les analyser avec les paramètres: 1 μL de volume d’injection à 230 ° c température de l’injecteur et 1:40 Split; 5MS colonne non polaire (table des matières) avec 15 m de longueur et 0,25 mm d’épaisseur de film; programme de température 30 ° c, tenir 2 min, rampe de + 40 ° c/min à 250 ° c, tenir 2 min; ionisation avec 70 mV et le détecteur MS en mode balayage avec une plage m/z de 35 − 400, chaque balayage en 0,3 s.
- Établissez des courbes d’étalonnage par la zone de crête du nombre total d’ions (TIC) et la concentration composée.
- Exécutez les échantillons préparés de phase liquide de TORSPYD HTC avec les mêmes paramètres analytiques et identifiez le furfural et le 5-méthylfurfural au moyen du temps de rétention de la norme et de la correspondance de spectre dans une bibliothèque de spectres.
- Déterminer les concentrations de furfural et de 5-méthylfurfural en utilisant la courbe d’étalonnage calculée (étape 9,6) et en insérant les zones de crête de l’échantillon du furfural et du 5-méthylfurfural.
10. les statistiques
- Analysez les données avec le test Shapiro Wilks pour une distribution normale.
- Utilisez le test U Mann-Whitney pour les ensembles de données non distribués normalement et le test t pour les ensembles de données normalement distribués afin de trouver des différences significatives entre les ensembles de données.
Remarque: si un jeu de données est normalement distribué et que l’autre ne l’est pas, utilisez le test Mann-Whitney U.
Résultats
Les résultats de l’analyse élémentaire ont révélé des différences entre le rapport O/C-H/C du bois de saule et les biocoals du MAHC (figure 1). La matière première montre des ratios O/C-H/C plus élevés et une variation plus élevée des valeurs. Le traitement par MAHC a réduit la variation de valeur due à l’homogénéisation dans le réacteur à micro-ondes. La précision du réacteur à micro-ondes a permis la différenciation de trois stade...
Discussion
Le MAHC permet la différenciation des étapes de la dégradation chimique en appliquant différentes intensités de traitement thermique. Par conséquent, il est possible d’évaluer les interactions entre la perte de masse, le rapport O/C-H/C, la valeur de chauffage, la réduction des composants de cendres, l’augmentation du pH de l’eau de procédé et l’accumulation de furannes dans l’eau du procédé. L’avantage de la méthode mahc par rapport à la méthode conventionnelle du réacteur HTC est basé sur l...
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Les auteurs aiment remercier Christoph Warth, Michael Russ, Carola Lepski, Julian Tejada et le Dr Rainer Kirchhof pour leur soutien technique. L’étude a été financée par le BMBF (projet BiCoLim-bio-combustibles limpios) sous le numéro de subvention 01DN16036.
matériels
| Name | Company | Catalog Number | Comments |
| 5MS non-polar cloumn | Thermo Fisher Scientific,Waltham, USA | TraceGOLD SQC | GCMS |
| 9µm polyvinylalcohol particle column | Methrom AG, Filderstadt, Germany | Metrosep A Supp 4 -250/4.0 | Ion chromatography |
| argon | Westfalen AG, Münster, Germany | UN 1006 | ICP-OES |
| calorimeter | IKA-Werke GmbH & Co.KG, Stauffen, Germany | C6000 | higher and lower heating value |
| centrifuge | Andreas Hettich GmbH & Co.KG, Germany | Rotofix 32 A | |
| centrifuge mill | Retsch Technology GmbH, Haan, Germany | ZM 200 | |
| ceramic dishes | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | XX83.1 | Ash content |
| cutting mill | Fritsch GmbH, Markt Einersheim, Germany | pulverisette 19 | |
| D(+) Glucose | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | X997.1 | higher and lower heating value |
| elemental analyzer | elementar Analysesysteme GmbH, Langenselbold, Germany | varioMACRO cube | elemental analysis |
| exicator | DWK Life Sciences GmbH, Wertheim, Germany | DURAN DN300 | Ash content |
| GC-MS system | Thermo Fisher Scientific,Waltham, USA | Trace 1300 | GCMS |
| hydrochloric acid | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | HN53.3 | ICP-OES |
| ICP OES | Spectro Analytical Instruments GmbH, Kleve, Germany | Spectro Blue-EOP- TI | ICP-OES |
| Ion chromatograph | Methrom GmbH&Co.KG, Filderstadt, Germany | 833 Basic IC plus | Ion chromatography |
| kiln dryer | Schellinger KG, Weingarten, Germany | ||
| kiln dryer | Schellinger KG, Weingarten, Germany | Ash content | |
| mesh filter paper | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | L874.1 | ICP-OES |
| microwave oven | Anton Paar GmbH, Graz, Austria | Multiwave Go | |
| muffel furnance | Carbolite Gero GmbH &Co.KG, Neuhausen, Germany | AAF 1100 | Ash content |
| nitric acid | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | 4989.1 | ICP-OES |
| oxygen | Westfalen AG, Münster, Germany | UN 1072 | higher and lower heating value |
| pH-meter | ylem Analytics Germany Sales GmbH & Co. KG, Weilheim,Germany | pH 3310 | pH |
| sample bag | IKA-Werke GmbH & Co.KG, Stauffen, Germany | C12a | higher and lower heating value |
| Standard Laboratory Vessels and Instruments | |||
| standard samples | Bernd Kraft GmbH, Duisburg, Germany | ICP-OES | |
| sulfonamite | elementar Analysesysteme GmbH, Langenselbold, Germany | SLBS4782 | elemental analysis |
| teflon reaction vessels | Anton Paar, Austria | HVT50 | |
| teflon reaction vessels | Anton Paar, Austria | HVT50 | ICP-OES |
| tin foil | elementar Analysesysteme GmbH, Langenselbold, Germany | S12.01-0032 | elemental analysis |
| tungstenVIoxide | elementar Analysesysteme GmbH, Langenselbold, Germany | 11.02-0024 | elemental analysis |
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | ||
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | higher and lower heating value | |
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | ICP-OES |
Références
- Li, C., Zhao, Z. K., Cai, H., Wang, A., Zhang, T. Microwave-promoted conversion of concentrated fructose into 5-hydroxymethylfurfural in ionic liquids in the absence of catalysts. Biomass and Bioenergy. 35 (5), 2013-2017 (2011).
- Möller, M., Harnisch, F., Schröder, U. Microwave-assisted hydrothermal degradation of fructose and glucose in subcritical water. Biomass and Bioenergy. 39, 389-398 (2012).
- Guiotoku, M., Rambo, C. R., Hansel, F. A., Magalhães, W. L. E., Hotza, D. Microwave-assisted hydrothermal carbonization of lignocellulosic materials. Materials Letters. 63 (30), 2707-2709 (2009).
- Guiotoku, M., Rambo, C. R., hansel, F. A., Magalhães, W. L. E., Hotza, D. Microwave-assisted hydrothermal carbonization of lignocellulosic materials. Materials Letters. (63), 2707-2709 (2009).
- Kannan, S., Gariepy, Y., Raghavan, G. S. V. Optimization and characterization of hydrochar produced from microwave hydrothermal cabonization of fish waste. Waste Management. , 159-168 (2017).
- Elaigwu, S. E., Greenway, G. M. Microwave-assisted and conventional hydrothermal carbonization of lignocellulosic waste material: Comparison of the chemical and structural properties of the hydrochars. Journal of Analytical and Applied Pyrolysis. 118, 1-8 (2016).
- Elaigwu, S. E., Greenway, G. M. Microwave-assisted hydrothermal carbonization of rapeseed husk: A strategy for improving its solid fuel properties. Fuel Processing Technology. 149, 305-312 (2016).
- Chen, W. -. H., Ye, S. -. C., Sheen, H. -. K. Hydrothermal carbonization of sugarcane bagasse via wet torrefaction in association with microwave heating. Bioresource technology. 118, 195-203 (2012).
- Nizamuddin, S., et al. Upgradation of chemical, fuel, thermal, and structural properties of rice husk through microwave-assisted hydrothermal carbonization. Environmental science and pollution research international. 25 (18), 17529-17539 (2018).
- Nizamuddin, S., et al. An overview of microwave hydrothermal carbonization and microwave pyrolysis of biomass. Reviews in Environmental Science and Bio/Technology. 17 (4), 813-837 (2018).
- Dallinger, D., Kappe, C. O. Microwave-assisted synthesis in water as solvent. Chemical reviews. 107 (6), 2563-2591 (2007).
- Qi, X., Watanabe, M., Aida, T. M., Smith, J. R. L. Catalytic dehydration of fructose into 5-hydroxymethylfurfural by ion-exchange resin in mixed-aqueous system by microwave heating. Green Chemistry. 10 (7), 799 (2008).
- Nüchter, M., Ondruschka, B., Bonrath, W., Gum, A. Microwave assisted synthesis - a critical technology overview. Green Chem. 6 (3), 128-141 (2004).
- Schanche, J. -. S. Microwave synthesis solutions from personal chemistry. Molecular Diversity. 7 (2-4), 291-298 (2003).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angewandte Chemie (International ed. in English). 43 (46), 6250-6284 (2004).
- Gronnow, M. J., White, R. J., Clark, J. H., Macquarrie, D. J. Energy Efficiency in Chemical Reactions: A Comparative Study of Different Reaction Techniques. Organic Process Research & Development. 9 (4), 516-518 (2005).
- Kruse, A., Dahmen, N. Hydrothermal biomass conversion: Quo vadis?. The Journal of Supercritical Fluids. 134, 114-123 (2018).
- Reza, M. T., et al. Hydrothermal Carbonization of Biomass for Energy and Crop Production. Applied Bioenergy. 1 (1), (2014).
- Libra, J. A., et al. Hydrothermal carbonization of biomass residuals: a comparative review of the chemistry, processes and applications of wet and dry pyrolysis. Biofuels. 2 (1), 71-106 (2011).
- Reza, M. T., Uddin, M. H., Lynam, J. G., Hoekman, S. K., Coronella, C. J. Hydrothermal carbonization of loblolly pine: reaction chemistry and water balance. Biomass Conversion and Biorefinery. 4 (4), 311-321 (2014).
- Funke, A., Ziegler, F. Hydrothermal carbonization of biomass: A summary and discussion of chemical mechanisms for process engineering. Biofuels, Bioproducts and Biorefining. 4 (2), 160-177 (2010).
- Kruse, A., Funke, A., Titirici, M. -. M. Hydrothermal conversion of biomass to fuels and energetic materials. Current opinion in chemical biology. 17 (3), 515-521 (2013).
- Reza, M. T., Lynam, J. G., Uddin, M. H., Coronella, C. J. Hydrothermal carbonization: Fate of inorganics. Biomass and Bioenergy. 49, 86-94 (2013).
- Zhang, D., et al. Comparison study on fuel properties of hydrochars produced from corn stalk and corn stalk digestate. Energy. 165, 527-536 (2018).
- Huang, Y. -. B., Yang, Z., Dai, J. -. J., Guo, Q. -. X., Fu, Y. Production of high quality fuels from lignocellulose-derived chemicals: a convenient C-C bond formation of furfural, 5-methylfurfural and aromatic aldehyde. RSC Advances. 2 (30), 11211 (2012).
- Van de Vyver, S., Geboers, J., Jacobs, P. A., Sels, B. F. Recent Advances in the Catalytic Conversion of Cellulose. ChemCatChem. 3 (1), 82-94 (2011).
- Delidovich, I., Leonhard, K., Palkovits, R. Cellulose and hemicellulose valorisation: an integrated challenge of catalysis and reaction engineering. Energy & Environmental Science. 7 (9), 2803 (2014).
- Sevilla, M., Fuertes, A. B. The production of carbon materials by hydrothermal carbonization of cellulose. Carbon. 47 (9), 2281-2289 (2009).
- Yao, Z., Ma, X. Characteristics of co-hydrothermal carbonization on polyvinyl chloride wastes with bamboo. Bioresource technology. 247, 302-309 (2018).
- Funke, A., Ziegler, F. Hydrothermal carbonization of biomass: A summary and discussion of chemical mechanisms for process engineering. Biofuels, Bioproducts and Biorefining. (4), 160-177 (2010).
- Liu, Z., Balasubramanian, R. Upgrading of waste biomass by hydrothermal carbonization (HTC) and low temperature pyrolysis (LTP): A comparative evaluation. Applied Energy. 114, 857-864 (2014).
- Khalsa, J., Döhling, F., Berger, F. Foliage and Grass as Fuel Pellets-Small Scale Combustion of Washed and Mechanically Leached Biomass. Energies. 9 (5), 361 (2016).
- Saddawi, A., Jones, J. M., Williams, A., Le Coeur, C. Commodity Fuels from Biomass through Pretreatment and Torrefaction: Effects of Mineral Content on Torrefied Fuel Characteristics and Quality. Energy & Fuels. 26 (11), 6466-6474 (2012).
- Kaltschmitt, M., Hartmann, H., Hofbauer, H. . Energie aus Biomasse: Grundlagen, Techniken und Verfahren. , (2016).
- Fengel, D., Wegener, G. . Wood: Chemistry, Ultrastructure, Reactions. , (1989).
- Obernberger, I., Thek, G. Physical characterisation and chemical composition of densified biomass fuels with regard to their combustion behaviour. Biomass and Bioenergy. 27 (6), 653-669 (2004).
- Kenney, W. A., Sennerby-Forsse, L., Layton, P. A review of biomass quality research relevant to the use of poplar and willow for energy conversion. Biomass. 21 (3), 163-188 (1990).
- Tharakan, P. J., Volk, T. A., Abrahamson, L. P., White, E. H. Energy feedstock characteristics of willow and hybrid poplar clones at harvest age. Biomass and Bioenergy. 25 (6), 571-580 (2003).
- Liu, Z., Quek, A., Balasubramanian, R. Preparation and characterization of fuel pellets from woody biomass, agro-residues and their corresponding hydrochars. Applied Energy. , 1315-1322 (2014).
- Technischen Komitee ISO/TC 238. . "Solid biofuels" und Technisches Komitee CEN/TC 335 "Biogene Festbrennstoffe" Solid biofuels - Determination of calorific value (ISO 18125:2017); German version EN ISO 18125:2017. , (2017).
- Kambo, H. S., Dutta, A. A comparative review of biochar and hydrochar in terms of production, physico-chemical properties and applications. Renewable and Sustainable Energy Reviews. 45, 359-378 (2015).
- Knappe, V., et al. Low temperature microwave assisted hydrothermal carbonization (MAHC) reduces combustion emission precursors in short rotation coppice willow wood. Journal of Analytical and Applied Pyrolysis. 134, 162-166 (2018).
- Liu, Z., Quek, A., Kent Hoekman, S., Balasubramanian, R. Production of solid biochar fuel from waste biomass by hydrothermal carbonization. Fuel. 103, 943-949 (2013).
- Hoekman, S. K., Broch, A., Robbins, C., Zielinska, B., Felix, L. Hydrothermal carbonization (HTC) of selected woody and herbaceous biomass feedstocks. Biomass Conversion and Biorefinery. 3 (2), 113-126 (2013).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon