Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Снижение ивы древесины топлива выбросов низкой температурой Микроволновая помощь гидротермических карбонизации
В этой статье
Резюме
Представлен протокол об истощении прекурсоров выбросов из низкокачественной биомассы при низких температурах микроволновых гидротермических карбонизации лечения. Этот протокол включает микроволновые параметры и анализ биоугольной продукции и перерабатывающей воды.
Аннотация
Биомасса является устойчивым топливом, так как его CO2 выбросы реинтегрированы в рост биомассы. Однако неорганические прекурсоры биомассы вызывают негативное воздействие на окружающую среду и образование шлаков. Выбранный короткий ротационной Перелесок иное прикрытие (КГД) ивы древесины имеет высокое содержание золы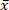 (= 1,96%) и, следовательно, высокое содержание выбросов и шлаковых прекурсоров. Поэтому, сокращение минералов из КЦГ ивы с низким температурным микроволновым гидротермических карбонизации (МАХК) на 150 ° c, 170 ° c, и 185 ° c исследован. Преимуществом МАХК по сравнению с обычными реакторами является даже температурная проводимость в реакционной среде, так как микроволновые печи проникают в весь объем реактора. Это позволяет лучше контролировать температуру и быстрее, охлаждая. Поэтому последовательность реакций демеризации, трансформации и реполимеризации можно эффективно анализировать. В этом исследовании анализ потерь массы, зольности и состава, значений теплоснабжения и молярных показателей O/C и H/C обработанных и необработанных ИВК ивы показал, что минеральное содержание угля МАХС было уменьшено, а значение нагрева увеличилось. Процесс воды показали снижение рН и содержащиеся furfural и 5-метилфурфураль. Температура процесса 170 ° c показала наилучшее сочетание энергетического ввода и уменьшения компонентов золы. МАХК позволяет лучше понять процесс гидротермических карбонизации, в то время как крупномасштабное промышленное применение маловероятно из-за высоких инвестиционных издержек.
(= 1,96%) и, следовательно, высокое содержание выбросов и шлаковых прекурсоров. Поэтому, сокращение минералов из КЦГ ивы с низким температурным микроволновым гидротермических карбонизации (МАХК) на 150 ° c, 170 ° c, и 185 ° c исследован. Преимуществом МАХК по сравнению с обычными реакторами является даже температурная проводимость в реакционной среде, так как микроволновые печи проникают в весь объем реактора. Это позволяет лучше контролировать температуру и быстрее, охлаждая. Поэтому последовательность реакций демеризации, трансформации и реполимеризации можно эффективно анализировать. В этом исследовании анализ потерь массы, зольности и состава, значений теплоснабжения и молярных показателей O/C и H/C обработанных и необработанных ИВК ивы показал, что минеральное содержание угля МАХС было уменьшено, а значение нагрева увеличилось. Процесс воды показали снижение рН и содержащиеся furfural и 5-метилфурфураль. Температура процесса 170 ° c показала наилучшее сочетание энергетического ввода и уменьшения компонентов золы. МАХК позволяет лучше понять процесс гидротермических карбонизации, в то время как крупномасштабное промышленное применение маловероятно из-за высоких инвестиционных издержек.
Введение
Применение микроволн для гидротермической карбонизации (махк) было использовано для термохимической трансформации моделей биомассы соединений, таких как фруктоза, глюкоза1,2 или целлюлоза3, и для органических субстратов, предпочтительно отходы4,5,6,7,8,9,10. Использование микроволновых печей выгодно, поскольку это позволяет даже нагревание обработан биомассы2,10 главным образом через термические потери диэлектрического растворителя11,12, хотя микроволны делают не передавать достаточно энергии, чтобы непосредственно разорвать химические связи и вызвать реакцию13. Микроволновые печи проникают весь объем реакции в реакторе HTC реактора и передачи энергии непосредственно к материалу, который не представляется возможным с обычным реактором, который показывает замедление скорости нагрева из-за высокой емкости отопления стальной мантии и Образец себя14. Даже возбуждение молекул воды образца микроволнами позволяет улучшить управление процессом, так как температура в микроволновом реакторе равномерно распределяется11,14,15 и после реакция гораздо быстрее. Кроме того, обычные реакторы нагревают гораздо медленнее, а химические реакции, возникающие во время нагрева, могут быть связаны с результатами, которые обычно назначаются для окончательной температуры. Улучшенный контроль процессов в реакторе МАХК позволяет точно определить температурные зависимости от выбранных реакций HTC (например, обезвоживание или декарбоксиляция). Еще одно преимущество даже распределения температур в томе HTC-реактор нижней адгезии иммобилизованным и полностью карбонизированных частиц на внутренней стене реактора2. Тем не менее, вода является лишь средним микроволнового растворителя, который даже показывает снижение микроволновой поглощения при более высоких температурах, что ограничивает достижимую максимальную температуру. Этот отрицательный эффект компенсируется, когда кислоты производятся в процессе HTC или катализаторов (ионных или полярных видов) добавляются до начала лечения. Микроволновые индуцированные реакции показывают более высокие урожаи продукта в целом11,15 и, в частности, 5-гидроцитметилфурфураль (5-ХМФ) из фруктозы по сравнению с реакциями катализированной песка12. Они также имеют гораздо лучше энергетический баланс, то обычные методы отопления15,16.
Фундаментальной химической концепцией гидротермических карбонизации является деградация и последующая полимеризация биомассы. В ходе этих сложных взаимодействующих реакций ткань истощается кислородом, что увеличивает тепловую ценность. Во-первых, полимеры гемикелюлоза и целлюлоза гидролизирована до сахара мономеров17, хотя низкие температуры в основном влияют на гемикелутерять18,19,20,21. В этой ранней стадии реакций HTC, органические кислоты образуются от преобразования сахара альдегиды и деацетилляции гемичелюпотерять. Эти кислоты могут быть ацетитическими, молочно-леулиновыми, акриловыми или форменными кислотами20,21,22 и снижают рН реакционной воды в реакторе. Из-за диссоциации они образуют свободные отрицательные ионы, которые увеличивают ионный продукт в процессе воды. Увеличивая Ион продукт позволяет разрешать катионов, которые будут главными компонентами золы в биомассе. По этому механизму ткани истощаются из прекурсоров и шлаков излучения (например, калия, натрия, кальция, хлора и тяжелых металлов)23,24.
Сформированные органические кислоты могут поддержать обезвоживание мономеров сахара для furans. Общий продукт обезвоживания сахара является furfural и 5-гидрокеметилfurfural, которые являются осуществимыми продуктами для химической промышленности, так как они служат в качестве платформы продуктов (например, для синтеза биоолиммеров). 5-метилфурфурал может формироваться путем катализируемой реакции из целлюлозы25,26 или 5-гидроцитметилфурфураль27. В то время как Биополимерный синтез является искусственной ремерцимеризации в контролируемых условиях, фураны могут также конденсироваться, полимеризировать и формировать высокие молекулярно-весовые ароматические структуры в комплексной химической среде реактора МАХК. Взаимодействие растворимой органической и неорганической соединений с модифицированной матрицей древесных клеток добавляет сложности системе реакции20. Пути реакции полимеризации фуран используют алдол конденсации или/и Межмолекулярное обезвоживание18,20 и урожайность гидрочар частиц с гидрофобной оболочкой и более гидрофильного ядра28. Пока еще не выявлено, полностью ли частицы биомассы разлагаются, а затем реполимеризации или если частицы биомассы служат образцом для карбонизации. Тем не менее, деградации и реполимеризации реакции включают обезвоживание и декарбоксилирования реакций, а также29,30, который индуцирует падение в диаграмме Ван карриен к O/c и H/c коэффициенты черного углерода.
В то время как другие исследования доказали, что минеральное снижение эффекта от традиционного реактора на основе гидротермических лечения31, воды Стиральная с комбинированным механическим выщелачивания32 или воды/Ацетат аммония/соляной кислоты Стиральная33, наши исследования исследуют минеральное выщелачивание при низкой температуре карбонизации с микроволнами в первый раз. Поскольку в этом исследовании основное внимание уделяется выщелачиванию прекурсоров для модернизации топлива, изучается судьба калия, натрия, магния, кальция, хлора, серы, азота и тяжелых металлов. В качестве прекурсоров мелкой пыли образуются летучие соли (например, KCl или K2so4) при повышенных температурах в газовой фазе. Когда эти соли накапливаются в дымовом газе, тяжелые металлы, такие как цинк, могут удалять их как частицы нуклеации, что приводит к цепной реакции роста частиц. При снижении температуры дымовых газов, конденсация соли дополнительно вызывает рост частиц и приводит к образованию канцерогенного мелкого пыли из дымохода. Эти выбросы в настоящее время являются главным фактором, подрывающих устойчивость топлива из биомассы. Устойчивое энергоснабжение опирается на их сокращение за счет дорогостоящих фильтров или их сокращение в топливе (например, по МАХК). Поскольку данное исследование следует практическим подходом, в качестве потенциального биоэнергетического сырья с высокими темпами роста была выбрана ивовое дерево в виде короткого вращения. Это может быть выращен фермерами на своих полях для самостоятельного обеспечения питания путем газификации, но и для тепловой генерации путем прямого сгорания. Недостатком ивы КГД является его высокое содержание коры из-за низкого ствола: кора соотношение на зрелой стадии. Кора содержит много минералов по сравнению с древесиной34,35,36,37 и дает более высокие количества газообразных или частиц выбросов38. Низкая температура HTC может улучшить свойства сгорания ивы древесины КГД и, тем самым, способствовать устойчивому теплу и энергоснабжение. Другим важным параметром биоугля HTC, исследуемых в этом исследовании, является его энергетическая плотность, ее более высокая начальная температура сгорания и более высокая окончательная температура сгорания39.
протокол
1. Подготовка образцов материала
- Урожай пятилетней ивы, клон типа "Tordes" ([Саликс schwerinii x . viminalis] x с. Вим.), с высотой 12 − 14 м и диаметром груди около 15 см.
- Чип древесины и сухой чипов в сушилке для обжига для 24 ч при температуре 105 ° c.
- Вырезать щепки с режущей мельницы и измельчить с центробежной мельницы до размера частиц 0,12 мм.
2. Микроволновая гидротермических карбонизации
- Используйте микроволновую печь с 850 W и магнатрон частота 2 455 МГц.
- Поместите 500 мг сырья из шага 1,3 в a 50 mL политетрафорэтилен (ПТФЕ) реакционной емкости с помощью шпателя. Добавьте 10 мл деминерализованной воды. Завинчиваем вниз крышка сосуда реакции так, что клапан давления в крышке находится на таком же уровне как край крышки.
- Для каждой температуры обработки, положите двенадцать сосудов реакции с сырьем в микроволновой печи и закройте духовку.
- Настройка трех температурных программ с микроволновой печью для трех температур: 150 ° c (пандус + 12,5 ° c,1, удерживайте 60 мин., Пиковая мощность 50%), 170 ° c (пандус + 9,6 ° c с-1, удерживайте 60 мин, Пиковая мощность 80%), and 185 ° c (пандус + 5,3 ° c,1 , удерживайте 30 мин, пандус-1,1 ° c мин-1 до 150 ° c, Пиковая мощность 100%). Запустите микроволновую печь, для каждой отдельной программы.
- После завершения программы удалите реакционную сосуды, дайте им остыть и активировать. После этого откройте их под шкафом дыма после выпускать давление внутрь.
- Добавьте 35 mL дважды дистиллированной воды к каждому сосуду реакции. Налейте раствор в каждом сосуде на центрифужные цилиндры и центрифугу на 1 714 x g в течение 10 мин.
- Процесс воды сливают в другую трубку и хранятся замороженные при-5 ° c для рН и газовой хроматографии-масс-спектрометрии (GC-MS) анализа.
- Заморозьте Центрифугированный цилиндр с оставшимся биоугольным грануляром при температуре-5 °C. Затем возьмите биоугольную Пелле и высушите его при температуре 105 ° c в течение 24 ч. взвешивают биоугольную Пелле и рассчитывают потерю веса, вызванную лечением МАХС.
- Повторные шаги 2.2 − 2.8 четыре раза на температуру (48 реакционной емкости на температуру) для выработки достаточного количества биоугля (приблизительно 22 г) для последующего анализа.
3. Определение содержания золы
- Взвешивание 20 пустых керамических блюд индивидуально. Добавить в каждый 1 г образца (5 х 1 г сырья, и 5 х 1 г биоугля от каждой температуры лечения).
Примечание: поскольку блюда не могут быть помечены, план должен быть составлен для расположения судов в духовке. - Поместите открытые керамические блюда в муфлиновой печи и закройте печь.
- Программа температурной программы для муфтной печи (+ 6 ° c мин-1 от 25 °c до 250 ° с, удержание 60 мин, + 10 °c мин-1 до 550 °c, удержание 120 мин) и запуск программы.
- После завершения программы, пусть муфтной печи остыть до 105 ° c. Затем откройте печь и возьмите керамическую посуду.
- Поместите керамические блюда в экстрактор (таблица материалов), наполненный сушки агента, состоящего из силикагеля. Закройте осушу и вакуумные сухие с помощью вакуумного насоса.
- Примите вне Керамические тарелки после 24 h охлаждать. Взвесить керамическое блюдо, содержащее пепел, и рассчитать вес золы, вычитая вес пустой керамической тарелки.
- Определите содержание золы в процентах путем деления массы пепла на сухую массу сырья или биоугля.
4. определение высших и нижних значений нагрева
- Активируйте водяной насос из каторимметра и откройте кислородный клапан, чтобы поставлять 99,5% кислорода к калоримметру.
- Взвесьте 1 г глюкозы и поместите его в пластиковый мешок образца с определенной теплотворной способностью 46 479 J/g. Положите образец мешок в горнило горения каторимметра бомба.
- Добавить 5 мл дважды деионизированной воды в нижней части бомбы и винт вниз бомбу. Поместите бомбу в каторимметр и закройте калоримметр.
- Введите вес образца и измените параметры к методу образца мешка. Начинайте каторимметр.
- После того, как измерение завершено, возьмите бомбу, поверните ее вверх дном и встряхните медленно в течение 1 мин.
- Открутить бомбу, удалить 5 мл дважды деминерализованной воды и хранить ее в контейнере с винтовой крышкой для последующего анализа ионов хроматографии.
- Повторные шаги 4.2 − 4.6 три раза для получения калибровочного стандарта.
- Повторные шаги 4.2 − 4.6 пять раз с каждым биоуглем МАХК (150 ° c, 170 °C, 185 °C) и сырьем.
- Расчет нижнего значения нагрева с использованием следующего уравнения40:
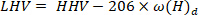
где ЛХВ является более низким значением нагрева, ЭОД является более высокая теплоснабжение, полученное из кальциметра в шаге 4,4, и ом является содержанием водорода [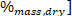 полученный из элементарного анализа.
полученный из элементарного анализа.
5. Ион хроматография для количественной оценки хлора
Примечание: Проверьте калибровку ионного хроматографа перед анализом.
- Примите вне 5 mL разрешения от шага 4,8 и добавьте 45 mL дважды деминерализованной воды в маске 50 mL объемно.
- Вставьте образец всасывающей трубки в образец контейнера и нарисуйте примерно 3 мл образца с помощью шприца в пре-столбце. Запустите анализ.
- Проводить измерения в соответствии с инструкциями производителя.
- Повторите шаги 5,2 и 5,3 для каждого образца, подготовленного в разделе 4.
6. элементарный анализ для определения коэффициентов O/C и H/C
- Выберите соответствующий метод из руководства по приборам для измерения образцов.
- Сделать все 20 мг сульфонамид стандартов и заготовок, необходимых для калибровки устройства.
- Чтобы подготовить образец материала, положите 20 мг образца в фольгу на микробалансе. Взвешивание образца на фольге, закрыть фольгу вокруг образца и нажмите пакет, чтобы содержать как мало воздуха, как это возможно. Затем повторите это 5x для каждого образца.
Примечание: для того, чтобы иметь возможность анализировать биоугля образцов, такое же количество триоксид вольфрама, как количество образца должны быть добавлены в соотношении 1:1. Это необходимо для компенсации отсутствующий кислород в биоугля для обеспечения полного сгорания в элементарный анализатор. - Вставьте подготовленные пробы в аутокамплер элементарного анализатора.
- Откройте кислородный и гелиевый клапан для камеры сгорания элементарного анализатора.
- Начало анализа, когда устройство достигло температуры, указанной устройством. В этом случае, подождите, пока температура достигает 900 ° c.
- Расчет молей каждого элемента в сульфонамид стандарт сульфонамид стандартный вес (шаг 6,2), и вес 1 моль соответствующего элемента.
- Вычислить связь между молей C, H, S, и N в сульфонамид, полученный от шага 6,7, и соответствующие пиковые области.
- Вычитание содержимого зольности образца, полученного из шага 3,7, от общего веса образца.
- Сравните соответствующий элемент пика области в сульфонамид стандарта и образца, и умножить на моль каждого элемента в сульфонамид, чтобы получить моль элемента в образце.
- Вычислите вес C, H, S и N в образце, умножая моль элемента, полученного из шага 6,10, с соответствующей молярной массой элемента из таблицы Менделеева.
- Рассчитать вес кислорода в образце с помощью золы бесплатный образец массы, полученный из шага 6,9, и вычитания веса C, H, N, и S, полученные от шага 6,11.
- Рассчитать молярную H/C и O/C коэффициенты в сырье и МАХС биоугля образцов.
7. индуцированных сочетании плазменных оптических излучения спектроскопии
- Весить 400 мг сухого сырья или МАХК биоугля и поместить его в 50 mL ПТФЕ реакционной сосуда с помощью шпателя. Добавить 3 мл 69% азотной кислоты и 9 мл 35% соляной кислоты.
- Завинчиваем вниз крышка сосуда реакции так, что клапан давления в крышке находится на таком же уровне как край крышки.
- Положите реакционную сосуды образцов для анализа в микроволновую печь и закройте духовку.
- Программа температурной программы для полной деградации органического материала: пандус + 15,5 °C мин-1 до 200 °c, удерживайте 30 мин, охладиться до 180 ° с, удерживайте в течение 5 мин. Запустите микроволновую печь.
- После завершения программы удалите реакционную сосуды, дайте им остыть и активировать. Затем откройте сосуды под вытяжке после высвобождения давления внутрь.
- Налейте образцы в цилиндр 50 мл лампы. Затем тщательно промыть реакционную емкость с дважды обожионизированной водой и перенести ее в цилиндр лампы. Сверху цилиндра к отметке 50 mL с дважды обожионизированной водой, чтобы обеспечить даже разбавление всех образцов.
- Фильтр образца от шага 7,6 с 150 мкм сетки фильтровальной бумаги. Заполните фильтрат в 50 mL конической центрифуги труб.
- Положите стандартные образцы в автоинжектор ПМС-ЕСА. Стандартные образцы известных концентраций (0,0001 стр/мин, 0,001 промилле, 0,1 промилле, 1 стр/мин 10 стр/мин, 20 стр/мин, 50 стр/мин) элементов, подлежащих количественной оценке (CA, AS, B, Be, Fe, SE, Zn, AG, Al, BA, BI, CD, CO, CR, Cu, GA, K , Mg, MN, Mo, Na, Ni, ПБ, РБ, SR, TE, TL, V).
- Положите образцы в автоинжектор ПМС-ЕСА и запустить МСП анализ с теми же параметрами.
- После анализа ПМС-ЕСА, получить элементарную концентрацию от программного обеспечения, автоматически рассчитывается в мг/кг, основанный на калибровочных кривых, полученных из стандартных образцов в шаге 7,8.
- Расчет уменьшения элементарной концентрации в производном биоугле:
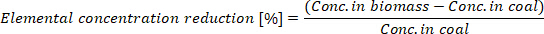
где conc. в биомассе является элементарной концентрации в биомассе и conc. В угле находится элементарная концентрация в биоугле.
8. Измерение рН воды процесса HTC
- Заполните каждую жидкую фракцию от лечения МАХК (шаг 2,7) сырья и трех биоуглей в четырех соответствующих биакрах.
- Калибровка зонда рН стандартными решениями.
- Измерить рН жидкой фракции сырья и трех биоуглей МАХК.
9. газовая хроматография-масс-спектрометрия
- Фильтр жидких фракций от лечения МАХК (шаг 2,7) с 150 мкм сетки фильтровальной бумаги. Добавьте 20 мл метанола в 1 мл отфильтрованных жидких фракций.
- Перенесите 200 мкл на флакон автосамплер GC-MS и положите ампулу в автосамплер GC-MS.
- Разбавляют чистые стандарты furfural и 5-метилфурфурал (аналитический класс) до 10-2, 10-3, 10-4, и 10-5 с метанолом.
- Поставьте стандарты на автосамплер GC-MS и проанализируйте их с параметрами: 1 мкл объем впрыска при температуре 230 °C инжектор и 1:40 раскол; 5MS неполярная колонка (таблица материалов) с длиной 15 м и толщиной 0,25 мм пленки; температурная программа 30 °C, удерживайте 2 мин, пандус + 40 °C/мин до 250 ° с, удерживайте 2 мин; ионизации с 70 м.в. и MS детектор в режиме сканирования с м/з диапазоне от 35 − 400, каждое сканирование в 0,3 s.
- Установите калибровочные кривые общим пиковым районом (TIC) ионных соединений и концентрацией соединения.
- Запустите подготовленные образцы жидкой фазы HTC для биоугля с теми же аналитическими параметрами и определите furfural и 5-метилфурфул с помощью времени удержания стандарта и совпадения спектра в библиотеке спектров.
- Определить концентрацию furfural и 5-метилфурфуль с помощью расчетной кривой калибровки (шаг 9,6) и вставки образца пиковые области furfural и 5-метилфурфураль.
10. Статистика
- Проанализируйте данные с тестом Шапиро Уилкс для нормального распределения.
- Используйте тест Манна-Уитни U-Test для необычно распределенных наборов данных и t-Test для обычно распределенных наборов данных для поиска существенных различий между наборами данных.
Примечание: если один набор данных обычно распределен, а другой нет, воспользуйтесь тестом Манна-Уитни U.
Результаты
Результаты элементарного анализа выявили различия между O/C-H/C соотношением ивовой древесины и биоуглей МАХК (рис. 1). Сырье показывает более высокие коэффициенты O/C-H/C и более высокую вариацию значений. Лечение МАХК уменьшило вариацию значений из-за гомо...
Обсуждение
МАХК позволяет дифференцировку шагов химической деградации, применяя различные интенсивности термической обработки. Таким образом, можно оценить взаимодействие между массой потери, O/c-H/c соотношение, теплоснабжение, уменьшение зольного компонента, увеличение рН процесса воды и накоп...
Раскрытие информации
Авторам нечего раскрывать.
Благодарности
Авторы хотели бы поблагодарить Кристофа Варта, Майкла Руса, Каролу Лепски, Джулиана Теджада и д-ра Райнера Кирхгофа за их техническую поддержку. Исследование финансировалось BMBF (проект BiCoLim-био-горючих Limpios) под номером гранта 01DN16036.
Материалы
| Name | Company | Catalog Number | Comments |
| 5MS non-polar cloumn | Thermo Fisher Scientific,Waltham, USA | TraceGOLD SQC | GCMS |
| 9µm polyvinylalcohol particle column | Methrom AG, Filderstadt, Germany | Metrosep A Supp 4 -250/4.0 | Ion chromatography |
| argon | Westfalen AG, Münster, Germany | UN 1006 | ICP-OES |
| calorimeter | IKA-Werke GmbH & Co.KG, Stauffen, Germany | C6000 | higher and lower heating value |
| centrifuge | Andreas Hettich GmbH & Co.KG, Germany | Rotofix 32 A | |
| centrifuge mill | Retsch Technology GmbH, Haan, Germany | ZM 200 | |
| ceramic dishes | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | XX83.1 | Ash content |
| cutting mill | Fritsch GmbH, Markt Einersheim, Germany | pulverisette 19 | |
| D(+) Glucose | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | X997.1 | higher and lower heating value |
| elemental analyzer | elementar Analysesysteme GmbH, Langenselbold, Germany | varioMACRO cube | elemental analysis |
| exicator | DWK Life Sciences GmbH, Wertheim, Germany | DURAN DN300 | Ash content |
| GC-MS system | Thermo Fisher Scientific,Waltham, USA | Trace 1300 | GCMS |
| hydrochloric acid | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | HN53.3 | ICP-OES |
| ICP OES | Spectro Analytical Instruments GmbH, Kleve, Germany | Spectro Blue-EOP- TI | ICP-OES |
| Ion chromatograph | Methrom GmbH&Co.KG, Filderstadt, Germany | 833 Basic IC plus | Ion chromatography |
| kiln dryer | Schellinger KG, Weingarten, Germany | ||
| kiln dryer | Schellinger KG, Weingarten, Germany | Ash content | |
| mesh filter paper | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | L874.1 | ICP-OES |
| microwave oven | Anton Paar GmbH, Graz, Austria | Multiwave Go | |
| muffel furnance | Carbolite Gero GmbH &Co.KG, Neuhausen, Germany | AAF 1100 | Ash content |
| nitric acid | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | 4989.1 | ICP-OES |
| oxygen | Westfalen AG, Münster, Germany | UN 1072 | higher and lower heating value |
| pH-meter | ylem Analytics Germany Sales GmbH & Co. KG, Weilheim,Germany | pH 3310 | pH |
| sample bag | IKA-Werke GmbH & Co.KG, Stauffen, Germany | C12a | higher and lower heating value |
| Standard Laboratory Vessels and Instruments | |||
| standard samples | Bernd Kraft GmbH, Duisburg, Germany | ICP-OES | |
| sulfonamite | elementar Analysesysteme GmbH, Langenselbold, Germany | SLBS4782 | elemental analysis |
| teflon reaction vessels | Anton Paar, Austria | HVT50 | |
| teflon reaction vessels | Anton Paar, Austria | HVT50 | ICP-OES |
| tin foil | elementar Analysesysteme GmbH, Langenselbold, Germany | S12.01-0032 | elemental analysis |
| tungstenVIoxide | elementar Analysesysteme GmbH, Langenselbold, Germany | 11.02-0024 | elemental analysis |
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | ||
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | higher and lower heating value | |
| twice deionized water | Carl Roth GmbH&Co.KG, Karlsruhe, Germany | ICP-OES |
Ссылки
- Li, C., Zhao, Z. K., Cai, H., Wang, A., Zhang, T. Microwave-promoted conversion of concentrated fructose into 5-hydroxymethylfurfural in ionic liquids in the absence of catalysts. Biomass and Bioenergy. 35 (5), 2013-2017 (2011).
- Möller, M., Harnisch, F., Schröder, U. Microwave-assisted hydrothermal degradation of fructose and glucose in subcritical water. Biomass and Bioenergy. 39, 389-398 (2012).
- Guiotoku, M., Rambo, C. R., Hansel, F. A., Magalhães, W. L. E., Hotza, D. Microwave-assisted hydrothermal carbonization of lignocellulosic materials. Materials Letters. 63 (30), 2707-2709 (2009).
- Guiotoku, M., Rambo, C. R., hansel, F. A., Magalhães, W. L. E., Hotza, D. Microwave-assisted hydrothermal carbonization of lignocellulosic materials. Materials Letters. (63), 2707-2709 (2009).
- Kannan, S., Gariepy, Y., Raghavan, G. S. V. Optimization and characterization of hydrochar produced from microwave hydrothermal cabonization of fish waste. Waste Management. , 159-168 (2017).
- Elaigwu, S. E., Greenway, G. M. Microwave-assisted and conventional hydrothermal carbonization of lignocellulosic waste material: Comparison of the chemical and structural properties of the hydrochars. Journal of Analytical and Applied Pyrolysis. 118, 1-8 (2016).
- Elaigwu, S. E., Greenway, G. M. Microwave-assisted hydrothermal carbonization of rapeseed husk: A strategy for improving its solid fuel properties. Fuel Processing Technology. 149, 305-312 (2016).
- Chen, W. -. H., Ye, S. -. C., Sheen, H. -. K. Hydrothermal carbonization of sugarcane bagasse via wet torrefaction in association with microwave heating. Bioresource technology. 118, 195-203 (2012).
- Nizamuddin, S., et al. Upgradation of chemical, fuel, thermal, and structural properties of rice husk through microwave-assisted hydrothermal carbonization. Environmental science and pollution research international. 25 (18), 17529-17539 (2018).
- Nizamuddin, S., et al. An overview of microwave hydrothermal carbonization and microwave pyrolysis of biomass. Reviews in Environmental Science and Bio/Technology. 17 (4), 813-837 (2018).
- Dallinger, D., Kappe, C. O. Microwave-assisted synthesis in water as solvent. Chemical reviews. 107 (6), 2563-2591 (2007).
- Qi, X., Watanabe, M., Aida, T. M., Smith, J. R. L. Catalytic dehydration of fructose into 5-hydroxymethylfurfural by ion-exchange resin in mixed-aqueous system by microwave heating. Green Chemistry. 10 (7), 799 (2008).
- Nüchter, M., Ondruschka, B., Bonrath, W., Gum, A. Microwave assisted synthesis - a critical technology overview. Green Chem. 6 (3), 128-141 (2004).
- Schanche, J. -. S. Microwave synthesis solutions from personal chemistry. Molecular Diversity. 7 (2-4), 291-298 (2003).
- Kappe, C. O. Controlled microwave heating in modern organic synthesis. Angewandte Chemie (International ed. in English). 43 (46), 6250-6284 (2004).
- Gronnow, M. J., White, R. J., Clark, J. H., Macquarrie, D. J. Energy Efficiency in Chemical Reactions: A Comparative Study of Different Reaction Techniques. Organic Process Research & Development. 9 (4), 516-518 (2005).
- Kruse, A., Dahmen, N. Hydrothermal biomass conversion: Quo vadis?. The Journal of Supercritical Fluids. 134, 114-123 (2018).
- Reza, M. T., et al. Hydrothermal Carbonization of Biomass for Energy and Crop Production. Applied Bioenergy. 1 (1), (2014).
- Libra, J. A., et al. Hydrothermal carbonization of biomass residuals: a comparative review of the chemistry, processes and applications of wet and dry pyrolysis. Biofuels. 2 (1), 71-106 (2011).
- Reza, M. T., Uddin, M. H., Lynam, J. G., Hoekman, S. K., Coronella, C. J. Hydrothermal carbonization of loblolly pine: reaction chemistry and water balance. Biomass Conversion and Biorefinery. 4 (4), 311-321 (2014).
- Funke, A., Ziegler, F. Hydrothermal carbonization of biomass: A summary and discussion of chemical mechanisms for process engineering. Biofuels, Bioproducts and Biorefining. 4 (2), 160-177 (2010).
- Kruse, A., Funke, A., Titirici, M. -. M. Hydrothermal conversion of biomass to fuels and energetic materials. Current opinion in chemical biology. 17 (3), 515-521 (2013).
- Reza, M. T., Lynam, J. G., Uddin, M. H., Coronella, C. J. Hydrothermal carbonization: Fate of inorganics. Biomass and Bioenergy. 49, 86-94 (2013).
- Zhang, D., et al. Comparison study on fuel properties of hydrochars produced from corn stalk and corn stalk digestate. Energy. 165, 527-536 (2018).
- Huang, Y. -. B., Yang, Z., Dai, J. -. J., Guo, Q. -. X., Fu, Y. Production of high quality fuels from lignocellulose-derived chemicals: a convenient C-C bond formation of furfural, 5-methylfurfural and aromatic aldehyde. RSC Advances. 2 (30), 11211 (2012).
- Van de Vyver, S., Geboers, J., Jacobs, P. A., Sels, B. F. Recent Advances in the Catalytic Conversion of Cellulose. ChemCatChem. 3 (1), 82-94 (2011).
- Delidovich, I., Leonhard, K., Palkovits, R. Cellulose and hemicellulose valorisation: an integrated challenge of catalysis and reaction engineering. Energy & Environmental Science. 7 (9), 2803 (2014).
- Sevilla, M., Fuertes, A. B. The production of carbon materials by hydrothermal carbonization of cellulose. Carbon. 47 (9), 2281-2289 (2009).
- Yao, Z., Ma, X. Characteristics of co-hydrothermal carbonization on polyvinyl chloride wastes with bamboo. Bioresource technology. 247, 302-309 (2018).
- Funke, A., Ziegler, F. Hydrothermal carbonization of biomass: A summary and discussion of chemical mechanisms for process engineering. Biofuels, Bioproducts and Biorefining. (4), 160-177 (2010).
- Liu, Z., Balasubramanian, R. Upgrading of waste biomass by hydrothermal carbonization (HTC) and low temperature pyrolysis (LTP): A comparative evaluation. Applied Energy. 114, 857-864 (2014).
- Khalsa, J., Döhling, F., Berger, F. Foliage and Grass as Fuel Pellets-Small Scale Combustion of Washed and Mechanically Leached Biomass. Energies. 9 (5), 361 (2016).
- Saddawi, A., Jones, J. M., Williams, A., Le Coeur, C. Commodity Fuels from Biomass through Pretreatment and Torrefaction: Effects of Mineral Content on Torrefied Fuel Characteristics and Quality. Energy & Fuels. 26 (11), 6466-6474 (2012).
- Kaltschmitt, M., Hartmann, H., Hofbauer, H. . Energie aus Biomasse: Grundlagen, Techniken und Verfahren. , (2016).
- Fengel, D., Wegener, G. . Wood: Chemistry, Ultrastructure, Reactions. , (1989).
- Obernberger, I., Thek, G. Physical characterisation and chemical composition of densified biomass fuels with regard to their combustion behaviour. Biomass and Bioenergy. 27 (6), 653-669 (2004).
- Kenney, W. A., Sennerby-Forsse, L., Layton, P. A review of biomass quality research relevant to the use of poplar and willow for energy conversion. Biomass. 21 (3), 163-188 (1990).
- Tharakan, P. J., Volk, T. A., Abrahamson, L. P., White, E. H. Energy feedstock characteristics of willow and hybrid poplar clones at harvest age. Biomass and Bioenergy. 25 (6), 571-580 (2003).
- Liu, Z., Quek, A., Balasubramanian, R. Preparation and characterization of fuel pellets from woody biomass, agro-residues and their corresponding hydrochars. Applied Energy. , 1315-1322 (2014).
- Technischen Komitee ISO/TC 238. . "Solid biofuels" und Technisches Komitee CEN/TC 335 "Biogene Festbrennstoffe" Solid biofuels - Determination of calorific value (ISO 18125:2017); German version EN ISO 18125:2017. , (2017).
- Kambo, H. S., Dutta, A. A comparative review of biochar and hydrochar in terms of production, physico-chemical properties and applications. Renewable and Sustainable Energy Reviews. 45, 359-378 (2015).
- Knappe, V., et al. Low temperature microwave assisted hydrothermal carbonization (MAHC) reduces combustion emission precursors in short rotation coppice willow wood. Journal of Analytical and Applied Pyrolysis. 134, 162-166 (2018).
- Liu, Z., Quek, A., Kent Hoekman, S., Balasubramanian, R. Production of solid biochar fuel from waste biomass by hydrothermal carbonization. Fuel. 103, 943-949 (2013).
- Hoekman, S. K., Broch, A., Robbins, C., Zielinska, B., Felix, L. Hydrothermal carbonization (HTC) of selected woody and herbaceous biomass feedstocks. Biomass Conversion and Biorefinery. 3 (2), 113-126 (2013).
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены