Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Tomographie automatisée de cohérence optique 3D pour élucider la morphogénèse du biofilm sur de grandes échelles spatiales
Dans cet article
Résumé
Les biofilms microbiens forment des architectures complexes en interphases et se développent en modèles spatiaux très dépendants de l'échelle. Ici, nous introduisons un système expérimental (dur et logiciel) pour l'acquisition automatisée de jeux de données de tomographie de cohérence optique 3D (OCT). Cet ensemble d'outils permet la caractérisation non invasive et multi-échelle de la morphogénèse du biofilm dans l'espace et le temps.
Résumé
Les biofilms sont un mode de vie microbien très réussi et prévalent dans une multitude de milieux environnementaux et d'ingénierie. Comprendre la morphogénèse du biofilm, c'est-à-dire la diversification structurelle des biofilms lors de l'assemblage communautaire, représente un défi remarquable à travers les échelles spatiales et temporelles. Ici, nous présentons un système automatisé d'imagerie biofilm basé sur la tomographie de cohérence optique (OCT). OCT est une technique d'imagerie émergente dans la recherche sur les biofilms. Cependant, la quantité de données qui peuvent actuellement être acquises et traitées entrave l'inférence statistique des modèles à grande échelle dans la morphologie des biofilms. Le système automatisé d'imagerie OCT permet de couvrir de grandes échelles spatiales et temporelles étendues de la croissance des biofilms. Il combine un système OCT disponible dans le commerce avec une plate-forme de positionnement robotique et une suite de solutions logicielles pour contrôler le positionnement de la sonde de balayage OCT, ainsi que l'acquisition et le traitement de jeux de données d'imagerie biofilm 3D. Cette configuration permet la surveillance automatisée in situ et non invasive du développement de biofilms et peut être développée pour coupler l'imagerie OCT avec la macrophotographie et le profilage des microcapteurs.
Introduction
Les biofilms sont une adaptation microbienne très réussie du mode de vie et ces communautés de micro-organismes associées à l'interphase et fermées par matrice dominent la vie microbienne dans les milieux naturels et industriels1,2. Là, les biofilms forment des architectures complexes, telles que les banderoles allongées3, ondulations4 ou les bouchons en forme de champignon5 avec des conséquences importantes pour la croissance des biofilms, la stabilité structurelle et la résistance au stress6. Bien que beaucoup de choses sur la différenciation structurelle des biofilms aient été tirées des travaux sur les cultures mono-espèces cultivées dans des chambres à débit miniatures, la plupart des biofilms sont des communautés très complexes, y compris souvent des membres de tous les domaines de la vie6. Apprécier ces biofilms complexes comme des paysages microbiens7 et comprendre comment la structure et la fonction des biofilms interagissent dans des communautés complexes est donc à l'avant-garde de la recherche sur les biofilms.
Une compréhension mécaniste de la morphogénèse de biofilms complexes en réponse à des indices environnementaux nécessite des expériences soigneusement conçues en conjonction avec des observations spatialement et temporellement résolues de la structure physique du biofilm à travers les échelles8. Cependant, l'observation non destructive de la croissance des biofilms dans les systèmes expérimentaux a été sévèrement limitée par des contraintes logistiques telles que la nécessité de déplacer des échantillons (par exemple, au microscope) endommageant souvent la structure délicate du biofilm.
Le protocole présenté ici introduit un système entièrement automatisé basé sur la tomographie de cohérence optique (OCT), qui permet la surveillance in situ et non invasive de la morphogénèse du biofilm à l'échelle méso-métrique (portée mm). OCT est une technique d'imagerie émergente dans la recherche sur les biofilms avec des applications dans le traitement de l'eau et la recherche sur le biofouling, la médecine9 et l'écologie des cours d'eau10. Dans OCT, une source lumineuse à faible cohérence est divisée en un échantillon et un bras de référence; l'interférence de la lumière réfléchie et dispersée par le biofilm (bras d'échantillon) et la lumière du bras de référence est analysée. Une série de profils d'intensité axiale (A-scans) qui contient des informations structurelles résolues en profondeur est acquise et fusionnée en une analyse B (une section transversale). Une série de B-scans adjacents compose le dernier balayage de volume 3D10. OCT fournit une résolution optique latérale de l'ordre d'environ 10 m et est donc bien adapté pour étudier la différenciation structurale mésoscopique des biofilms10,12. Pour une description plus détaillée de l'OCT, consultez Drexler et Fujimoto13et Fercher et ses collègues14. Bien que le champ de vision d'un seul tCO xy-scan atteigne jusqu'à des centaines de micromètres carrés, les modèles à plus grande échelle ne peuvent pas être quantifiés au moyen de l'OCT dans un seul balayage. En ce qui concerne les biofilms dans les habitats naturels tels que les cours d'eau et les rivières, cela limite actuellement notre capacité d'évaluer la morphogénèse du biofilm à des échelles correspondant au modèle physique et hydraulique de l'habitat.
Afin de dépasser ces limites spatiales et d'acquérir automatiquement des scans OCT, une sonde d'imagerie OCT de domaine spectral a été montée sur un système de positionnement à 3 axes. L'installation permet l'acquisition de plusieurs scans OCT dans un motif de mosaïque qui se chevauche (analyse de tuiles), réalisant efficacement l'imagerie tomographique des surfaces jusqu'à 100 cm2. En outre, la haute précision de positionnement de ce système permet de surveiller de manière fiable la croissance et le développement des caractéristiques des biofilms dans des sites spécifiques au cours d'expériences à long terme. Le système est modulaire et les composants individuels (c.-à-d., dispositif de positionnement et OCT) de l'installation peuvent être utilisés comme solutions autonomes ou combinés avec souplesse. La figure 1 donne un aperçu des composants durs et logiciels de l'installation.
Le système a été testé avec un dispositif de positionnement CNC contrôlé par GRBL (Tableaudes matériaux). Les distances de fonctionnement de cette plate-forme de positionnement spécifique sont de 600 à 840 x 140 mm, avec une précision indiquée par le fabricant de 0,05 mm et une résolution programmable de 0,005 mm. GRBL est un open-source (licence GPLv3), un contrôle de mouvement haute performance pour CNC Dispositifs. Par conséquent, chaque appareil de positionnement basé sur GRBL (version '1.1) doit être compatible avec les lignes directrices et les progiciels présentés ici. En outre, le logiciel pourrait être adapté à d'autres contrôleurs stepmotor avec le type d'entrée STEP-DIR avec peu de modifications.
Le dispositif OCT utilisé pour évaluer les performances du système (Tableau des matériaux) dispose d'une source lumineuse à faible cohérence avec une longueur d'onde centrale de 930 nm (bande passante de 160 nm) et une longueur et une intensité de référence réglables. Dans l'exemple présenté ici, un adaptateur d'immersion pour plonger la sonde OCT dans l'eau qui coule a également été utilisé (Tableau des matériaux). Le logiciel développé ici pour l'acquisition automatisée de balayage OCT dépend de façon critique de la SDK fourni avec le système OCT spécifique, cependant, les systèmes OCT du même fabricant avec différentes lentilles d'analyse et longueurs d'onde centrales devraient être facilement compatibles.
L'appareil GRBL est contrôlé par un serveur web installé sur un ordinateur à seule carte (Figure 1). Cela permet de contrôler à distance l'appareil à partir de n'importe quel ordinateur avec un réseau local ou un accès à Internet. L'appareil OCT est contrôlé par un ordinateur séparé, permettant le fonctionnement du système OCT en dehors de la configuration expérimentale automatisée. Enfin, les progiciels comprennent des bibliothèques pour synchroniser le positionnement de la sonde OCT et l'acquisition d'un scan OCT (c.-à-d. pour acquérir automatiquement des ensembles de données d'imagerie 3D dans un modèle de mosaïque ou dans un ensemble de positions définies). Définir la position de la sonde OCT en 3D permet d'ajuster efficacement le plan focal spécifiquement pour les scans (régionaux). Plus précisément, sur des surfaces inégales, différents plans focaux (c.-à-d. différentes positions dans la direction z) peuvent être spécifiés pour chaque analyse OCT.
Un ensemble de progiciels a été développé pour traiter les scans D'OCT bruts (tableau1). La navigation du dispositif de positionnement, l'acquisition d'analyse OCT et le traitement des ensembles de données sont effectués avec des ordinateurs portables Jupyter codés python, ce qui permet une flexibilité remarquable dans le développement et l'optimisation du logiciel. Deux exemples travaillés et annotés de ces ordinateurs portables (pour l'acquisition et le traitement d'images, respectivement) sont disponibles à partir de https://gitlab.com/FlumeAutomation/automated-oct-scans-acquisition.git Ils sont destinés comme points de départ pour la personnalisation de la méthode. Un ordinateur portable Jupyter est une application basée sur le navigateur Web qui contient des cellules avec du code Python annoté. Chaque étape est contenue dans une cellule du carnet, qui peut être exécutée séparément. En raison de la longueur différente du chemin de lumière à travers la lentille de balayage (aberration sphérique)15, les scans BRUTs OCT semblent déformés (Figure 2A). Nous avons développé un algorithme pour corriger automatiquement cette distorsion dans les scans OCT acquis (contenu dans ImageProcessing.ipynb, Dossier supplémentaire 1). En outre, la morphologie des biofilms peut être visualisée comme une carte d'élévation 2D, comme cela a été utilisé précédemment dans les systèmes membranaires16, et nous illustrons comment les cartes d'altitude obtenues à partir de scans effectués dans un tableau de carrelage peuvent être cousues.
Enfin, la fonctionnalité de l'installation de laboratoire décrite est illustrée à l'aide d'une expérience de flume dans laquelle le biofilm de flux phototrophique est exposé à un gradient de vitesse d'écoulement.
Protocole
1. Configuration de l'appareil de positionnement
- Câblez le dispositif de positionnement à un tableau de microcontrôleur, suivant l'instruction en https://github.com/grbl/grbl/wiki/Connecting-Grbl.
- Connectez le microcontrôleur à un ordinateur à une seule carte avec connexion Internet via un câble USB et installez le serveur GRBL tel que décrit dans https://gitlab.com/FlumeAutomation/GRBL_Server.git. Maintenant, le dispositif de positionnement doit être navigable à partir d'une page Web hébergée à http://IP:5020/. Alternativement, le dispositif de positionnement peut être navigué avec un script Python, comme démontré dans la première partie de l'exemple travaillé ImagesAcquisition.ipynb (Fichier supplémentaire 2).
2. Configuration OCT
- Montez la sonde OCT jusqu'au dispositif de positionnement à l'aide d'un porte-queue de colombe compatible. Au besoin, installez un adaptateur d'immersion sur la lentille objective.
- Placez l'ordinateur et l'unité de base OCT sur un banc à côté de l'expérience (p. ex., dispositifs microfluidiques, chambres d'écoulement, canalisations, systèmes de filtration). Assurez-vous que le cordon optique (longueur maximale d'environ 1,8 m) est en mouvement libre, assez long pour atteindre tous les emplacements prévus et ne pas interférer avec la configuration expérimentale.
- Installez le système OCT avec le logiciel disponible tel que décrit par le fabricant.
- Installez les progiciels pour l'acquisition automatisée d'analyse OCT tel que décrit dans https://gitlab.com/FlumeAutomation/automated-oct-scans-acquisition.git.
3. Acquisition d'images
- Puissance sur le système OCT et le dispositif de positionnement. Assurez-vous que l'appareil peut se déplacer librement.
- Ouvrez le fichier config.json dans un éditeur de texte. Modifier le fichier config.json pour ajuster le paramètre d'acquisition d'images par défaut (tableau 2), tel que l'indice de réfraction (1,33 pour l'eau à 20 oC, 1,00 pour l'air) et le dossier de destination pour les données acquises et les métadonnées.
- Définissez la taille du champ de vision (FOV) et le nombre de Scans A par B-scan dans config.json.
REMARQUE : Ces deux paramètres déterminent la taille des voxels de l'ensemble de données final et la taille du fichier de sortie et doivent correspondre à la résolution optique de la sonde (la taille du voxel x-y ne doit pas être inférieure à la moitié de la résolution optique). Le nombre de scans A et B affecte l'étendue spatiale à couvrir qui se négocie contre l'espace disque disponible et la puissance de traitement. - Définissez les limites du signal de l'analyse OCT de sortie dans config.json. Celles-ci dépendent du type d'échantillon. Il est donc recommandé de déterminer ces paramètres en fonction des histogrammes d'intensité d'un ensemble d'analysepréliminaire. Enregistrer les changements dans config.json.
- Naviguez dans la sonde OCT jusqu'à un site d'intérêt. Concentrez l'échantillon et ajustez le bras de référence et l'intensité de la source lumineuse pour une qualité d'image optimale. Répétez cette procédure pour un certain nombre de postes et notez les coordonnées.
REMARQUE : Cela permettra l'acquisition automatique subséquente d'analyse OCT autour de ces points de référence. Notez que la longueur et l'intensité du bras de référence ne peuvent pas être modifiées lors de l'acquisition automatisée d'images. - Ouvrez le fichier ImageAcquisition.ipynb (Fichier supplémentaire 2) dans Juypter Notebook. Chaque cellule contient du code pour effectuer des tâches spécifiques et peut être exécuté séparément via la pression Cellule Exécuter, ou Ctrl - Entrez ou shift - Entrez.
- Définiz le chemin vers les bibliothèques requises et les paramètres de configuration par défaut. Vous pouvez également définir un nouvel ensemble de paramètres temporaires.
- Connectez-vous au dispositif de positionnement et initialisez l'OCT.
- Calibrer le dispositif de positionnement (c.-à-d. effectuer un « homing »).
- Acquérir les ensembles de données couvrant les positions d'intérêts dans un modèle de balayage unique ou de mosaïque, en précisant le nombre et le chevauchement (p. ex. 30 %) de tuiles voisines.
REMARQUE : La mémoire est allouée avant l'analyse, ce qui optimise l'utilisation des ressources informatiques. Les données sont enregistrées en 8 bits-.raw format pour économiser de l'espace de stockage, dans le dossier de destination défini en config.json, en utilisant l'horodatage et la position comme convention de nommage (c.-à-d., %Y%m%%%H%M%S-lt;position -gt;). Les métadonnées, y compris les paramètres et coordonnées OCT, sont enregistrées dans le même dossier dans un fichier.srm avec la même convention de nommage. Selon les paramètres tels que FOV et résolution, la taille du fichier peut atteindre jusqu'à 1,5 Go par analyse OCT.
- Pour éviter l'avortement de l'acquisition de données, assurez-vous qu'il y a suffisamment d'espace disque libre ou déplacez continuellement les ensembles de données OCT vers un disque dur externe.
4. Correction et affichage d'image
- Ouvrez le carnet Jupyter ImageProcessing.ipynb (Dossier supplémentaire 1) pour un exemple travaillé de traitement d'image OCT (correction de la distorsion, soustraction de fond, calcul des cartes d'altitude, couture souillage de carte d'altitude).
- Au besoin, les cultures scannent l'OCT afin d'exclure les signaux fallacieux et de réorienter l'ensemble de données (le biofilm doit apparaître au-dessus du substrat).
- Correct pour l'aberration sphérique. Ceci est accompli par un algorithme de correction qui utilise une surface de référence très réfléchissante connue pour être plate (par exemple, le fond de la cheminée, substrat). Tout d'abord, l'algorithme définit une grille de 20 à 20 lignes verticales régulièrement espacées à travers le xy-plan de l'analyse OCT. Ensuite, il sélectionne une zone circulaire autour de chaque point et fait la moyenne des intensités du signal le long du profil vertical (figure 2B). Les profils verticaux sont traités avec un filtre Gaussian modifié :
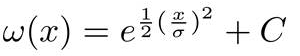
où x est le signal d'entrée, et son écart type, tandis que C est déterminé comme: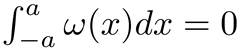
La surface de référence est localisée en tant que maxima local dans chacun de ces profils. Les points mal identifiés sont filtrés en fonction des positions de leurs voisins en trois dimensions (figure 2C). Enfin, une surface polynomiale de 2nd reflétant la distorsion introduite par la lentille d'analyse est installée sur ces points (Figure 2C). La surface ajustée est ensuite utilisée pour déplacer chaque pixel en z-direction, obtenant ainsi une image aplatie. Les paramètres de cet algorithme doivent être ajustés aux caractéristiques de l'analyse OCT. - Correct pour le bruit de fond. Identifiez une zone vide de l'image (généralement au-dessus du biofilm) et utilisez l'algorithme de correction pour soustraire l'intensité moyenne de fond des valeurs d'intensité de l'image pour produire une image OCT corrigée finale (Figure 2D).
- Calculd une carte d'altitude à partir du jeu de données OCT 3D. Dans cette étape, définissez une surface de référence d'intérêt pour l'expérience spécifique (p. ex., le substrat) et une intensité de seuil appropriée. Ensuite, utilisez l'algorithme de calcul de la carte d'altitude pour calculer l'épaisseur du biofilm pour chaque coordonnées (x,y) du masque binaire et l'attribuer à une nouvelle matrice 2D (Figure 3A). Les valeurs d'épaisseur sont ensuite attribuées à une matrice 2D de la taille de l'image originale dans les directions x et y. Une image est rendue dans laquelle l'élévation de la surface est signalée comme valeur à l'échelle grise (figure 3B).
- Dans le cas où plusieurs scans OCT sont pris dans un modèle de mosaïque, définir le nombre de lignes et de colonnes et coudre les cartes d'altitude respectives. La figure 5 présente des exemples de cartes d'altitude cousues, couvrant la large gamme d'échelles spatiales et de résolutions réalisables avec la configuration décrite.
Résultats
Nous démontrons la fonctionnalité du système automatisé d'imagerie OCT à l'aide d'une expérience de flume conçue pour étudier la morphogenèse spatio-temporelle des biofilms de flux phototrophiques. Une géométrie de rétrécissement progressif des flumes induits gradients de vitesse d'écoulement le long du centre de la canalisation (voir la référence17). Le développement temporel et la différenciation structurelle du biofilm ont été surveillés pendant 18 jours dans le but de mieu...
Discussion
L'imagerie OCT est bien adaptée pour résoudre les structures de la gamme micrométrique avec un FOV de plusieurs millimètres carrés. C'est donc un outil puissant pour la recherche biofilm10,18. Cependant, l'OCT est actuellement limité à une surface d'analyse maximale de 100 à 256 mm2,tandis que les modèles structurels du biofilm dépassent souvent cette échelle spatiale19, surtout lorsque la différenciation morphologiq...
Déclarations de divulgation
Sebastian Schàfer est employé chez Thorlabs Inc.
Remerciements
Nous remercions Mauricio Aguirre Morales pour sa contribution au développement de ce système. Le soutien financier est venu de la Fondation nationale suisse pour la science à T.J.B.
matériels
| Name | Company | Catalog Number | Comments |
| OCT Probe | Thorlabs | GAN210C1 | OCT imaging device |
| OCT scan lens | Thorlabs | OCT-LK3-BB | |
| Immersion adapter | Thorlabs | OCT-IMM3-SP1 | |
| Stepcraft 840 CK | STEPCRAFT | NA | positioning device |
| microcontroller | Arduino Uno R3 | NA | |
| Single-board computer | Raspberry PI | NA | |
| camera | Canon EOS 7D Mark II | NA | |
| camera lens | Canon MACRO EFS 35 mm | NA |
Références
- Flemming, H. C., Wingender, J. The biofilm matrix. Nature reviews. Microbiology. 8, 623-633 (2010).
- Flemming, H. -. C., et al. Biofilms: an emergent form of bacterial life. Nature reviews. Microbiology. 14, 563 (2016).
- Stoodley, P., Lewandowski, Z., Boyle, J. D., Lappin-Scott, H. M. Oscillation characteristics of biofilm streamers in turbulent flowing water as related to drag and pressure drop. Biotechnology and Bioengineering. 57, 536-544 (1998).
- Stoodley, P., Lewandowski, Z., Boyle, J. D., Lappin-Scott, H. M. The formation of migratory ripples in a mixed species bacterial biofilm growing in turbulent flow. Environmental microbiology. 1, 447-455 (1999).
- Banin, E., Vasil, M. L., Greenberg, E. P. Iron and Pseudomonas aeruginosa biofilm formation. Proceedings of the Natural Academy of Sciences U.S.A. 102, 11076-11081 (2005).
- Battin, T. J., Besemer, K., Bengtsson, M. M., Romani, A. M., Packmann, A. I. The ecology and biogeochemistry of stream biofilms. Microbiology. 14, 251-263 (2016).
- Battin, T. J., et al. Microbial landscapes: new paths to biofilm research. Nature Reviews. Microbiology. 5, 76-81 (2007).
- Neu, T. R., Lawrence, J. R. Innovative techniques, sensors, and approaches for imaging biofilms at different scales. Trends in Microbiology. 23, 233-242 (2015).
- Meleppat, R. K., Shearwood, C., Seah, L. K., Matham, M. V. Quantitative optical coherence microscopy for the in situ investigation of the biofilm. J. of Biomedical Optics. 21 (12), 127002 (2016).
- Wagner, M., Horn, H. Optical coherence tomography in biofilm research: A comprehensive review. Biotechnology and Bioengineering. 114, 1386-1402 (2017).
- Huang, D., et al. Optical coherence tomography. Science. 254, 1178-1181 (1991).
- Haisch, C., Niessner, R. Visualisation of transient processes in biofilms by optical coherence tomography. Water Resources. 41, 2467-2472 (2007).
- Drexler, W., Fujimoto, J. G. . Optical Coherence Tomography: Technology and Applications. , (2008).
- Fercher, A. F. Optical coherence tomography – development, principles, applications. Zeitschrift für Medizinische Physik. 20, 251-276 (2010).
- Lee, H. -. C., Liu, J. J., Sheikine, Y., Aguirre, A. D., Connolly, J. L., Fujimoto, J. G. Ultrahigh speed spectral-domain optical coherence microscopy. Biomedical Optics Express. , 41236-41254 (2013).
- Fortunato, L., Leiknes, T. In-situ biofouling assessment in spacer filled channels using optical coherence tomography (OCT): 3D biofilm thickness mapping. Bioresource Technology. 229, 231-235 (2017).
- Niederdorfer, R., Peter, H., Battin, T. J. Attached biofilms and suspended aggregates are distinct microbial lifestyles emanating from differing hydraulics. Nature Microbiology. 1, 16178 (2016).
- Roche, K. R., et al. Benthic biofilm controls on fine particle dynamics in streams. Water Resources. 53, 222-236 (2016).
- Fortunato, L., Jeong, S., Wang, Y., Behzad, A. R., Leiknes, T. Integrated approach to characterize fouling on a flat sheet membrane gravity driven submerged membrane bioreactor. Bioresource Technology. 222, 335-343 (2016).
- Morgenroth, E., Milferstedt, K. Biofilm engineering: linking biofilm development at different length and time scales. Reviews in Environmental Science and Bio/Technology. 8, 203-208 (2009).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon