Method Article
Manipulation des motifs de couleur dans les araignées sautantes pour une utilisation dans des expériences comportementales
Dans cet article
Résumé
Le but de ce protocole est de manipuler les modèles de couleurs des araignées sautantes et d’autres très petits arthropodes avec de la peinture afin d’étudier les questions liées à la sélection sexuelle, le cannibalisme sexuel, la prédation, l’aposématime, ou tout autre champ de coloration animale.
Résumé
Dans le domaine de l’écologie comportementale, de nombreuses expériences sont conçues pour étudier les objectifs évolutionnaires des traits colorés dans le contexte de la sélection sexuelle et de la prédation. Les méthodes sont diverses, mais consistent principalement à modifier les modèles de couleur des individus avec divers colorants. De telles techniques ont été utilisées dans de nombreux taxons vertébrés, en particulier chez les oiseaux, mais sont restées sous-développées pour les invertébrés en raison de la difficulté de manipuler efficacement la couleur chez les petits organismes. Au lieu de cela, pour manipuler l’apparence des invertébrés, les scientifiques ont généralement modifié l’environnement d’éclairage pour filtrer certaines longueurs d’onde. Cependant, une telle méthode affecte non seulement le caractère phénotypique de l’intérêt, mais l’apparence entière de l’individu et de ses environs. Ici, en défaisant les techniques précédemment utilisées sur les oiseaux colorés, nous présentons des façons de manipuler les couleurs des petits arthropodes, en utilisant des espèces tout aussi emblématiques mais sous-étudiées: les araignées sautantes colorées.
Introduction
Les animaux ont souvent des motifs de couleurs élaborés qu’ils affichent pendant les rencontres sexuelles, les rencontres agonistiques, ou pour dissuader la prédation. Ces traits peuvent transmettre des informations à des récepteurs tels que la qualité individuelle du signaleur en tant que compagnon1, capacité de combat en tant que concurrent2, ou palatabilité comme un élément de proie3. Pour comprendre les objectifs adaptatifs des traits colorés, les chercheurs ont conçu des expériences qui impliquent manipuler des couleurs de différentes manières. Certains chercheurs ont utilisé des stimuli de leurre colorés tels que les modèles4,5,6,7,8, des photographies9, ou des vidéos10,11, 12 qui sont présentés aux récepteurs dans les expériences comportementales. D’autres, en particulier lors de l’utilisation d’invertébrés, ont manipulé l’environnement d’éclairage pour affecter l’apparence des couleurs des individus vivants13,14,15,16, 17. toutes ces manipulations, tout en étant ingénieuses, ont l’inconvénient de supprimer un comportement naturel potentiellement important et/ou d’affecter beaucoup plus que le trait d’intérêt. Chez les grands vertébrés, comme les oiseaux, les chercheurs manipulent très souvent la couleur directement sur les animaux vivants (examinés dans Hill et McGraw, 200618). Des plumes ou des becs individuels ont été directementcolorés avec des marqueurs2,19,20,21,22,23,24, colorants contenant du peroxyde d’hydrogène souvent utilisé dans les éclaircisseurs de cheveux25,26,27, ou diverses peintures y compris vernis à ongles28. Chez les invertébrés, ces études qui manipulent les motifs de couleur directement sur les animaux vivants sont comparativement rares mais ont encore fourni un aperçu immense de la fonction et de l’évolution de la couleur29,30,31 ,32,33,34,35,36,37,38,39. Même les études d’arthropodes semblent être biaisées vers des taxons plus grands qui peuvent être plus facilement manipulés et peints, laissant des modèles de couleur dans les espèces très petites relativement sous-étudiées.
Ici, nous décrivons une technique délicate de manipulation des couleurs qui a été développée pour les très petits taxons d’animaux. Plus précisément, cette méthode consiste à manipuler la coloration faciale des araignées sautantes mâles sous un microscope afin d’étudier l’importance de ces traits colorés dans le contexte du choix du compagnon et du cannibalisme sexuel. Dans ce cas, nous avons utilisé Habronattus pyrrithrix (recueilli à partir de Phoenix, AZ, USA) comme une espèce modèle (figure 1). Nous avons publié les résultats du travail expérimental en utilisant certaines de ces techniques ailleurs38,39, mais ici, nous décrivons les méthodes plus en détail que ce qui a été fait précédemment, d’une manière qui devrait les rendre accessibles à d’autres en essayant de les reproduire ou de les adapter pour les utiliser sur d’autres très petits taxons. Ces protocoles devraient ouvrir des possibilités expérimentales sur les animaux qui peuvent être aussi colorés que les oiseaux les plus emblématiques, mais qui sont généralement sous-étudiés.
Protocole
1. préparation de l’équipement
- Sélectionnez les peintures appropriées.
- Pour une application réussie, utilisez des peintures qui sont à séchage rapide et ont une texture qui est facilement manipulé avec plus mince. Les produits qui ont été utilisés avec succès comprennent des liners non imperméables qui peuvent être éclaircis avec de l’eau, et des peintures d’émail qui peuvent être éclaircis avec l’émail diluant (table des matières).
- Lorsque vous peignez des araignées, considérez que la carapace de la plupart des espèces a un exosquelette endurci tandis que l’abdomen mou s’étire et se constricte avec l’alimentation40.
- Les peintures émaillées produisent un revêtement solide et trempé sur la surface peinte; par conséquent, appliquez-les sur des parties dures de la cuticule (p. ex. carapace, pattes, pédipalpes). Ces revêtements en émail sont moins efficaces pour les abdomen d’araignée parce qu’ils décollent de l’araignée que l’abdomen change de forme avec l’alimentation.
- En revanche, les liners ne produisent pas un revêtement trempé, mais plutôt s’infiltrer dans les écailles de corps colorées; en tant que tels, utilisez-les sur les parties du corps dur et mou (y compris les abdomen d’araignée).
Note: dans les prochaines étapes, la technique la plus délicate est présentée qui consiste à peindre le visage et les pédipalpes des araignées; la peinture d’émail est employée, qui est la méthode la plus généralisable en raison de la diversité de couleur de la peinture d’émail disponible.
- Avant d’expérimenter des peintures sur des animaux vivants, si possible, mesurez d’abord les propriétés spectrales de la peinture (simplement appliquée sur du papier ou une autre surface) à l’aide d’un spectrophotomètre UV-VIS de réflectance pour s’assurer qu’il n’y a pas de pics UV indésirables dans le spectre qui serait invisible pour les humains, mais peut-être visible pour les espèces étudiées.
- Utilisez un microscope de dissection relié à une caméra et un ordinateur pour prendre plus facilement des photos du résultat de la manipulation pour la documentation et l’augmentation de la reproductibilité (table des matières).
- Allumez le microscope, l’ordinateur et le logiciel qui traitent l’entrée de la caméra.
- Sélectionnez le zoom pertinent auquel l’image finale sera prise.
- Collez une épingle de montage d’insectes ou un petit clou (avec la tête pointée vers l’extérieur) dans une boule de pâte à modeler non durcissante (approximativement la taille d’un raisin). (L’araignée vivante à peindre sera provisoirement montée à la tête de cette épingle à l’étape 3,1 ci-dessous). Placez l’argile de modélisation et la goupille sous le microscope pour ajuster les objectifs de sorte qu’ils se concentrent grossièrement sur la tête de la goupille (où l’araignée doit être montée).
- Assurez-vous que les objectifs sont à la bonne distance pour les yeux du peintre, et que la caméra n’entrave pas le champ de vision pendant la peinture (comme c’est le cas si la caméra est montée dans l’un des oculaires, entravant la perception de la profondeur).
- Transférer l’araignée dans un flacon en plastique propre (environ 12 drams, sans sangle ni proie morte).
- Préparez l’équipement de montage et de peinture.
- Placez une épingle de montage d’insectes extra-minces dans une boule de pâte à modeler non durcissante (en plus de celle utilisée à l’étape 1.2.3) et placez-les sur le côté gauche du microscope (pour les droitiers). Cette goupille sera utilisée pour ajuster doucement les positions des pattes de l’araignée et des pédipalpes (au besoin) pendant la peinture.
- Obtenez un petit morceau de papier absorbant (tel qu’une serviette en papier), un morceau de papier blanc d’imprimeur, les peintures pour appliquer (ici, la peinture d’émail), des récipients distincts de diluant de peinture (un pour chaque couleur plus un gardé transparent et propre), micro brosses individuelles pour chaque couleur (voir tableau des matériaux), et un micro brosse pour être utilisé uniquement avec un diluant propre, tous positionnés de façon organisée à droite du microscope (pour les droitiers).
- À l’aide d’un cure-dent, ajouter une goutte de peinture dans un plat en plastique ouvert (comme une petite boîte de Petri ou un bouchon de flacon) et ajouter diluant de peinture, par exemple avec une petite seringue. Mélanger les deux avec le cure-dent à la bonne consistance (lorsque la peinture est complètement homogénéisée, mais pas trop Runny) en le testant sur le papier blanc de l’imprimante avec une brosse micro.
Remarque: dans certains cas, si la peinture sèche rapidement, préparez-la avec un peu plus de liquide que désiré pour l’application, et laissez les brosses tremper dans le pot de diluant de peinture jusqu’à l’utilisation ultérieure (étape 4). - Placez une goutte de colle à base d’eau (voir tableau des matériaux) dans un coin du papier de l’imprimante.
NOTE: ce doit être la dernière étape de la préparation et l’étape suivante doit se produire immédiatement après cela, de sorte que la colle ne sèche pas.
2. anesthésiant l’araignée
- Avec l’araignée dans le flacon et une main couchée sur l’ouverture pour éviter l’évasion, ajouter lentement CO2 gaz jusqu’à ce que la troisième paire de jambes de l’araignée s’étend à 180 degrés.
- Utiliser une période d’exposition au CO2 d’environ 20 secondes à 1,5 minutes, en fonction de la taille moyenne de l’espèce et de l’araignée individuelle. Nous avons trouvé l’extension de la troisième paire de jambes pour être un indicateur fiable du niveau approprié de l’anesthésie dans H. pyrrithrix, mais cela varie probablement d’une espèce à l’autre. Si vous utilisez ces techniques avec une espèce différente pour la première fois, testez d’abord l’anesthésie sur quelques spécimens pour évaluer leur réponse.
- Donnez aux araignées le moins de CO2 possible pour atteindre le niveau d’anesthésie nécessaire. Alors que les courtes périodes d’anesthésie décrites ici n’ont produit aucune mortalité (et aucune différence de comportement notable des araignées non anesthésiées), donnent à tous les animaux dans une expérience des niveaux égaux d’anesthésie (y compris les contrôles factices).
- Garder le flacon fermé après avoir ajouté CO2 pour maintenir l’araignée sous anesthésie; par conséquent, incluez cette heure lors du calcul de la durée d’exposition de l’araignée au CO2.
- Une fois que l’araignée a été retirée du flacon pour commencer la manipulation des couleurs, elle restera complètement anesthésiée pendant environ 1 à 2 minutes; par conséquent, effectuez les étapes suivantes (sections 3-6) rapidement. En raison de cette fenêtre de temps limitée, essayez la méthode de peinture suivante avec des spécimens morts d’abord (pour la pratique) avant de tenter de peindre des araignées vivantes.
3. montage de l’araignée sous le microscope
- Ajouter une très petite quantité de colle sur la tête de la goupille de montage ou de l’ongle dans l’argile de modélisation préparée dans le champ de vision du microscope.
NOTE: utilisez la plus petite quantité de colle qui permet de maintenir l’araignée en place pour s’assurer que i) l’araignée ne glisse pas hors de la tête d’épingle (si trop de colle est utilisée), et II) l’araignée parvient à se libérer après se réveiller. - Glissez doucement l’araignée anesthésiée de son flacon sur la table avec son côté ventrale vers le haut.
NOTE: parce que les araignées’abdomen sont douces, il faut prendre soin de ne pas taper ou déposer les araignées sur la table, car cela pourrait causer des blessures. - Presser doucement la tête d’épingle (avec de la colle) sur le sternum de l’araignée (la zone centrale où les pattes de l’araignée s’attachent au corps) de telle sorte que l’araignée rebondira légèrement et étende ses jambes sous la petite pression appliquée. Pour un contrôle supplémentaire de la pression appliquée, tenez l’argile de modélisation avec les deux mains, ayant les deux mains stabilisé fermement contre la table.
- Repositionner l’argile à modeler sous le microscope afin que la zone à peindre soit orientée vers le haut et la mise au point.
4. peindre l’araignée
- Évaluez la consistance de la peinture avant de toucher le pinceau à l’araignée.
- Retestez la consistance de la peinture (utilisez le papier absorbant pour essuyer les brosses si elles ont été maintenues dans le diluant), ajustez à nouveau si nécessaire, et toujours d’abord essayer d’appliquer de la peinture sur le papier de l’imprimante pour contrôler la quantité de peinture contenue dans les poils de brosse.
- Avec la main droite et tout en regardant à travers le microscope, apportez la pointe de la brosse dans le champ de vision, et assurez-vous (une seconde fois) que les poils de la brosse ne contiennent pas trop de peinture, dans ce cas, essuyez-en une partie sur le papier de l’imprimante.
- Testez la consistance de la peinture sur l’araignée.
- Touchez l’araignée avec la brosse sur la plus grande zone qui devra être peinte plus. Cela informera le peintre si la consistance et la quantité de peinture est bonne (c.-à-d., quand la peinture légèrement et lentement s’enfile dans les cheveux/écailles de l’araignée).
- Si aucune peinture n’est appliquée, faites tremper la brosse dans la peinture et revenez à l’étape 4,1 pour répéter la procédure.
- Si la peinture s’enfile rapidement et se renverse sur une zone qui ne doit pas être recouverte par la peinture, et en supposant que le déversement est minime et que l’individu peut encore prendre part à l’expérience, essuyez la brosse sur le papier absorbant et revenez à l’étape 4,1 pour répéter la procédure.
Remarque: ce type de déversement de liquide ne peut pas être fixé. Si le déversement atteint les chélicères ou les yeux, ou d’autres parties qui pourraient être mortelles ou toxiques pour l’individu, envisagez de placer l’araignée immédiatement dans le congélateur pour l’euthanasier avant qu’il ne se réveille et l’exclusion de l’araignée de l’expérience.
- Touchez l’araignée avec la brosse sur la plus grande zone qui devra être peinte plus. Cela informera le peintre si la consistance et la quantité de peinture est bonne (c.-à-d., quand la peinture légèrement et lentement s’enfile dans les cheveux/écailles de l’araignée).
- Peindre toutes les zones qui ont besoin de couleurs suivant les étapes 4,1 et 4,2.
- Si vous peignez le visage de l’araignée, utilisez la goupille extra-fine avec la main gauche pour maintenir les pattes avant et les pédipalpes (de sorte qu’ils soient hors de la voie du pinceau). Ceci est mieux fait en regardant à travers le microscope pour éviter d’endommager les appendices de l’araignée. En outre, si la peinture de la face de l’araignée, et en fonction des pinceaux utilisés pour peindre, envisager de peindre les deux côtés du visage avant d’essayer de peindre la partie centrale entre les yeux-les deux zones peintes peuvent être jointes en tenant la brosse parallèle à la face de l’araignée et induisant une action capillaire.
NOTE: lorsque vous peignez le visage de l’araignée, il est plus facile d’abord peindre le côté le plus proche de la main dominante, puis tournez la boule d’argile (avec l’araignée montée) autour sous le microscope pour peindre l’autre côté, suivi par le milieu. - Lorsque vous peignez des pédipalpes ou des jambes, assurez-vous de ne pas toucher les articulations si la peinture est un durcissement (comme la peinture émaillée), et assurez-vous de ne pas appliquer de la peinture aux organes de l’accouchement du sperme du mâle (sur la face inférieure du segment distal des pédipalpes).
- Si vous peignez le visage de l’araignée, utilisez la goupille extra-fine avec la main gauche pour maintenir les pattes avant et les pédipalpes (de sorte qu’ils soient hors de la voie du pinceau). Ceci est mieux fait en regardant à travers le microscope pour éviter d’endommager les appendices de l’araignée. En outre, si la peinture de la face de l’araignée, et en fonction des pinceaux utilisés pour peindre, envisager de peindre les deux côtés du visage avant d’essayer de peindre la partie centrale entre les yeux-les deux zones peintes peuvent être jointes en tenant la brosse parallèle à la face de l’araignée et induisant une action capillaire.
5. prendre l’image de l’araignée
- Basculez l’objectif sur le mode caméra.
- Prenez une photo en utilisant le logiciel, en vous assurant que le zoom choisi est celui sélectionné sur le microscope, de sorte qu’une barre d’échelle peut être ajoutée.
6. libérer l’araignée de la goupille ou de l’ongle
- Lorsque l’araignée commence à bouger, tenez la goupille de sorte que les pattes avant de l’araignée touchent le flacon de l’araignée.
- Laissez l’araignée se relâcher, et si nécessaire, inclinez doucement la goupille pour aider l’araignée à se retirer de la colle séchée.
- Si l’araignée se réveille avant que la peinture soit terminée, laissez l’araignée au moins 15 minutes pour récupérer avant d’être anesthésiée à nouveau. Si cela est fait, assurez-vous que tous les groupes obtiennent les mêmes niveaux d’anesthésie (y compris les individus traités de manière factice, le cas échéant).
NOTE: les araignées semblent reprendre leur comportement normal rapidement après la manipulation (< 15min) mais nous recommandons un temps de repos normalisé de 12 heures avant d’utiliser l’araignée dans un test comportemental.
- Si l’araignée se réveille avant que la peinture soit terminée, laissez l’araignée au moins 15 minutes pour récupérer avant d’être anesthésiée à nouveau. Si cela est fait, assurez-vous que tous les groupes obtiennent les mêmes niveaux d’anesthésie (y compris les individus traités de manière factice, le cas échéant).
7. analyse du comportement des araignées
- Comparez le comportement des sujets non manipulés, traités simulés et manipulés pour évaluer la toxicité potentielle de l’application (qui peut varier selon le type de peinture, la couleur, la zone d’application et les espèces étudiées). Le comportement pertinent à comparer pourrait inclure le taux d’activité, le type d’activité effectuée, le succès dans l’exécution d’activités spécifiques (par exemple, capturer des proies), etc.
- Utiliser des araignées simulées dans le cadre de la conception expérimentale (par exemple, recevoir l’application de peinture sur une zone non visible ou avoir des peintures de couleur neutre appliquées aux mêmes zones) afin de ne changer que la couleur de l’individu tout en contrôlant pour autres facteurs (p. ex. temps de manutention, odeur, texture de surface, etc.).
Remarque: Si vous peignez des jambes ou des pedipalps, considérez la possibilité que cela puisse interférer avec les poils sensoriels (répandus sur les pattes d’araignée et les pedipalps, voir Foelix 201040) et, dans ces cas, les mâles traités par simulacre doivent avoir des peintures de couleur neutre appliquées à la les mêmes zones qu’un contrôle. - Lors du développement de nouvelles méthodes, comparez les araignées peintes avec des araignées non manipulées pour évaluer si les individus manipulés par la couleur se comportent toujours normalement.
- Utiliser des araignées simulées dans le cadre de la conception expérimentale (par exemple, recevoir l’application de peinture sur une zone non visible ou avoir des peintures de couleur neutre appliquées aux mêmes zones) afin de ne changer que la couleur de l’individu tout en contrôlant pour autres facteurs (p. ex. temps de manutention, odeur, texture de surface, etc.).
8. mesure des propriétés de réflectance de la manipulation des couleurs sur le sujet peint
- Une fois euthanasiés (après que les araignées aient été impliquées dans une expérience ou spécifiquement euthanasiées à cet effet, voir note ci-dessous), mesurez les propriétés spectrales de la manipulation des couleurs à l’aide d’un spectrophotomètre UV-VIS portatif standard (tableau des matériaux ), en particulier pour les zones de plus de 1 mm de diamètre.
- Pour les zones plus petites, utilisez un microspectrophotomètre sur mesure (un spectrophotomètre UV-VIS acheminé à travers un microscope) pour des mesures plus faciles et plus précises, bien que l’optique du microscope découpe la lumière UV, ce qui signifie que les mesures sont limitées à la les longueurs d’onde humaines visibles (voir Taylor et al. 2011 à41).
- Dans les cas où les zones manipulées par des couleurs sont extrêmement petites et les données de réflectance UV sont nécessaires, utilisez des microspectrophotomètres UV-VIS disponibles dans le commerce, bien qu’ils soient plus coûteux (voir Taylor et al. 201442).
Remarque: la source lumineuse des spectrophotomètres UV-VIS contient de la lumière UV et peut être dangereuse pour les yeux des animaux (y compris les nôtres), de sorte que les mesures spectrales ne doivent être effectuées que lorsque les animaux sont euthanasiés et non simplement anesthésiés. Pour les araignées peintes en émail, cela peut être fait après que les araignées ont été utilisées dans des expériences puisque la peinture ne s’use pas (voir les résultats représentatifs ci-dessous). Pour la peinture à base d’eau qui peut parfois s’estomper après des jours ou des semaines, un ensemble d’araignées pourrait être sacrifié pour la mesure au moment où leur homologue serait impliqué dans une expérience (pour capturer des données qui reflètent la manipulation de couleur réelle utilisée dans le expérience). La déclaration des propriétés spectrales des peintures permettra la réplication par d’autres chercheurs qui peuvent vouloir reproduire la manipulation des couleurs, mais n’ont pas accès aux mêmes produits de peinture spécifiques.
Résultats
Efficacité de la manipulation des couleurs
En utilisant ces techniques, différents degrés de manipulation des couleurs sont efficaces, y compris la dissimulation des couleurs complètement ou de réduire ou d’améliorer leur intensité. Ceci est évident à la fois des photographies et des mesures de réflectance spectrale (figure 2, figure 3et figure 4). Nous montrons ici le mâle Habronattus pyrrithrix manipulé en couleur par rapport aux mâles naturels à face rouge. Les propriétés spectrales ont été mesurées à l’aide d’un spectrophotomètre UV-VIS (voir tableau des matériaux) qui peut mesurer précisément les zones colorées aussi petites que 1mm de diamètre. Des mesures ont été prises par rapport à un étalon blanc de réflectance diffuse (voir tableau des matériaux).
En de rares occasions (5 des 108 mâles peints avec un eyeliner noir 1 (voir le tableau des matériaux) sur leur visage), l’eyeliner soluble dans l’eau a commencé à porter les visages des araignées après une semaine ou deux. Cela n’a pas été observé pour l’autre marque d’eyeliner (eyeliner 2; voir tableau des matériaux). Dans les deux cas, les cages d’araignée ont été pulvérisées avec de l’eau trois à cinq fois par semaine. Différentes conditions d’entretien peuvent affecter l’usure de la peinture à base d’eau. La peinture émaillée était encore intacte pour tous les mâles manipulés (n = 221), même pour ceux qui étaient encore vivants après 6 mois.
Toxicité potentielle de la manipulation des couleurs
Il faut éviter d’obtenir de la peinture sur les yeux des araignées afin de ne pas obstruer leur vision, ni sur leurs chelicerae, les parties de la bouche et d’autres orifices, et peut-être d’autres parties du corps mou pour empêcher l’ingestion et l’empoisonnement possibles. Il faut également faire attention avec les joints de peinture ou les parties qui contiennent des poils sensoriels (tels que les jambes et les pedipalps) afin de ne pas restreindre leur mobilité ou système sensoriel. Cependant, si de telles manipulations de couleur sur ces régions du corps sont nécessaires, ou s’il y a un doute sur la possibilité d’effets négatifs subtils, il est alors préférable d’appliquer des peintures à des individus dans toutes les catégories de traitement. De cette façon, on éviterait de manipuler involontairement les systèmes sensoriels des individus d’une manière qui pourrait être partial contre l’un des traitements seulement. Par exemple, dans une expérience utilisant des mâles manipulés dans la figure 4, l’objectif était d’augmenter et de diminuer le nombre de taches rouges affichées par les mâles pendant la parade nuptiale. Puisque certains mâles obtiennent leurs visages rouges naturels dissimulés avec la peinture d’émail gris (pour diminuer la quantité de rouge affichée), les autres mâles pour lesquels nous voulions maintenir un visage rouge ont été peints rouge sur leur visage naturellement rouge avec le même produit que le gris-face Mâles. De même, puisque nous voulions ajouter des taches rouges au Pédipalpe sur certains mâles pour augmenter la quantité de taches de couleur rouge affichées, la peinture grise a été utilisée pour couvrir le Pédipalpe d’autres mâles de sorte que tous les mâles seraient peints sur cette zone sensible (voir figure 4) . Bien qu’il soit préférable, cette stratégie n’est peut-être pas toujours réalisable. Par exemple, dans une autre expérience, la coloration rouge a été enlevée en utilisant un eyeliner noir donnant la même propriété spectrale que la cuticule sous-jacente du mâle, tout en laissant les autres couleurs mâles intactes et naturelles (figure 2). Dans ce cas, pour les mâles à la recherche naturelle, la même quantité d’eyeliner a été appliquée à la zone sur le dessus de leur carapace juste derrière leurs yeux médiane antérieurs (une zone qui n’est pas clairement visible pour les femelles), pour contrôler l’odeur potentielle ou la toxicité globale de la produit. Cependant, l’endroit où la peinture est appliquée peut affecter les araignées différemment. Par conséquent, pour évaluer les différences subtiles dans la façon ou l’emplacement où la peinture a été appliquée peut avoir sur l’intégrité de l’araignée, le comportement des deux types de mâles dans un contexte qui était pertinent à nos hypothèses (par rapport au choix de contrainte et le cannibalisme sexuel) a été comparé. Les mâles ont été mis deux par deux en présence d’une femelle, et nous avons comparé leur retard pour devenir actifs, leur retard à Courter, et la durée totale qu’ils ont passé à Courter avec des modèles linéaires à effet mixte linéaire (en utilisant la fonction de l’ensemble R lme443 dans R version 3.5.244 avec l’identité féminine comme un effet aléatoire, et en utilisant le critère de probabilité maximale pour obtenir des valeurs de p). Dans ce cas, toutes les comparaisons ne révèlent aucune différence entre les traitements (voir le tableau 1) et il a donc été conclu que nous n’avons pas introduit de partialité en faveur de l’une ou l’autre catégorie de traitement.
Dans les deux cas, lorsqu’ils ont des catégories de traitement très similaires (figure 4), ou seulement des individus traités par simulacre (figure 2 et figure 3), les chercheurs doivent évaluer la façon dont leurs espèces modèles sont affectées par la peinture qu’ils utilisent et s’assurer que ils se comportent toujours de manière similaire et écologiquement pertinente. On pourrait enregistrer des données pour évaluer les effets possibles de la toxicité autant que possible, par exemple en comparant les taux d’activité entre les individus traités et non manipulés. Nos araignées peintes avec de la peinture émaillée comme dans la figure 4 ont été comparées aux mâles non manipulés dans un contexte autrement identique. Plus précisément, les mâles ont été introduits individuellement dans une cage femelle et leur retard à quitter le flacon, à retarder le cours et à Courter le taux (avant la copulation, et avant d’être attaqué ou cannibalisé) ont été comparés. Aucune différence n’a été constatée (lors de l’utilisation de modèles d’effets mixtes linéaires similaires comme ci-dessus) et nous avons donc conclu que nos mâles peints se comportaient naturellement (tableau 2).
Enfin, il est important de noter que toutes les araignées dans les expériences (généralement les femelles) qui cannibalisé les mâles manipulés par la couleur n’ont jamais semblé souffrir d’effets négatifs. Les araignées digèrent leurs proies extérieurement, laissant généralement les zones peintes de la cuticule derrière. Toutefois, si l’on adapte cette méthode pour d’autres systèmes où les animaux manipulables en couleur seront consommés, on devrait évaluer les risques potentiels de toxicité.

Figure 1 . Mâle adulte Habronattus pyrrithrix illustrant comment minuscules de leurs régions de corps de couleur sont. Photographié par Lyle Buss. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
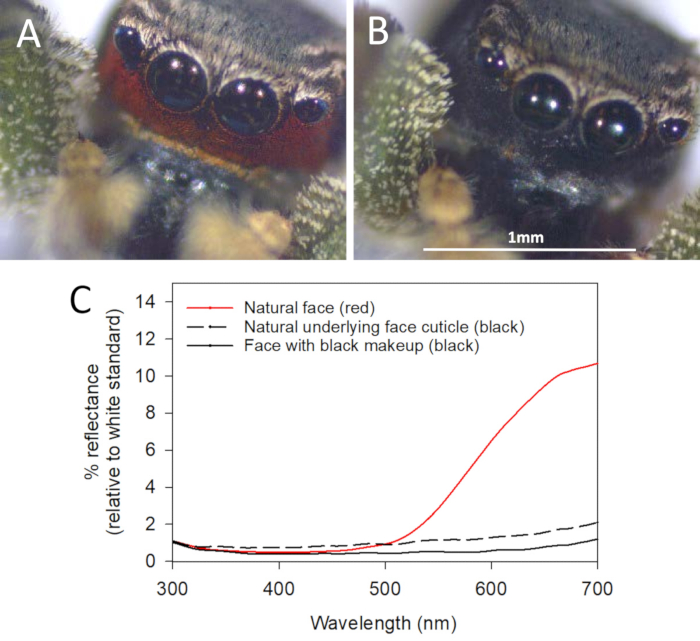
La figure 2 . Manipulation expérimentale des couleurs utilisée pour dissimuler la coloration faciale rouge chez Habronattus pyrrithrix. (A) la coloration faciale rouge intacte avant la manipulation des couleurs. (B) la coloration faciale du même mâle après avoir dissimulé la coloration rouge naturelle avec l’eyeliner noir 1. (C) spectres de réflectance représentatifs pour la face rouge naturelle, la cuticule noire sous-jacente naturelle et le visage rouge peint avec un eyeliner noir 2. Modifié de Taylor et McGraw 201339. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
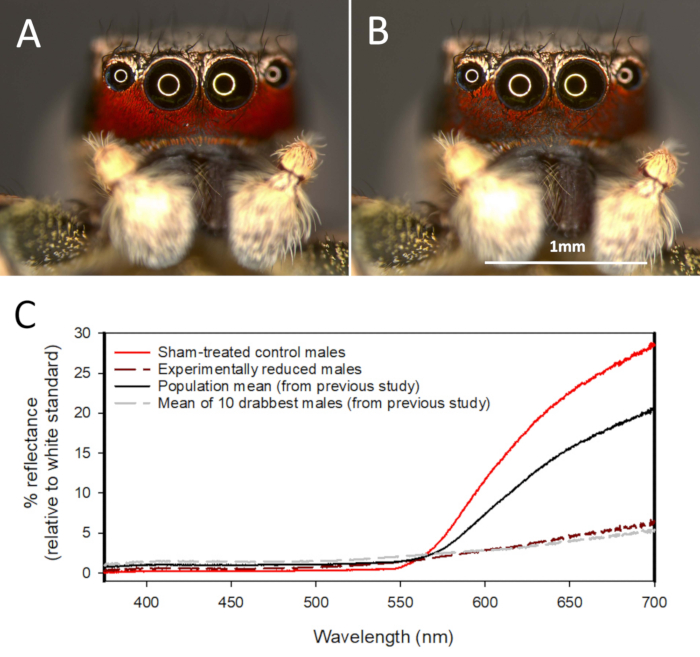
Figure 3 . Manipulation expérimentale de la couleur utilisée pour réduire la taille et la rougeur du patch facial rouge du mâle Habronattus pyrrithrix. (A) la coloration faciale rouge intacte avant la manipulation des couleurs. (B) la coloration faciale du même mâle après application de l’eyeliner noir dilué (Urban Decay) à la partie avant du visage, et de l’eyeliner noir non dilué le long des bords de la tache faciale pour réduire la taille de la zone rouge. (C) les courbes spectrales moyennes des mâles témoins traités simulés (n = 21) et des mâles manipulés en couleur (n = 21), comparativement à la moyenne de la population (n = 57) et aux 10 hommes les plus drabmeilleurs d’une étude précédente41. Figure reproduite dans Taylor et al. 201438. S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
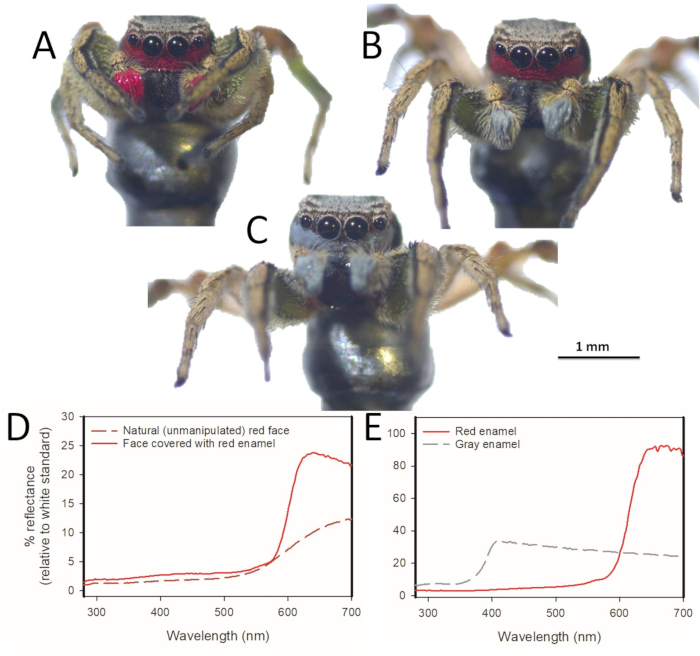
Figure 4 . Manipulation expérimentale de la couleur utilisée pour modifier la couleur du patch facial rouge du mâle Habronattus pyrrithrix. Habronattus pyrrithrix mâles peints avec (A) rouge, (B) rouge et gris, et (C) peinture émaillée grise sur leur visage rouge naturel et pedipalps naturellement de couleur crème. (D) les courbes spectrales moyennes pour les mâles non manipulés (n = 9) et les mâles dont le visage est recouvert de peinture émaillée rouge (n = 9). En appliquant un rouge plus brillant sur le visage de l’araignée, nous avons efficacement amélioré sa coloration faciale rouge. Parce que la peinture en émail couvre entièrement les échelles sous-jacentes, la couleur pourrait également être changée entièrement, comme c’est le cas avec l’émail gris. (E) dans cette expérience, les peintures en émail rouge et gris ont été choisies pour être appariées pour la luminosité totale (réflectance totale sur la gamme des longueurs d’onde visibles à ces araignées). Les différences dans l’échelle des axes Y en D et E sont dues à des techniques différentes (comme la distance par rapport à l’échantillon et la taille des zones mesurées) pour mesurer des échantillons de couleur sur papier (E) par rapport aux mesures directes des couleurs sur la face de l’araignée (D). S’il vous plaît cliquez ici pour voir une version plus grande de ce chiffre.
| n | Variable dépendante | page | T | Face rouge | ± SE | Face noire | ± SE | la nFID |
| 202b | Retard mâle pour laisser le plat | 0,35 | -0,93 | 140,0 | 23,9 | 109,8 | 23,9 | 102 |
| 179c | Retard masculin à la Cour | 0,74 | 0,33 | 983,4 | 127,1 | 1031,0 | 126,5 | 95 |
| 204a | Effort de Cour de mâle | 0,52 | 0,63 | 181,2 | 24,4 | 203,0 | 24,4 | 102 |
| 204a | Effort de la Cour masculine avant toute attaque | 0,41 | 0,68 | 89,0 | 15,7 | 97,5 | 15,7 | 102 |
Tableau 1. Effet de la manipulation de la couleur du visage masculin sur le comportement, lorsqu’il est peint avec eyeliner noir contre Sham traitée (figure 2). La structure de chaque modèle est donnée, ainsi que les estimations moyennes en secondes (± SE) pour chaque groupe de traitement. N = nombre de mâles, p et t = valeur de p et valeur t pour le traitement masculin, nFID = le nombre de niveaux dans l’identité féminine à effet aléatoire. un Sur les 104 tests masculins effectués, 102 ont été enregistrés avec succès, conduisant à 204 mâles uniques observés. b2 mâles ont été cannibalisés par la femelle avant de sortir de la boîte de Petri. c25 mâles ont été cannibalisés par la femelle avant de toujours Courter la femelle.
| n | Variable dépendante | page | T | Non manipulés | ± SE | Peint | ± SE |
| 32a | Retard mâle pour laisser le plat | 0,87 | -0,17 | 380,8 | 143,1 | 345,4 | 152,4 |
| 31b | Retard masculin à la Cour | 0,93 | -0,09 | 502,6 | 105,8 | 488,1 | 116,6 |
| 31b | Effort de Cour de mâle | 0,74 | -0,33 | 2324,3 | 455,0 | 2102,1 | 484,4 |
| 31b | Effort de la Cour masculine avant toute attaque | 0,68 | 0,42 | 1495,1 | 450,8 | 1770,1 | 479,9 |
Tableau 2. Effet de la manipulation de la couleur du visage masculin sur le comportement, lorsqu’il est peint avec de la peinture émaillée rouge ou grise (n = 15, figure 4) contre les mâles non manipulés (n = 17). La structure de chaque modèle est donnée, ainsi que les estimations moyennes en secondes (± SE) pour chaque groupe de traitement. N = nombre de mâles, p et t = valeur de p et valeur t pour le traitement masculin. a17 mâles non manipulés ont été comparés à un sous-ensemble de tous les mâles peints dans notre expérience (n = 221). Plus précisément, ils ont été comparés à 15 mâles peints (5 rouges (figure 2a), 5 rouges et gris (figure 2b) et 5 gris (Figure 2c)) testés dans le même contexte (en présence d’une femelle) et dans la même période de temps spécifique. C’est important parce que les mâles non manipulés ont été testés vers la fin de l’expérience (en août et septembre 2018), ce qui correspond à la fin de leur saison de reproduction naturelle et où les mâles sont généralement moins actifs. Garder toutes ces autres variables égales nous permet de comparer le traitement de la peinture sans introduire d’autres préjugés. b Un mâle (tout gris) a été cannibalisé avant de toujours Courter la femelle.
Discussion
Ici, nous montrons que les couleurs des petites parties du corps des arthropodes peuvent effectivement être manipulées en utilisant des colorants tels que les peintures de maquillage et d’émail.
La première étape cruciale pour réaliser une telle manipulation délicate est de pouvoir immobiliser les petits animaux qui ne peuvent généralement pas être retenus dans la main. Ici, pour pouvoir peindre des zones sensibles comme le visage de l’araignée sautante, nous avons anesthésié les individus avec CO2 et les avons montés sur la tête d’une épingle. Cela permet de travailler près des yeux de l’araignée avec moins de stress que l’araignée aurait probablement l’expérience si elle était éveillée (avec la lumière du microscope qui brille dans leurs visages pendant le processus de peinture).
La méthode exige également obtenir des micro brosses de bonne qualité, et, plus critique, des substances de coloration appropriées. L’étape la plus difficile dans l’application de la peinture sans déversement, mais avec une bonne couverture est d’obtenir la bonne consistance. Par conséquent, les substances de coloration doivent être facilement diluées avec un diluant, et facilement séché pour l’épaississement. Différents types de peintures pourraient être utilisés; ici, les résultats sont présentés avec des liners hydrosolubles (non étanches) et des peintures émaillées. Les liners non étanches ont l’avantage d’être facilement liquéfiés lorsqu’ils sont mélangés avec de l’eau. Cependant, cela se négocie avec la dilution de la pigmentation (qui ne peut pas ou peut être souhaitable (voir par exemple figure 3)). Les peintures émaillées ont une consistance qui peut facilement être contrôlée en ajoutant l’émail diluant, tout en offrant une couverture complète. Toutefois, cette caractéristique se négocie avec la possibilité de maintenir les cheveux ou la structure de l’échelle de la partie du corps peinte. En outre, les peintures émaillées sont de longue durée. L’inconvénient est que la peinture d’émail et de diluant émettent des odeurs fortes pendant l’application et avant de sécher. Une difficulté supplémentaire concernant les substances de coloration peut être de trouver l’ombre droite, avec les propriétés spectrales droit. Il est par exemple difficile d’obtenir eyeliner rouge à utiliser en parallèle avec eyeliner noir, comme les liners sont souvent plus rose que le rouge. Il est également difficile d’obtenir de la poudre de maquillage (ou des pigments) qui ne contiennent pas de paillettes (qui peut parfois être seulement visible sous le microscope). De nombreux produits de maquillage reflètent également la lumière UV qui, tout en étant invisible pour les expérimentateurs, pourrait être visible pour les animaux étudiés.
Manipuler la coloration des arthropodes en appliquant directement des colorants sur leurs parties du corps est livré avec des avantages et des inconvénients par rapport à d’autres méthodes. Sa principale limitation est qu’on ne peut absolument pas rejeter la possibilité de certains effets de toxicité subtile. Cependant, on peut s’assurer de ne pas introduire de biais contre un groupe de traitement en appliquant de la peinture à toutes les catégories de traitement, et/ou on peut tester si l’application de peinture interfère avec des comportements d’intérêt. Avec les méthodes présentées ici, nous avons recueilli suffisamment de preuves pour suggérer que l’application de peinture a conduit à négligeable à aucun effet négatif (tableau 1 et tableau 2). Le principal avantage de cette méthode est que de minuscules taches de couleur peuvent être ciblées, leur couleur «enlevé» (voir figure 2), fait plus terne (figure 3) ou plus lumineux (figure 4), en isolement du reste de la coloration du corps et de la personne l'environnement. Cela contraste avec la méthode alternative la plus courante qui consiste à manipuler les conditions d’éclairage, et ainsi à modifier l’apparence visuelle de l’individu entier et de son environnement. En fait, même lorsqu’ils ne manipulent pas spécifiquement les conditions d’éclairage, on peut manipuler avec succès la couleur et voir limité ou aucun effet de cette manipulation si l’environnement d’éclairage n’est pas approprié39. Par conséquent, il est important de mesurer et de tenir compte de l’environnement de lumière où des expériences seront effectuées (c.-à-d., mesurer l’irradiance) et de s’assurer de la faire correspondre étroitement aux conditions d’éclairage naturel (par exemple en utilisant des ampoules à spectre complet qui imitent lumière naturelle en captivité). Dans l’ensemble, en utilisant des micro-brosses et un microscope, ce protocole permet une manipulation plus précise de minuscules patchs de couleur que la plupart des autres méthodes de coloration directe qui ont été utilisées précédemment sur les invertébrés. La plupart des études antérieures ont utilisé des animaux avec des patchs de couleur qui sont relativement grands par rapport aux visages des araignées sautantes (par exemple, manipulation des couleurs d’aile de papillon29,34,35, les corps de l’adulte Hémiptères ('vrais bugs')30,36 et sauterelles31, ou les pattes des araignées de loup relativement grandes32,33,37). Les méthodes présentées ici ouvrent des possibilités d’étudier la diversité étonnante des patchs de couleur sur les taxons qui sont sous-étudiés en raison de leur petite taille.
Des techniques similaires pourraient être appliquées à d’autres arthropodes qui peuvent être immobilisés ou anesthésiés et pour les zones où la peinture n’affecterait pas la mobilité ou la santé de l’individu (c.-à-d., à l’exclusion des zones telles que les articulations, les structures telles que les cheveux ou les arolia qui sont nécessaires pour la locomotion appropriée, les parties buccales ou d’autres orifices tels que les structures respiratoires). Ces techniques peuvent également être étendues pour inclure une plus grande palette de colorants, de peintures et de maquillages qui sont largement disponibles.
Enfin, ces techniques délicates pourraient être utilisées non seulement pour manipuler la couleur sur les petits organismes, mais aussi pour manipuler des modèles (tels que des rayures) dans des organismes relativement plus grands. Cela devrait être bénéfique pour une grande variété de chercheurs qui peuvent adapter nos méthodes à leurs propres études sur la sélection sexuelle, la communication, les signaux de proies aposématiques, et d’autres contextes dans lesquels les animaux utilisent la couleur.
Déclarations de divulgation
Les auteurs n’ont rien à divulguer.
Remerciements
Ce travail a été appuyé par le financement de la National Science Foundation (IOS-1557867 à LAT), le Musée de la Floride d’histoire naturelle, et le département d’entomologie et de nématologie de l’Université de Floride. Les frais de publication de cet article ont été financés en partie par le Fonds d’édition Open Access de l’Université de Floride.
matériels
| Name | Company | Catalog Number | Comments |
| CO2 tank | AirGas (Radnor, PA) | #CD 50 | to anesthesize spiders |
| Enamel paint thinner | Testors (Vernon Hills, IL) | 75611792569 | to thin enamel paint |
| Flat enamel paint | Testors (Vernon Hills, IL) | red: 075611115009, black: 075611114903, white: 075611116808 | can be thinned with enamel paint thinner |
| Light microscope | Zeiss (Jena, Germany) | stemi 508 | to paint small areas with precision |
| Light microscope camera | Zeiss (Jena, Germany) | Axiocam 105 color | to take picture before and after manipulation for documentation |
| Light microscope camera software | Zeiss (Jena, Germany) | Zen 2 blue edition | to process pictures taken before and after manipulation |
| Liquid liner eyeliner, shade “Perversion” | Urban Decay (Costa Mesa, CA) | (discontinued) | non-waterproof eyeliner which can be thinned with water; eyeliner 2 |
| MegaLiner liquid eyeliner, black | WetnWild (Los Angeles, CA) | SKU# 871A | non-waterproof eyeliner which can be thinned with water; eyeliner 1 |
| Micro brushes | MicroMark (Berkeley Heights, NJ) | #84648 | to allow precise painting of small areas |
| Non-hardening modelling clay | Van Aken International Claytoon (North Charleston, SC) | 18165 | to stick small nail or insect pin in and flexily adjust their angles |
| Small nail or insect mounting pins | BioQuip (Rancho Dominguez, CA) | #1208B7 | to glue spiders on as well as moving away spider’s appendages in front of the area to paint |
| Small plastic containers such as the lids of snap-cap insect collection vials | BioQuip (Rancho Dominguez, CA) | #8912 | to mix paint and thinner to the right consistency |
| Small syringe | Fisher Scientific | 1482910F | to transfer small amount of enamel thinner |
| Spectralon white standard | Labsphere Inc. (North Sutton, NH) | WS-1-SL | to measure spectral properties of colors |
| UV-VIS spectrophotometer | Ocean Optics (Dunedin, FL) | USB 2000 (spectrophotometer) with PX-2 (light source) | to measure spectral properties of colors |
| Water soluble school glue | Elmer's (High Point, NC) | #E304 | to mount the spiders onto a nail/pin |
| Wood toothpicks | Up&Up, Target Corporation (Minneapolis, MN) | #253-05-0125 | to transfer drops of enamel paint |
Références
- Baeta, R., Faivre, B., Motreuil, S., Gaillard, M., Moreau, J. Carotenoid trade-off between parasitic resistance and sexual display: an experimental study in the blackbird (Turdus merula). Proceedings of the Royal Society B: Biological Sciences. 275 (1633), 427-434 (2008).
- Ninnes, C. E., Webb, S. L., Andersson, S. Are red bishops red enough? On the persistence of a generalized receiver bias in Euplectes. Behavioral Ecology. 28 (1), 117-122 (2017).
- Mappes, J., Marples, N., Endler, J. A. The complex business of survival by aposematism. Trends in Ecology & Evolution. 20 (11), 598-603 (2005).
- Clark, D. L., Macedonia, J. M., Rowe, J. W., Kamp, K., Valle, C. A. Responses of Galápagos Lava Lizards (Microlophus bivittatus) to Manipulation of Female Nuptial Coloration on Lizard Robots. Herpetologica. 73, (2017).
- Finkbeiner, S. D., Briscoe, A. D., Reed, R. D. Warning signals are seductive: Relative contributions of color and pattern to predator avoidance and mate attraction in Heliconius butterflies. Evolution. 68 (12), 3410-3420 (2014).
- Moore, M. P., Martin, R. A. Intrasexual selection favours an immune-correlated colour ornament in a dragonfly. Journal of Evolutionary Biology. 29 (11), 2256-2265 (2016).
- Nokelainen, O., Valkonen, J., Lindstedt, C., Mappes, J. Changes in predator community structure shifts the efficacy of two warning signals in Arctiid moths. Journal of Animal Ecology. 83 (3), 598-605 (2014).
- Yewers, M. S. C., Pryke, S., Stuart-Fox, D. Behavioural differences across contexts may indicate morph-specific strategies in the lizard Ctenophorus decresii. Animal Behaviour. 111, 329-339 (2016).
- Baldwin, J., Johnsen, S. The male blue crab, Callinectes sapidus, uses both chromatic and achromatic cues during mate choice. The Journal of Experimental Biology. 215 (7), 1184 (2012).
- Künzler, R., Bakker, T. C. M. Female preferences for single and combined traits in computer animated stickleback males. Behavioral Ecology. 12 (6), 681-685 (2001).
- Landmann, K., Parzefall, J., Schlupp, I. A sexual preference in the Amazon molly, Poecilia formosa. Environmental Biology of Fishes. 56 (3), 325-331 (1999).
- Nelson, X. J., Jackson, R. R. A predator from East Africa that chooses malaria vectors as preferred prey. PLoS ONE. 1 (1), e132 (2006).
- Bajer, K., Molnár, O., Török, J., Herczeg, G. Female European green lizards (Lacerta viridis) prefer males with high ultraviolet throat reflectance. Behavioral Ecology and Sociobiology. 64 (12), 2007-2014 (2010).
- Gerlach, T., Sprenger, D., Michiels, N. K. Fairy wrasses perceive and respond to their deep red fluorescent coloration. Proceedings of the Royal Society B: Biological Sciences. 281 (1787), 20140787 (2014).
- Girard, M. B., Elias, D. O., Kasumovic, M. M. The role of red coloration and song in peacock spider courtship: insights into complex signaling systems. Behavioral Ecology. 29 (6), 1234-1244 (2018).
- Lim, M. L. M., Land, M. F., Li, D. Sex-specific UV and fluorescence signals in jumping spiders. Science. 315 (5811), 481 (2007).
- Xu, M., Fincke, O. M. Ultraviolet wing signal affects territorial contest outcome in a sexually dimorphic damselfly. Animal Behaviour. 101, 67-74 (2015).
- Hill, G. E., McGraw, K. J. . Bird coloration: function and evolution. 2, 137-200 (2006).
- Chaine, A. S., Roth, A. M., Shizuka, D., Lyon, B. E. Experimental confirmation that avian plumage traits function as multiple status signals in winter contests. Animal Behaviour. 86 (2), 409-415 (2013).
- Hasegawa, M., Arai, E. Experimentally reduced male ornamentation increased paternal care in the Barn Swallow. Journal of Ornithology. 156 (3), 795-804 (2015).
- Lawes, M. J., Pryke, S. R., Andersson, S., Piper, S. E. Carotenoid status signaling in captive and wild red-collared widowbirds: independent effects of badge size and color. Behavioral Ecology. 13 (5), 622-631 (2002).
- Quesada, J., et al. Plumage coloration of the blue grosbeak has no dual function - A test of the armament-ornament model of sexual selection. The Condor. 115 (4), 902-909 (2013).
- Safran, R. J., et al. The maintenance of phenotypic divergence through sexual selection: An experimental study in barn swallows Hirundo rustica. Evolution. 70 (9), 2074-2084 (2016).
- Tringali, A., Bowman, R. Plumage reflectance signals dominance in Florida scrub-jay, Aphelocoma coerulescens, juveniles. Animal Behaviour. 84 (6), 1517-1522 (2012).
- Jerónimo, S., et al. Plumage color manipulation has no effect on social dominance or fitness in zebra finches. Behavioral Ecology. 29 (2), 459-467 (2018).
- Hill, G. E. Plumage coloration is a sexually selected indicator of male quality. Nature. 350 (6316), 337-339 (1991).
- Wolfenbarger, L. L. Female mate choice in northern cardinals: is there a preference for redder males?. The Wilson Bulletin. 111 (1), 76-83 (1999).
- ten Cate, C., Verzijden, M. N., Etman, E. Sexual imprinting can induce sexual preferences for exaggerated parental traits. Current Biology. 16 (11), 1128-1132 (2006).
- Davis, A. K., Cope, N., Smith, A., Solensky, M. J. Wing color predicts future mating success in male monarch butterflies. Annals of the Entomological Society of America. 100 (2), 339-344 (2007).
- Exnerová, A., et al. Avoidance of aposematic prey in European tits (Paridae): learned or innate?. Behavioral Ecology. 18 (1), 148-156 (2006).
- Forsman, A., Appelqvist, S. Visual predators impose correlational selection on prey color pattern and behavior. Behavioral Ecology. 9 (4), 409-413 (1998).
- Hebets, E. A. Subadult experience influences adult mate choice in an arthropod: exposed female wolf spiders prefer males of a familiar phenotype. Proceedings of the National Academy of Sciences. 100 (23), 13390 (2003).
- Hebets, E. A., Cuasay, K., Rivlin, P. K. The role of visual ornamentation in female choice of a multimodal male courtship display. Ethology. 112 (11), 1062-1070 (2006).
- Kingsolver, J. G. Experimental manipulation of wing pigment pattern and survival in western white butterflies. The American Naturalist. 147 (2), 296-306 (1996).
- Morehouse, N. I., Rutowski, R. L. In the eyes of the beholders: Female choice and avian predation risk associated with an exaggerated male butterfly color. The American Naturalist. 176 (6), 768-784 (2010).
- Prudic, K. L., Skemp, A. K., Papaj, D. R. Aposematic coloration, luminance contrast, and the benefits of conspicuousness. Behavioral Ecology. 18 (1), 41-46 (2006).
- Rutledge, J. M., Miller, A., Uetz, G. W. Exposure to multiple sensory cues as a juvenile affects adult female mate preferences in wolf spiders. Animal Behaviour. 80 (3), 419-426 (2010).
- Taylor, L. A., Clark, D. L., McGraw, K. J. Natural variation in condition-dependent display colour does not predict male courtship success in a jumping spider. Animal Behaviour. 93, 267-278 (2014).
- Taylor, L. A., McGraw, K. J. Male ornamental coloration improves courtship success in a jumping spider, but only in the sun. Behavioral Ecology. 24 (4), 955-967 (2013).
- Foelix, R. . Biology of spiders. Third edn. , (2010).
- Taylor, L. A., Clark, D. L., McGraw, K. J. Condition dependence of male display coloration in a jumping spider (Habronattus pyrrithrix). Behavioral Ecology and Sociobiology. 65 (5), 1133-1146 (2011).
- Taylor, L. A., Maier, E. B., Byrne, K. J., Amin, Z., Morehouse, N. I. Colour use by tiny predators: jumping spiders show colour biases during foraging. Animal Behaviour. 90, 149-157 (2014).
- Bates, D., Maechler, M., Bolker, B., Walker, S. Fitting Linear Mixed-Effects Models Using lme4. Journal of Statistical Software. 67 (1), 1-48 (2015).
- R Core Team. . R: A language and environment for statistical computing. , (2018).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon