Method Article
Système de micro-injectrode pour l'infusion combinée de drogue et l'électrophysiologie
Dans cet article
Résumé
Nous présentons un système de micro-injectrode conçu pour l'électrophysiologie et la livraison assistée de sondes expérimentales (c.-à-d. nanocapteurs, microélectrodes), avec perfusion de drogue facultative. Les composants microfluidiques largement disponibles sont couplés à une canule contenant la sonde. Un protocole étape par étape pour la construction de microinjectrode est inclus, avec des résultats pendant l'infusion de muscimol dans le cortex macaque.
Résumé
Ce système de micro-injectrode est conçu pour l'infusion de médicaments, l'électrophysiologie, et la livraison et la récupération de sondes expérimentales, telles que les microélectrodes et les nanocapteurs, optimisés pour une utilisation répétée chez les animaux éveillés et se comportant. Le système de micro-injectrode peut être configuré à de multiples fins : (1) arrangement simple de la canule pour le placement d'une sonde expérimentale qui serait autrement trop fragile pour pénétrer la dura mater, (2) l'infusion microfluidique d'un médicament, soit d'une canule contenant une sonde expérimentale (microélectrode, nanocapteur) de façon indépendante ou couplée à une canule contenant une sonde expérimentale. Dans ce protocole, nous expliquons la construction étape par étape du microinjectrode, son couplage à des composants microfluidiques, et le protocole d'utilisation du système in vivo. Les composants microfluidiques de ce système permettent la livraison de volumes à l'échelle nanolitre, avec un minimum de dommages de pénétration. L'infusion de médicaments peut être réalisée indépendamment ou simultanément avec des sondes expérimentales telles que des microélectrodes ou des nanocapteurs chez un animal éveillé et se comportant. Les applications de ce système vont de la mesure des effets d'un médicament sur l'activité et le comportement électriques corticaux, à la compréhension de la fonction d'une région spécifique du cortex dans le contexte de la performance comportementale basée sur des mesures de sonde ou de nanocapteurs. Pour démontrer certaines des capacités de ce système, nous présentons un exemple d'infusion de muscimol pour l'inactivation réversible du champ d'oeil frontal (FEF) dans le macaque de rhésus pendant une tâche de mémoire de travail.
Introduction
L'électrophysiologie et les méthodes d'injection de médicaments sont largement utilisées en neurosciences pour étudier l'activité et le comportement neuronaux, in vivo, chez les rongeurs et les primates. Au cours des trois dernières décennies, les améliorations des premiers modèles d'injection ont permis une technique plus précise et moins invasive, et l'enregistrement simultané et l'injection de drogues à des sites cérébraux spécifiques1,2,3. Pour les primates en particulier, la capacité de délivrer avec précision de petits volumes avec des dommages minimes aux tissus est essentielle si la technique doit être utilisée pour l'étude des fonctions cognitives avancées qui nécessitent des animaux hautement qualifiés. Les progrès récents incluent des mesures électrophysiologiques et chimiques chroniques en combinaison avec la stimulation utilisant des sondes implantées4, et l'enregistrement combiné et l'administration de médicaments microfluidiques a récemment été mis à l'essai chez les rongeurs5. Le système d'injection décrit ici permet l'enregistrement électrophysiologique, la stimulation, et l'administration précise de médicaments, et il a déjà été mis en œuvre avec succès dans plusieurs laboratoires de primates6,7,8.
La disponibilité croissante de capteurs délicats et spécialisés, tels que les nanocapteurs9,10 avec des applications de neurosciences, exige une méthode fiable pour obtenir la sonde à travers la dura mater sans endommager les dispositifs nanométriques fragiles ou des pointes de microélectrode.
Nous avons conçu un système de micro-injectrode qui surmonte les défis techniques de combiner ces méthodes en utilisant des composants facilement disponibles et peu coûteux, et facilite deux fonctions principales: (i) La capacité de placer une sonde expérimentale fragile, comme un microélectrode ou nanocapteur, à travers le dura mater et le tissu neural, protégé de tout dommage. Cette fonctionnalité permet de placer la sonde expérimentale à des endroits ciblés, livré en utilisant la canule comme un guide à travers le tissu neural. (ii) La capacité d'utiliser un microélectrode pour effectuer des expériences combinant des enregistrements d'électrophysiologie et de stimulation électrique avec l'injection de médicaments.
Notre système utilise un tube guide pour pénétrer dans la dura, avec une canule qui fonctionne à la fois pour la livraison de médicaments (lors de l'utilisation du système pour la microinfusion) et fournit une protection supplémentaire pour la microélectrode ou nanocapteur (à la fois lors du passage à travers la dura et tissu neural). Ce système peut être facilement construit avec des composants largement disponibles dans le commerce, qui sont peu coûteux et faciles à trouver. Nous minimisons les dommages de pénétration en utilisant une canule de petit diamètre (oD de diamètre externe - 235 m, ID de diamètre intérieur - 108 m).
Nous présentons ici des instructions étape par étape pour la construction et la configuration micro-injectrode du système microfluidique. Nous expliquons les étapes nécessaires à l'utilisation du microinjectrode, indépendamment ou couplé au système microfluidique pour l'injection de drogues. Une approche similaire peut être appliquée avec n'importe quelle sonde expérimentale fragile, comme un nanocapteur9,10. La sonde peut être chargée à l'avant ou à l'arrière dans la canule (selon la conception), et sera protégée contre les dommages lors de la pénétration du tissu dura et neuronal. Nous fournissons des exemples de données d'une expérience in vivo avec des primates non humains, dans laquelle nous avons utilisé un microélectrode de tungstène pour effectuer la stimulation électrique, et ensuite injecté du muscimol dans le champ oculaire frontal (FEF) tandis que l'animal a effectué une mémoire guidée saccade (MGS) tâche.
Protocole
Les procédures expérimentales ont suivi le National Institutes of Health Guide for the Care and Use of Laboratory Animals et la Society for Neuroscience Guidelines and Policies. Les protocoles pour les procédures expérimentales et comportementales ont été approuvés par le Comité institutionnel de soins et d'utilisation des animaux de l'Université de l'Utah.
1. Construction du Microinjectrode pour la stimulation et l'enregistrement (Figure 1a)
- Mesurer la longueur de la canule et de la sonde (dans cet exemple un nanocapteur). La sonde doit être plus longue que la canule par la longueur qu'elle doit dépasser de la pointe de la canule (selon la conception de la sonde) plus environ 2 cm.
- Sous un grossisseur ou un microscope (grossissement de 10x), chargez la sonde dans la canule; si possible, un rechargement est préférable pour protéger la pointe de la sonde.
REMARQUE: Cette étape, effectuée manuellement, est difficile. Il est recommandé de pratiquer avec un microélectrode sous une loupe avant d'essayer avec une sonde expérimentale réelle. -
Passer la canule (contenant la sonde) à travers la ferrule supérieure, la jonction En et la ferrule inférieure.
- Si la sonde n'est qu'un seul fil sans pièces jointes, rechargez-la dans le canule et insérez l'assemblage dans la jonction En T à partir de la ferrule inférieure. Le haut de la canule (côté plat) doit être placé au milieu de la jonction T, dans le fond, mais pas la ferrule supérieure. La sonde expérimentale ou le biocapteur doit dépasser au-dessus du haut de la ferrule supérieure.
REMARQUE: Des ferrules sur mesure peuvent également être faites en perçant un trou dans les bouchons de ferrule à l'aide de micro-morceaux de forage, la taille du trou étant basée sur le diamètre nécessaire pour serrer la canule à la jonction T.
- Si la sonde n'est qu'un seul fil sans pièces jointes, rechargez-la dans le canule et insérez l'assemblage dans la jonction En T à partir de la ferrule inférieure. Le haut de la canule (côté plat) doit être placé au milieu de la jonction T, dans le fond, mais pas la ferrule supérieure. La sonde expérimentale ou le biocapteur doit dépasser au-dessus du haut de la ferrule supérieure.
- Utilisez la clé ferrule pour resserrer les ferrules sur le dessus et le bas de la jonction En. Ne pas trop serrer. Un petit morceau de tuyauterie peut être ajouté pour renforcer le support d'électrode dans la ferrule supérieure.
- Épingles en or de soudure à chacun des terminaux de sonde (signal, sol, etc.), selon les spécifications de la sonde.
- Ajuster la position relative de la sonde et de la canule. Mesurez la distance que la sonde dépasse de la canule sous grossissement, et ajustez manuellement à partir de l'extrémité supérieure (la sonde peut glisser librement dans les ferrules).
- Ajouter de la colle époxy entre les broches d'or et la ferrule supérieure pour attacher la sonde à la ferrule.
- Dévisser la ferrule supérieure pour rétracter la sonde à l'intérieur de la canule. Confirmer visuellement que la sonde est entièrement dans la canule sous grossissement.
- Fixez l'injectrode au microdrive.
2. Construction du Microinjectrode pour l'infusion de drogues (Figure 1b)
- Fixez le « non-beveled » ou l'extrémité plate de la canule au fond de la jonction de T à l'aide d'une ferrule. Utilisez la clé de ferrule pour resserrer la ferrule.
- Fixez un petit morceau de tube capillaire (1,5 cm) au sommet de la jonction T en le passant à travers la ferrule standard. Resserrer avec une clé de ferrule.
- Chargez le microélectrode à travers le tube capillaire, la jonction En, la canule et les ferrules correspondantes.
- Assurez-vous que l'extrémité arrière de l'électrode dépasse de moins de 1 cm de l'arrière du tube capillaire, et que la pointe de l'électrode dépasse de la canule à la distance désirée du côté inférieur. La position de l'électrode peut être ajustée manuellement à partir du haut de gamme.
- Souder une broche d'or au terminal de microélectrode.
- Ajouter de la colle époxy entre la goupille d'or et la ferrule supérieure pour attacher le microélectrode à la ferrule.
- Dévisser la ferrule supérieure pour rétracter la sonde à l'intérieur de la canule. Confirmez visuellement que le microélectrode est entièrement rétracté dans la canule.
3. Construction du circuit microfluidique (Figure 2)
- Placer une planche à pain sur une surface stable. Placez les deux vannes à trois voies parallèles aux côtés les plus longs de la planche à pain, à environ 6 po l'un de l'autre avec un port (celui qui est toujours ouvert) face à face. Utilisez des vis pour fixer les vannes à la planche à pain.
- Placez une règle à côté des vannes (pour mesurer et suivre le mouvement des fluides à l'intérieur du tube capillaire).
- Chargez un mélange d'huile de viscosité faible de 1:1 et de colorant alimentaire (marqueur) dans la seringue étanche et placez-le dans la pompe Marker. Coupez un morceau de tubes capillaires et utilisez des ferrules standard et des connecteurs À verrouillage Luer pour connecter la seringue à l'un des ports de la soupape d'entrée. C'est la "ligne de repère".
- Coupez un court morceau de tube capillaire pour la « ligne de règle ». Utilisez des ferrules standard pour serrer aux ports de face des vannes.
- Couper deux tubes capillaires plus longs pour relier la soupape de sortie au microinjectrode et pour connecter la pompe Drug à la soupape d'entrée (utiliser des ferrules standard).
REMARQUE: La longueur de ces deux lignes dépend de la configuration expérimentale, l'une doit être assez longue pour atteindre de l'appareil de perfusion à l'animal, et l'autre de la pompe de drogue à la valve d'entrée. Utilisez une pierre de clivage pour couper le tube capillaire.
4. Montage du Microinjectrode au Microdrive (Figure 3)
- Assurez-vous que la sonde microélectrode/expérimentale est rétractée dans la canule avant le montage.
REMARQUE: Le tube guide doit être en position en micropropulsion. - Fixez un adaptateur sur mesure au microinjectrode.
- Chargez le microinjectrode à travers le tube guide et fixez-le à l'adaptateur à l'aide de vis.
- Mesurer la position microdrive (profondeur) à laquelle le microinjectrode dépasse du tube guide, puis rétracter 1 cm pour se préparer à l'insertion.
- Pour les expériences de microinfusion, connectez la « ligne cérébrale » à l'ouverture inutilisée de la jonction T du microinjectrode. Utilisez une ferrule standard et serrez avec la clé de ferrule.
5. Flushing et préparation du système microfluidique
- Placez le microdrive avec le microinjectrode sur un bécher.
- Chargez la chlorhexidine (p. ex. nolvasan; dissous à 20 g/L) dans la seringue étanche à gaz de 1 ml et placez-la dans la pompe à médicaments. Tournez la direction d'écoulement des valves de telle sorte que le fluide va de la pompe de drogue par la valve à la ligne de valve et dehors la « ligne de cerveau ».
- Rincer le circuit avec de la chlorhexidine à l'aide d'un faible débit (50-200 l/min) pendant un minimum de 10 min. Répétez les étapes de 5,2 à 5,3 avec la saline stérile, puis l'air.
REMARQUE: Il est important de vérifier s'il y a des fuites à ce stade. Appliquez délicatement des lingettes sans papier à la jonction pour aider à révéler les fuites de liquide à travers les ferrules. - Chargez le médicament dans la seringue étanche à gaz de 500 l,l, comprimez l'air et placez-le dans la pompe à médicaments. Flux à 50 oL/min jusqu'à ce que quelques gouttes s'écoulent du microinjectrode.
- Faire tremper le tube guide dans la chlorhexidine (dissous à 20 g/L) pendant 15 min.
- Tournez la direction de la soupape de sortie vers la « ligne de chasse ». Avancez la pompe Marker jusqu'à ce qu'un bord clair de couleur et d'huile soit observé sur la ligne de règle. Assurez-vous qu'il ya toujours de l'huile entre le médicament et la couleur afin de ne pas mélanger les deux matériaux solubles dans l'eau et de perdre le bord pointu entre eux. Marquez la position de départ de cette ligne d'huile/de teinture (avec un morceau de ruban adhésif ou un marqueur).
- Tournez la direction de la valve de sortie vers la ligne du cerveau.
6. Enregistrement d'exécution ou expérience d'infusion
REMARQUE: Les étapes de manipulation des animaux varient selon le laboratoire et l'expérience. Les étapes suivantes doivent être effectuées après la mise en place chirurgicale nécessaire et la préparation a été effectuée pour exposer la dura. Après l'expérience, toutes les étapes post-procédures nécessaires doivent être effectuées conformément aux protocoles approuvés par l'institution.
- Fixez le microdrive à la chambre d'enregistrement. Abaissez le tube guide pour pénétrer dans la dura.
REMARQUE: Le tube guide ne doit pas pénétrer plus loin que le dura afin d'éviter d'endommager le cortex. - Abaissez le microinjectrode à environ 2 mm au-dessus du site pour l'enregistrement/injection dans le cerveau.
- Resserrer la ferrule supérieure (microélectrode/biocapteur saillante) et connecter les broches d'or au système d'enregistrement. Continuez à faire avancer le micro-injectrode vers le site cible.
REMARQUE: N'oubliez pas d'inclure la distance que le microélectrode s'étend au-delà de la canule dans les calculs. - Pour les expériences de perfusion, utilisez la pompe manuelle de microseringue pour déplacer la colonne d'huile de 1 cm toutes les 3 min (60 nL/min). Une fois que le volume désiré a été infusé, basculez la vanne de sortie vers la ligne de rinçage.
REMARQUE: Le volume infusé variera en fonction des espèces modèles et de la zone du cerveau ciblée. Des débits plus rapides peuvent endommager les tissus neuronaux. - Lorsque les expériences sont terminées, rétractez le microinjectrode dans le tube guide (laissez la sonde en saillie). Ensuite, retirez le microdrive pour le rinçage. Rincer le système microfluidique tel que décrit dans les étapes 5.1-5.5. pour se préparer à la réutilisation.
REMARQUE: D'après notre expérience, le microinjectrode durera plusieurs fois si l'on prend soin d'eux. La qualité d'enregistrement électrophysiologique diminue plus rapidement que la capacité d'injection.
Résultats
Nous avons effectué l'injection d'un agoniste GABAa (muscimol) pour l'inactivation réversible du champ oculaire frontal (FEF), tandis que l'animal a effectué une tâche de saccade guidée par mémoire11. Dans cette tâche, l'animal fixe et une cible visuelle périphérique est présentée. L'animal maintient la fixation tout en se souvenant de l'emplacement cible, et une fois que le point de fixation disparaît, exécute un mouvement oculaire saccadique à l'endroit rappelé pour recevoir une récompense. Le microinjectrode a été construit selon les instructions de la figure 1b. Le volume d'infusion pour l'expérience d'exemple était de 850 nL. La performance comportementale sur la tâche de saccade guidée par la mémoire (MGS) à divers endroits et heures par rapport à l'infusion de muscimol est montrée dans la figure 4. Les déficits de performance les plus importants ont été observés à 2 à 3 h après l'infusion.

Figure 1 : Fabrication progressive de microinjectrode. (a) Configuration pour une utilisation indépendante du système microfluidique. La canule et la sonde sont mesurées afin de confirmer que la pointe de la sonde peut être saillante à la longueur désirée (p. ex., 150 m). La sonde est chargée à l'avant dans la canule. La canule est passée par la jonction En et attachée sur le côté inférieur, avec l'extrémité plate au milieu de la jonction En; l'extrémité arrière de la sonde continue à travers la ferrule supérieure. Le microinjectrode est finalisé en souchant des goupilles d'or sur chacun des terminaux de sonde et en ajoutant de la colle entre eux et la ferrule supérieure pour la stabilité. La connexion au système d'acquisition dépend de la conception de la sonde. Dans cet exemple, notre sonde est un nanocapteur avec trois pistes. (b) Configuration pour utilisation avec système microfluidique. Pour coupler le microinjectrode au système microfluidique, un morceau de tube capillaire est utilisé pour le côté supérieur de la jonction T. La sonde peut être chargée à l'avant ou à l'arrière. La ligne microfluidique est ensuite branchée à la troisième ouverture de jonction En. Dans cet exemple, nous avons utilisé une microélectrode. Voir l'image zoomée de la pointe d'une canule dans laquelle le microélectrode a été saillant en resserrant la ferrule supérieure. Consultez la Table des Matériaux pour une liste des articles utilisés dans la construction. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
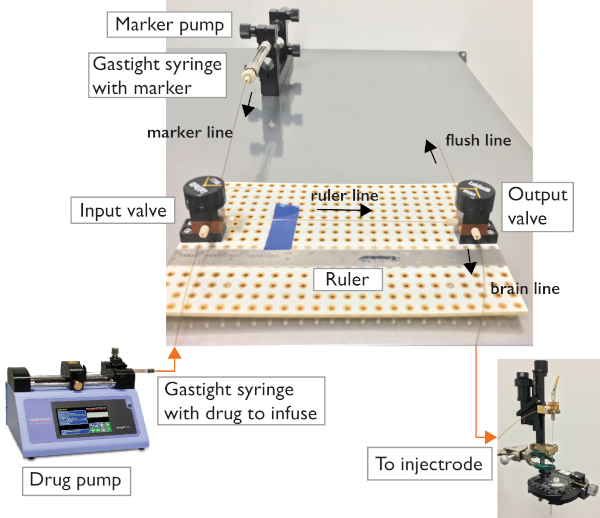
Figure 2 : Système microfluidique. La configuration à deux soupapes permet de contrôler la direction du débit vers le microinjectrode ou vers la ligne de rinçage pour le dépannage. Le circuit repose sur deux vannes à 3 ports reliées à l'aide de tubes capillaires et de ferrules standard. Des seringues étanches sont utilisées pour transporter et injecter le médicament par perfusion et le marqueur. Une pompe à seringues programmable permet le rinçage automatique du système et le chargement du médicament. Une pompe manuelle de microseringue permet l'injection et la visualisation commandées. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 3 : Montage de micro-injectrode à un micropropulsion hydraulique avec et sans capacité d'injection. Étape 4.1 : Un adaptateur sur mesure permet l'attachement du microinjectrode au microdrive. Une seule vis fixe l'adaptateur au microdrive; deux vis fixent le microinjectrode à l'adaptateur. La ferrule supérieure doit être dévissée au moins 2 virages afin de protéger la pointe de la microélectrode/sonde expérimentale lors du chargement du microinjectrode dans le tube guide du microdrive. Étape 4.3 : Insérez le microinjectrode dans le tube de guidage à partir du haut. Étape 4.4 : Si vous effectuez une microinfusion, branchez la ligne de drogue à la troisième ouverture de jonction En à l'aide d'une ferrule en plastique. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
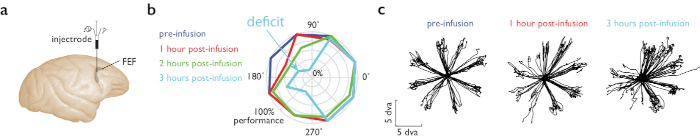
Figure 4 : Tâche guidée de saccade guidée de mémoire pendant l'infusion de muscimol dans FEF. (a) Le microinjectrode a été placé dans l'hémisphère droit, zone FEF. (b) Performance comportementale au cours d'une tâche MGS dans laquelle huit cibles sont placées périphériquement. Nous avons couru 4 blocs de la tâche MGS, avant et à trois reprises après l'injection. L'intrigue polaire montre la performance (excentricité) à chacun de ces moments (couleur), pour différents endroits par rapport au point de fixation (angle sur l'intrigue polaire). La performance a nettement diminué dans l'hémifield visuel gauche 2 h après injection (trace bleue, moitié gauche de l'intrigue polaire). (c) Traces de saccade pour 8 emplacements de mémoire périphériques avant (à gauche) et après injection de muscimol dans le FEF (droite, 1 et 3 h après l'infusion). La précision de saccade dans l'hémifield visuel gauche (moitié gauche des parcelles polaires) a diminué après injection de muscimol. Échelle en degrés d'angle visuel (dva). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Discussion
Plusieurs méthodes sont actuellement disponibles pour effectuer l'administration simultanée de médicaments et l'électrophysiologie. Notre système est destiné à avoir la flexibilité d'être utilisé pour les enregistrements indépendamment ou en combinaison avec l'injection de drogues, et d'avoir la capacité de placer précisément toute sonde expérimentale fragile, comme un nanocapteur ou un microélectrode, à l'abri de tout dommage, par le dura mater et le tissu neural. Le système permet un contrôle précis des volumes d'infusion de médicaments à l'œil nu (17 nL de précision montrée dans des études antérieures dans notre laboratoire3).
Il existe des systèmes plus spécialisés pour l'injection de pression avec des diamètres plus petits12. Ces systèmes permettent de multiples sites d'enregistrement, mais la configuration complexe des logiciels et du matériel nécessaires au contrôle du système entraîne des coûts plus élevés pour chacun des composants, et a moins de flexibilité pour interagir avec des sondes expérimentales qui ne sont pas encore commercialisées à grande échelle. De plus, notre injection n'a pas besoin d'implant chronique et offre une grande flexibilité : compatible avec des biocapteurs pour mesurer les signaux chimiques et électrophysiologiques, et capable d'infuser des médicaments aussi, avec le potentiel de mesurer l'effet des perfusions localisées de médicaments sur ces réponses.
La conception permet à la sonde expérimentale d'être saillante après la pénétration de dura afin d'éviter des dommages à la structure de la sonde. Cette fonctionnalité permet à la multifonctionnalité de l'appareil, de pénétrer la dura sans risquer d'endommager toute sonde expérimentale telle que nanomètres à l'échelle nanométriquenanocapteurs 10. Cependant, il y a une limitation de la longueur qui peut être dépassée, limitée par le nombre de virages de la ferrule, limité à 1 mm pour les ferrules standard. Il y a des dommages aux tissus minimes dus au petit diamètre de la canule (228 m).
Dans l'expérience que nous avons montrée, le système a été employé pour exécuter la livraison commandée du muscimol pour l'inactivation réversible de FEF, simultanément avec la stimulation électrique ou l'enregistrement extracellulaire (neurone simple, potentiel local de champ) utilisant un microélectrode. Cette expérience dans FEF exige la microstimulation du FEF pour confirmer des vecteurs de saccade avant l'inactivation, et le médicament a été infusé pour étudier la mémoire de travail pendant l'inactivation réversible de FEF. Il est peu probable qu'un enregistrement du même neurone isolé unique puisse être maintenu avant et après l'injection de drogue ; cependant, nous avons été en mesure d'enregistrer les potentiels locaux sur le terrain avant et après l'infusion. Ici, nous montrons une expérience combinant injection, enregistrement et stimulation électrique.
Une fois qu'elle est mise en place, la méthode est très fiable et robuste. Cependant, en raison de la précipitation de petites molécules (p. ex. sel) dans le petit tube et les ports, un rinçage complet est nécessaire après chaque expérience afin de garder la microfluidique exempte d'obstructions et de fuites. En raison de la simplicité de l'ensemble du circuit, chaque composant peut être remplacé indépendamment pour un dépannage facile.
Bien que la méthode ait été démontrée dans la zone feF chez un primate non humain, le principe peut être appliqué à n'importe quelle autre zone du cerveau où une certaine combinaison de stimulation électrique, d'enregistrement et d'injection de drogue sont désirées, chez des espèces de taille de rongeur ou plus grandes.
Déclarations de divulgation
Aucun.
Remerciements
Ce travail a été soutenu par le financement des National Institutes of Health (NIH), les subventions EY026924 et EY014800 (à B.N.), une subvention sans restriction de la recherche pour la prévention de la cécité, Inc., New York, NY au Département d'ophtalmologie et des sciences visuelles, Université de l'Utah, et les fonds de démarrage fournis à R.E. par la Henry Samueli School of Engineering et le Département de génie électrique de l'Université de Californie à Irvine. Cette méthode est basée sur un rapport précédent d'une méthode similaire développée dans le laboratoire du Dr Tirin Moore, publié dans Noudoost et Moore 2011, Journal of Neuroscience Methods. Les auteurs remercient le Dr Kelsey Clark pour ses commentaires sur le manuscrit.
matériels
| Name | Company | Catalog Number | Comments |
| 3-port manual valves | LabSmith | Manual 3-Port Selector Valve (MV201-C360) | https://products.labsmith.com/mv201-manual-3-port-selector-valve/#.XNYEC9NKh26 |
| Cannulae | Vita Needle Company | 304 Stainless steel tubing, Outer Diameter 228μm, Inner Diameter 165μm | Vita Needle Master Tubing Gauge Chart |
| Cleaving stone | Molex | Cleaving stone 1" x 1" (part No. 1068680064) | Highly recommended to follow method for cleaving capillary tubing: https://www.cmscientific.com/info_sheets/cleaving_procedure.pdf |
| Clorhexidine diacetate | Walmart | Nolvasan solution disinfectant (AAP311) | Used for microfluidic circuit flushing, dissolved at 20 g/L |
| Custom adapter | Custom provider | - | Custom machined adapter to connect microinjectrode to hydraulic microdrive |
| Driver | LabSmith | T7 TORX driver for installing breadboard screws (LS-TORX Driver) | https://products.labsmith.com/ls-torx-driver/#.XO8sndNKh25 |
| Epoxy glue | LabSmith | Two-part high-strength epoxy adhesive (LS-EPOXY) for metal and plastic bonding | https://products.labsmith.com/ls-epoxy-12ml-epoxy-adhesive/#.XO8t89NKh24 |
| Ferrule | LabSmith | One-Piece Fitting (C360-100) for connecting capillary, thru hole sized for 360μm OD capillary | https://products.labsmith.com/one-piece-fitting#.XNYEaNNKh24 |
| Ferrule plug | LabSmith | One-Piece Plug (C360-101) for use in any -C360 port | https://products.labsmith.com/one-piece-fitting-plug/#.XNYFl9NKh24 |
| Ferrule wrench | LabSmith | 1/8" hex wrench for installing one-piece fittings and plugs (LS-HEX 1/8" Hex Wrench) | https://products.labsmith.com/ls-hex-1-8-hex-wrench/#.XO8sqtNKh24 |
| Gastight syringe | Hamilton Company | 500μL gastight syringe model 1750 (81220) and 1mL gastight syringe model 1001 (81320) | https://www.hamiltoncompany.com/laboratory-products/syringes/81220#top |
| Gold pins | Aim-Cambridge | Male gold plated crimp-on connector pin (40-9856M) | https://www.masterelectronics.com/aim-cambridge-cinch-connectivity-solutions/409856m-10109145.html |
| Lint-free wipes | Kimberly Clark | Kimtech Science Kimwipes Delicate Task | Lint-free wipes, used to identify leaks in the system |
| Liquid food color | McCormick & Co. | Water based, black liquid food color (52100581873) | https://www.mccormick.com/spices-and-flavors/extracts-and-food-colors/food-colors/black-food-color |
| Low viscosity oil | Clearco Products Co. | Pure Silicone Fluid Octamethyltrisiloxane with a viscosity of 1cSt at 25°C (PSF-1cSt) | http://www.clearcoproducts.com/pure-silicone-super-low-viscosity.html |
| Luer-Lock connector | LabSmith | Luer-Lock Adapter (C360-300), female fitting for connecting Luer Lock syringe to 360μm capillary tubing | https://products.labsmith.com/luer-lock-adapter-assembly#.XO81MtNKh24 |
| Micro drill bits | Grainger | Micro drill bit, 0.23mm (414H85) | https://www.grainger.com/category/machining/drilling-and-holemaking/drill-bits/machining-drill-bits/micro-drill-bits |
| Microelectrode | FHC | Metal microelectrode, tungsten with epoxy insulation | https://www.fh-co.com/category/metal-microelectrodes |
| Oil hydraulic micromanipulator | Narishige Group | Oil Hydraulic Micromanipulator with guide tube attached (MO-96) | http://products.narishige-group.com/group1/MO-96/chronic/english.html |
| Polymicro Capillary Tubing | Molex | Polymicro Flexible Fused Silica Capillary Tubing (TSP150375), Outer Diameter 375µm, Inner Diameter 150µm | Polymicro Capillary Tubing |
| Programmable syringe pump | Harvard Apparatus | Standard Infuse/Withdraw Pump, programmable (70-2213) | https://www.harvardapparatus.com/standard-infuse-withdraw-pump-11-pico-plus-elite-programmable-syringe-pump.html |
| Ruler | Empire | Stainless steel 6" Stiff ruler (27303) | http://www.empirelevel.com/rulers.php |
| Screw set | LabSmith | Valve mounting screw set (LS-SCREWS .25), thread-forming screws (2-28 x 1/4”) to mount valves to breadboard | https://products.labsmith.com/ls-screws-25#.XO8widNKh24 |
| Standard Breadboard | LabSmith | 4" x 6" platform (LS600), with 0.25" hole spacing for mounting fluid circuit | https://products.labsmith.com/standard-breadboard/#.XO8xDdNKh24 |
| Sterile saline (sodium chloride) 0.9% | Baxter | 0.9% Sodium Chloride sterile | Sterile Intravenous Infusion |
| Sterile syringe filters | Millipore Sigma | MilliporeSigma™ Millex™-GP Sterile Syringe Filters with PES Membrane (SLGPM33RS) | https://www.fishersci.com/shop/products/emd-millipore-millex-sterile-syringe-filters-pes-membrane-green-4/slgpm33rs |
| Stoelting manual microsyringe pump | Stoelting Company | Manual infusion/withdrawal pump (51222) | https://www.stoeltingco.com/manual-infusion-withdrawal-pump-2649.html |
| T-junction | LabSmith | Interconnect tee (C360-203) for combining flow streams, for use with 360μm OD capillary tubing | https://products.labsmith.com/interconnect-tee#.XO8z8dNKh24 |
Références
- Chen, L. T. L., Goffart, L., Sparks, D. L. A simple method for constructing microinjectrodes for reversible inactivation in behaving monkeys. Journal of Neuroscience Methods. 107 (1-2), 81-85 (2001).
- Crist, C. F., Yamasaki, D. S. G., Komatsu, H., Wurtz, R. H. A grid system and a microsyringe for single cell recording. Journal of Neuroscience Methods. 26 (2), 117-122 (1988).
- Noudoost, B., Moore, T. A reliable microinjectrode system for use in behaving monkeys. Journal of Neuroscience Methods. 194 (2), 218-223 (2011).
- Zhang, S., et al. Real-time simultaneous recording of electrophysiological activities and dopamine overflow in the deep brain nuclei of a non-human primate with Parkinson's disease using nano-based microelectrode arrays. Microsystems & Nanoengineering. 4, (2018).
- Altuna, A., et al. SU-8 based microprobes for simultaneous neural depth recording and drug delivery in the brain. Lab on a Chip. 13 (7), 1422-1430 (2013).
- Noudoost, B., Clark, K. L., Moore, T. A Distinct Contribution of the Frontal Eye Field to the Visual Representation of Saccadic Targets. Journal of Neuroscience. 34 (10), 3687-3698 (2014).
- Rajalingham, R., DiCarlo, J. J. Reversible Inactivation of Different Millimeter-Scale Regions of Primate IT Results in Different Patterns of Core Object Recognition Deficits. Neuron. 102 (2), 493 (2019).
- Katz, L. N., Ates, J. L. Y., Pillow, J. W., Huk, A. C. Dissociated functional significance of decision-related activity in the primate dorsal stream. Nature. 535 (7611), 285 (2016).
- Esfandyarpour, R., Esfandyarpour, H., Javanmard, M., Harris, J. S., Davis, R. W. Microneedle biosensor: A method for direct label-free real time protein detection. Sensors and Actuators B-Chemical. 177, 848-855 (2013).
- Esfandyarpour, R., Yang, L., Koochak, Z., Harris, J. S., Davis, R. W. Nanoelectronic three-dimensional (3D) nanotip sensing array for real-time, sensitive, label-free sequence specific detection of nucleic acids. Biomedical Microdevices. 18 (1), (2016).
- Bahmani, Z., Daliri, M. R., Merrikhi, Y., Clark, K., Noudoost, B. Working Memory Enhances Cortical Representations via Spatially Specific Coordination of Spike Times. Neuron. 97 (4), 967-979 (2018).
- Veith, V. K., Quigley, C., Treue, S. A Pressure Injection System for Investigating the Neuropharmacology of Information Processing in Awake Behaving Macaque Monkey Cortex. JoVE: Journal of Visualized Experiments. (109), (2016).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon