Method Article
Sistema de microininjeção para infusão combinada de drogas e eletrofisiologia
Neste Artigo
Resumo
Apresentamos um sistema de microinvacinação projetado para eletrofisiologia e entrega assistida de sondas experimentais (ou seja, nanossensores, microeletrodos), com infusão opcional de medicamentos. Componentes microfluídicos amplamente disponíveis são acoplados a uma cânula contendo a sonda. Um protocolo passo a passo para a construção de microinjectrodes está incluído, com resultados durante a infusão de muscimol no córtex de macaco.
Resumo
Este sistema de microinvacinação é projetado para infusão de drogas, eletrofisiologia e entrega e recuperação de sondas experimentais, como microeletrodos e nanosensores, otimizados para uso repetido em animais acordados e comportados. O sistema de microininjectrode pode ser configurado para múltiplos fins: (1) arranjo simples da cânula para a colocação de uma sonda experimental que de outra forma seria muito frágil para penetrar na dura mater, (2) infusão microfluídica de uma droga, ou independenteou acoplado a uma cânula contendo uma sonda experimental (ou seja, microeletrodo, nanosensor). Neste protocolo explicamos a construção passo a passo do microinjectrode, seu acoplamento aos componentes microfluídicos e o protocolo para uso do sistema in vivo. Os componentes microfluídicos deste sistema permitem a entrega de volumes na escala de nanolitros, com danos mínimos de penetração. A infusão de medicamentos pode ser realizada de forma independente ou simultaneamente com sondas experimentais, como microeletrodos ou nanosensores em um animal acordado e comportado. As aplicações deste sistema variam de medir os efeitos de uma droga na atividade elétrica cortical e no comportamento, a compreender a função de uma região específica do córtex no contexto do desempenho comportável baseado em medidas da ponta de prova ou do nanosensor. Para demonstrar algumas das capacidades deste sistema, apresentamos um exemplo de infusão de muscimol para inativação reversível do campo frontal dos olhos (FEF) no macaco rhesus durante uma tarefa de memória de trabalho.
Introdução
Os métodos de eletrofisiologia e injeção de drogas são amplamente utilizados na neurociência para estudar a atividade e o comportamento neuronal, in vivo, em roedores e primatas. Ao longo das últimas três décadas, as melhorias dos primeiros modelos de injetado permitiram uma técnica mais precisa e menos invasiva, e gravação simultânea e injeção de drogas em locais específicos do cérebro1,2,3. Para os primatas, em particular, a capacidade de entregar com precisão pequenos volumes com danos mínimos nos tecidos é fundamental para que a técnica seja usada para o estudo de funções cognitivas avançadas que requerem animais altamente treinados. Os avanços recentes incluem medições eletrofisiológicas crônicas e químicas em combinação com estimulação usando sondas implantadas4,e gravação combinada e entrega de medicamentos microfluídicos foi recentemente pilotada em roedores5. O sistema de injetode descrito aqui permite a gravação eletrofisiológica, estimulação e entrega precisa de drogas, e já foi implementado com sucesso em vários laboratórios de primatas6,7,8.
A crescente disponibilidade de sensores delicados e especializados, como nanosensores9,10 com aplicações de neurociência, exige um método confiável para obter a sonda através da dura mater sem danificar os dispositivos de nanoescala frágil ou dicas de microeletrodos.
Nós projetamos um sistema de microininjectrode que supera os desafios técnicos de combinar esses métodos usando facilmente disponíveis, componentes de baixo custo, e facilita duas funções principais: (i) A capacidade de colocar uma sonda experimental frágil, como um microeletrodo ou nanosensor, através da dura mater e tecido neural, protegido de qualquer dano. Esta funcionalidade permite a colocação da sonda experimental em locais direcionados, entregue usando a cânula como um guia através do tecido neural. (ii) A capacidade de usar um microeletrodo para realizar experimentos que combinam gravações de eletrofisiologia e estimulação elétrica com injeção de drogas.
Nosso sistema usa um tubo-guia para penetrar na dura, juntamente com uma cânula que funciona tanto para a entrega de medicamentos (ao usar o sistema para microinfusão) e fornece proteção adicional para o microeletrodo ou nanosensor (tanto ao passar pela dura quanto tecido neural). Este sistema pode ser facilmente construído com componentes amplamente disponíveis comercialmente, que são baratos e fáceis de encontrar. Minimizamos os danos à penetração usando uma cânula de pequeno diâmetro (OD de diâmetro externo = 235 μm, ID de diâmetro interno = 108 μm).
Aqui apresentamos instruções passo a passo para a construção e configuração de microinjectrode do sistema microfluídico. Nós explicamos as etapas necessárias para o uso do microinjectrode, independentemente ou acoplado ao sistema microfluídico para injeção de drogas. Uma abordagem semelhante pode ser aplicada com qualquer sonda experimental frágil, como um nanosensor9,10. A sonda pode ser frontal ou traseira-carregado na cânula (dependendo do design), e será protegido de danos ao penetrar o tecido dura e neural. Nós fornecemos exemplodes de um experimento in vivo com primatas não humanos, no qual usamos um microeletrodo de tungstênio para realizar estimulação elétrica e, posteriormente, injetamos muscimol no campo dos olhos frontais (FEF), enquanto o animal realizava uma tarefa de sacada guiada por memória (MGS).
Protocolo
Os procedimentos experimentais seguiram o Guia Nacional de Saúde para o Cuidado e Uso de Animais de Laboratório e a Society for Neuroscience Guidelines and Policies. Protocolos para procedimentos experimentais e comportamentais foram aprovados pelo Comitê Institucional de Cuidados e Uso de Animais da Universidade de Utah.
1. Construção do Microinjectrode para estimulação e gravação (Figura 1a)
- Medir o comprimento da cânula e da sonda (neste exemplo um nanosensor). A sonda deve ser mais longa do que a cânula pelo comprimento que é projetar-se da ponta da cânula (dependendo do projeto da sonda) mais aproximadamente 2 cm.
- uma lupa ou um microscópio (ampliação de~10x), carregue a sonda na cânula; se possível, um carregamento traseiro é preferível proteger a ponta da sonda.
Nota: Esta etapa, executada manualmente, é desafiante. Recomenda-se praticar com um microeletrodo uma lupa antes de tentar com uma sonda experimental real. -
Passe a cânula (contendo a sonda) através da ferrule superior, junção T e ferrule inferior.
- Se a sonda é apenas um único fio sem anexos, carregá-lo na cânula e inserir a montagem na junção T a partir da ferrule inferior. Topo da cânula (lado plano) deve ser posicionado no meio da junção T, dentro do fundo, mas não o ferrule superior. A sonda experimental ou biossensor deve se projetam acima da parte superior da ferrule superior.
Nota: Ferrules feitos medida também podem ser feitas através da perfuração de um buraco nos plugues ferrule usando micro brocas, o tamanho do buraco sendo baseado no diâmetro necessário para apertar a cânula para a junção T.
- Se a sonda é apenas um único fio sem anexos, carregá-lo na cânula e inserir a montagem na junção T a partir da ferrule inferior. Topo da cânula (lado plano) deve ser posicionado no meio da junção T, dentro do fundo, mas não o ferrule superior. A sonda experimental ou biossensor deve se projetam acima da parte superior da ferrule superior.
- Use a chave ferrule para apertar as ferrules na parte superior e inferior da junção T. Não aperte demais. Uma parte pequena de tubulação pode ser adicionada para reforçar a sustentação do elétrodo dentro do ferrule superior.
- Pinos de ouro da solda para cada um dos terminais de sonda (sinal, solo, etc.), de acordo com as especificações da sonda.
- Ajuste a posição relativa da sonda e da cânula. Medir a distância que a sonda está se projetando da cânula ampliação, e ajustar manualmente a partir da extremidade superior (sonda pode deslizar livremente dentro ferrules).
- Adicione a cola epóxi entre os pinos de ouro e a ferrule superior para anexar a sonda à ferrule.
- Desenrosque a ferrule superior para retrair a sonda dentro da cânula. Confirmar visualmente que a sonda está totalmente dentro da cânula ampliação.
- Anexar o injeto para o microdrive.
2. Construção do Microinjectrode para infusão de drogas (Figura 1b)
- Anexar o "não-beveled" ou flat-end da cânula para o fundo da junção T usando uma ferrule. Use a chave ferrule para apertar o ferrule.
- Anexe um pequeno pedaço de tubos capilares (~ 1,5 cm) para o topo da junção T, passando-o através da ferrule padrão. Aperte com uma chave de ferrule.
- Carregar de volta o microeletrodo através da tubulação capilar, Junção T, cânula e ferrules correspondentes.
- Certifique-se de que o back-end do eletrodo se projeta menos de 1 cm da parte de trás da tubulação capilar, e a ponta do eletrodo se projeta da cânula na distância desejada no lado inferior. A posição do eletrodo pode ser ajustada manualmente a partir do topo.
- Solda um alfinete de ouro para o terminal de microeletrodos.
- Adicione a cola epóxi entre o pino de ouro e a ferrule superior para anexar o microeletrodo à ferrule.
- Desenrosque a ferrule superior para retirar a sonda dentro da cânula. Confirmar visualmente que o microeletrodo é totalmente retraído na cânula.
3. Construção do Circuito Microfluídico (Figura 2)
- Coloque uma tábua de pão em uma superfície estável. Coloque as duas válvulas de três vias paralelas aos lados mais longos da placa, cerca de 6 polegadas, com uma porta (a que está sempre aberta) de frente para o outro. Use parafusos para reparar as válvulas ao breadboard.
- Coloque uma régua ao lado das válvulas (para medir e rastrear o movimento dos fluidos dentro da tubulação capilar).
- Carregue uma mistura de 1:1 óleo de baixa viscosidade e corante alimentar (marcador) na seringa gastight e coloque na bomba Marcador. Corte um pedaço de tubulação capilar e use ferrules padrão e conectores de bloqueio luer para conectar a seringa a uma das portas da válvula de entrada. Esta é a "linha marcadora".
- Corte um pequeno pedaço de tubos capilares para a "linha de régua". Use ferrules padrão para apertar aos portos de revestimento das válvulas.
- Corte dois pedaços mais longos de tubos capilares para conectar a válvula de saída ao microinjectrode e conecte a bomba de drogas à válvula de entrada (use ferrules padrão).
Nota: O comprimento dessas duas linhas depende da configuração experimental, uma deve ser longa o suficiente para alcançar do aparelho de infusão para o animal, e a outra da bomba de drogas para a válvula de entrada. Use uma pedra de clivagem para cortar a tubulação capilar.
4. Montagem do Microinjectrode para o Microdrive (Figura 3)
- Certifique-se de que a sonda microeletrodo/experimental seja retraída na cânula antes da montagem.
Nota: O tubo-guia deve estar em posição no microdrive. - Anexe um adaptador feito medida para o microinjectrode.
- Carregar o microinjectrode através do tubo de guia e fixá-lo para o adaptador usando parafusos.
- Medir a posição de microdrive (profundidade) em que o microinjectrode se projeta do tubo-guia, em seguida, retrai-lo ~ 1 cm para se preparar para a inserção.
- Para experimentos de microinfusão, conecte a "linha cerebral" à abertura não utilizada da junção T do microininjectrode. Use uma ferrule padrão e aperte com a chave de ferrule.
5. Rubor e Preparação do Sistema Microfluídico
- Posicione o microdrive com o microinjectrode sobre um copo de resíduos.
- Carregue a clorexidina (por exemplo, nolvasan; dissolvana em 20 g/L) na seringa gastight de 1 mL e coloque-a na bomba da droga. Vire a direção de fluxo das válvulas de tal forma que o fluido vai da bomba de drogas através da válvula para a linha da válvula e para fora da "linha cerebral".
- Lave o circuito com clorexidina usando uma baixa taxa de fluxo (50-200 μL/min) por um mínimo de 10 min. Repita os passos 5,2 a 5,3 com soro salina estéril e, em seguida, ar.
Nota: É importante verificar se há vazamentos nesta fase. Aplique delicadamente as limpezas fiapos-livres nas junções para ajudar a revelar todos os escapes líquidos através das ferrules. - Carregue a droga na seringa gastight de 500 μL, comprima o ar e coloque-a então na bomba da droga. Flua a 50 μL/min até que algumas gotas fluam do microinjectrode.
- Mergulhe o tubo-guia em clorexidina (dissolvido a 20 g/L) por 15 min.
- Vire a direção da válvula de saída em direção à "linha de descarga". Avançar a bomba Marcador até que uma borda clara de cor e óleo é observado na linha de régua. Certifique-se de que há sempre óleo entre a droga ea cor, a fim de não misturar os dois materiais solúveis em água e perder a borda afiada entre eles. Marque a posição inicial desta linha de óleo/tinqinteiro (com um pedaço de fita ou marcador).
- Vire a direção da válvula de saída em direção à linha cerebral.
6. Gravação de execução ou um experimento de infusão
Nota: As etapas de manuseio de animais variam dependendo do laboratório e do experimento. As seguintes etapas devem ser executadas depois que a configuração cirúrgica necessária e a preparação foram executadas para expor o dura. Após o experimento, todas as etapas pós-procedimento necessárias devem ser realizadas de acordo com protocolos aprovados institucionalmente.
- Anexe o microdrive à câmara de gravação. Abaixe o tubo de guia para penetrar a dura.
Nota: O tubo-guia não deve penetrar mais do que a dura, a fim de evitar danificar o córtex. - Abaixe o microinjectrode a aproximadamente 2 milímetros acima do local para a gravação/injeção no cérebro.
- Aperte a ferrule superior (microeletrodo/biossensor saliente) e conecte os pinos de ouro ao sistema de gravação. Continue avançando o microinjectrode para o local alvo.
Nota: Lembre-se de incluir a distância que o microeletrodo se estende além da cânula nos cálculos. - Para experimentos de infusão, use a bomba manual de microseringa para mover a coluna de óleo por 1 cm a cada 3 min (~60 nL/min). Uma vez que o volume desejado foi infundido, mude a válvula da saída para a linha nivelando.
Nota: O volume infundido variará com base em espécies modelo e área do cérebro alvo. Taxas de fluxo mais rápidas podem danificar o tecido neural. - Quando os experimentos estiverem completos, retire o microinjectrode dentro do tubo-guia (deixe a sonda saliente). Em seguida, retire o microdrive para rubor. Lave o sistema microfluídico descrito nos passos 5.1-5.5. para se preparar para a reutilização.
Nota: Em nossa experiência, o microinjectrode durará para diversos usos se o cuidado apropriado é tomado. A qualidade do registro eletrofisiológico cai mais rápido do que a capacidade de injeção.
Resultados
Realizamos injeção de um agonista GABAa (muscimol) para inativação reversível do campo dos olhos frontais (FEF), enquanto o animal realizou uma tarefa de sacade guiada por memória11. Nesta tarefa, o animal se fixa e um alvo visual periférico é apresentado. O animal mantém fixação ao lembrar o local alvo, e uma vez que o ponto de fixação desaparece, executa um movimento ocular saccadic para o local lembrado para receber uma recompensa. O microinjectrode foi construído de acordo com instruções na Figura 1b. O volume de infusão para o experimento de exemplo foi de 850 nL. O desempenho comportamental na tarefa de sacade guiada por memória (MGS) em vários locais e horários em relação à infusão de muscimol é mostrado na Figura 4. Os maiores déficits de desempenho foram observados em 2 a 3 h pós-infusão.

Figura 1: Fabricação passo a passo de microinjectrode. (a)Configuração para uso independente do sistema microfluídico. Cânula e sonda são medidos para confirmar que a ponta da sonda pode ser saliente no comprimento desejado (por exemplo, 150 μm). A sonda está carregada na cânula. A cânula é passada através da junção T e anexada no lado inferior, com a extremidade plana no meio da junção T; a extremidade traseira da sonda continua através da ferrule superior. O microinjectrode é finalizado por pinos de ouro solda em cada um dos terminais de sonda e adicionando cola entre eles e a ferrule superior para a estabilidade. A conexão com o sistema de aquisição depende do projeto da sonda. Neste exemplo, nossa sonda é um nanosensor com três pistas. (b)Configuração para uso com sistema microfluídico. Para acoplar o microinjectrode ao sistema microfluidic, uma parte de tubulação capillary é usada para o lado superior da T-junção. A sonda pode ser frontal ou traseira carregada. A linha microfluídica é então conectada à terceira abertura da junção T. Neste exemplo, usamos um microeletrodo. Veja a imagem ampliada da ponta de uma cânula em que o microeletrodo foi sobretruded apertando o ferrule superior. Veja a Tabela de Materiais para uma lista de itens usados na construção. Clique aqui para ver uma versão maior deste número.
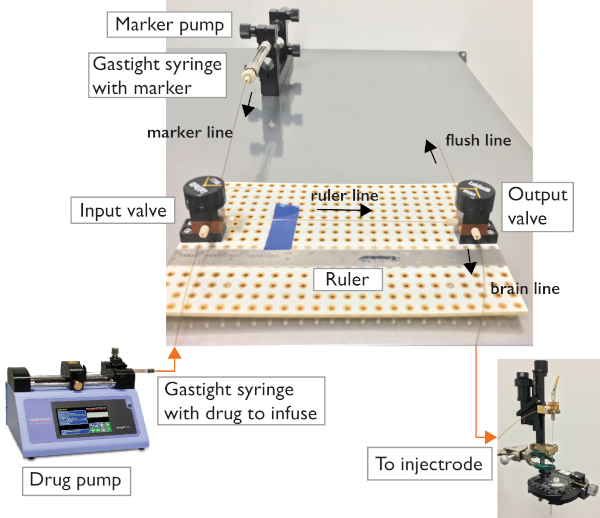
Figura 2: Sistema microfluídico. A configuração de duas válvulas permite o controle da direção de fluxo em direção ao microinjectrode ou em direção à linha de descarga para solução de problemas. O circuito conta com duas válvulas de 3 portas conectadas usando tubos capilares e ferrules padrão. Seringas gasesas são usadas para transportar e injetar a droga de infusão e o marcador. Uma bomba de seringa programável permite a lavagem automática do sistema e o carregamento da droga. Uma bomba manual da microseringa permite a injeção e a visualização controladas. Clique aqui para ver uma versão maior deste número.

Figura 3: Montagem de microinjectrode a um microdrive hidráulico com e sem capacidade de injeção. Passo 4.1: Um adaptador feito medida permite a fixação do microinjectrode ao microdrive. Um único parafuso une o adaptador ao microdrive; dois parafusos seguram microinjectrode ao adaptador. A ferrule superior deve ser desaparafusada pelo menos 2 voltas a fim proteger a ponta da ponta da ponta da ponta da ponta da ponta do microelectrode/experimental sonda ao carregar o microinjectrode no tubo de guia da micromovimentação. Passo 4.3: Insira microinjectrode no tubo-guia a partir do topo. Passo 4.4: Se realizar microinfusão, ligue a linha de drogas para a terceira abertura da junção T usando uma ferrule de plástico. Clique aqui para ver uma versão maior deste número.
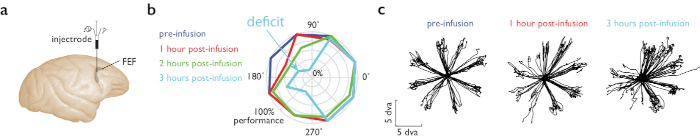
Figura 4: Tarefa guiada de sacada de memória durante a infusão de muscimol na FEF. (a)O microinjectrode foi colocado no hemisfério direito, área fef. (b)Desempenho comportamental durante uma tarefa mgs em que oito alvos são colocados perifericamente. Nós corremos 4 blocos da tarefa MGS, antes e em três vezes após a injeção. Enredo polar mostra desempenho (excentricidade) em cada um desses tempos (cor), para diferentes locais em relação ao ponto de fixação (ângulo na trama polar). O desempenho diminuiu claramente no hemifield visual esquerdo 2 h após a injeção (traço azul, metade esquerda da trama polar). (c)Traços de Saccade para 8 locais de memória periférica antes (à esquerda) e após a injeção de muscimol na FEF (direita, 1 e 3 h pós-infusão). A precisão da saccade no hemifield visual esquerdo (metade esquerda das parcelas polares) diminuiu após a injeção de muscimol. Escala em graus de ângulo visual (dva). Clique aqui para ver uma versão maior deste número.
Discussão
Vários métodos estão atualmente disponíveis para realizar entrega e eletrofisiologia simultânea de medicamentos. Nosso sistema destina-se a ter a flexibilidade para ser usado para gravações de forma independente ou em combinação com a injeção de drogas, e ter a capacidade de colocar com precisão qualquer sonda experimental frágil, como um nanosensor ou um microeletrodo, protegido de qualquer dano, através da dura mater e tecido neural. O sistema permite o controle preciso dos volumes de infusão de drogas a olho nu (17 nL precisão mostrada em estudos anteriores em nosso laboratório3).
Existem sistemas mais especializados para injeção de pressão com diâmetros menores12. Esses sistemas permitem vários locais de gravação, mas a configuração complexa de software e hardware necessária para o controle do sistema carrega custos mais altos para cada um dos componentes e tem menos flexibilidade para interagir com sondas experimentais que ainda não são comercializadas em grande escala. Além disso, nosso injetode não requer um implante crônico e proporciona um grande grau de flexibilidade: compatível com biossensores para medir sinais químicos e eletrofisiológicos, e capaz de infundir drogas também, com o potencial de medir o efeito das infusões de medicamentos localizados nessas respostas.
O projeto permite que a sonda experimental seja sobretruded após a penetração dura a fim evitar dano à estrutura da ponta de prova. Esta característica permite que a multifuncionalidade do dispositivo, penetre a dura sem arriscar danos de qualquer sonda experimental, como nanosensores em escala de nanômetros10. No entanto, há uma limitação do comprimento que pode ser saliente, restringido pelo número de voltas da ferrule, limitado a ~ 1 mm para os ferrules padrão. Há danos mínimos nos tecidos devido ao pequeno diâmetro da cânula (228 μm).
No experimento que mostramos, o sistema foi usado para realizar a entrega controlada de muscimol para inativação reversível de FEF, simultaneamente com estimulação elétrica ou gravação extracelular (neurônio único, potencial de campo local) usando um microeletrodo. Este experimento na FEF requer microestimulação da FEF para confirmar vetores de saccade antes da inativação, e a droga foi infundida para estudar a memória de trabalho durante a inativação reversível da FEF. É improvável que uma gravação do mesmo neurônio isolado único pode ser mantida antes e depois da injeção de drogas; no entanto, fomos capazes de registrar potenciais de campo local antes e depois da infusão. Aqui, mostramos um experimento combinando injeção, gravação e estimulação elétrica.
Uma vez configurado, o método é muito confiável e robusto. No entanto, devido à precipitação de pequenas moléculas (por exemplo, sal) dentro do pequeno tubo e portas, uma descarga completa é necessária após cada experimento, a fim de manter a microfluídica livre de obstruções e vazamentos. Devido à simplicidade de todo o circuito, cada componente pode ser substituído de forma independente para fácil solução de problemas.
Embora o método tenha sido demonstrado na área de FEF em um primata não humano, o princípio pode ser aplicado a qualquer outra área cerebral onde alguma combinação de estimulação elétrica, registro e injeção de drogas são desejadas, em espécies de tamanho de roedorou maior.
Divulgações
Nenhum.
Agradecimentos
Este trabalho foi apoiado por financiamento dos Institutos Nacionais de Saúde (NIH), concede EY026924 e EY014800 (para B.N.), um Subsídio Irrestrito de Pesquisa para Prevenir a Cegueira, Inc., Nova York, NY para o Departamento de Oftalmologia e Ciências Visuais, Universidade de Utah, e os fundos de start-up fornecidos à R.E. pela Henry Samueli School of Engineering e pelo Departamento de Engenharia Elétrica da Universidade da Califórnia, Irvine. Este método é baseado em um relatório anterior de um método semelhante desenvolvido no laboratório do Dr. Tirin Moore, publicado em Noudoost & Moore 2011, Journal of Neuroscience Methods. Os autores agradecem ao Dr. Kelsey Clark por seus comentários sobre o manuscrito.
Materiais
| Name | Company | Catalog Number | Comments |
| 3-port manual valves | LabSmith | Manual 3-Port Selector Valve (MV201-C360) | https://products.labsmith.com/mv201-manual-3-port-selector-valve/#.XNYEC9NKh26 |
| Cannulae | Vita Needle Company | 304 Stainless steel tubing, Outer Diameter 228μm, Inner Diameter 165μm | Vita Needle Master Tubing Gauge Chart |
| Cleaving stone | Molex | Cleaving stone 1" x 1" (part No. 1068680064) | Highly recommended to follow method for cleaving capillary tubing: https://www.cmscientific.com/info_sheets/cleaving_procedure.pdf |
| Clorhexidine diacetate | Walmart | Nolvasan solution disinfectant (AAP311) | Used for microfluidic circuit flushing, dissolved at 20 g/L |
| Custom adapter | Custom provider | - | Custom machined adapter to connect microinjectrode to hydraulic microdrive |
| Driver | LabSmith | T7 TORX driver for installing breadboard screws (LS-TORX Driver) | https://products.labsmith.com/ls-torx-driver/#.XO8sndNKh25 |
| Epoxy glue | LabSmith | Two-part high-strength epoxy adhesive (LS-EPOXY) for metal and plastic bonding | https://products.labsmith.com/ls-epoxy-12ml-epoxy-adhesive/#.XO8t89NKh24 |
| Ferrule | LabSmith | One-Piece Fitting (C360-100) for connecting capillary, thru hole sized for 360μm OD capillary | https://products.labsmith.com/one-piece-fitting#.XNYEaNNKh24 |
| Ferrule plug | LabSmith | One-Piece Plug (C360-101) for use in any -C360 port | https://products.labsmith.com/one-piece-fitting-plug/#.XNYFl9NKh24 |
| Ferrule wrench | LabSmith | 1/8" hex wrench for installing one-piece fittings and plugs (LS-HEX 1/8" Hex Wrench) | https://products.labsmith.com/ls-hex-1-8-hex-wrench/#.XO8sqtNKh24 |
| Gastight syringe | Hamilton Company | 500μL gastight syringe model 1750 (81220) and 1mL gastight syringe model 1001 (81320) | https://www.hamiltoncompany.com/laboratory-products/syringes/81220#top |
| Gold pins | Aim-Cambridge | Male gold plated crimp-on connector pin (40-9856M) | https://www.masterelectronics.com/aim-cambridge-cinch-connectivity-solutions/409856m-10109145.html |
| Lint-free wipes | Kimberly Clark | Kimtech Science Kimwipes Delicate Task | Lint-free wipes, used to identify leaks in the system |
| Liquid food color | McCormick & Co. | Water based, black liquid food color (52100581873) | https://www.mccormick.com/spices-and-flavors/extracts-and-food-colors/food-colors/black-food-color |
| Low viscosity oil | Clearco Products Co. | Pure Silicone Fluid Octamethyltrisiloxane with a viscosity of 1cSt at 25°C (PSF-1cSt) | http://www.clearcoproducts.com/pure-silicone-super-low-viscosity.html |
| Luer-Lock connector | LabSmith | Luer-Lock Adapter (C360-300), female fitting for connecting Luer Lock syringe to 360μm capillary tubing | https://products.labsmith.com/luer-lock-adapter-assembly#.XO81MtNKh24 |
| Micro drill bits | Grainger | Micro drill bit, 0.23mm (414H85) | https://www.grainger.com/category/machining/drilling-and-holemaking/drill-bits/machining-drill-bits/micro-drill-bits |
| Microelectrode | FHC | Metal microelectrode, tungsten with epoxy insulation | https://www.fh-co.com/category/metal-microelectrodes |
| Oil hydraulic micromanipulator | Narishige Group | Oil Hydraulic Micromanipulator with guide tube attached (MO-96) | http://products.narishige-group.com/group1/MO-96/chronic/english.html |
| Polymicro Capillary Tubing | Molex | Polymicro Flexible Fused Silica Capillary Tubing (TSP150375), Outer Diameter 375µm, Inner Diameter 150µm | Polymicro Capillary Tubing |
| Programmable syringe pump | Harvard Apparatus | Standard Infuse/Withdraw Pump, programmable (70-2213) | https://www.harvardapparatus.com/standard-infuse-withdraw-pump-11-pico-plus-elite-programmable-syringe-pump.html |
| Ruler | Empire | Stainless steel 6" Stiff ruler (27303) | http://www.empirelevel.com/rulers.php |
| Screw set | LabSmith | Valve mounting screw set (LS-SCREWS .25), thread-forming screws (2-28 x 1/4”) to mount valves to breadboard | https://products.labsmith.com/ls-screws-25#.XO8widNKh24 |
| Standard Breadboard | LabSmith | 4" x 6" platform (LS600), with 0.25" hole spacing for mounting fluid circuit | https://products.labsmith.com/standard-breadboard/#.XO8xDdNKh24 |
| Sterile saline (sodium chloride) 0.9% | Baxter | 0.9% Sodium Chloride sterile | Sterile Intravenous Infusion |
| Sterile syringe filters | Millipore Sigma | MilliporeSigma™ Millex™-GP Sterile Syringe Filters with PES Membrane (SLGPM33RS) | https://www.fishersci.com/shop/products/emd-millipore-millex-sterile-syringe-filters-pes-membrane-green-4/slgpm33rs |
| Stoelting manual microsyringe pump | Stoelting Company | Manual infusion/withdrawal pump (51222) | https://www.stoeltingco.com/manual-infusion-withdrawal-pump-2649.html |
| T-junction | LabSmith | Interconnect tee (C360-203) for combining flow streams, for use with 360μm OD capillary tubing | https://products.labsmith.com/interconnect-tee#.XO8z8dNKh24 |
Referências
- Chen, L. T. L., Goffart, L., Sparks, D. L. A simple method for constructing microinjectrodes for reversible inactivation in behaving monkeys. Journal of Neuroscience Methods. 107 (1-2), 81-85 (2001).
- Crist, C. F., Yamasaki, D. S. G., Komatsu, H., Wurtz, R. H. A grid system and a microsyringe for single cell recording. Journal of Neuroscience Methods. 26 (2), 117-122 (1988).
- Noudoost, B., Moore, T. A reliable microinjectrode system for use in behaving monkeys. Journal of Neuroscience Methods. 194 (2), 218-223 (2011).
- Zhang, S., et al. Real-time simultaneous recording of electrophysiological activities and dopamine overflow in the deep brain nuclei of a non-human primate with Parkinson's disease using nano-based microelectrode arrays. Microsystems & Nanoengineering. 4, (2018).
- Altuna, A., et al. SU-8 based microprobes for simultaneous neural depth recording and drug delivery in the brain. Lab on a Chip. 13 (7), 1422-1430 (2013).
- Noudoost, B., Clark, K. L., Moore, T. A Distinct Contribution of the Frontal Eye Field to the Visual Representation of Saccadic Targets. Journal of Neuroscience. 34 (10), 3687-3698 (2014).
- Rajalingham, R., DiCarlo, J. J. Reversible Inactivation of Different Millimeter-Scale Regions of Primate IT Results in Different Patterns of Core Object Recognition Deficits. Neuron. 102 (2), 493 (2019).
- Katz, L. N., Ates, J. L. Y., Pillow, J. W., Huk, A. C. Dissociated functional significance of decision-related activity in the primate dorsal stream. Nature. 535 (7611), 285 (2016).
- Esfandyarpour, R., Esfandyarpour, H., Javanmard, M., Harris, J. S., Davis, R. W. Microneedle biosensor: A method for direct label-free real time protein detection. Sensors and Actuators B-Chemical. 177, 848-855 (2013).
- Esfandyarpour, R., Yang, L., Koochak, Z., Harris, J. S., Davis, R. W. Nanoelectronic three-dimensional (3D) nanotip sensing array for real-time, sensitive, label-free sequence specific detection of nucleic acids. Biomedical Microdevices. 18 (1), (2016).
- Bahmani, Z., Daliri, M. R., Merrikhi, Y., Clark, K., Noudoost, B. Working Memory Enhances Cortical Representations via Spatially Specific Coordination of Spike Times. Neuron. 97 (4), 967-979 (2018).
- Veith, V. K., Quigley, C., Treue, S. A Pressure Injection System for Investigating the Neuropharmacology of Information Processing in Awake Behaving Macaque Monkey Cortex. JoVE: Journal of Visualized Experiments. (109), (2016).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados