Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Génération d’une puce de barrière de sang-brain basée sur iPSC
Dans cet article
Résumé
La barrière hémato-encéphalique (BBB) est une unité neurovasculaire multicellulaire régulant étroitement l’homéostasie cérébrale. En combinant les iPSC humains et les technologies d’organes sur puce, nous avons généré une puce BBB personnalisée, adaptée à la modélisation des maladies et aux prédictions de pénétrabilité des médicaments du SNC. Un protocole détaillé est décrit pour la génération et l’exploitation de la puce BBB.
Résumé
La barrière hémato-encéphalique (BBB) est formée par des unités neurovasculaires (NSU) qui protègent le système nerveux central (SNC) d’une série de facteurs trouvés dans le sang qui peuvent perturber la fonction cérébrale délicate. En tant que tel, le BBB est un obstacle majeur à la livraison de produits thérapeutiques au SNC. L’accumulation des preuves suggère que le BBB joue un rôle clé dans l’début et la progression des maladies neurologiques. Ainsi, il y a un besoin énorme pour un modèle de BBB qui peut prévoir la pénétration des drogues cNS-visées aussi bien qu’élucider le rôle du BBB dans la santé et la maladie.
Nous avons récemment combiné des technologies d’organe sur puce et de cellules souches pluripotentes induites (iPSC) pour générer une puce BBB entièrement personnalisée aux humains. Cette nouvelle plate-forme affiche les propriétés cellulaires, moléculaires et physiologiques qui conviennent à la prédiction du transport de médicaments et de molécules à travers le BBB humain. En outre, en utilisant des puces BBB spécifiques au patient, nous avons généré des modèles de maladies neurologiques et démontré le potentiel d’applications de médicaments prédictifs personnalisés. Fourni ici est un protocole détaillé démontrant comment générer des puces BBB dérivées de l’iPSC, en commençant par la différenciation des cellules endothéliales microvasculaires du cerveau dérivées de l’iPSC (iBMECs) et résultant en cultures neuronales mixtes contenant des progéniteurs neuronaux, neurones différenciés et astrocytes. On décrit également une procédure pour l’ensemencement des cellules dans la puce d’organe et la culture des puces de BBB sous le flux laminaire contrôlé. Enfin, des descriptions détaillées des analyses de puces BBB sont fournies, y compris des tests de perméabilité paracellulaire pour évaluer la perméabilité des médicaments et des molécules ainsi que des méthodes immunocytochimiques pour déterminer la composition des types de cellules à l’intérieur de la puce.
Introduction
Le BBB est une barrière très sélective qui sépare le SNC du sang circulant. Il protège les fonctions critiques du cerveau contre les substances potentiellement perturbatrices, les facteurs et les xénobiotiques tout en permettant l’afflux de nutriments et d’autres métabolites nécessaires pour maintenir l’homéostasie du cerveau1. Le BBB est un NVU multicellulaire dans lequel les péricytes, les pieds d’extrémité d’astrocyte, et les processus neuronaux contactent directement les cellules endothéliales microvasculaires de cerveau (BMECs). Ces interactions permettent aux BMEC de former des propriétés de barrière spécialisées qui sont soutenues par des jonctions serrées et adhérentes2,3. La formation de cette barrière limite le passage paracellulaire des molécules, mais elle contient des transporteurs polarisés pour transporter activement des molécules dans le SNC ou dans le sang1. En raison de ces propriétés de barrière uniques, le BBB constitue un obstacle majeur à la livraison de produits biopharmaceutiques dans le cerveau, et on estime que moins de 5% des petites molécules approuvées par la FDA peuvent atteindre le SNC4.
Les modèles animaux ont été largement utilisés pour étudier la pénétration de BBB et les mécanismes moléculaires impliqués dans le développement de BBB5. Alors que les modèles animaux représentent fidèlement l’environnement in vivo multicellulaire complexe, les différences d’expression et d’activité des transporteurs BBB ainsi que la spécificité du substrat entre les espèces empêchent souvent l’extrapolation précise des données animales aux humains6. Ainsi, les modèles à base humaine sont essentiels pour étudier le BBB humain et pour une utilisation dans le développement de médicaments conçus pour cibler le SNC. Ce besoin devient encore plus évident avec la prédominance croissante des médicaments biologiques spécifiques à l’homme dans le domaine du développement pharmaceutique. L’accumulation de preuves suggère qu’un BBB compromis est associé à un certain nombre de troubles graves du SNC, y compris les tumeurs cérébrales et les maladies neurologiques7,8,9. Les modèles humains reflétant fidèlement ces maladies ont le potentiel d’identifier à la fois 1) de nouvelles voies qui pourraient être ciblées pour le développement de médicaments et 2) de prédire la pénétration du SNC, réduisant ainsi le temps et les ressources dans les études précliniques et peut-être la diminution du taux d’échec dans les essais cliniques.
Des modèles in vitro ont été largement mis en œuvre pour étudier les interactions entre les BMEC et d’autres cellules de la NVU et effectuer des écrans pour les médicaments bBB-perméables potentiels10. Pour recréer les aspects clés du BBB humain, les modèles in vitro doivent présenter des propriétés physiologiquement pertinentes (c.-à-d. faible perméabilité paracellulaire et résistance électrique transendothéliale physiologiquement pertinente [TEER] à travers la monocouche endothéliale). En outre, le profil moléculaire d’un système in vitro doit inclure l’expression de systèmes de transport fonctionnels représentatifs. Typiquement, les modèles in vitro sont composés de cellules endothéliales qui sont co-cultivées sur une membrane semi-perméable avec des combinaisons d’autres cellules NVU pour améliorer les propriétés BBB11. Cette approche permet une évaluation simple et relativement rapide de la fonctionnalité de la barrière et de la perméabilité des molécules. De tels modèles de BBB à base de cellules peuvent être établis avec des sources de cellules animales ou humaines, y compris des cellules isolées des excisions chirurgicales ou des lignées de BMEC immortalisées.
Récemment, des protocoles visant à différencier les cellules pluripotentes humaines en BMEC ont été introduits comme une source attrayante pour les modèles bBB humains in vitro12,13. Les BMECs (iBMECs) dérivés de cellules souches pluripotentes induites (iPSC) sont très évolutifs, démontrent des caractéristiques morphologiques et fonctionnelles cruciales du BBB humain, et portent la génétique du patient. En culture, les iBMEC forment une monocouche qui exprime des marqueurs de jonction serrés et affiche des complexes de jonction serrés semblables à des vivo. Ces cellules expriment également des marqueurs de BBB, y compris le transporteur de glucose de BBB, le transporteur de glucose 1 (GLUT1). Fait important, et contrairement à d’autres sources cellulaires alternatives pour les BMEC humains, les iBMECs acquièrent des propriétés de barrière avec des valeurs aussi élevées que celles mesurées in vivo14,polarisent le long de l’axe basolatéral, et expriment les pompes fonctionnelles d’efflux. En outre, l’utilisation d’iPSC de divers sujets à la fois 1) se félicite de la possibilité de tester les aspects de la BBB d’une manière de médecine personnalisée et 2) fournit une source flexible pour générer des types de cellules supplémentaires de la NVU. Générer ces cellules à partir d’une source de cellules isogéniques pour créer des puces BBB personnalisées aiderait également à comprendre les différences interindividuelles dans les réponses aux médicaments, ce qui est une cause majeure de résistance ou de réponse compromise au traitement observé dans les études cliniques.
L’utilisation d’iBMECs comme monocouches dans un plat ou sur un insert transwell semi perméable représente une approche puissante pour la modélisation BBB. Ces systèmes ont tendance à être robustes, reproductibles et rentables. En outre, les analyses fonctionnelles telles que TEER et perméabilité sont relativement simples à effectuer. Cependant, les systèmes bidimensionnels (2D) ne récapitulent pas la nature 3D du tissu in vivo, et ils n’ont pas les forces physiologiques de stress de cisaillement fournies par le sang et les cellules sanguines circulants. Cela limite la capacité de l’endothélium vasculaire dans ces modèles de développer et de maintenir les propriétés et les fonctions intrinsèques bBB.
Des systèmes micro-ingénieurs bordés de cellules vivantes ont été mis en place pour modéliser diverses fonctionnalités d’organes dans un concept appelé organ-on-chips. En recréant l’architecture multicellulaire in vivo-like, les interfaces tissu-tissu, les microenvironnements physicochimiques, et la perfusion vasculaire, ces plates-formes microengineered génèrent des niveaux de la fonctionnalité de tissu et d’organe pas possible avec systèmes de culture 2D conventionnels. Ils permettent également la haute résolution, l’imagerie en temps réel, et l’analyse des profils biochimiques, génétiques, et métaboliques semblables aux cellules vivantes dans le tissu in vivo et le contexte d’organe. Cependant, un défi particulier de l’orgue sur la puce est que la conception, la fabrication et l’application de ces puces micro-ingénierie nécessite une expertise en ingénierie spécialisée qui fait généralement défaut dans les laboratoires universitaires orientés biologiquement.
Nous avons récemment combiné les technologies iPSC et organ-on-chip pour générer un modèle personnalisé de puce BBB15,16. Afin de surmonter les défis technologiques décrits, le Chip-S1 disponible dans le commerce est utilisé avec le module de culture, un instrument conçu pour automatiser l’entretien des puces d’une manière simple et robuste (Emulate Inc.). La puce BBB recrée les interactions entre les cellules neurales et endothéliales et atteint des valeurs TEER physiologiquement pertinentes, qui sont mesurées par des puces d’organes faites sur mesure avec des électrodes aurifères intégrées17. En outre, la puce BBB affiche une faible perméabilité paracellulaire, répond aux signaux inflammatoires au niveau des organes, exprime des pompes à efflux actives et présente un transport prédictif de biomarqueurs solubles et de produits biopharmaceutiques. Notamment, les puces BBB générées par plusieurs individus capturent les différences fonctionnelles attendues entre les personnes en bonne santé et les patients atteints de maladies neurologiques15.
Le protocole détaillé ci-dessous décrit une méthode fiable, efficace et reproductible pour la génération de puces BBB à base d’iPSC dans des conditions de flux dynamiques. Des directives sont fournies sur le type d’analyses et d’analyses de points de terminaison qui peuvent être effectuées directement dans la puce BBB ou à partir d’effluents d’échantillonnage. Ainsi, le protocole démontre le spectre des techniques qui peuvent être appliquées pour évaluer les propriétés et les réponses biologiques et fonctionnelles dans un modèle humain-pertinent.
Une brève description de la puce BBB basée sur iPSC est fournie ici. Les iPSC humains sont initialement différenciés et propagés dans les flacons de culture tissulaire sous forme d’agrégats flottants d’ancêtres neuronaux, appelés ez-sphères. Le canal supérieur de la Chip-S116,18,19 est enseveavec avec dissociéEZ EZ-sphères qui forment le «côté cerveau» de la puce, que les cellules se différencient sur 7 jours dans une culture mixte de cellules progénitrices neuronales (iNPc), iAstrocytes, et iNeurons. Les iPSC humains sont également différenciés dans les plaques de culture tissulaire en iBMECs. Le canal inférieur de la puce est ensevement d’iBMECs pour former le « côté sang » au fur et à mesure qu’ils se développent pour former un tube endothélial (Figure 1). La membrane enduite de matrice extracellulaire poreuse (ECM) qui sépare les canaux supérieurs et inférieurs 1) permet la formation d’interactions cellule-cellule entre les canaux et 2) permet à l’utilisateur d’exécuter des essais de perméabilité et des cellules d’image dans l’un ou l’autre canal à l’aide d’un microscope à lumière classique.
Protocole
1. Génération de cellules progénitrices neurales dérivées de l’iPSC (iNPC)
- Produire des EZ-sphères à partir de colonies iPSC comme décrit ci-dessous et comme précédemment publié20,21,22.
- Culture iPSC colonies à la confluence sur la membrane du sous-sol matrice enduite 6 plaques de puits (0,5 mg/plaque) dans mTESR1 ou d’autres médias commerciaux (voir Tableau des matériaux).
- Retirez le milieu iPSC et remplacez-le par 2 ml de milieu EZ-sphère [ESM; DMEM:F12 7:3 complété par 100 ng/mL facteur de croissance de base de fibroblaste (bFGF), 100 ng/mL facteur de croissance épidermique, 5 'g/mL héparine, et 2% B27 supplément].
- Gratter le fond de chaque puits de confluent avec le dos d’une pointe stérile de tuyauterie de 1000 l ou d’un grattoir cellulaire.
- Recueillir toutes les cellules et placer dans un flacon t25 d’attachement ultra-faible pour permettre la formation spontanée de sphères flottantes. Incuber toute la nuit à 37 oC.
- Nourrir les sphères tous les 2 à 3 jours lorsque le milieu jaunit en remplaçant la moitié du milieu par un ESM frais. Cela permet aux sphères de rester dans le milieu conditionné, ce qui est très important pour leur croissance et leur entretien.
- Abaissez le flacon sur un support à tube et laissez les sphères se déposer par gravité pendant une demi-min jusqu’au coin du flacon.
- Une fois installé, aspirez la moitié du supernatant avec une pipette sérologique de 5 ml ou 10 ml et remplacez par un ESM frais et préréchauffé.
- Passage EZ-sphères hebdomadaire en coupant des sphères à 200 diamètres de m comme précédemment décrit23,20,21. Les sphères EZ peuvent être maintenues jusqu’à 25 passages et sont idéales lorsqu’elles sont utilisées entre les passages 8-25.
- Préparer la suspension à cellule unique des iNPC :
- Pour induire la différenciation neuronale, dissocier EZ-sphère en cellules simples.
- Recueillir les sphères 3 à 4 jours après le hachage d’un flacon T75 et le transférer dans un conique de 15 ml, puis laisser reposer pendant 2 min ou jusqu’à ce que toutes les sphères soient réglées au fond.
- Retirez lentement l’ESM avec une pipette de 5 ml sans perturber les sphères installées. Ajouter 1 ml de solution de dissociation (voir Tableau des matériaux)et couver pendant 10 min à 37 oC.
- Tourbillonner la solution de dissociation et les sphères après 5 min d’incubation pour s’assurer que toutes les sphères réglées sont traitées.
- Retirez lentement la solution de dissociation. Ajouter 1 ml de milieu de différenciation neuronale [NDM; DMEM: F12 avec 2% B27 moins la vitamine A, 1% N2 supplément, et le cerveau humain dérivé du facteur neurotrophique (hBDNF, 20 ng/mL)].
- Trituratez les sphères en cellules individuelles à l’aide d’une pipette de 1 ml suivie d’une pipette de 200 l, jusqu’à ce que toutes les sphères se soient dissociées. Évitez la formation de bulles pendant la procédure de trituration.
- Compter les cellules dissociées à l’aide d’un hémocytomètre et diluer les cellules jusqu’à une densité finale de 1 x 106 cellules/mL. Il est possible de modifier la densité en fonction de l’application.
REMARQUE : Des densités plus élevées (jusqu’à 6 x 106 cellules/mL) sont recommandées pour les cultures à court terme allant jusqu’à 3 jours, et des densités plus faibles sont recommandées pour les applications à long terme allant jusqu’à 3 semaines.
REMARQUE : Les cellules sont maintenant prêtes à semer dans le canal supérieur de la puce pour former le « côté cerveau ».
2. Différenciation des iPSC en iBMECs
- Passage iPSCs d’un puits de confluent unique d’une plaque de puits 6 à un rapport de 1:6 dans une plaque de 6 puits membrane de membrane recouverte de membrane. Laissez les cellules adhérer pendant 24 h. Changer le milieu iPSC tous les jours.
- Compter les cellules quotidiennement à l’aide d’un hémocytomètre.
- Lorsque les cellules atteignent une densité de 1,5 à 3,0 x 105 cellules/puits, remplacez le milieu iPSC par 3 ml de milieu non conditionné sans bFGF [DMEM:F12 1:1, avec 10 % de remplacement du sérum knock-out (KOSR), 1 % d’acides aminés non essentiels (NEAA), 0,5 % de supplément de glutamine(Tableau des matériaux),et 100 m-mercapto. Remplacer à moyen tous les jours pendant 6 jours24.
- Au jour 6, remplacer le milieu par la cellule endothéliale (EC) moyen [milieu sans sérum endothélial humain (hESFM) complété par 1% de sérum bovin plasmatique pauvre en plaquettes, 20 ng/mL bFGF, et 10 'M’acide rétinoïque tout-trans (RA)]. Laisser moyen pendant 2 jours.
- Retirez le milieu EC et ajoutez 1 ml de solution de dissociation par puits. Incuber à 37 oC pendant 35 min.
REMARQUE: Bien que cela soit considéré comme un long temps d’incubation dans la solution de dissociation utilisée ici, iBMECs peuvent supporter ce traitement avec une viabilité cellulaire supérieure à 90%. - Détachez les cellules du puits en pipetilant doucement la suspension cellulaire et en recueillant toutes les cellules dans un tube conique de 15 ml.
REMARQUE : Évitez les tuyaux durs. Si les cellules ne se détachent pas facilement, incuber pendant 5 min supplémentaires. - Ajouter 1 volume de milieu EC dans le conique de 15 ml pour inactiver Accutase, centrifugeuse à 200 x g pendant 5 min, retirer le milieu et remplacer par 1 ml de milieu EC (sans bFGF et RA).
- Comptez les cellules à l’aide d’un hémocytomètre et ajustez la densité cellulaire à 14 à 20 x 106 cellules/mL.
REMARQUE : Les cellules sont maintenant prêtes à être ensemencées dans le canal inférieur de la puce pour former le « côté sang ».
3. Microfabrication de la puce d’organe
- Utilisez une puce d’organe pour le modèle de puce BBB et sa production comme fait précédemment16,18,19. La puce d’organe de canal haute (voir tableau des matériaux)est fabriquée à partir d’un élastomère polydiméthylsiloxane (PDMS) très flexible qui contient deux canaux micro-échelle superposés et parallèles séparés par une membrane poreuse flexible. Les tailles microcanaux supérieures et inférieures sont respectivement de 1 mm x 1 mm et de 1,0 mm x 0,2 mm. Les deux canaux sont séparés par une membrane poreuse flexible de 50 m d’épaisseur, contenant des pores de 7 m de diamètre avec un espacement de 40 m. La surface de la membrane poreuse qui sépare les canaux est de 0,171 cm2.
4. Préparation des copeaux
- Les puces d’organe sont fournies préemballées dans le support de puce, éliminant la nécessité de perturber ou de déformer l’alignement de puce pendant la manipulation. En outre, le support de puces se connecte en toute sécurité à un module portable ("Pod") qui agit comme l’interface entre le module de culture et la puce.
- Vaporiser l’emballage des copeaux avec 70 % d’éthanol et les introduire dans l’armoire de biosécurité (BSC).
- Ouvrez l’emballage et étaler la puce d’organe dans un plat stérile Petri. Manipulez le support de puce seulement par les côtés pour éviter le contact direct avec la puce.
- Assurez-vous que l’onglet du transporteur est orienté vers la droite (Figure 2), et lors de l’utilisation de plusieurs puces, alignez-les tous dans la même orientation.
- Étiquetez chaque puce sur l’onglet du transporteur (la préparation complète des puces et le flux de travail sont affichés dans la figure 3).
5. Activation de surface et revêtement ECM
- Préparation de la solution d’activation de surface
- Le réactif Emulate 1 (ER-1), fourni dans une fiole contenant 5 mg, est sensible à la lumière. Préparer la solution ER-1 fraîche immédiatement avant utilisation. L’intégrité ER-1 est cruciale pour la préparation réussie des jetons.
- Éteignez la lumière dans le BSC lors de la manipulation ER-1.
REMARQUE : L’ER-1 est un irritant pour les yeux et doit être manipulé dans le BSC avec des gants appropriés et une protection oculaire. - Laissez les réactifs ER-1 et ER-2 réacquiller à température ambiante (RT) avant utilisation.
- Protégez la solution de la lumière en enveloppant un tube conique stérile vide de 15 ml avec du papier d’aluminium.
- Dans le BSC, appuyez brièvement sur la fiole ER-1 pour régler la poudre au fond.
- Ajouter 1 mL de tampon ER-2 au flacon, et transférer immédiatement son contenu au fond du tube conique enveloppé de 15 ml. Ne pas pipette à mélanger. La couleur de la solution transférée au tube conique sera rouge.
- Répétez l’étape 5.1.6 3x. Au dernier tour, plafonner le flacon ER-1 et inverser pour recueillir toute poudre restante du couvercle, puis transférer la solution dans le tube conique; cela portera le volume total à 4 ml de solution ER-1.
- Ajouter 6 mL de solution ER-2 à la solution DE 4 ml d’ER-1 dans le tube conique de 15 ml jusqu’à une concentration finale de 0,5 mg/mL. Er-1 doit être entièrement dissous dans la solution ER-2.
- Activation de surface
- En utilisant une pipette P200 et une pointe de pipette filtrée stérile de 200 l, prenez 200 l de mélange ER-1.
- Placer la pipette dans l’entrée inférieure et pousser 20 'L du mélange ER-1 à travers le canal inférieur jusqu’à ce que le mélange commence à s’écouler de la sortie du canal inférieur.
- Ajouter environ 50 l de mélange ER-1 et le placer dans l’inlet du canal supérieur. Poussez le mélange à travers le canal supérieur jusqu’à ce qu’il commence à s’écouler de la sortie du canal supérieur.
- Retirer tout le mélange ER-1 excédentaire de la surface de la puce par aspiration douce. Assurez-vous que le mélange ER-1 n’est retiré que de la surface de la puce et non des canaux.
- Vérifiez que les canaux sont exempts de bulles d’air avant l’activation des rayons ultraviolets (UV). Si des bulles d’air sont détectées, retirer les bulles en lavant le canal avec le mélange ER-1.
- Placez le plat ouvert contenant les copeaux dans la boîte de lumière UV (fournie par Emulate Inc.).
- Réglez l’interrupteur à l’arrière de la boîte de lumière UV au réglage « Cohérent ». Allumez la puissance et lancez l’activation UV. Laisser les copeaux sous la lumière UV pendant 20 min.
REMARQUE : Évitez l’exposition du personnel à la lumière UV. - Retirer le mélange ER-1 des deux canaux.
- Laver chaque canal avec une solution ER-2 de 200 l.
- Retirez ER-2 des deux canaux.
- Laver chaque canal avec 200 l de saline à phosphate (DPBS) de Dulbecco, un froid stérile.
- Laissez le DPBS froid à l’intérieur des canaux jusqu’à l’étape suivante.
- Préparation et revêtement de matrice extracellulaire (ECM)
- Préparer la solution ECM en combinant les composants ECM individuels avec le DPBS froid, l’eau ou tout autre solvant aux concentrations de travail finales. La solution ECM doit être préparée à la frais chaque fois qu’elle est utilisée.
- Enrober les canaux supérieurs et inférieurs de la puce avec ECM, avec une composition déterminée par le type de cellule à ensemencer. Le mélange D’ECM doit être maintenu sur la glace jusqu’à l’utilisation.
- Utilisez la lamininin (50 g/mL) pour enrober le « côté cerveau », et le collagène IV et la fibronectin mélangés à un rapport de 4:1 (320:80 g/mL) pour enrober le « côté sang » tel que décrit à la section 5.6.
- Préparation des aliquots ECM
- Diluer 1 mg/mL de laminindans dans le DPBS froid jusqu’à une concentration finale de 50 g/mL. Aliquot et conserver à -20 oC jusqu’à utilisation.
- Dissoudre le collagène IV dans 0,1 % d’acide acétique à une concentration de 1 mg/mL. Incuber la solution à 2'8 oC pendant la nuit ou à RT pendant 1-3 h ou jusqu’à dissolution complète.
- Préparer un mélange de 1 ml de collagène IV:fibronectin (320 l de collagène IV, 80 l de fibronectin, 600 'L de h 2Ostérile à double distillation). Le mélange peut être stocké à -20 oC.
- Enduit les puces d’ECM
- Aspirez entièrement le DPBS froid des deux canaux. Définir une pipette P200 pour prendre 100 L de collagène IV:fibronectin solution.
- Introduire la solution par l’inlet du canal inférieur jusqu’à ce qu’une petite gouttelette se forme sur la prise. Laisser une petite gouttelette sur l’inlet après avoir enlevé la pointe de la pipette.
- Introduire la solution de lamininpare par l’inlet du canal supérieur jusqu’à ce qu’une petite gouttelette se forme sur la prise. Laisser une petite gouttelette sur l’inlet après avoir enlevé la pointe de la pipette.
- Regardez attentivement les canaux pour vous assurer qu’aucune bulle n’est présente. Si des bulles sont présentes, lavez le canal avec la solution ECM appropriée jusqu’à ce que toutes les bulles soient enlevées.
- Répétez les étapes 5.5.1-5.5.4 pour chaque puce.
- Ajouter 1,5 ml de DPBS au bouchon d’un tube conique de 15 ml. Placez le bouchon DPBS dans le plat de culture de 150 mm avec les croustilles pour fournir une humidité supplémentaire et scellez le plat avec du parafilm. Pour de meilleurs résultats, incuber les copeaux à 4 oC pendant la nuit.
REMARQUE : Si désiré, les cellules peuvent être ensemencées le même jour que l’activation des puces et le revêtement ECM, bien que l’incubation de nuit soit préférable. Les copeaux peuvent être prêts pour l’ensemencement de 4 h après l’ajout de l’ECM et l’incubation de copeaux à 37 oC.
6. Ensemencement du canal du « côté cerveau » et en différenciant les sphères EZ en cultures neuronales mixtes
- Apportez le plat contenant les croustilles préparées au BSC. Laver délicatement les deux canaux avec 200 'L de NDM.
- Éviter tout contact avec les ports, aspirer soigneusement les gouttelettes de médias excédentaires à partir de la surface de la puce. Suspension cellulaire doucement agitée avant d’ensemencer chaque puce pour assurer une suspension cellulaire homogène
- Ensemencement des iNPC dans le canal supérieur pour générer le "côté cerveau"
- Ensemencer les cellules (1 x 106 cellules/mL) dans le canal supérieur de la puce. Ajoutez une pointe P200 contenant une suspension de 30 à 100 l de cellules à l’inlet du canal supérieur et relâchez doucement la pointe de la pipette. Prenez une pipette P200 vide, appuyez sur le piston, insérez-vous dans la prise de canal supérieure et tirez soigneusement la suspension des cellules simples à travers la puce.
- Couvrir le plat et le transférer au microscope pour vérifier la densité d’ensemencement et la distribution homogène des cellules dans le canal supérieur. Retirez délicatement la pointe de pipette de l’entrée de puce et des ports de sortie.
- La densité d’ensemencement devrait apparaître comme une couverture de 20 %. Si la densité d’ensemencement est plus élevée ou inférieure à ce qui est prévu ou inégale, retournez les copeaux au BSC, lavez le canal 2x avec 200 ll de milieu frais, et répétez l’étape 6.3.1.
- Après avoir confirmé la densité cellulaire correcte, placez immédiatement les copeaux dans l’incubateur pendant 2 h à 37 oC après l’ensemencement de chaque lot de copeaux. Lavez les cellules qui ne se fixent pas avec NDM frais.
- Maintenir les cellules dans des conditions statiques à 37 oC avec un remplacement quotidien de NDM pendant au moins 48 h avant d’amorcer le débit. Les iBMEC peuvent être ensemencés après l’attachement des iNPC ou un jour suivant l’ensemencement iNPC.
7. Ensemencement des iBMECs dans le canal inférieur pour générer le « côté sang »
- Apportez le plat contenant les croustilles préparées au BSC. Laver délicatement le canal inférieur avec 200 ll de milieu EC.
- Éviter tout contact avec les ports, aspirer soigneusement les gouttelettes d’excès de milieu EC à partir de la surface de la puce, en veillant à laisser le milieu dans les deux canaux. Agiter doucement la suspension cellulaire avant d’ensemencer chaque puce pour assurer une suspension cellulaire homogène.
- À l’aide d’une pipette P200, dessinez 30 à 100 l de la suspension de la cellule iBMEC (14 à 20 x 106 cellules/mL) et placez la pointe dans l’entrée du canal inférieur. Déconnectez délicatement la pointe de la pipette, en laissant la pointe contenant des cellules dans le port d’entrée.
- Déprimer le piston sur une pipette P200 avec une pointe vide, insérer dans la prise du canal inférieur, et tirer soigneusement la suspension d’une seule cellule à travers le canal inférieur en libérant lentement le piston pipette.
- Aspirez la suspension de cellules excédentaires de la surface de la puce. Évitez tout contact direct avec les ports d’entrée et de sortie pour vous assurer qu’aucune suspension cellulaire n’est aspirée hors des canaux.
- Couvrez la puce et transférez-la au microscope pour observer la densité d’ensemencement. Le canal inférieur doit être rempli sans écartobservable entre les cellules lorsqu’il est observé à 4x ou 10x sous un microscope (Figure 4).
- Si la densité d’ensemencement est inférieure à 90 % de couverture ou est inégalement répartie, ajustez la densité cellulaire en conséquence et répétez les étapes 7,2 à 7,6 jusqu’à ce que la densité correcte soit atteinte dans le canal. Après avoir confirmé la densité cellulaire correcte (Figure 4), cellules de graines dans les puces restantes. Pour fixer les cellules sur la membrane poreuse, qui est située sur le dessus du canal inférieur, inverser chaque puce et reposer dans un berceau de puce.
- Placez un petit réservoir (15 ml de bouchon conique contenant du DPBS stérile) à l’intérieur du plat de 150 mm pour fournir de l’humidité aux cellules. Incuber les copeaux à 37 oC pendant environ 3 h, ou jusqu’à ce que les cellules du canal inférieur se soient attachées. Une fois que les iBMEC s’y sont attachés (3 h après l’ensemencement), retournez les copeaux en position verticale pour permettre l’attachement cellulaire à la partie inférieure du canal inférieur.
8. Initiation du flux
- Le débit est généralement initié 48 h après l’ensemencement des iBMECs. Ce temps est nécessaire pour que les iBMECs s’attachent fermement à la puce.
- Pour maintenir le débit laminaire à travers la puce, il est important de dégazer et d’équilibrer la température du milieu. Le milieu doit être réchauffé à l’eau à 37 oC pendant 1 h.
- Jusqu’à 50 ml de milieu réchauffé peuvent être dégazés par incubation sous un système de filtration sous vide pendant 15 min.
- Priming des modules portables
- Assainissez l’extérieur de l’emballage et des plateaux portatifs du module avec 70 % d’éthanol, essuyez et transférez-le au BSC. Ouvrez le paquet et placez les modules dans le plateau. Orientez-les avec les réservoirs vers l’arrière du plateau.
- Pipette 3 mL de support pré-équilibré et chaud à chaque réservoir d’inlet. Ajouter le milieu de culture EC au réservoir d’inlet du canal inférieur et Le NDM au réservoir d’inlet du canal supérieur(figure 5).
- Pipette 300 l de supports chauds pré-équilibrés à chaque réservoir de sortie, directement au-dessus de chaque port de sortie (Figure 5).
- Placez jusqu’à six modules portatifs sur chaque plateau. Apportez des plateaux à l’incubateur et glissez complètement dans le module de culture avec la poignée de plateau tournée vers l’extérieur.
- Sélectionnez et exécutez le cycle "Prime" sur le module de culture. Fermez la porte de l’incubateur et laissez le module de culture amorcer les modules portables (prend 1 min). Le cycle d’amorçage est terminé lorsque la barre d’état indique « Prêt ». Retirez le plateau du module de culture et apportez-le au BSC.
- Vérifier que les modules portatifs ont été amorcés avec succès en inspectant le dessous de chaque module portable dans le BSC. Recherchez la présence de petites gouttelettes dans les quatre ports.
- Si un module portable ne montre pas de gouttelettes, réexécutez le cycle principal sur ces modules. Si un support s’écoulait sur le plateau (cela peut se produire plus souvent par les ports de sortie), nettoyez le plateau avec 70% d’éthanol.
- Connexion des puces aux modules portables, régulation et initiation du débit
- Laver délicatement les deux canaux de chaque puce avec un milieu de culture chaud et équilibré spécifique à chaque cellule pour éliminer les bulles possibles dans le canal et placer de petites gouttelettes de milieu (selon les médias dans le canal) sur le dessus de chaque entrée et port de sortie.
- Insérez des puces avec des supports dans les modules portatifs et placez jusqu’à six sur chaque plateau. Insérer des plateaux dans le module de culture. Programmez les conditions appropriées de culture de puce d’organe (taux de débit et étirement) sur le module de culture.
- Les conditions programmées commenceront dès que le cycle « Réglementer » sera terminé.
REMARQUE : Les débits de chaque canal peuvent être contrôlés indépendamment et peuvent être réglés à des taux qui vont de 0 à 1 000 l/h. La puce BBB est généralement cultivée à 30 oL/h. Lorsque les médias qui circulent tels que les médias EC ou ESM à 30 l/h et 1000 l/h, les forces de cisaillement sont 0,01 dyn/cm2 et 0,33 dyn/cm2, respectivement. - Exécuter le cycle "Regulate", qui prend environ 2 h, après quoi le module de culture commencera à couler aux conditions préfixées de culture de puce d’organe.
9. Évaluation de la perméabilité paracellulaire sang-cerveau
- Préparer NDM complété par 10 g/mL dextran-FITC (4 kDa). Cette solution sera utilisée comme entrée pour le canal "côté sang".
- Remplissez les réservoirs de canal inférieur des modules portables avec NDM complété avec dextran-FITC. Remplissez les réservoirs de canal supérieur avec NDM sans traceur.
- Perfayez les deux, les canaux supérieurs et inférieurs à un débit de 30 l/h pendant au moins 4 h jusqu’à ce que suffisamment de médias s’accumulent pour être collectés pour l’évaluation de la fluorescence dans un lecteur de plaque (généralement 100 l).
- Recueillir des échantillons multimédias à partir des réservoirs d’entrée et de sortie des canaux supérieurs et inférieurs. Protégez les échantillons de la lumière.
- Diluez en série le NDM complété par 10 'g/mL dextran-FITC 1:1 en utilisant NDM sans traceur pour générer une courbe d’étalonnage de 10 à 12 points.
- Prenez 100 L de chaque échantillon, y compris la courbe d’étalonnage, dans une plaque noire de puits de 96 et lisez la fluorescence à l’aide d’un lecteur de plaque (485 nm d’excitation, 530 nm d’émission).
- Utilisez les valeurs mesurées pour calculer les valeurs del’application P comme suit :
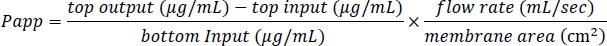
- Prenez des mesures quotidiennes pour évaluer les propriétés de la barrière et confirmer que la puce BBB est toujours fonctionnelle.
10. Immunocytochimie
- Apportez des copeaux sur une hotte chimique. À l’aide d’une pipette P200, fixer les cellules en perfusant les deux canaux avec 200 l de paraformaldéhyde (PFA) de 4 % en DPBS et incuber pendant 10 min à RT.
- Après la fixation, perfuser chaque canal avec 200 L de DPBS et couver pendant 5 min. Répéter le lavage DPBS 2x.
- Bloquer et perméabilize cellules sur la puce en perspayant la solution de blocage primaire (PBS, complété par 5% de sérum d’âne normal et 0,1% Triton X-100). Incuber à RT pendant 1 h.
- Diluer les anticorps primaires dans la solution de blocage primaire et couver toute la nuit à 4 oC. Les marqueurs bMECs sont GLUT-1 (1:100 dilution), ZO-1 (1:300), PECAM-1 (1:250; CD31), et VE-cadherin (1:200). Les marqueurs neuronaux sont 'III-tubulin (1:1000; Tuj1, S100 (1:500), nestin (1:1000) et GFAP (1:1000).
- Laver les copeaux 3x avec dPBS froid.
- Diluer les anticorps secondaires dans la solution de blocage secondaire (DPBS avec 5% de sérum d’âne normal sans Triton-X).
- Perfil la solution d’anticorps secondaire à travers les deux canaux. Typiquement, les anticorps secondaires fluorescents sont dilués 1:1000. Incuber pendant 1 h à RT protégé de la lumière.
- Laver les jetons 3x avec DPBS.
- Nucléi de cellules de tache en perfusant la puce avec 100 l de solution d’API. Incuber à RT pendant 5 min.
- Laver les jetons 3x avec DPBS.
- La puce est prête pour l’imagerie à l’aide d’un microscope fluorescent droit ou inversé. La transparence PDMS permet l’imagerie dans la puce d’organe intacte. Les grossissements supérieurs à 10x peuvent nécessiter des objectifs de longue distance de travail en raison de l’épaisseur de la puce d’organe.
Résultats
Figure 6A,B,C représente une puce BBB enseisée avec des sphères EZ sur le canal supérieur du « côté cerveau » et des iBMECs sur le canal inférieur du « côté sang ». IBMECs ont été ensedus d’abord et autorisés à attacher pendant la nuit, après quoi EZ-sphères ont été ensedus. Les copeaux ont ensuite été cultivés dans des conditions statiques avec le remplacement quotidien des médias pendant sept jours. La puce BBB a ensuite été fixée à l’aide ...
Discussion
La combinaison de la technologie d’organe sur puce et des cellules iPSC-dérivées dans le NVU est prometteuse pour la modélisation précise du BBB humain. Ici, nous fournissons un protocole détaillé pour l’application simple et robuste de la puce BBB récemment publiée iPSC16. Une vue d’ensemble et le moment du paradigme d’ensemencement sont présentés à la figure 3. Il est essentiel d’obtenir et de maintenir des fonctions de barrière adaptées à la...
Déclarations de divulgation
Cedars-Sinai détient une participation minoritaire dans Emulate, la société qui produit les puces d’organes microfluidiques de l’étude. Un dirigeant de Cedars-Sinai siège également au conseil d’administration d’Emulate. Emulate n’a fourni aucun soutien financier à cette recherche. Cedars-Sinai et Emulate ont déposé des brevets relatifs à ce travail.
Remerciements
Nous tenons à remercier le Dr Soshana Svendsen pour l’édition critique. Ce travail a été soutenu par la subvention 1621/18 de la Fondation des sciences israéliennes, le Ministère des sciences et de la technologie (MOST), Israel 3-15647, le California Institute for Regenerative Medicine Grant ID DISC1-08800, la Sherman Family Foundation, la subvention NIH-NINDS 1UG3NS105703 et la subvention de l’Association de la SLA 18-SI-389. AH a été financé par la Fondation Wallenberg (numéro de subvention 2015.0178).
matériels
| Name | Company | Catalog Number | Comments |
| Accutase | EMD Millipore | SCR005 | Dissociation solution |
| B27 | Gibco | 12587010 | |
| Bfgf | Peprotech | 100-18B | |
| Chip-S1 | Emulate Inc | Chip-S1 | Organ-Chip |
| Collagen IV | Sigma | C5533 | |
| DAPI | Invitrogen | D3571 | |
| Dextran-FITC | Sigma | 46944 | |
| DMEM: F12 | Thermo Fisher Scientific | 31330038 | |
| Donkey serum | Sigma | D9663 | |
| Emulate Reagent 1 (ER-1) | Emulate Inc | ER-1 | |
| Emulate Reagent 2 (ER-2) | Emulate Inc | ER-2 | |
| Fibronectin | Sigma | F1141 | |
| Glial Fibrillary Acidic Protein (GFAP) | Dako | Z0334 | |
| GLUT-1 | Invitrogen | MA5-11315 | |
| Glutamax | Life Technologies | 35050038 | Glutamine supplement |
| hBDNF | Peprotech | 450-02 | |
| KOSR | Thermo Fisher Scientific | 10828028 | |
| Laminin | Sigma | L2020 | |
| Matrigel | Corning | 354234 | Basement membrane matrix |
| mTeSR1 | StemCell Technologies, Inc. | 85851 | |
| NEAA | Biological industries | 01-340-1B | |
| Nestin | Millipore | MAB353 | |
| NutriStem | Biological industries | 05-100-1A | Alternate media |
| PECAM-1 | Thermo Fisher Scientific | 10333 | |
| Platelet-poor plasma-derived bovine serum (PPP) | Biomedical Technologies | J64483AB | |
| Retinoic acid (RA) | Sigma | R2625 | |
| S100β | Abcam | ab6602 | |
| Steriflip-GP Sterile Centrifuge Tube Top Filter Unit | Millipore | SCGP00525 | |
| Triton X-100 | Sigma | X100 | |
| ZO-1 Monoclonal Antibody | Invitrogen | 33-9100 | |
| βIII-tubulin (Tuj1α) | Sigma | T8660 | |
| β-mercaptoethanol | Life Technologies | 31350010 |
Références
- Pardridge, W. M. Blood-brain barrier endogenous transporters as therapeutic targets: a new model for small molecule CNS drug discovery. Expert Opinion on Therapeutic Targets. 19 (8), 1059-1072 (2015).
- Gastfriend, B. D., Palecek, S. P., Shusta, E. V. Modeling the blood-brain barrier: beyond the endothelial cells. Current Opinion in Biomedical Engineering. 5, 6-12 (2018).
- Jamieson, J. J., Linville, R. M., Ding, Y. Y., Gerecht, S., Searson, P. C. Role of iPSC-derived pericytes on barrier function of iPSC-derived brain microvascular endothelial cells in 2D and 3D. Fluids and Barriers of the CNS. 16 (1), 15 (2019).
- El-Habashy, S. E., et al. Novel treatment strategies for brain tumors and metastases. Pharmaceutical Patent Analyst. 3 (3), 279-296 (2014).
- Lim, R. G., et al. Huntington's disease iPSC-derived brain microvascular endothelial cells reveal WNT-mediated angiogenic and blood-brain barrier deficits. Cell Reports. 19 (7), 1365-1377 (2017).
- Dumitrescu, A. M., Liao, X. H., Weiss, R. E., Millen, K., Refetoff, S. Tissue-specific thyroid hormone deprivation and excess in monocarboxylate transporter (mct) 8-deficient mice. Endocrinology. 147 (9), 4036-4043 (2006).
- Spencer, J. I., Bell, J. S., DeLuca, G. C. Vascular pathology in multiple sclerosis: reframing pathogenesis around the blood-brain barrier. Journal of Neurology and Neurosurgical Psychiatry. 89 (1), 42-52 (2018).
- Yamazaki, Y., Kanekiyo, T. Blood-brain barrier dysfunction and the pathogenesis of Alzheimer's disease. International Journal of Molecular Sciences. 18 (9), 1965 (2017).
- Ben-Zvi, A., et al. Mfsd2a is critical for the formation and function of the blood-brain barrier. Nature. 509 (7501), 507 (2014).
- Heng, M. Y., Detloff, P. J., Albin, R. L. Rodent genetic models of Huntington disease. Neurobiology of Disease. 32 (1), 1-9 (2008).
- Ho, R., et al. ALS disrupts spinal motor neuron maturation and aging pathways within gene co-expression networks. Nature Neuroscience. 19 (9), 1256 (2016).
- Griep, L. M., et al. BBB on chip: microfluidic platform to mechanically and biochemically modulate blood-brain barrier function. Biomedical Microdevices. 15 (1), 145-150 (2013).
- Prabhakarpandian, B., et al. Synthetic tumor networks for screening drug delivery systems. Journal of controlled release. 201, 49-55 (2015).
- Delsing, L., et al. Barrier properties and transcriptome expression in human iPSC-derived models of the blood-brain barrier. Stem Cells. 36 (12), 1816-1827 (2018).
- Park, T. E., et al. Hypoxia-enhanced Blood-Brain Barrier Chip recapitulates human barrier function and shuttling of drugs and antibodies. Nature Communications. 10 (1), 2621 (2019).
- Vatine, G. D., et al. Human iPSC-Derived Blood-Brain Barrier Chips Enable Disease Modeling and Personalized Medicine Applications. Cell Stem Cell. 24 (6), 995-1005 (2019).
- Henry, O. Y. F., Villenave, R., Cronce, M. J., Leineweber, W. D., Benz, M. A., Ingber, D. E. Organs-on-chips with integrated electrodes for trans-epithelial electrical resistance (TEER) measurements of human epithelial barrier function. Lab on a Chip. 17 (13), 2264-2271 (2017).
- Sances, S., et al. Human iPSC-derived endothelial cells and microengineered organ chip enhance neuronal development. Stem Cell Reports. 10 (4), 1222-1236 (2018).
- Workman, M. J., et al. Enhanced utilization of induced pluripotent stem cell–derived human intestinal organoids using microengineered chips. Cellular and Molecular Gastroenterology and Hepatology. 5 (4), 669-677 (2018).
- Ebert, A. D., et al. EZ spheres: a stable and expandable culture system for the generation of pre-rosette multipotent stem cells from human ESCs and iPSCs. Stem Cell Research. 10 (3), 417-427 (2013).
- Shelley, B. C., Gowing, G., Svendsen, C. N. A cGMP-applicable expansion method for aggregates of human neural stem and progenitor cells derived from pluripotent stem cells or fetal brain tissue. Journal of Visualized Experiments. (88), e51219 (2014).
- Vatine, G. D., et al. Modeling psychomotor retardation using iPSCs from MCT8-deficient patients indicates a prominent role for the blood-brain barrier. Cell Stem Cell. 20 (6), 831-843 (2017).
- Svendsen, C. N., et al. A new method for the rapid and long term growth of human neural precursor cells. Journal of Neuroscience Methods. 85 (2), 141-152 (1998).
- Lippmann, E. S., Al-Ahmad, A., Azarin, S. M., Palecek, S. P., Shusta, E. V. A retinoic acid-enhanced, multicellular human blood-brain barrier model derived from stem cell sources. Scientific Reports. 4, 4160 (2014).
- Canfield, S. G., et al. An isogenic blood-brain barrier model comprising brain endothelial cells, astrocytes, and neurons derived from human induced pluripotent stem cells. Journal of Neurochemistry. 140 (6), 874-888 (2017).
- Jamieson, J. J., Gerecht, S. Chipping Away at Blood-Brain-Barrier Modeling. Cell stem cell. 24 (6), 831-832 (2019).
- Faal, T., et al. Induction of Mesoderm and Neural Crest-Derived Pericytes from Human Pluripotent Stem Cells to Study Blood-Brain Barrier Interactions. Stem Cell Reports. 12 (3), 451-460 (2019).
- Lippmann, E. S., et al. Derivation of blood-brain barrier endothelial cells from human pluripotent stem cells. Nature Biotechnology. 30 (8), 783 (2012).
- Qian, T., et al. Directed differentiation of human pluripotent stem cells to blood-brain barrier endothelial cells. Science Advances. 3 (11), 1701679 (2017).
- Neal, E. H., et al. A Simplified, Fully Defined Differentiation Scheme for Producing Blood-Brain Barrier Endothelial Cells from Human iPSCs. Stem Cell Reports. 12 (6), 1380-1388 (2019).
- Wevers, N. R., et al. A perfused human blood-brain barrier on-a-chip for high-throughput assessment of barrier function and antibody transport. Fluids and Barriers of the CNS. 15 (1), 23 (2018).
- Huh, D., et al. Microfabrication of human organs-on-chips. Nature Protocols. 8 (11), 2135 (2013).
- Huh, D., Matthews, B. D., Mammoto, A., Montoya-Zavala, M., Hsin, H. Y., Ingber, D. E. Reconstituting organ-level lung functions on a chip. Science. 328 (5986), 1662-1668 (2010).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon