Method Article
Essai de physiologie thermique sur le terrain : récupération des chocs à froid dans des conditions ambiantes
Dans cet article
Résumé
Ici, un protocole peu coûteux et accessible est décrit pour évaluer la récupération des papillons par choc froid dans des conditions environnementales ambiantes.
Résumé
La physiologie écologique, en particulier des ectothermes, est de plus en plus importante dans ce monde en évolution, car elle utilise des mesures des espèces et des traits environnementaux pour explorer les interactions entre les organismes et leur environnement afin de mieux comprendre leur survie et leur condition physique. Les analyses thermiques traditionnelles sont coûteuses en temps, en argent et en équipement et sont donc souvent limitées à de petites tailles d’échantillons et à peu d’espèces. Présenté ici est un nouveau protocole qui génère des données détaillées sur le comportement individuel et la physiologie des grands insectes terrestres volants, en utilisant l’exemple des papillons. Cet article décrit les méthodes d’un essai de récupération de choc froid qui peut être effectué sur le terrain dans des conditions environnementales ambiantes et ne nécessite pas d’équipement de laboratoire coûteux. Cette méthode a été utilisée pour comprendre la réponse et le programme de rétablissement en cas de choc froid des papillons tropicaux, générant ainsi des données individuelles sur des communautés entières de papillons. Ces méthodes peuvent être utilisées à la fois dans des environnements de terrain éloignés et dans des salles de classe et peuvent être utilisées pour générer des données physiologiques pertinentes sur le plan écologique et comme outil d’enseignement.
Introduction
L’intégration de la physiologie thermique et de l’écologie à la fin des années 1970 et au début des années 19801,2 a lancé le domaine de la physiologie écologique. Des études thermiques approfondies menées sur les ectothermes mettent en évidence des synergies éco-physiologiques dans divers contextes éco-évolutifs3,4,5. La recherche sur la physiologie thermique des organismes ectothermiques a récemment regagné l’attention face au changement climatique et à l’altération des paysages thermiques à travers le monde6,7. En plus d’éclairer les études dans le domaine universitaire de la physiologie écologique, les essais de physiologie thermique peuvent être largement accessibles aux chercheurs et peuvent servir d’approche d’enseignement pratique pour tous les niveaux. Les composantes de la performance thermique, y compris les limites thermiques et les effets des chocs de température, sont fondamentales pour l’écologie, le comportement et le cycle de vie des animaux8,9.
Plus précisément, les écotothermes sont utilisés pour aborder des questions de physiologie, car l’endothermie dicte un lien inextricable entre la température ambiante et la température de l’organisme. La plage de températures que les organismes peuvent supporter (leur plage thermique minimale à maximale thermique critique) et les températures auxquelles leurs comportements et leur aptitude sont maximisés (optimum thermique) sont souvent enracinées dans des processus écologiques et évolutifs. Ces traits physiologiques sont de plus en plus importants car les températures, moyennes et extrêmes, augmententde 10. Par exemple, les changements abiotiques, y compris les augmentations de température, qui accompagnent la destruction et la fragmentation de l’habitat ont affecté les communautés d’ectothermes, y compris les anoures, limitant les espèces physiologiquement fragiles (avec une tolérance thermique étroite) à de petites parcelles d’habitat restantes11,12.
L’évaluation des composants clés de la performance thermique peut être coûteuse en termes de temps et de ressources et nécessite traditionnellement un équipement de laboratoire et des conditions normalisées. De plus, les essais conventionnels ne reflètent souvent pas l’étendue des conditions ambiantes vécues dans la nature par un animal donné13, car la température dans des expériences physiologiques similaires est soigneusement contrôlée et souvent sans rapport avec les conditions ambiantes vécues par un animal. Ce contrôle de la température peut diminuer la compréhension de la variation des réponses individuelles2,14. Les physiologistes se sont appuyés sur des expériences de chauffage et de refroidissement en laboratoire, utilisant des bains d’eau programmables pour chauffer ou refroidir régulièrement l’environnement d’un animal afin d’éclairer les courbes de performance thermique15.
En règle générale, les animaux sont placés dans des flacons avec un thermocouple, et leur température ambiante est modifiée régulièrement en contrôlant la température du bain d’eau environnant. Les chercheurs mesurent le temps qu’il faut pour atteindre un état physiologique altéré (p. ex., coma froid, knockdown) et la température à laquelle le changement de statut s’est produit16,17. À partir d’un minimum de 500 $ US, ces outils sont grands, lourds et nécessitent de l’équipement technique supplémentaire (p. ex. ordinateur, thermocouples). Par conséquent, les outils de base pour mettre en œuvre les méthodes classiques d’évaluation de la performance thermique sont 1) non économiquement accessibles à tous, 2) ne conviennent pas à l’analyse d’animaux trop gros pour être contenus dans des flacons habituels utilisés pour les petits diptères, et 3) ne sont pas portables pour une utilisation dans des environnements de terrain éloignés. L’adhésion à la pratique courante a entraîné une représentation limitée entre la taxonomie et les conditions expérimentales18,19,20.
Alors que des courbes de performance thermique complètes peuvent informer la distribution des espèces, les caractéristiques du cycle biologique et le comportement, entre autres caractéristiques, la quantification de mesures thermiques moins nombreuses et plus simples peut être plus efficace et toujours extrêmement informative. Les dosages physiologiques, qui mesurent l’apparition du coma froid et la récupération subséquente du choc froid, le durcissement au froid et le comportement de redressement, sont des approximations efficaces et exécutables du minimum thermique critique d’un organisme8. Décrit ici est un essai de choc froid utile pour obtenir des données physiologiques de grands insectes ectothermiques terrestres. Le test est abordable, accessible et facile à exécuter dans des conditions de terrain ou en classe. Les données sur la récupération par choc froid générées par ce protocole peuvent être couplées à des données sur les espèces ou les caractères au niveau individuel pour répondre à des questions concernant la physiologie écologique et / ou utilisées pour enseigner aux étudiants les principes physiologiques.
Protocole
1. Identification des espèces d’intérêt
- Identifier les espèces d’intérêt pour déterminer le temps de récupération du choc froid. Gardez à l’esprit que chaque groupe sera différent dans le temps qu’il faut pour induire un coma froid (c.-à-d. le point auquel l’insecte est encore en vie, mais ne bouge pas et ne réagit pas). De même, en fonction de l’organisme et de l’utilisation des données, choisissez différents seuils auxquels arrêter l’expérience si la ou les personnes focales ne volent pas (voir la section 4).
REMARQUE: Ce protocole a été conçu et développé pour une utilisation sur les lépidoptères. Cependant, elle s’applique aux gros insectes terrestres volants, en particulier ceux qui peuvent être entreposés à plat dans des enveloppes de glassine limitant les mouvements et les dommages (p. ex. papillons et libellules/demoiselles).
2. Conduite d’une mise en état
- Procéder à une mise en état sur un petit échantillon de personnes afin de déterminer les paramètres clés. Suivez les sections 3 à 5 du protocole ci-dessous avec 5 à 10 personnes pour une mise en état.
- Tester le temps nécessaire sur la glace pour induire un coma froid (ne bouge pas), mais ne pas tuer l’espèce focale en suivant l’étape 5.1 en utilisant des traitements de 30 min, 60 min et 90 min.
REMARQUE: Le temps nécessaire pour induire un coma froid dépendra de la taille, de l’emplacement et de l’histoire naturelle / du comportement des individus. - Sur la base des résultats des étapes 4.1 à 4.4 et en utilisant les connaissances sur l’écologie des insectes focals, choisissez un moment pour conclure l’essai si une personne donnée ne se rétablit pas complètement. Basez également cette limite de temps sur l’écologie de l’espèce, en gardant à l’esprit qu’après de nombreuses minutes d’incapacité de vol, de nombreux insectes sont antérieurs.
REMARQUE : Par exemple, si la plupart des essais préliminaires se terminent en vol après 15 min, on pourrait décider de mettre fin aux essais après 25 min pour s’assurer que même les valeurs aberrantes ont une chance de se rétablir complètement (c.-à-d. voler). Ce protocole est basé sur un temps limite de 30 minutes (étape 5.4).
- Tester le temps nécessaire sur la glace pour induire un coma froid (ne bouge pas), mais ne pas tuer l’espèce focale en suivant l’étape 5.1 en utilisant des traitements de 30 min, 60 min et 90 min.
- Utilisez les paramètres des données préalables au procès pour éclairer la collecte de données pour les expériences. Modifier le protocole décrit ci-dessous en fonction des besoins des organismes focaux, y compris le temps passé dans la boue de glace, le moment où mettre fin aux essais et les comportements documentés sur la fiche technique (p. ex., le frisson peut être un comportement inapproprié pour l’insecte de choix).
- Définir des questions de recherche précises auxquelles il faut répondre à l’aide de ces données tout en affinant les paramètres.
NOTA : Par exemple, si le chercheur s’intéresse à l’effet d’une exposition prolongée sur la récupération, le temps dans la glace est une variable clé à modifier. Si les chercheurs s’intéressent aux différences physiologiques entre les espèces de couleur claire et foncée, ils peuvent choisir deux espèces de couleur distincte ou modifier la couleur des ailes de l’insecte pour mesurer l’effet de la couleur des ailes sur le temps de récupération. Il est important de savoir si cette méthode est hautement personnalisable en cas de besoins et de questions de recherche (voir la section discussion).
- Définir des questions de recherche précises auxquelles il faut répondre à l’aide de ces données tout en affinant les paramètres.
3. Collecte d’insectes
- Recueillir les insectes à l’aide de méthodes appropriées telles que des pièges appâtés et des filets entomologiques(figure supplémentaire 1). Lors de la collecte, placez chaque individu dans une enveloppe vitrée séparée avec une pièce d’identité unique.
- Entreposez les animaux dans un endroit ombragé et frais après avoir été capturés et avant l’exposition à l’expérience de choc froid. Exposez toujours l’animal au traitement expérimental dans les 24 h suivant sa capture et normalisez ce temps autant que possible d’un essai à l’autre.
- Bien que les conditions de stockage puissent varier, gardez les insectes hors du soleil direct. Si possible, placez-les à l’intérieur dans une pièce fraîche et sombre.
- Sur le terrain, assurez-vous qu’ils seront ombragés pendant leur stockage et qu’ils sont protégés du vent (qui souffle) et des autres insectes prédateurs qui peuvent pénétrer dans les enveloppes.
4. Mettre en place l’expérience de choc froid
- Remplissez une glacière avec de la glace et de l’eau. S’assurer qu’il y a suffisamment de glace pour persister pendant au moins une heure et ajouter de la glace périodiquement au besoin dans le but de maintenir l’environnement dans l’eau à 0 °C.
- Choisissez entre 1 et 4 personnes focales pour une série d’expérimentations, en vous assurant que chaque individu est identifiable.
- Si vous utilisez plusieurs espèces, n’utilisez qu’une seule de chacune pour éviter de confondre les individus sur la fiche technique. Si vous expérimentez avec une seule espèce, n’utilisez que des individus qui peuvent facilement être distingués, par exemple par une aile cassée ou un marquage distinct.
- Si le but de l’expérience n’est pas lié à la coloration des ailes, marquez les ailes avec des identifiants uniques (p. ex. nombres) avec un marqueur fin à pointe de feutre pour distinguer les individus.
- Si les expériences ne répondent à aucun des critères ci-dessus, effectuez l’expérience sur une personne à la fois.
- Remplissez les rangées de la fiche technique avec les informations pertinentes pour chaque insecte analysé, y compris leur identifiant unique et un identifiant utile dans les notes telles que le nom de l’espèce ou le caractère distinctif(tableau supplémentaire 1).
- Placez toutes les personnes focales (toujours dans leurs enveloppes marquées individuellement) dans un sac en plastique scellé avec un poids(table des matériaux)et placez le sac dans de l’eau glacée pendant 60 min (ou jusqu’à ce que le coma froid ait été induit; voir la discussion)(figure supplémentaire 2).
- Assurez-vous que le poids est lourd (p. ex. grosses pièces de monnaie, grandes rondelles ou rochers lisses) et assez grand pour garder le sac d’insectes immergé dans l’eau glacée et perpendiculaire à la surface de l’eau. Utilisez un poids qui ne cause pas de fuites dans le sac en plastique scellé.
REMARQUE : Bien que les insectes soient toujours capables de récupérer s’ils sont exposés directement à l’eau lorsqu’ils sont submergés, les enveloppes humides compliquent l’enlèvement de chaque individu. Il est préférable de maintenir les insectes secs dans leur sac.
- Assurez-vous que le poids est lourd (p. ex. grosses pièces de monnaie, grandes rondelles ou rochers lisses) et assez grand pour garder le sac d’insectes immergé dans l’eau glacée et perpendiculaire à la surface de l’eau. Utilisez un poids qui ne cause pas de fuites dans le sac en plastique scellé.
- Enregistrez les données de température et de lumière.
- Utilisez une centrale de mesure (voir la table des matériaux)pour enregistrer la température ambiante et les données de lumière en utilisant l’étape 5.1 ou 5.2.
- Programmez la centrale de mesure pour collecter des données de température et de lumière à des intervalles de 10 s, à partir du moment où les insectes seront libérés.
- Basez l’heure de début de l’enregistreur de données sur le moment où les insectes ont été placés dans l’eau glacée. Assurez-vous que les informations de la centrale de mesure (date, heure) sont synchronisées afin que les données sur les conditions ambiantes puissent ensuite être appariées avec chaque insecte focal individuel.
- Utilisez un simple thermomètre pour enregistrer à la main les données de température et de lumière à de courts intervalles (par un deuxième chercheur).
- Décidez des paramètres expérimentaux à associer au temps de récupération qui peut être mesuré sans centrale de mesure. Utilisez des traitements distincts: ombre / soleil; crépuscule/milieu de journée.
- Utilisez une centrale de mesure (voir la table des matériaux)pour enregistrer la température ambiante et les données de lumière en utilisant l’étape 5.1 ou 5.2.
- Placez une cage en maille pour les insectes dans un endroit approprié afin que la température et les environnements lumineux soient aussi homogènes que possible dans la cage et que la base de la cage soit surélevée et puisse être exploitée par l’observateur.
- Placez l’enregistreur de données juste à l’extérieur de la cage, ou à l’intérieur de la cage afin qu’elle ne soit pas renversée ou autrement affectée par de petits mouvements à l’intérieur de la cage. Si vous n’utilisez pas une centrale de mesure, placez un thermomètre de manière appropriée et/ou placez les cages dans la configuration appropriée.
REMARQUE: La centrale de mesure doit être placée de manière à ce que les conditions ambiantes enregistrées soient aussi proches que possible de celles que connaît l’insecte.
5. Commencez l’expérience de choc froid
- Retirer les animaux du bain d’eau glacée après 60 min (ou heure jugée appropriée; voir ci-dessus). Retirez immédiatement les insectes du sac en plastique et retirez chaque individu de son enveloppe le plus rapidement possible tout en minimisant la manipulation(figure supplémentaire 3).
- Démarrez le chronomètre dès que les animaux sont dans les cages maillées (voir exemple de données, tableau supplémentaire 1).
- Appuyez sur la base de la cage avec un crayon pour agiter les insectes en convalescence.
REMARQUE: Fournir des stimuli pendant la récupération garantit que les insectes focaux démontrent l’état de rétablissement et les comportements dès qu’ils sont physiologiquement capables (Vidéo supplémentaire).- Appuyez assez fréquemment et assez fort pour vous assurer qu’un animal réagira si possible, mais ne provoquera pas de réponse.
REMARQUE: Par exemple, lors du tapotement de la cage, si un animal est catapulté dans les airs et atterrit debout, mais ne se déplace pas pour se tenir seul, cela n’est pas considéré comme un comportement de « stand », car l’organisme ne s’est pas en effet tenu tout seul.
- Appuyez assez fréquemment et assez fort pour vous assurer qu’un animal réagira si possible, mais ne provoquera pas de réponse.
- Marquer l’essai comme terminé une fois qu’une personne a pris l’en vol (c.-à-d. qu’elle a montré un rétablissement complet). Terminez l’essai et considérez que l’insecte a atteint un rétablissement complet s’il ne bouge pas après 30 min.
- Retirez les insectes de la cage en maille et replacez les individus dans leurs enveloppes de glassine étiquetées. Libérer les animaux ou les garder pour une collecte de données plus approfondie (p. ex., caractéristiques individuelles de taille, de poids).
- Si vous utilisez une centrale de mesure, arrêtez la collecte des données de la centrale de mesure et enregistrez le fichier de données de température et de lumière pendant l’expérience avec les informations de date / heure appropriées.
6. Traitement des données
- Entrez les données présentées à partir de la feuille de données dans une feuille de calcul (p. ex., MS Excel).
- Si vous utilisez une centrale de mesure, ajoutez des données de température et de lumière pour chaque réponse de chaque individu analysé.
- Calculez la moyenne et l’écart type de la température et de la lumière pour chaque comportement de chaque individu.
REMARQUE: Comme la centrale de mesure enregistre les données tous les 10 s, si le comportement du peuplement d’un animal a pris 48 s pour se produire, utilisez les 5 premières entrées de la centrale de mesure pour cet essai. - Associez chaque comportement de récupération de chaque individu aux données abiotiques enregistrées par la centrale de mesure, en arrondissant vers le haut ou vers le bas à des intervalles de 10 s si nécessaire.
- Calculez la moyenne et l’écart type de la température et de la lumière pour chaque comportement de chaque individu.
- Tracer et analyser les données. La figure 1,par exemple, visualise l’effet de la température et de la lumière sur le temps de récupération des chocs à froid. Compiler d’autres données pertinentes (caractéristiques des espèces, caractéristiques régionales de l’habitat) pour examiner les modèles écologiques et évolutifs des traits physiologiques des groupes testés.
REMARQUE: La figure 1 a été tracée à l’aide du paquet ggplot2 dans R. Le niveau de détail des données sur les conditions ambiantes variera en fonction des instruments utilisés pour mesurer les conditions ambiantes. Si une centrale de mesure est utilisée, des chiffres avec des détails comparables à ceux de la figure 2 peuvent être générés. Si un thermomètre est utilisé, le chercheur ne sera pas en mesure de créer une parcelle éclairée par la lumière ambiante. De même, si les chercheurs utilisent des catégories de lumière ou de température, ces nuages de points peuvent être modifiés en boîtes à moustache ou en un autre modèle approprié pour illustrer ces phénomènes.
Résultats
Les données recueillies dans ce protocole permettent l’examen et le partage des variables importantes à la physiologie de l’organisme. Par exemple, les conditions de température et d’éclairage contribuent à la récupération des papillons après un choc froid (Figure 1). Le diagramme vise à explorer l’interaction entre les conditions ambiantes et la récupération des chocs froids. À l’aide de papillons capturés à l’état sauvage à partir de pièges et de filets, 181 espèces de papillons ont démontré un rétablissement distinct du coma froid induit par le choc froid (figure 2). Les données présentées à la figure 2 ont été recueillies par trois observateurs sur une période d’environ cinq mois (janvier, février, mai-juillet 2020) dans les Andes colombiennes. Les expériences étaient toujours menées le matin après la collecte des papillons. Avec une efficacité maximale, il a été possible pour deux observateurs d’observer simultanément quatre papillons chacun, répétés sept fois (minimum 7,37 heures), ce qui a entraîné l’analyse de 56 individus sur une seule matinée. Cela a permis de collecte d’une grande partie des données dans des communautés entières de papillons tout en incluant et en tenant compte des données sur les variations individuelles. Comme les essais peuvent avoir lieu dans des conditions environnementales ambiantes, les conditions de rétablissement sont représentatives de leurs habitats et reflètent la variation naturelle vécue par les organismes dans la nature. La figure 3 illustre le chevauchement entre les conditions de température et de lumière de l’expérience de récupération par choc froid et les conditions dans un pâturage où certains papillons testés ont été recueillis.
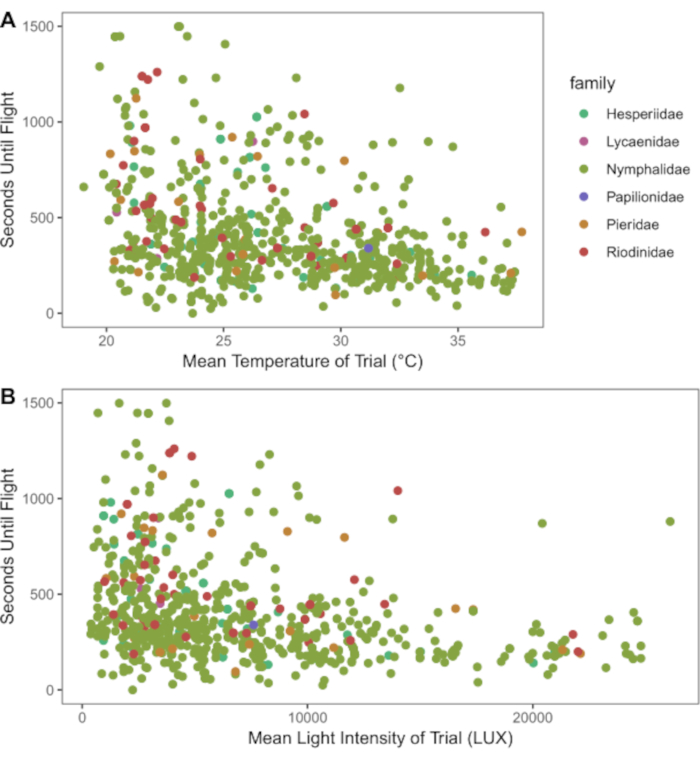
Figure 1: Nuages de points du temps de récupération (en secondes) des papillons après choc froid. (A) Température moyenne et (B) moyenne LUX (intensité lumineuse) pendant leur récupération. Les espèces sont organisées et colorées par famille. Dans l’ensemble, à mesure que la lumière et la température augmentent, le temps de récupération des chocs à froid diminue, ce qui montre une variabilité entre les taxons. Veuillez cliquer ici pour voir une version plus grande de cette figure.
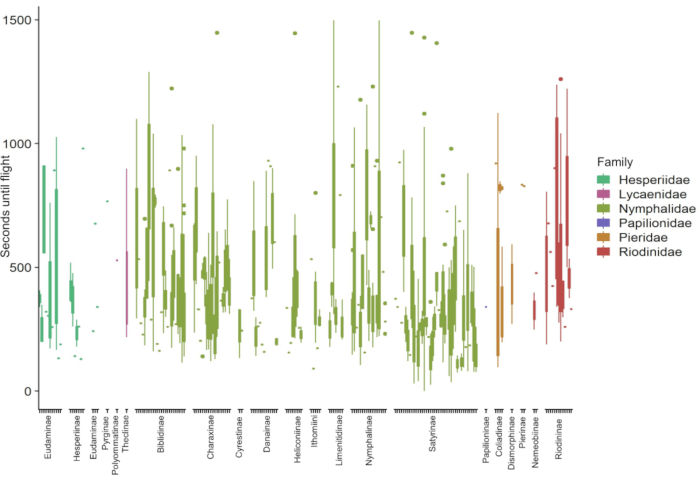
Figure 2: Exemple de résultats de l’essai de récupération par choc froid sur 181 espèces de papillons des Andes colombiennes. Les données représentent le nombre de secondes qui se sont écoulées entre le retrait du papillon du froid et le moment où il a pu voler. Les espèces sont organisées et colorées par famille. Cette figure montre l’étendue taxonomique dans laquelle cette expérience peut être appliquée avec succès, ainsi que la variété des réponses de rétablissement du choc froid à travers les espèces. Veuillez cliquer ici pour voir une version plus grande de cette figure.
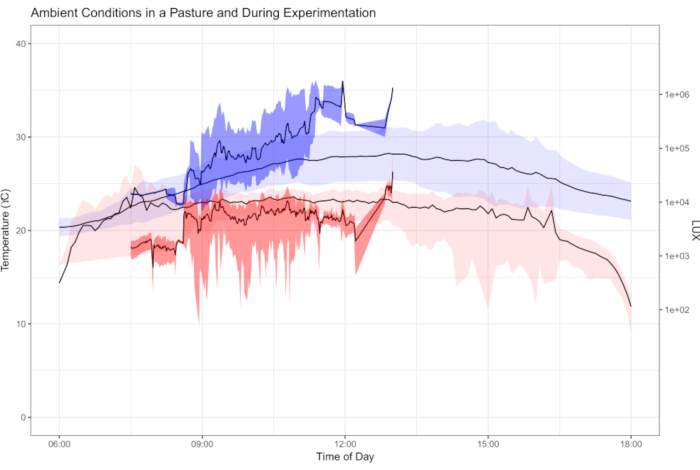
Figure 3: Température ambiante et LUX pendant les essais de récupération des chocs à froid. Tracé de la température ambiante (bleu) et LUX (intensité lumineuse, rouge) tels qu’enregistrés par les enregistreurs de données placés dans les pâturages où la collecte des papillons a eu lieu (couleurs claires, conditions s’étendent sur toute la journée) et des conditions pendant les essais de récupération des chocs à froid (couleurs sombres, seulement les heures du matin). Les conditions ambiantes du champ et les conditions expérimentales tracées montrent la gamme et les conditions moyennes vécues par les papillons au cours d’une semaine d’échantillonnage et d’expérimentation sur le terrain. Les expériences n’ont été menées qu’aux premières heures (07:00-13:00 h), tandis que les centrales de mesure ont été déployées sur le terrain pendant une semaine (heures du jour, 06:00-18:00 h indiquées). On voit ici le chevauchement entre les conditions expérimentales et les conditions ambiantes vécues par les papillons, démontrant la pertinence écologique de la réalisation d’essais physiologiques dans des conditions ambiantes. Veuillez cliquer ici pour voir une version plus grande de cette figure.
Figure supplémentaire 1: Procédure de collecte des insectes focaux-dansce cas, les papillons-à l’aide de pièges Van-Someren appâtés et de filets actifs. Les pièges étaient appâtés avec des appâts à poissons en décomposition et des appâts à fruits en décomposition. Piège (sans appât) en arrière-plan, au premier plan se trouve un spécimen dans son enveloppe unique contre une boîte de collecte en plastique bleu. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 2: Sacs avec jusqu’à quatre papillons individuels immergés dans de l’eau glacée dans une glacière. Les sacs en plastique ont été marqués avec l’heure à laquelle ils ont été placés dans l’eau glacée, de sorte que les expériences de choc froid ont pu être échelonnées tout au long de la matinée. Les sacs en plastique doivent être scellés pour empêcher les échantillons de se mouiller; cependant, l’inondation des sacs et de l’enveloppe dans ce cas n’a eu aucun effet mesurable sur la récupération des papillons. Veuillez cliquer ici pour télécharger ce fichier.
Figure supplémentaire 3: Deux observateurs recueillent des données sur le terrain. Chaque cage en maille contient quatre papillons uniques se remettant d’un choc froid. Le joint en T de chlorure de polyvinyle dans la cage abrite la centrale de mesure pour empêcher l’exposition directe au soleil ou à la pluie. Chaque observateur a un chronomètre qui a été démarré immédiatement après la libération du papillon dans la cage. Les cages sont surélevées par des bancs, ce qui permet aux observateurs d’agiter la base de la cage pour s’assurer que les papillons répondent comportementalement le plus rapidement possible physiologiquement. Veuillez cliquer ici pour télécharger ce fichier.
Tableau supplémentaire 1 : Exemple de fiche technique. La feuille montre l’ID unique de chaque papillon tel qu’il est attribué dans le champ et les caractères distinctifs (nom de l’espèce, couleurs clés) dans les notes. On a également enregistré la position dominante du papillon (c.-à-d. quel côté de l’aile a été exposé au soleil) pendant la période de récupération, notée D (dorsale) ou V (ventrale). Veuillez cliquer ici pour télécharger ce tableau.
Vidéo supplémentaire 1: Tapotement de la cage pour la récupération des chocs froids. Au fur et à mesure que les papillons se rétablissent, l’observateur tape doucement sur la base de la cage pour induire des comportements dès que les papillons sont capables. Veuillez cliquer ici pour télécharger cette vidéo.
Discussion
L’étude de la physiologie thermique intègre des mesures des espèces et des traits environnementaux afin de mieux comprendre les interactions entre les organismes et leur environnement qui sont essentielles à la survie et à la condition physique. Bien qu’ils fassent toujours partie intégrante de la compréhension de l’histoire naturelle et de l’écologie des plantes et des animaux, les traits thermiques sont de plus en plus importants face au paysage et au changement climatique11,21. Plusieurs groupes d’insectes terrestres ectothermes, en particulier les lépidoptères et les odonatans, sont relativement grands et abondants, présentent des comportements distincts et se présentent à la manipulation. Voici un test efficace et peu coûteux pour mesurer efficacement les réponses physiologiques de ces insectes. Ce protocole nécessite une source d’organismes sains à analyser, dont le temps de manipulation avant l’expérience est limité. Bien que le nombre d’organismes analysés en même temps soit flexible, le nombre d’individus focaux par expérience variera en fonction du but de la collecte de données et/ou du nombre d’observateurs.
Par exemple, ce protocole a été élaboré pour recueillir des données individuelles détaillées sur les papillons dans des collectivités entières. À ce titre, les résultats représentatifs illustrent un effort visant à maximiser la collecte de données pour les individus d’autant d’espèces que possible et dans diverses conditions pertinentes pour l’environnement local. Quel que soit le nombre d’espèces focales, il est crucial que l’observateur soit en mesure d’identifier chaque individu dans la cage qui subit le rétablissement. Si l’objectif est de recueillir des données auprès d’une seule espèce, alors seulement un ou deux individus (s’ils sont identifiables en fonction de l’usure différente des ailes ou s’ils sont marqués individuellement) devraient être analysés en même temps. Les sujets de l’étude doivent être choisis en fonction d’une question de recherche ou d’un plan d’études précis. Selon la question posée et le but de la collecte de données (recherche ou salle de classe, par exemple), la taille de l’échantillon et la collecte d’autres caractères diffèrent.
Pour illustrer les composantes fondamentales de la physiologie élucidées par ce protocole (induction du coma froid, étapes de rétablissement, rôle des conditions ambiantes), un instructeur en classe peut choisir deux espèces distinctes ou des morphes d’une seule espèce. Si les individus focaux ne diffèrent que par un seul caractère clé (p. ex. la couleur), une taille d’échantillon plus petite sera nécessaire, et les élèves pourront étudier de près la relation entre ce caractère et la physiologie de l’organisme. Les chercheurs qui s’intéressent à la physiologie écologique peuvent utiliser leurs données expérimentales pour explorer des questions écologiques et évolutives complexes. Les chercheurs doivent s’assurer de choisir soigneusement les insectes focaux qui répondent directement à leurs questions (p. ex. en fonction du stade de vie, de l’âge, du sexe et de l’emplacement) et, en fonction du nombre de variables en cause, de déterminer la taille appropriée de l’échantillon. La taille des échantillons pour les modèles complexes sera plus grande que celles décrites ci-dessus.
Lors de la collecte de données de récupération comportementale, il est essentiel que la cage repose au-dessus du sol, car l’observateur doit être en mesure d’appuyer sur le fond de la cage pour obtenir des comportements de récupération. Cela garantit que l’organisme répond (debout, mouches) dès qu’il est physiologiquement capable de le faire, et le comportement de récupération terminale (vol) est documenté. L’enregistrement des conditions ambiantes pendant la récupération du choc froid fait partie intégrante de l’étude de la physiologie thermique, car ce protocole est conçu pour étudier et démêler le rôle de l’environnement dans la physiologie de l’organisme. Les enregistreurs de données (voir la table des matériaux)sont utiles pour enregistrer des mesures normalisées des conditions pertinentes (par exemple, la température, la lumière et même l’humidité). Cependant, si ces outils ne sont pas disponibles, les conditions pertinentes peuvent être mesurées d’autres manières, comme avec un thermomètre numérique ou en simplifiant la variable des conditions environnementales et en utilisant des environnements distincts tels que l’ombre et le soleil. Ce protocole donne au chercheur des options pour mesurer les conditions pendant la récupération du choc froid en fonction du but et de la portée de l’étude.
Bien que cette méthode puisse être modifiée pour mieux s’adapter à des groupes taxonomiques spécifiques, il est recommandé d’utiliser de gros insectes volants. Les insectes volants qui retrouvent leur capacité de voler de façon autonome peuvent être considérés comme ayant accompli un rétablissement complet. La méthode, telle que décrite, a été utilisée avec succès sur les papillons dans les tropiques et les régions subtropicales. D’après les tendances thermiques d’une zone donnée (c.-à-d. la plage de températures vécues à un site qui variera, influençant ainsi les attentes en fonction de l’altitude, de la latitude et de la couverture de la canopée), un organisme peut avoir besoin de plus ou moins d’une heure dans un bain d’eau glacée pour entrer dans un coma froid. La taille de l’organisme peut également affecter le temps nécessaire pour entrer dans un coma froid. Il est essentiel de trouver le moment de l’exposition au froid nécessaire pour induire un coma froid (ne bouge pas), mais pas pour tuer les espèces focales. Le temps nécessaire pour induire un coma froid dépendra de la taille, de l’emplacement et de l’histoire naturelle / du comportement des individus. En se basant sur les résultats de l’expérience de choc froid décrite ici et en utilisant les connaissances sur l’écologie des insectes focaux, choisissez un moment pour conclure l’essai si une personne donnée ne se rétablit pas complètement.
En fonction des questions spécifiques du chercheur, cette méthode peut être utilisée sur le terrain ou en laboratoire pour permettre à la fois la variation naturelle de l’environnement et le contrôle des variables importantes, respectivement. Ce test est simple et peu coûteux et aide à combler les lacunes existantes dans le domaine de la physiologie thermique. La facilité de ce protocole le rend accessible à l’emploi pour un large éventail de taxons, ouvrant le champ à plus que des organismes de laboratoire. La nouveauté de la réalisation d’un essai thermique standardisé mais ambiant comble l’écart entre les résultats de laboratoire et de terrain22. Tirer parti des conditions ambiantes pour le rétablissement des organismes aidera les chercheurs à répartir le rôle des facteurs environnementaux et des espèces dans la physiologie14,22. Enfin, en raison de son faible coût et du manque de matériel requis, ce protocole peut être utilisé dans des endroits éloignés sur le terrain avec peu d’équipement - idéal pour de nombreux biologistes de terrain - ainsi que dans les salles de classe pour permettre aux jeunes étudiants une expérience d’apprentissage pratique.
Déclarations de divulgation
L’auteur n’a pas d’intérêts financiers concurrents ou d’autres conflits d’intérêts.
Remerciements
Merci à Jaret Daniels, Isabella Plummer, Brett Scheffers et Dan Hahn pour leurs commentaires sur le protocole tel qu’il a été développé. Remerciements supplémentaires à Jaime Haggard, Sebastián Durán et Indiana Cristóbal Róis-Málaver pour la mise en œuvre de plusieurs itérations de ce protocole et pour leurs commentaires sur les composants clés. Merci également à un réviseur anonyme pour ses commentaires sur le manuscrit dans son ensemble. Le soutien a été fourni par le fonds de publication du McGuire Center for Lepidoptera and Biodiversity, le College of Agricultural and Life Sciences, l’École des ressources naturelles et de l’environnement et le département d’écologie et de conservation de la faune à l’UF.
matériels
| Name | Company | Catalog Number | Comments |
| 24 x 24 x 36" Popup Rearing & Observation Cage | Bioquip | 1466PB | Ensure that the cage is slightly elevated from the ground to be able to tap the floor of the cage during experiments. |
| Cooler | Any | NA | |
| Glassine envelopes | Bioquip | 1130B | |
| HOBO Pendant Temperature/Light 8K Data Logger | Onset | UA-002-08 | If a datalogger is not accessible, researchers may choose to use a digital thermometer to record ambient temperatures at regular intervals. See protocol step 4.5 for additional information. |
| HOBO Optic USB Base Station | Onset | Base-U-1 | |
| Ice water | NA | NA | |
| Insects (focal taxa) | NA | Any | Collect sufficient samples to test, ensuring replication of experimental groups (e.g. species, sampling location) |
| PVC T-joint | Any | Any | |
| Sealable plastic bag | Any | NA | |
| Stopwatch/timer | Any | NA | |
| Weight | Any | NA | Large coins or small rocks to weigh down the plastic bags will ensure that specimens are submerged in ice water. A standardized weight is ideal. |
Références
- Huey, B., Stevenson, R. D. Integrating thermal physiology and ecology of ectotherms a discussion of approaches. American Zoologist. 19 (1), 357-366 (1979).
- Huey, R. B., Slatkin, M. Cost and benefits of lizard thermoregulation. The Quarterly Review of Biology. 51 (3), 363-384 (1976).
- Kingsolver, J. G. Butterfly thermoregulario: Organismic mechanisms and population consequences. Journal of Research on the Lepidoptera. 24, 1-20 (1985).
- Kingsolver, J. G. Evolution and coadaptation of thermoregulatory behavior and wing pigmentation pattern in pierid butterflies. Evolution. 41 (3), 472-490 (1987).
- Kingsolver, J. G., Huey, R. B. Evolutionary analyses of morphological and physiological plasticity in thermally variable environments. American Zoologist. 38, 545-560 (1998).
- Malhi, Y., Wright, J. Spatial patterns and recent trends in the climate of tropical rainforest regions. Philosophical Transactions of the Royal Society of London. Series B, Biological Sciences. 359 (1443), 311-329 (2004).
- Sears, M. W., et al. Configuration of the thermal landscape determines thermoregulatory performance of ectotherms. Proceedings of the National Academy of Sciences of the United States of America. 113 (38), 10595-10600 (2016).
- Sinclair, B. J., Coello Alvarado, L. E., Ferguson, L. V. An invitation to measure insect cold tolerance: Methods, approaches, and workflow. Journal of Thermal Biology. 53, 180-197 (2015).
- Angilletta, M. . Thermal adaptation: a theoretical and empirical synthesis. , (2009).
- Perkins-Kirkpatrick, S. E., Gibson, P. B. Changes in regional heatwave characteristics as a function of increasing global temperature. Scientific Reports. 7, 12256 (2017).
- Frishkoff, L. O., Hadly, E. A., Daily, G. C. Thermal niche predicts tolerance to habitat conversion in tropical amphibians and reptiles. Global Change Biology. 21 (11), 3901-3916 (2015).
- Nowakowski, A. J., Otero Jiménez, B., Allen, M., Diaz-Escobar, M., Donnelly, M. Landscape resistance to movement of the poison frog, Oophaga pumilio, in the lowlands of northeastern Costa Rica. Animal Conservation. 16 (2), 188-197 (2013).
- Kingsolver, J. G., Buckley, L. B. Quantifying thermal extremes and biological variation to predict evolutionary responses to changing climate. Philosophical Transactions of the Royal Society B. Biological Sciences. 372 (1723), 20160147 (2017).
- Dowd, W. W., King, F. A., Denny, M. W. Thermal variation, thermal extremes and the physiological performance of individuals. Journal of Experimental Biology. 218, 1956-1967 (2015).
- Sinclair, B. J., Williams, C. M., Terblanche, J. S. Variation in thermal performance among insect populations. Physiological and Biochemical Zoology. 85 (6), 594-606 (2012).
- Gotcha, N., Terblanche, J. S., Nyamukondiwa, C. Plasticity and cross-tolerance to heterogeneous environments: divergent stress responses co-evolved in an African fruit fly. Journal of Evolutionary Biology. 31 (1), 98-110 (2018).
- Mutamiswa, R., Chidawanyika, F., Nyamukondiwa, C. Superior basal and plastic thermal responses to environmental heterogeneity in invasive exotic stemborer Chilo partellus Swinhoe over indigenous Busseola fusca (Fuller) and Sesamia calamistis Hampson. Physiological Entomology. 43 (2), 108-119 (2018).
- de Jong, M. A., Saastamoinen, M. Environmental and genetic control of cold tolerance in the Glanville fritillary butterfly. Journal of Evolutionary Biology. 31 (5), 636-645 (2018).
- DeVries, Z. C., Kells, S. A., Appel, A. G. Estimating the critical thermal maximum (CTmax) of bed bugs, Cimex lectularius: Comparing thermolimit respirometry with traditional visual methods. Comparative Biochemistry and Physiology. Part A, Molecular & Integrative Physiology. 197, 52-57 (2016).
- De Keyser, R., Breuker, C. J., Hails, R. S., Dennis, R. L. H., Shreeve, T. G. Why small is beautiful: Wing colour is free from thermoregulatory constraint in the small lycaenid butterfly, Polyommatus icarus. PLoS One. 10 (4), 0122623 (2015).
- Nowakowski, A. J., et al. Tropical amphibians in shifting thermal landscapes under land-use and climate change. Conservation Biology. 31 (1), 96-105 (2017).
- Niehaus, A. C., Angilletta, M. J., Sears, M. W., Franklin, C. E., Wilson, R. S. Predicting the physiological performance of ectotherms in fluctuating thermal environments. Journal of Experimental Biology. 215, 694-701 (2012).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon