Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Mesure des complexes de transfert d’électrons mitochondriaux dans le tissu cardiaque précédemment congelé de la progéniture de la truie: un modèle pour évaluer les changements bioénergétiques mitochondriaux induits par l’exercice
Dans cet article
Résumé
La préparation d’échantillons enrichis en mitochondries à partir de tissus solides archivés précédemment congelés a permis aux chercheurs d’effectuer des évaluations fonctionnelles et analytiques des mitochondries dans diverses modalités expérimentales. Cette étude montre comment préparer des préparations enrichies en mitochondries à partir de tissus cardiaques congelés et effectuer des évaluations analytiques des mitochondries.
Résumé
Le profil du complexe de transfert d’électrons mitochondrial (ETC) est modifié dans le tissu cardiaque de la progéniture née d’une truie exerçante. L’hypothèse proposée et testée était qu’un exercice maternel régulier d’une truie pendant la grossesse augmenterait l’efficacité mitochondriale de la bioénergétique cardiaque de la progéniture. Cette hypothèse a été testée en isolant les mitochondries à l’aide d’une procédure d’isolement léger pour évaluer les profils ETC et supercomplexes mitochondriaux. La procédure décrite ici a permis le traitement de tissus cardiaques archivés précédemment congelés et a éliminé la nécessité d’une préparation fraîche des mitochondries pour l’évaluation des complexes ETC mitochondriaux, des supercomplexes et des profils d’activité complexes ETC. Ce protocole décrit la mesure optimale du complexe protéique ETC dans l’immunoblotting multiplexé à base d’anticorps et l’évaluation super complexe à l’aide de l’électrophorèse sur gel bleu-natif.
Introduction
L’objectif de ce protocole était de fournir des étapes détaillées pour obtenir une préparation enrichie en mitochondries à partir de tissus cardiaques précédemment congelés avec une nouvelle technologie de perturbation mécanique à faible énergie des tissus qui améliore la lyse tissulaire et l’extraction des mitochondries. Avec cette méthode, une efficacité d’extraction améliorée sans générer de contrainte de cisaillement élevée ou de température élevée et un temps d’homogénéisation court (10-12 s) deviennent réalisables1.
Obtenir des mitochondries à partir de tissus congelés archivés est un atout précieux pour effectuer des études fonctionnelles2 et biochimiques3 autrement difficilement reproductibles dans les conditions expérimentales exactes. Un homogénéisateur classique en verre de pilon Potter-Elvehjem ou homogénéisateur Dounce a été utilisé et est toujours utilisé dans les laboratoires de recherche pour homogénéiser les tissus mous tels que le foie, les reins et le cerveau. Cependant, l’homogénéisation des tissus durs tels que les muscles et le cœur nécessite plus de temps d’homogénéisation, un traitement enzymatique, une homogénéisation à grande vitesse et une expérience utilisateur étendue. Ceci est désavantageux pour l’extraction d’organites intacts tels que les mitochondries des tissus durs tels que les muscles et le cœur. La méthode décrite dans ce protocole est utilisée pour obtenir une préparation enrichie en mitochondries à haut rendement pour analyser les complexes protéiques de la chaîne de transport d’électrons mitochondriaux (ETC) et leur formation supercomplexe dans les tissus cardiaques prélevés sur une progéniture née à une truie exercée et sédentaire, congelée dans de l’azote liquide et stockée à -80 ° C pour une utilisation future. Cette méthode permet à l’utilisateur d’isoler la préparation enrichie en mitochondries à partir de tissus archivés précédemment congelés.
L’exposition externe aux nanomatériaux aux rongeurs gravides peut affecter négativement la fonction cardiaque, la respiration mitochondriale et la bioénergétique sur la progéniture pendant la gestation4. Néanmoins, les changements positifs induits par l’exercice aérobie dans la bioénergétique des myocytes fœtaux pendant la grossesse n’ont pas encore été documentés. Cependant, de nouvelles études fournissent des preuves que l’exercice aérobique maternel pendant la grossesse a une influence positive sur la fonction cardiaque fœtale5. Afin de fournir des preuves supplémentaires, une analyse des effets longitudinaux de l’exercice maternel sur les complexes de la chaîne respiratoire mitochondriale cardiaque de la progéniture (c.-à-d. du complexe I au complexe V) pendant la grossesse a été effectuée.
Cette étude a une pertinence significative pour la santé puisque les résultats peuvent suggérer que l’exercice maternel améliore l’efficacité de la production d’énergie dans les mitochondries cardiaques de la progéniture. Dans cette étude, les truies (femelles porcines) ont été utilisées comme modèle animal pour deux raisons : (i) la physiologie cardiaque est similaire à celle de l’homme6, et (ii) la récolte de tissus cardiaques sur la progéniture à différents moments est réalisable sous une approbation institutionnelle de l’IACUC. L’étude proposée vise à répondre à de nombreuses questions fondamentales liant l’exercice maternel et ses effets positifs potentiels sur la composition cellulaire et biochimique du tissu cardiaque de la progéniture. Cette approche nécessite des techniques d’isolement des mitochondries douces mais efficaces à partir de tissus cardiaques précédemment congelés obtenus à partir d’études longitudinales longues et coûteuses qui ont abordé les problèmes des changements bioénergétiques dans les myocytes cardiaques fœtaux pendant la grossesse. La méthode décrite dans cette étude permet d’utiliser de grandes quantités de tissus archivés précédemment congelés pour une préparation enrichie en mitochondries pour des études analytiques et fonctionnelles. L’étude aidera également à combler le manque de connaissances dans ce domaine en fournissant des données préliminaires, ce qui pourrait conduire à de futures études déterminant les effets de l’exercice maternel sur la santé cardiaque in utero et au-delà.
Protocole
Les tissus cardiaques congelés de la progéniture ont été reçus du Dr Sean Newcomer avec la lettre d’approbation de l’IACUC de l’établissement. Les tissus cardiaques ont été obtenus à partir d’une étude longitudinale à long terme, congelés dans de l’azote liquide et stockés à -80 °C pour une utilisation future. Tous les protocoles concernant le traitement du tissu cardiaque de la progéniture suivaient les directives des comités IBC et IACUC de l’Université de Kansas City.
1. Préparation des tampons et des réactifs
REMARQUE: Préparez tous les échantillons conformément aux directives du fabricant. Utilisez de l’eau ultra-purifiée ou équivalente dans toutes les recettes et étapes du protocole. Portez de l’équipement de protection individuelle (jubilations de laboratoire, masque facial, gants et lunettes / écran facial) pendant cette procédure. Les volumes tampons conviennent au traitement de six échantillons de tissus.
- Préparer un tampon de lavage des tissus de 1,5 L en combinant 154,035 g de saccharose (0,3 M final), 3,904 g de HEPES (10 mM final), 0,111 g d’EDTA (0,2 mM final). Ajouter les ingrédients à 1,0 L d’eau sur la plaque de remue-ménage, ajuster le pH à 7,2 avec du HCl dilué et maquiller au volume final à 1,5 L.
REMARQUE: Environ 200 mL de tampon de lavage sont nécessaires par échantillon (50-300 mg). Six échantillons de tissus peuvent être traités en une journée. Utilisez le tampon de lavage restant pour créer un tampon d’isolement. - Préparer le tampon d’isolement à partir du tampon de lavage décrit précédemment à l’étape 1.1 en ajoutant 210 mg de BSA dans 210 mL de tampon de lavage. Ajuster le pH à 7,4 avec une solution diluée de NaOH.
REMARQUE : Environ 35 mL de tampon d’isolement sont nécessaires par échantillon de tissu; par conséquent, 210 mL de tampon d’isolement sont nécessaires pour six échantillons. Préparez ce tampon en ajoutant une solution de BSA fraîche (1 mg/mL final) le jour de la préparation. BSA est utilisé pour isoler les mitochondries car il améliore les propriétés mitochondriales en éliminant les découpleurs naturels tels que les acides gras libres. Il a été constaté que le BSA a une activité antioxydante en augmentant le taux d’oxydation des substrats, en particulier du succinate, dans les mitochondries du cerveau7. Alternativement, l’albumine sérique bovine peut être remplacée par des analogues sans acide moins coûteux tels que l’ovalbumine. - Préparer 150 mL de tampon de remise en suspension en combinant 0,011 g d’EDTA (concentration finale de 0,2 mM d’EDTA ou utiliser 150 μL de solution d’EDTA de 200 mM pour 150 mL de tampon de remise en suspension), 12,836 g de saccharose (concentration finale de saccharose de 0,25 M) et 0,236 g de Tris (10 mM de Tris-HCl final). Ajustez le pH à 7,8 avec 0,1 N NaOH. Ajouter 60 μL du cocktail d’inhibiteurs de la protéase juste avant utilisation.
- Préparer la solution de trypsine en dissolvant 7,5 mg de trypsine dans 3,0 mL de 1 mM HCl (2,5 mg de trypsine/mL finale). Cette quantité est suffisante pour un échantillon.
REMARQUE: Préparer la solution de trypsine en fonction du nombre d’échantillons de tissus devant être traités. - Préparer la solution d’inhibiteur de trypsine à partir de soja en combinant 13,0 mg d’inhibiteur de trypsine dans 20 mL de tampon d’isolement contenant du BSA (0,65 mg/mL d’inhibiteur de trypsine final).
REMARQUE: Préparez une nouvelle solution d’inhibiteur de la trypsine. - Préparer le réactif de persulfate d’ammonium en ajoutant 0,1 g de persulfate d’ammonium dans 1 mL d’eau (10 % de persulfate d’ammonium final).
REMARQUE: Le réactif au persulfate d’ammonium doit être fraîchement préparé ou un grand volume peut être alicité et conservé dans un congélateur à -20 ° C. - Préparer la solution d’acide aminocaproïque (ACA) en combinant 0,131 g d’acide 6-amino caproïque dans 1,0 mL d’eau ultra-purifiée et la stocker dans 4 °C (1 M d’acide 6-aminocaproïque final).
- Préparer la solution de colorant bleu brillant coomassie en dissolvant 1 g de Coomassie G-250 dans 0,5 mL d’eau et 0,5 mL d’acide aminocaproïque 1 M (concentration finale de la solution de colorant à 10 %).
- Préparez 5% de Digitonin pour Blue native-PAGE (BN-PAGE). Calculer approximativement la quantité de digitonine nécessaire dans la préparation de l’échantillon plus un volume supplémentaire pour compenser les erreurs de pipetage (surestimer de 10 mg). Pour 15 mg : Tout d’abord, diluer 15 mg de digitonine dans 30 μL de DMSO à 100 %. Vortex pour aider la digitonine à entrer dans la solution. Ensuite, ajoutez les 90% restants de ddH2O (270 μL). Chauffer doucement pour mélanger la solution (vortex), puis la refroidir sur de la glace.
- Préparez le tampon d’anode PAGE natif. Ajoutez 50 mL de tampon de fonctionnement PAGE natif 20x à 950 mL d’eau pour obtenir un volume final de 1 L. Préparez un tampon d’anode frais pour une utilisation immédiate. Utilisez-le comme tampon d’exécution 1x.
- Préparez un tampon cathodique bleu foncé. Dissoudre 0,0160 g de Coomassie bleu brillant G-250 dans 80 mL de tampon d’anode PAGE natif; bien mélanger.
REMARQUE: Préparez un tampon cathodique frais pour une utilisation immédiate. Seulement 60 mL peuvent être nécessaires, mais faire un supplément de 20 mL en cas de fuites. - Préparez le tampon cathodique bleu clair. Ajoutez 20 mL de tampon cathodique bleu foncé dans 180 mL de tampon d’anode PAGE natif et mélangez bien.
REMARQUE : Ce tampon ne peut être utilisé qu’une seule fois. - Préparer 5% de Coomassie G-250 comme additif d’échantillon. Diluer 200 μL de 10 % de bouillon de Coomassie déjà fabriqué (étape 1.8) avec 200 μL de 1 MCA et conserver à 4 °C.
- Préparez 4x tampon d’échantillon NATIF PAGE en combinant 40% de glycérol, 0,04% de Ponceau S, 25 mM de Tris-HCl (pH 6,8), 192 mM de glycine dans 10 mL de volume final. Aliquotez-les et conservez-les à -20 °C au congélateur.
2. Isolement des mitochondries du tissu cardiaque congelé
REMARQUE: Effectuez la procédure d’isolement des mitochondries dans une chambre froide à 4 ° C. Cependant, en cas d’indisponibilité de la chambre froide, utilisez un bain de glace de grande taille pour effectuer la procédure.
- Retirez des échantillons de tissus cardiaques préalablement congelés du congélateur à -80 °C.
REMARQUE: Un maximum de quatre échantillons de tissus peuvent être traités confortablement pour l’isolement des mitochondries dans une journée donnée. - Peser le tube contenant l’échantillon de tissu cardiaque et enregistrer le poids. Préparer trois béchers (chacun de 50 mL) contenant 40 mL de tampon de lavage. Refroidir chaque bécher dans le bain de sel glacé avec des quantités égales de glace et de sel mélangés pendant 3 à 5 minutes avant de passer à l’étape suivante. Mettez des barres d’agitation magnétiques dans chaque bécher et réglez l’agitateur pour une vitesse moyenne.
REMARQUE: Ne pas trop geler les béchers et les utiliser immédiatement juste après l’apparition de nuages de cristaux de glace. - Mettez le tissu cardiaque congelé directement dans la solution glacée dans le premier bécher. Attendez environ 5 minutes en remuant et en appliquant une légère pression sur le tissu à l’aide d’une pince à épiler pour faire sortir autant de sang que possible.
- Peser le tube vide et soustraire du poids d’origine (étape 2.2) pour obtenir un poids net du tissu cardiaque.
- Retirez le mouchoir avec une pince et pressez le cœur avec une serviette en papier propre de papier filtre pour enlever le sang. Ensuite, placez le tissu dans le deuxième bécher. Attendez environ 5 minutes en remuant pour enlever l’excès de sang.
- Séchez doucement le mouchoir sur une serviette en papier. Enlevez toute la graisse, le sang coagulé, les oreillettes et les fascias (tissu blanc). Ensuite, mettez en commun le tissu ventriculaire.
- Déchiqueter les échantillons de tissus à l’aide du broyeur en suivant les étapes 2.7.1 à 2.7.9.
- Placez le tissu cardiaque (~ 50-300 mg) dans la chambre de broyage des tissus du côté du bélier.
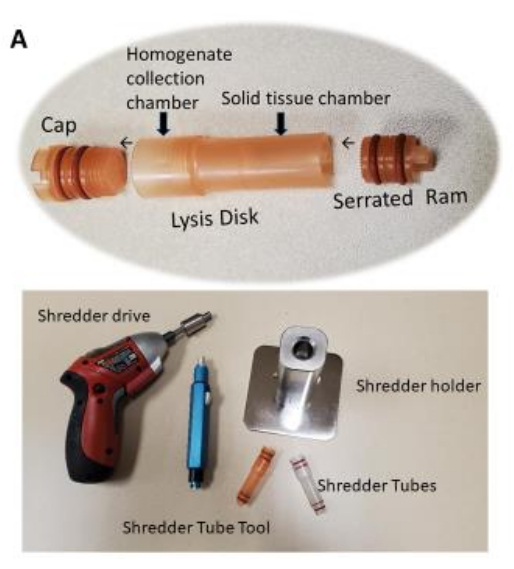
Figure 1 : Chambre de broyage de tissus (tube) à utiliser avec le broyeur. L’homogénéisation des tissus dans le tube de broyage nécessite environ 10 à 12 s par échantillon de tissu. L’homogénéisation tissulaire est terminée une fois que le tissu homogénéisé passe à travers le disque perforé dans la chambre supérieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Ajouter ~ 0,2-0,8 mL de tampon de lavage du côté du bouchon du tube.
REMARQUE: Assurez-vous que le volume total de l’échantillon et du tampon de lavage combinés pendant le broyage ne dépasse pas 0,7-0,8 mL. - Utilisez l’outil de tube pour boucher la chambre de broyage avec le bouchon de broyeur bien ajusté.
REMARQUE: Ne pas trop serrer le capuchon du broyeur. - Placez la chambre de broyage dans l’unité de support de broyeur avec le côté bélier vers le bas. Le bélier engagera un raccord dans le support du broyeur.
- Insérez le bit du pilote de broyeur ; laissez le mors s’engager avec le capuchon du broyeur. Assurez-vous que le bit est bien verrouillé en place.
REMARQUE: Utilisez toujours le pilote de broyeur complètement chargé. - Appliquez manuellement une pression vers le bas sur le conducteur du broyeur et la chambre du broyeur jusqu’à ce que l’indicateur de pression sur le support du broyeur atteigne un réglage d’environ 2 sur le support du broyeur.
REMARQUE: Le réglage peut être à un niveau plus élevé si le déchiquetage du tissu est plus fibreux. - Exécutez le pilote du broyeur pendant environ 10 à 12 s en appuyant sur la gâchette du pilote du broyeur, tout en maintenant le réglage à 2.
- Regardez le tube pour vérifier si la totalité ou la majeure partie de la masse solide du tissu est déchiquetée à travers le disque de lyse et passée dans la chambre supérieure de la chambre de broyage en regardant le tube.
REMARQUE: Il peut être nécessaire de déchiqueter l’échantillon de tissu pendant une période plus longue. Il suffit de retourner le tube dans le support du broyeur et de poursuivre le processus. La plupart des types d’échantillons de tissus ne nécessitent que 10 à 12 s de broyage. Bien que tout broyage produise de la chaleur en raison de la friction, ce court temps de traitement ne chauffera pas de manière significative l’échantillon. - Après avoir déchiqueté l’échantillon, soulevez la chambre de broyage hors de l’unité de support. Utilisez l’outil de tube pour retirer le bouchon du broyeur et placez-le sur une surface propre pour une utilisation ultérieure.
REMARQUE: Le bouchon du broyeur doit être considéré comme contaminé par un extrait d’échantillon et, selon le type d’échantillon, peut être contaminé par des matières infectieuses. N’utilisez pas le même bouchon de broyeur pour tout autre échantillon de tissu afin d’éviter la contamination croisée.
- Transférer le tissu cardiaque déchiqueté dans le troisième bécher avec 40 mL de tampon de lavage et de barre d’agitation et remuer le tissu pendant 5 min à une vitesse moyenne sur la plaque d’agitation.
- Filtrer la suspension à travers un monofilament en maille de nylon (taille des pores de 74 μm) et jeter le filtrat. Lavez le tissu déchiqueté sur le filtre 3x avec 10 mL de tampon de lavage.
REMARQUE: Assurez-vous que le monofilament en maille de nylon est pré-mouillé avec de l’eau. - Transférer le tissu lavé et déchiqueté dans un bécher de 50 mL avec 20 mL de tampon de lavage et placer le bécher dans le bain de glace sur l’agitateur magnétique. Ajouter 0,5 mL de solution de trypsine en remuant constamment pendant 15 min. Environ à mi-chemin de l’incubation (environ 7,5 minutes), transférez la suspension tissulaire dans un homogénéisateur portatif verre sur verre lâche qui contiendra 0 à 15 mL de volume.
Figure 1 : Chambre de broyage de tissus (tube) à utiliser avec le broyeur. L’homogénéisation des tissus dans le tube de broyage nécessite environ 10 à 12 s par échantillon de tissu. L’homogénéisation tissulaire est terminée une fois que le tissu homogénéisé passe à travers le disque perforé dans la chambre supérieure. Veuillez cliquer ici pour voir une version agrandie de cette figure.
- Homogénéiser doucement avec 4-5 coups pour disperser la suspension sans produire de mousse. Placer l’homogénat dans un bécher de 50 mL et mélanger doucement sur une plaque remuante pendant 15 min à 4 °C.
- Après 15 min d’incubation, ajouter 10 mL du tampon d’isolement qui contient l’inhibiteur de la trypsine dans le bécher contenant l’homogénat et incuber pendant 1 min à 4 °C en remuant doucement.
- Filtrez à nouveau la suspension à travers un filtre en nylon et conservez le filtrat dans un tube conique de 50 mL.
- Recueillir la fraction particulaire laissée sur le filtre en nylon et la placer dans l’homogénéisateur verre sur verre. Ajouter 15-20 mL du tampon de lavage et homogénéiser doucement à la main pendant 25-30 s.
REMARQUE: Le filtrat s’écoule très lentement à cette étape. Pour augmenter le débit de filtrat, placez la pointe de l’entonnoir en touchant l’intérieur du tube conique. - Mélanger l’homogénat avec le filtrat, équilibrer les tubes et centrifuger à 600 x g pendant 15 min à 4 °C.
- Filtrer le surnageant résultant dans un nouveau tube conique à l’aide d’un filtre en nylon pour éviter la contamination par la pastille. Faites refaire tourner la centrifugeuse à 8 500 x g pendant 15 min à 4 °C.
REMARQUE: Utilisez une pipette de transfert en plastique pour retirer le surnageant et sacrifier 0,2 mL de surnageant du haut de la pastille duveteuse. - Jetez le surnageant et rincez la pastille 2 à 3 fois avec 1 mL de tampon d’isolement. Assurez-vous de jeter la couche de bord extérieur blanc moelleux à chaque fois.
REMARQUE: Lavez la pastille en ajoutant le tampon d’isolation à l’aide d’une pipette avec une pointe de 1 mL ou d’une nouvelle pipette de transfert. Ajoutez le tampon sur le côté du tube, pas directement sur le granulé, pour éviter de casser le granulé et éviter la contamination du surnageant. Ensuite, aspirez le tampon avec une pipette de transfert et répétez le processus deux fois de plus. - Ajouter 5 mL de tampon d’isolement à chaque tube et briser la pastille à l’aide d’une pipette avec une pointe de 1 mL ou d’une nouvelle pipette de transfert.
- Diluer la suspension avec 20 mL de tampon d’isolement supplémentaire et faire fonctionner à nouveau la centrifugeuse à 8 500 x g pendant 15 min à 4 °C.
- Jeter le surnageant et remettre la pastille en suspension dans 5 mL du tampon de remise en suspension. Ensuite, ajoutez 15 mL de plus du tampon pour un total de 20 mL, et centrifugez à 8 500 x g pendant 15 min. à 4 °C. Jetez le surnageant. La pastille brune résultante contient des mitochondries intactes lavées.
- Remettre en suspension la pastille enrichie en mitochondries dans 250 μL du tampon de remise en suspension, y compris les inhibiteurs de la protéase. Aliquote dans 25 μL, congeler rapidement dans de l’azote liquide et conserver dans un congélateur à -80 °C pendant plusieurs années.
REMARQUE: Épargnez 5 μL de préparation enrichie en mitochondries pour le test d’analyse des protéines. Pour une étude BN-PAGE (Blue native-PAGE), aliquote la pastille remise en suspension dans 50 μg de protéine mitochondriale par tube. Centrifuger à 8 500 x g pendant 15 min à 4 °C. Aspirer soigneusement le surnageant et conserver la pastille mitochondriale (50 μg de protéines/aliquotes) dans un congélateur à -80 °C pendant plusieurs années.
3. Évaluation du complexe de transfert d’électrons mitochondriaux (ETC)
REMARQUE: Les protéines ETC mitochondriales individuelles (c.-à-d. complexes I, II, III, IV, V) peuvent être évaluées par un test immunoblotting standard. En raison de la variété des échantillons (quatre points de temps: 48 h, 3 mois, 6 mois, 9 mois), de deux conditions expérimentales (exercées et sédentaires) et d’un certain nombre d’anticorps immunoprobants (cinq anticorps), une immunobuvardage multiplexée est recommandée. Effectuez l’immunoblotting multiplexé comme suit.
- Résoudre 50 μg d’échantillon/puits de protéines enrichies en mitochondries dans une électrophorèse sur gel de polyacrylamide à gradient de 4% à 20% (100 V, 90 min).
- Transférer les protéines sur une membrane PVDF (75 V; 60 min)
- Bloquer la membrane dans une solution tampon bloquante pendant au moins 1 h à 4 °C.
REMARQUE: Le temps de blocage peut être prolongé jusqu’à la nuit à 4 ° C. Le tampon bloquant (Table des matériaux) contient des ingrédients non mammifères (c.-à-d. des protéines de poisson) qui sont moins susceptibles d’avoir des interactions de liaison spécifiques avec des anticorps ainsi que d’autres protéines de mammifères présentes dans les méthodes typiques. - Sondez la membrane avec le cocktail d’anticorps comprenant les anticorps anti-Complex-I, II, III, IV, V et incubez pendant la nuit sur un agitateur orbital à 4 °C.
- Le lendemain, lavez la membrane et la sonde avec un anticorps secondaire marqué IR pendant 2 h sur un agitateur orbital à RT (température ambiante).
- Laver cinq fois avec 1x TBS-T (TBS contenant Tween 20), et une fois avec 1x TBS (Tris buffered saline).
REMARQUE: Pour le dernier lavage, n’incluez pas de détergent dans le tampon TBS. - Imagez le blot dans un analyseur d’images.
4. L’évaluation du supercomplexe des mitochondries par électrophorèse sur gel de polyacrylamide natif bleu (BN-PAGE)
REMARQUE: Un profil supercomplexe d’ETC peut également être évalué en utilisant la technique BN-PAGE.
- Préparer le cocktail tampon de l’échantillon pour 20 μL par 50 μg de protéine de granulé enrichie en mitochondries (7 μL d’eau + 5 μL de 4x tampon de charge d’échantillon d’électrophorèse en gel de polyacrylamide natif + 8 μL de 5% de digitonine + 2 μL de Coomassie G-250).
REMARQUE: Faites un cocktail tampon d’échantillon de stock en fonction du nombre d’échantillons disponibles (50 μg de protéines / échantillon). Choisissez les quantités de digitonine appropriées en fonction de la concentration en protéines de la pastille enrichie en mitochondries (tableau 1)8. - Chauffer le bouillon de digitonine à 95 °C pendant 3 min, mélanger et refroidir sur glace avant de faire le mélange principal.
- Ajouter l’additif d’échantillon Coomassie G-250 juste avant de charger les échantillons dans le gel.
- Ajouter 20 μL du cocktail tampon de l’échantillon dans un tube contenant 50 μg de granulés de protéines mitochondriales. Solubilisez/resuspendez la pastille en mélangeant doucement la pastille avec une pipette sans générer de mousse.
- Incuber le mélange sur de la glace pendant 20 min pour obtenir une solubilisation maximale de la pastille enrichie en mitochondries. De temps en temps, faites glisser doucement les tubes pour améliorer la solubilisation.
- En attendant l’incubation, préparez le tampon d’anode PAGE natif / tampon de fonctionnement 1x et le tampon de cathode de couleur bleu foncé.
- Centrifuger la pastille solubilisée enrichie en mitochondries à 20 000 x g pendant 10 min à 4 °C.
- Après centrifugation, recueillir 15 μL du surnageant dans de nouveaux tubes placés sur la glace.
- Ajouter la quantité appropriée de réactif Coomassie G-250 à 5 % au surnageant obtenu à l’étape 4.8 (voir tableau 1).
REMARQUE: Le volume de 5% de Coomassie G-250 doit être tel que la concentration finale du colorant soit de 1/4 de la concentration de détergent. Effectuez cette étape juste avant de charger les échantillons dans le gel.
| Protéine | Digitonine/protéine | 4x Tampon d’échantillon | 5% Digitonine | Eau | Volume final | 5% Coomassie G-250 |
| rapport (g/g) | exemple d’additif | |||||
| 50 μg | 8 | 5 | 8 | 7 | 20 | 2 |
| 50 μg | 4 | 5 | 4 | 11 | 20 | 1 |
Tableau 1 : Préparation de cocktail tampon d’échantillon avec deux rapports détergent/protéines différents. Pour obtenir une solubilisation maximale des protéines membranaires de la suspension mitochondriale, la concentration en digitonine/protéine de suspension mitochondriale doit être ajustée entre 4 et 8 g de digitonine/g de protéine. Dans le tissu cardiaque, 400 μg de digitonine pour 50 μg de protéines de suspension mitochondriale (c.-à-d. 8 g de digitonine/g de protéine mitochondriale) ont été utilisés pour maximiser la solubilité des supercomplexes de la suspension mitochondriale.
- Versez un gel gradient de 3% à 8%, retirez le peigne et lavez les puits du gel avec 1x tampon de course trois fois.
REMARQUE: Le gel polymérise le mieux s’il est versé un jour avant. - Installez le système d’électrophorèse et placez le gel dans l’appareil.
- Remplissez les puits d’échantillon avec le tampon cathodique de couleur bleu foncé.
- Chargez 10 μL de l’étalon protéique non coloré en tant que marqueur de poids moléculaire natif sur le premier et le dernier puits du gel.
- Chargez la totalité de l’échantillon de surnageant + additif d’échantillon coomassie préparé à l’étape 4.9 ci-dessus dans les puits à l’aide d’une pointe de chargement de gel à tête plate.
- Remplissez soigneusement le mini barrage tampon cellulaire avec environ 60 mL de tampon cathodique de couleur bleu foncé sans perturber les échantillons dans les puits, puis remplissez le réservoir tampon avec le tampon natif PAGE 1x.
- Allumez l’alimentation et électrophorèsez les échantillons à 150 V pendant environ 30 min.
- Retirez le tampon cathodique de couleur bleu foncé du barrage tampon (chambre intérieure) à l’aide d’une pipette de transfert ou aspirez les puits d’échantillonnage. Remplissez la chambre intérieure avec 150-200 mL de tampon cathodique de couleur bleu clair et exécutez l’électrophorèse à 250 V pendant 60 min.
REMARQUE: Le temps d’électrophorèse peut être déterminé en vérifiant lorsque le front de teinture migre à seulement 0,5 cm au-dessus du fond de la cassette de gel. - Retirez le gel de la cassette et placez-le dans un récipient en plastique propre. Lavez le gel avec de l’eau distillée de bonne qualité pendant 15 minutes sur un shaker à bascule/orbital.
REMARQUE: Pour retirer le gel dégradé de la cassette, manipulez la cassette par le bas, qui est plus forte, afin de minimiser les risques de rupture. - Versez de l’eau, immergez le gel dans une quantité suffisante de réactif de coloration Coomassie GelCode Blue et incubez pendant 1 h sur une orbitale/bascule à température ambiante.
REMARQUE: Mélanger la solution de réactif de teinture bleue (table des matériaux) avant utilisation en faisant tourbillonner doucement le flacon plusieurs fois. - Décantez la solution de colorant, ajoutez de l’eau distillée, rincez plusieurs fois avec de l’eau, puis mettez sur l’orbitale / bascule pour la décoloration.
REMARQUE: Insérez un morceau d’éponge (~ 3 cm x 0,5 cm) dans le récipient contenant du gel et laissez le gel pour le décolorer pendant la nuit. L’éponge adsorbe les particules de colorant sans nécessiter de multiples changements d’eau. - Analysez le gel dans un analyseur d’images.
5. Évaluation du supercomplexe des mitochondries par analyse par transfert d’immunoblot
- Effectuez un nouvel ensemble de BN-PAGE sans tacher le gel à la fin de l’électrophorèse.
- Suivez la même procédure que dans la rubrique 3 (évaluation du complexe de transfert d’électrons mitochondriaux (ETC)) pour compléter l’immunobuvardage.
Résultats
En suivant le protocole, un bon rendement de mélange de protéines enrichi en mitochondries à partir de tissu cardiaque a été préparé. Environ 15 mg/mL de mélange de protéines enrichies en mitochondries ont été obtenus à partir d’une moyenne de 1,2 g de tissu cardiaque congelé prélevé sur la progéniture de la truie. Les observations ont indiqué que moins de 0,5 g de tissu cardiaque congelé ne produisait pas une quantité suffisante de mélange de protéines enrichies en mitochondries pour effectuer un ...
Discussion
Les étapes critiques de ce protocole sont indiquées ici. Tout d’abord, l’homogénéisation des tissus doit être manipulée avec soin afin que des effets excessifs ne soient pas appliqués pendant le processus d’homogénéisation des tissus. Il faut utiliser un broyeur de tissus, qui fait partie de la technologie de cycle de pression (PCT) pour l’homogénéisation initiale des tissus9. Cette étape réduira le cycle excessif d’AVC de l’homogénéisateur verre sur verre (
Déclarations de divulgation
Les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu financièrement par la subvention intra-muros de l’Université de Kansas City pour Abdulbaki Agbas et la bourse de recherche d’été pour Daniel Barrera. Les auteurs sont reconnaissants pour le travail éditorial du Dr Jan Talley.
matériels
| Name | Company | Catalog Number | Comments |
| Amino caproic acid | Sigma/Aldrich | A2504-100G | |
| Anti-Hu Total OxPhos complex kit | Invitrogen | 458199 | |
| anti-VDAC antibody | abcam | ab15895 | use 1 µg/mL |
| Coomassie G-250 | ThermoSientific | 20279 | |
| Coomassie GelCode Blue | ThermoScientific | 24592 | |
| Digitonin | Cabiochem | 300410 | |
| Glass-Glass pestle homogenizer | VWR | KT885451-0020 | |
| Image Studio | LICOR | ||
| IR-Dye conjugated anti-Rabbit Ab | LICOR | LC0725 | |
| Multiwell plate reader | BioTek | Synergy HT | |
| Native molecular weight marker | ThermoFisher | BN2001 | |
| Nylon mesh monofilament | Small Part Inc | CMN-74 | |
| Orbital shaker | ThermoScientfic | ||
| PCT Shredder | Pressure Bioscience Inc | ||
| SEA BLOCK Blocking buffer | ThermoScienctific | 37527 | |
| Shredder PULSE Tube | Pressure Bioscience Inc | FT500-PS | |
| Table top centrifuge | Eppendorf | 5418 | |
| Trypsin | Amresco | M150-1G | |
| Trypsin inhibitor | Amresco | M191-1G | Requires fresh preparation |
Références
- Gross, V. S., et al. Isolation of functional mitochondria from rat kidney and skeletal muscle without manual homogenization. Analytical Biochemistry. 418 (2), 213-223 (2011).
- Osto, C., et al. Measuring mitochondrial respiration in previously frozen biological samples. Current Protocols in Cell Biology. 89 (1), 116 (2020).
- Agbas, A., et al. Mitochondrial electron transfer cascade enzyme activity assessment in cultured neurons and select brain regions. Current Protocols in Toxicology. 80, 73 (2019).
- Hathaway, Q. A., et al. Maternal-engineered nanomaterial exposure disrupts progeny cardiac function and bioenergetics. American Journal of Physiology-Heart and Circulatory Physiology. 312 (3), 446-458 (2017).
- May, L. E., et al. Influence of maternal aerobic exercise during pregnancy on fetal cardiac function and outflow. American Journal of Obstetrics & Gynecology MFM. 2 (2), 100095 (2020).
- Ehler, W. J., et al. Avoidance of malignant hyperthermia in a porcine model for experimental open heart surgery. Laboratory Animal Science. 35 (2), 172-175 (1985).
- Panov, A. V., et al. Effect of bovine serum albumin on mitochondrial respiration in the brain and liver of mice and rats. Bulletin of Experimental Biology and Medicine. 149 (2), 187-190 (2010).
- Jha, P., Wang, X., Auwerx, J. Analysis of mitochondrial respiratory chain supercomplexes using blue native polyacrylamide gel electrophoresis (BN-PAGE). Current Protocols in Mouse Biology. 6 (1), 1-14 (2016).
- Pressure Biosciences Inc. . Isolation of Functional Mitochondria from Whole Rat Heart Using a PBI Shredder and Pressure Cycling Technology (PCT). , (2010).
- McLaughlin, K. L., et al. Novel approach to quantify mitochondrial content and intrinsic bioenergetic efficiency across organs. Scientific Reports. 10 (1), 17599 (2020).
- Hom, J., Sheu, S. S. Morphological dynamics of mitochondria--a special emphasis on cardiac muscle cells. Journal of Molecular and Cellular Cardiology. 46 (6), 811-820 (2009).
- Greggio, C., et al. Enhanced respiratory chain supercomplex formation in response to exercise in human skeletal muscle. Cell Metabolism. 25 (2), 301-311 (2017).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon