Method Article
Microéchantillonnage dans l’analyse protéique ciblée basée sur la spectrométrie de masse de protéines de faible abondance
Dans cet article
Résumé
Un protocole est présenté pour la détermination de biomarqueurs de faible abondance à partir d’échantillons de sérum séché illustrés par le peptide de libération de progastrine biomarqueur (ProGRP). Les billes magnétiques enrobées d’anticorps sont utilisées pour le nettoyage sélectif et l’enrichissement d’un peptide ProGRP protéotypique. Le peptide capturé est ensuite analysé par chromatographie liquide-spectrométrie de masse en tandem.
Résumé
Cet article présente un protocole avec des descriptions détaillées pour un nettoyage efficace des échantillons de protéines de faible abondance provenant d’échantillons séchés. Ceci est réalisé à l’aide de la protéolyse à base de billes avant la capture d’affinité peptidique protéotypique et la spectrométrie de masse en tandem par chromatographie liquide (LC-MS/MS). La procédure peut être appliquée à la fois aux échantillons séchés conventionnels à l’aide de cartes papier (p. ex., les taches de sang séché [DBS] et les taches de sérum séché [DSS]), ainsi qu’aux échantillons prélevés avec de nouvelles méthodes d’échantillonnage telles que le microéchantillonnage volumétrique absorbant (VAMS). En plus de décrire cette procédure, la préparation des billes de trypsine et des billes enrobées d’anticorps est présentée étape par étape dans ce travail. Les avantages de la procédure présentée sont une protéolyse rapide à l’aide de billes et un nettoyage sélectif robuste utilisant la capture d’affinité peptidique. La procédure actuelle décrit la détermination du biomarqueur du cancer du poumon à petites cellules (CPPC) à faible abondance, le peptide libérant de la progastrine (ProGRP), dans le sérum séché (DSS et VAMS). Les procédures détaillées pour la préparation des billes facilitent la mise en œuvre du flux de travail dans de nouvelles applications ou d’autres laboratoires. Il est démontré que les résultats peuvent dépendre du matériel d’échantillonnage; pour le présent projet, des intensités de signal plus élevées ont été observées pour les échantillons prélevés à l’aide de VAMS par rapport aux DSS.
Introduction
Le microéchantillonnage existe depuis plus de 100 ans depuis qu’Ivar Bang a décrit la surveillance du glucose à partir de SCP en 19131. Après que Guthrie et Susi ont introduit les SCP en 1963 pour la détermination de la phénylalanine chez les nouveau-nés2, la technique est devenue de plus en plus répandue. Les premiers rapports de DBS pour l’échantillonnage et le stockage des protéines ont été faits au début des années 19703,4, et une décennie plus tard, dans les années 1980, nous avons trouvé le premier rapport de spectrométrie de masse (MS) pour la détermination des protéines à partir de DBSs5. Malgré cette introduction précoce, ce n’est qu’après le tournant du siècle que la détermination par la SEP des protéines à partir de DBS et d’autres techniques de micro-échantillonnage s’est répandue.
Dans un contexte clinique, il est intéressant de déterminer les protéines dans le diagnostic et le suivi des maladies, ainsi qu’à des fins de surveillance des traitements et de dopage. Cette détermination ciblée des analytes protéiques par la SEP à partir de petites quantités d’échantillons séchés est encore difficile et nécessite souvent une préparation approfondie des échantillons avant l’analyse.
La détermination quantitative ciblée des protéines par la SEP est généralement effectuée en appliquant l’approche ascendante, en digérant les protéines en peptides avant l’analyse. Cette procédure produit une myriade de peptides, ce qui rend difficile l’analyse directe de l’échantillon biologique digéré. Une façon de contourner cela est d’appliquer une étape de nettoyage d’affinité sélective en amont de l’analyse de la SEP avant ou après la digestion 6,7,8. De cette façon, la protéine d’intérêt (ou son peptide protéotypique, si l’étape de capture d’affinité est effectuée après la digestion) est sélectivement isolée de la matrice de l’échantillon avant l’analyse, fournissant des limites de détection inférieures9.
Le microéchantillonnage à l’aide de cartes DBS présente certains avantages par rapport aux échantillons de sang conventionnels, notamment un faible volume d’échantillons, un échantillonnage moins invasif et une stabilité de stockage accrue. Cependant, la matrice de l’échantillon est différente et peut présenter d’autres défis dans l’analyse (p. ex. matrice d’échantillon séchée ou liquide et sang capillaire par rapport au sérum ou au plasma)10,11. Un autre défi observé avec les SCP est ce que l’on appelle l’effet hématocrite, où l’hématocrite sanguin affecte le volume de l’échantillon traité pour analyse, et introduit donc une variabilité interindividuelle dans l’analyse12. Les nouvelles unités de microéchantillonnage, telles que VAMS introduites en 201413, résolvent ce problème en recueillant un volume fixe de sang au lieu d’une goutte de sang.
Ce protocole décrit une configuration pour l’analyse de biomarqueurs de faible abondance à partir de microéchantillons séchés. Après élution, l’échantillon séché est digéré et, par la suite, le peptide protéotypique est isolé par capture d’affinité peptidique. L’analyte modèle est le biomarqueur SCLC ProGRP. Comme le ProGRP ne peut pas être déterminé de manière fiable à partir du sang total, le sérum a été utilisé comme matrice d’échantillonnage. Les résultats représentatifs des DSS et des échantillons de sérum prélevés à l’aide de VAMS sont présentés.
Protocole
Le sérum provenant de donneurs de sang sains a été utilisé pour la préparation de solutions étalons. L’utilisation de sérum provenant de donneurs de sang sains a été effectuée en stricte conformité avec la loi norvégienne. Le consentement éclairé a été obtenu de tous les sujets. Les échantillons de sérum ont été analysés à l’aide de méthodes conformes aux lignes directrices et aux règlements pertinents. Le protocole décrit est une version modifiée de la méthode décrite dans les travaux précédents14. Un aperçu de la composition des tampons et des solutions et de la façon de les préparer se trouve dans le tableau supplémentaire S1, tandis que le tableau des matériaux contient les matériaux , l’équipement et les réactifs utilisés dans ce protocole.
1. Préparation de billes magnétiques enrobées d’anticorps
- Calculez la quantité d’anticorps nécessaire pour préparer le nombre de billes souhaité. Utilisez 1 mg d’anticorps pour 50 mg de billes magnétiques.
REMARQUE : En règle générale, 20 μL d’une suspension de billes à 20 mg/mL sont utilisés par échantillon dans des expériences ultérieures (voir l’étape 5.1). - Calculez le volume d’anticorps nécessaire pour préparer le nombre de billes souhaité.
REMARQUE: Le volume d’anticorps dépend de la concentration d’anticorps et doit être calculé pour chaque anticorps. - Transférer le volume désiré de solution d’anticorps dans un tube microcentrifuge à faible liaison aux protéines de 5 mL. Par exemple, si la solution d’anticorps contient 1 mg/mL d’anticorps, utiliser 0,4 mL pour préparer 1,0 mL de suspension de billes (billes de 20 mg/mL avec 1 mg d’anticorps/50 mg de billes).
REMARQUE: Les anticorps doivent être dans un tampon sans amine. Utilisez des tubes microcentrifuges à faible liaison aux protéines pour toutes les solutions contenant des protéines afin d’éviter la perte d’analyte due à l’adsorption. - Ajouter une petite barre d’agitation magnétique à la solution d’anticorps et ajuster le pH à 2,5 sous agitation continue. Utilisez un pH-mètre muni d’une microélectrode pour mesurer le pH et ajuster le pH en ajoutant progressivement des volumes définis de HCl 1,0 M (commencez par ajouter des portions de 10 μL de HCl de 1,0 M et réduisez le volume lorsque le pH approche de 2,5). Enregistrer le volume total de 1,0 M HCl nécessaire pour ajuster le pH à 2,5.
- Retirer la micro-électrode et incuber l’anticorps acidifié sur de la glace sur un agitateur magnétique pendant 1 h.
REMARQUE: Le traitement acide de l’anticorps est effectué pour favoriser l’orientation correcte des anticorps sur la bille. La concentration de HCl peut être réduite à 0,5 M ou 0,2 M HCl, selon la concentration tampon dans la solution d’anticorps. - Neutraliser la solution d’anticorps. Utilisez un pH-mètre muni d’une microélectrode pour mesurer le pH et ajustez le pH à 7 en ajoutant progressivement des volumes définis de 1,0 M de NaOH (commencez par une portion de 10 μL et réduisez le volume à mesure que le pH approche de 7). Enregistrer le volume total de 1,0 M de NaOH ajouté.
NOTA : La concentration de NaOH doit être la même que la concentration de HCl utilisée à l’étape 1.4. Le NaOH est très corrosif; utiliser un équipement de protection, y compris des gants et une protection oculaire appropriée. - Calculer le volume souhaité de billes magnétiques activées par tosyle à utiliser.
REMARQUE: En règle générale, il est recommandé d’utiliser des billes de 20 mg / mL lors d’un couplage à petite échelle. Un minimum de 5 mg de billes doit être utilisé. - Bien mélanger la suspension de billes magnétiques sur un mélangeur vortex et prélever un volume contenant la quantité désirée de suspension de billes. Par exemple, pour préparer 1 mL de suspension de billes, prélever un volume contenant 20 mg de billes (667 μL si la concentration de billes est de 30 mg/mL).
- Placez la suspension du cordon sur un support magnétique pendant 1 min et retirez le surnageant. Laver les billes 2x avec un volume égal de type 1 H2O (667 μL si une solution de billes à 30 mg/mL est utilisée pour préparer 1 mL de billes enrobées d’anticorps à 20 mg/mL). Mélanger à l’aide d’un mélangeur vortex après chaque ajout de solution de lavage et placer sur la grille magnétique pendant 1 min avant de retirer le surnageant.
- Ajouter ce qui suit aux billes magnétiques : anticorps traité à l’acide, tampon de borate de 0,5 M (pH 9,5) (1/5 du volume total puisque la concentration finale devrait être de 0,1 M; cela équivaut à 0,2 mL pour préparer 1 mL de suspension de billes), et tampon de couplage pour le couplage d’anticorps (pour préparer 1 mL de billes magnétiques enrobées d’anticorps, le volume du tampon de couplage doit être égal à 1 mL - volume d’anticorps traité à l’acide - 0,2 mL tampon de borate). Mélanger à l’aide d’un mélangeur vortex.
REMARQUE : Le volume d’anticorps traités à l’acide est égal au volume de la solution d’anticorps (0,4 mL en préparation de 1 mL de suspension de billes à l’aide d’une solution d’anticorps à 1 mg/mL) + le volume de HCl de 1,0 M utilisé pour ajuster le pH à 2,5 + le volume de 1,0 M de NaOH utilisé pour ajuster le pH à 7).
REMARQUE : La composition du tampon de borate 0,5 M (pH 9,5) et du tampon de couplage pour le couplage des anticorps se trouve dans le tableau supplémentaire S1. - Faire tourner à température ambiante pendant la nuit à l’aide d’un mélangeur d’échantillons de bout en bout, de préférence avec rotation et vibrations réciproques.
- Centrifuger pendant 10 min à 239 × g. Placez le tube sur l’aimant pendant 2 min et retirez le surnageant.
- Lavez les billes 2 x 2 h et une fois pendant la nuit en faisant tourner le tampon de stockage pour les billes d’anticorps à température ambiante à l’aide d’un mélangeur d’échantillons bout en bout. Utilisez le même volume que le volume total à l’étape 1.10. Placez le tube sur l’aimant pendant 1 min et retirez le surnageant entre chaque lavage.
REMARQUE : La composition du tampon de stockage pour les billes d’anticorps se trouve dans le tableau supplémentaire S1. - Conserver dans le tampon désiré (p. ex., le même tampon qu’à l’étape 1.13) en utilisant la concentration de billes désirée (habituellement 20 mg/mL). A conserver au réfrigérateur.
2. Préparation de 2 mL de billes immobilisées à la trypsine (billes de 20 mg/mL)
- Ajouter 20 mL de HCl 1 mM à 2 mL de billes d’agarose activées par le NHS pour laver les perles.
- Mélanger et centrifuger à 2 655 × g pendant 5 min. Retirez le surnageant.
- Ajouter 20 mL de tampon phosphate 0,1 M (pH 7,8). Mélanger à l’aide d’un mélangeur vortex et centrifuger à 2 655 × g pendant 5 min. Retirez le surnageant.
NOTA : La composition du tampon phosphate 0,1 M (pH 7,8) se trouve dans le tableau supplémentaire S1. - Ajouter 2 mL de trypsine à 20 mg/mL (dissous dans un tampon de couplage à froid pour le couplage de la trypsine).
NOTE: La composition du tampon de couplage pour le couplage de trypsine se trouve dans le tableau supplémentaire S1. Conservez le tampon au réfrigérateur. - Incuber pendant 25 min à 22 °C et 1 100 tr/min à l’aide d’un mélangeur à température contrôlée. Centrifuger à 2 655 × g pendant 5 min. Retirez le surnageant.
- Ajouter 2 mL de tampon de modification pour la préparation des billes de trypsine et incuber pendant 20 min à 22 °C et 1 100 rpm à l’aide d’un mélangeur à température contrôlée. Centrifuger à 2 655 × g pendant 5 min. Retirez le surnageant.
NOTE: La composition du tampon de modification pour la préparation des billes de trypsine se trouve dans le tableau supplémentaire S1. Conservez le tampon au réfrigérateur. - Ajouter 10 mL de tampon bloquant pour la préparation des billes de trypsine et incuber pendant 10 min à 22 °C et 1 100 rpm à l’aide d’un mélangeur à température contrôlée. Centrifuger à 2 655 × g pendant 5 min. Retirez le surnageant.
NOTE: La composition du tampon de blocage pour la préparation des billes de trypsine se trouve dans le tableau supplémentaire S1. Conservez le tampon au réfrigérateur. - Ajouter 2 ml de tampon de stockage, mélanger à l’aide d’un mélangeur vortex et conserver au réfrigérateur jusqu’à utilisation.
NOTE: La composition du tampon de stockage pour les billes de trypsine se trouve dans le tableau supplémentaire S1. Conservez le tampon au réfrigérateur.
3. Échantillonnage DSS/VAMS et extraction ultérieure du sérum séché
- Préparer les étalons en ajoutant au sérum du ProGRP (ou de la protéine d’intérêt) au niveau approprié. Maintenez le volume de pointe ≤ 1% du volume total.
REMARQUE : Ici, une solution mère de 295 μg/mL de ProGRP dans l’eau a été utilisée pour la préparation d’étalons de sérum enrichi. - Mélangez les étalons sur un mélangeur vortex.
- Appliquez 10 μL de sérum (étalons enrichis) sur les cartes DBS ou laissez 10 μL de sérum être recueilli par VAMS (10 μL) en suivant les directives du fabricant. Pour DSS, assurez-vous que l’endroit se trouve à l’intérieur du cercle pointillé.
- Laisser sécher à l’air libre à température ambiante pendant au moins 2 h.
- Découpez toute la tache et transférez-la dans un tube microcentrifuge à faible liaison aux protéines de 2 ml ou retirez le VAMS du support et placez-le dans un tube microcentrifuge à faible liaison aux protéines de 2 mL.
- Ajouter 1 000 μL de solution de bicarbonate d’ammonium (ABC) de 100 mM. Extraire le sérum séché du spot/VAMS pendant 1 h à 22 °C à l’aide d’un mélangeur à température contrôlée à 1 000 tr/min.
- Transférer l’extrait dans un nouveau tube microcentrifuge à faible liaison aux protéines de 1,5 mL pour la protéolyse tryptique.
4. Digestion des extraits DSS/VAMS
- Utiliser 30 μL de billes de trypsine (préparées à la section 2) par échantillon. Transférer un volume contenant des billes de trypsine pour tous les échantillons dans un nouveau tube microcentrifuge à faible liaison aux protéines de 1,5 mL, centrifuger à 2 655 × g pendant 5 minutes et retirer le surnageant.
- Laver les billes de trypsine 2x avec 1 mL de froid 50 mM ABC, avant de les remettre en suspension dans le même volume qui a été pipeté. Centrifuger à 2 655 × g pendant 5 min et retirer le surnageant entre les étapes.
- Ajouter 30 μL de billes de trypsine lavées à chaque extrait DSS / VAMS pour initier la digestion.
- Incuber pendant 2 h à 37 °C et 1 000 tr/min à l’aide d’un mélangeur à température contrôlée ou similaire. Centrifuger à 2 655 × g pendant 5 minutes et transférer le surnageant (pas les billes) dans un nouveau tube microcentrifuge à faible liaison aux protéines de 2,0 mL.
- Ajouter 25 μL de solution étalon interne (IS) à 14 ng/mL contenant le peptide marqué aux isotopes stables (SIL) ALGNQQPSWDSEDSSNF[K_13C6_15 N2] dans une solution ABC de 100mM.
5. Capture du peptide ProGRP protéotypique à l’aide de billes magnétiques enrobées d’anticorps
- Utiliser 20 μL de billes enrobées d’anticorps (20 mg/mL tel que préparé à la section 1) par extraction. Transférer toutes les billes enrobées d’anticorps dans un nouveau tube microcentrifuge à faible liaison aux protéines de 1,5 mL, placer sur l’aimant pendant 1 minute et retirer le tampon de stockage.
- Lavez les billes enduites d’anticorps magnétiques avec 1 mL de solution saline tamponnée au phosphate (PBS), pH 7,4, contenant 0,05 % de polysorbate 20, et 2 x 1 mL de PBS avant de les remettre en suspension dans le même volume qui a été pipeté. Mélanger sur un mélangeur vortex et placer sur l’aimant pendant 1 min entre les échanges de tampon.
REMARQUE: PBS contient 137 mM NaCl, 2,7 mM KCl, 8 mMNa2 HPO 4 et 1,8 mM KH2PO4. Il est recommandé de préparer la solution à une concentration de 10x pour une stabilité accrue. Pour la composition de 100 mL de PBS 10x, voir le tableau supplémentaire S1. La dilution du PBS 10x 10x atteindra un pH de ~7,4. - Ajouter 20 μL de suspension de billes magnétiques lavées à chaque tube de microcentrifugation à faible liaison aux protéines contenant un extrait DSS/VAMS digéré et un IS. Effectuer une immunoextraction pendant 1 h à l’aide d’un mélangeur d’échantillons de bout en bout à température ambiante.
- Lavez les billes magnétiques à l’aide des solutions suivantes : 500 μL de PBS avec 0,05 % (v/v) de polysorbate 20, 400 μL de PBS, 300 μL de Tris HCl 10 mM (pH 7,4) et 300 μL de 100 mM ABC.
- Après l’ajout de chaque solution de lavage, retirer le tube microcentrifuge à faible liaison aux protéines avec des billes et la solution de lavage du support magnétique et retourner délicatement jusqu’à homogénéité. Ensuite, placez le tube microcentrifuge à faible liaison aux protéines sur l’aimant pendant 30 s, inversez pendant 30 s et placez-le sur l’aimant pendant 1 min. Retirez la solution de lavage.
- Faites tourner la suspension restante à l’aide d’une microcentrifugeuse. Placer sur l’aimant pendant 1 min et retirer le reste de la solution de lavage.
- Ajouter 15 μL d’acide formique à 2 % (v/v) de type 1 H2O à chaque échantillon et incuber pendant 5 min à 22 °C et 1 000 tr/min à l’aide d’un mélangeur à température contrôlée ou similaire pour éluer les peptides capturés. Placer sur l’aimant pendant 1 min et transférer l’éluat dans un nouveau tube microcentrifuge à faible liaison aux protéines de 1,5 mL. Répéter une fois et transférer le deuxième éluat dans le même tube microcentrifuge à faible liaison aux protéines que le premier éluat.
- Ajouter 20 μL de 100 mM ABC à chaque éluat (volume total de 50 μL).
- Centrifuger (microcentrifugeuse) et transférer 40 μL de l’éluat dans des micro-inserts pour flacons de chromatographie liquide à haute performance (CLHP).
6. Analyse par LC-MS/MS
- Utilisez un micro LC triple quadripôle MS avec ionisation par électrospray pour une grande robustesse.
- Préparer le système LC-MS/MS pour l’analyse en purgeant les pompes avec la phase mobile A (20 mM FA en H2O et MeCN, 95:5 v/v) et B (20 mM FA enH2Oet MeCN, 5:95 v/v).
- Insérer la colonne d’analyse (C18, 50 mm x 1 mm de diamètre intérieur [ID], particules de 3 μm).
- Continuez à préparer l’instrument pour l’analyse en suivant les procédures de démarrage de l’instrument spécifique.
- Dans le logiciel de l’instrument, réglez la température du four à colonne à 25 °C et le débit à 50 μL/min (phase A mobile à 100 %).
- Équilibrer la colonne avec la phase mobile A pendant au moins 15 min.
- Placez les échantillons dans l’échantillonneur automatique.
- Préparer la méthode instrumentale pour l’analyse du peptide tryptique spécifique au ProGRP, ALGNQQPSWDSEDSSNFK, et de son IS.
REMARQUE: Plusieurs paramètres de méthode sont spécifiques à l’instrument et doivent être optimisés sur l’instrument spécifique utilisé. Les détails des paramètres de méthode utilisés ici sont décrits aux étapes 6.9 à 6.11. - Pour le programme de gradient en LC, utilisez les paramètres suivants : débit : 50 μL/min; du temps 0,0 à 3,0 min: phase A 100% mobile; de temps 3,0 à 18,0 min: exécuter un gradient linéaire de 0% à 50% phase mobile B; de temps 18,0 à 18,1 min: augmenter la phase B mobile de 50% à 100%; du temps 18,1 à 20,0 min: 100% mobile phase B; de temps 20,0 à 20,1 min: diminuer la phase B mobile de 100% à 0%; de temps 20,1 à 30 min : phase A 100% mobile pour rééquilibrer la colonne (utiliser au moins 10 volumes de colonne).
- Pour les paramètres MS/MS, exécutez MS/MS en mode positif en utilisant les réglages de l’instrument qui garantissent une ionisation efficace. Pour suivre ce protocole, utilisez une tension de pulvérisation de +4 000 V, une température capillaire chauffée de 270 °C, de l’azote sous forme de gaz en feuille (5 unités arbitraires) et de l’argon (2 mTorr) pour la fragmentation par dissociation induite par collision (CID). Si l’instrument le permet, dirigez le débit LC pour gaspiller les 2 premières minutes (0-2 min) et les 1 dernières minutes (29-30 min) de la course, au lieu de les envoyer dans le MS.
- Utilisez les transitions de surveillance de réaction sélectionnées (SRM) pour (A) le peptide signature (ALGNQQPSWDSEDSSNFK) : 1 005,45→913,3, 1 005,45→1 028,3 et 1 005,45→1 398,5, et (B) le peptide IS SIL (ALGNQQPSWDSEDSSNF[K_13C6_15N2]) : 1 009,45→921,3, 1 009,45→1 036,3 et 1 009,45→1 406,5. Utilisez une énergie de collision optimisée (35 V dans ce protocole) pour toutes les transitions surveillées.
- Préparez une séquence contenant les échantillons à exécuter à l’aide du logiciel disponible pour votre système LC-MS/MS. Réglez le volume d’injection sur 10 μL.
REMARQUE: Assurez-vous d’ajouter des échantillons vierges et des échantillons de contrôle de la qualité au besoin. - Appuyez sur « Run sequence » dans le logiciel de l’instrument pour démarrer la séquence.
- Surveillez la zone de pic du peptide tryptique ALGNQQPSWDSEDSSNFK capturé par affinité, spécifique au ProGRP, et de son peptide IS SIL.
NOTE: La sélection et la confirmation du peptide signature, ALGNQQPSWDSEDSSNFK, sont décrites ailleurs14.
Résultats
Une vue d’ensemble du flux de travail analytique utilisant à la fois l’échantillonnage DSS et VAMS est présentée à la figure 1. À l’exception des différences dans la méthode d’échantillonnage, les procédures sont identiques. Des images du sérum échantillonné à l’aide des deux méthodes d’échantillonnage peuvent être vues à la figure 2.
Les deux formes d’échantillonnage (VAMS et DSS) conviennent à l’échantillonnage du sérum contenant du ProGRP. C’est ce que montre la figure 3 où les chromatogrammes MS du peptide protéotypique et du peptide IS SIL issus de l’échantillonnage DSS et VAMS sont présentés. De plus, le chromatogramme MS après l’analyse d’un échantillon témoin constitué de 10 μL d’échantillon de sérum liquide enrichi traité de la même manière que les échantillons séchés est inclus. Ce dernier a été dilué dans le même volume que le volume de la solution d’extraction DSS/VAMS, soumis à une digestion à l’aide de billes de trypsine et nettoyé par capture d’affinité peptidique.
En comparant l’échantillonnage VAMS et DSS (Figure 4), VAMS fournit un rapport peptide/IS protéotypique plus élevé que le DSS. Cela indique qu’il pourrait y avoir une perte de la protéine cible ProGRP dans le papier utilisé pour le DSS (cellulose pure). Lors de la comparaison avec un échantillon témoin, où le sérum n’est pas séché avant un traitement et une analyse ultérieurs (figure 4), on montre que VAMS fournit des rapports de surface similaires à ceux de l’échantillon témoin (test t bilatéral, p≤ 0,65), ce qui indique qu’il n’y a pas de perte pour le matériel d’échantillonnage, tandis que le DSS fournit un rapport de surface significativement plus faible (test t bilatéral, p≤ 0,005), indiquant une perte pour le matériel d’échantillonnage.
Une brève évaluation a été effectuée à l’aide de VAMS. La linéarité a été montrée de 10 à 1 000 ng/mL (R2 = 0,9996), avec une limite de détection (LD, S/N = 3) de 6,7 ng/mL. La LD est jugée satisfaisante car l’analyse a été effectuée sur un quadripôle triple assez ancien (2008) avec une colonne ID de 1 mm. La répétabilité de tous les niveaux avec un S/N > 10 a également été jugée satisfaisante avec une DSR comprise entre 7 % et 17 % (n = 3), en utilisant la correction SI.
La capture d’affinité peut être effectuée avant et après l’étape de digestion en capturant soit la protéine d’intérêt, soit son peptide protéotypique. La procédure actuelle décrit la capture d’affinité peptidique. Un avantage de cette approche par rapport à la capture de protéines est que seul le peptide d’intérêt est capturé et qu’un nettoyage encore plus efficace de l’échantillon est obtenu. Ceci est illustré à la figure 5, montrant un chromatogramme à balayage complet plus complexe avec plus de bruit après la capture des protéines par rapport à la capture du peptide. Les échantillons analysés à la figure 5 ne sont pas échantillonnés à l’aide de l’échantillonnage DSS ou de la SMVA; Cependant, le sérum est également la matrice de l’échantillon, et la capture d’affinité est effectuée en utilisant le même anticorps utilisé pour la capture de peptides dans la procédure décrite.
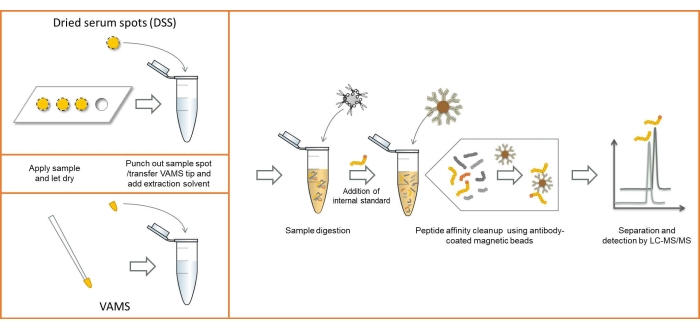
Figure 1 : Vue d’ensemble du flux de travail analytique à l’aide de l’échantillonnage DSS et VAMS. Abréviations : DSS = tache de sérum séché; VAMS = microéchantillonnage volumétrique absorbant; LC-MS/MS = chromatographie liquide-spectrométrie de masse en tandem. Veuillez cliquer ici pour voir une version agrandie de cette figure.
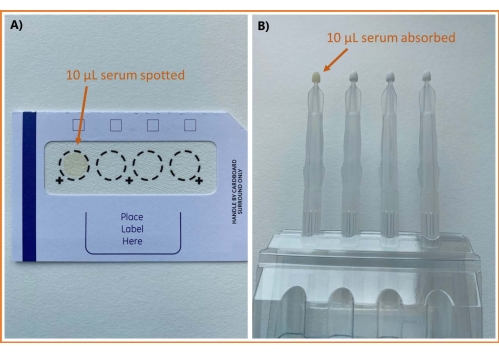
Figure 2 : Images de sérum échantillonnées selon différentes méthodes. (A) carte de cellulose DBS et (B) VAMS. Abréviations : DBS = goutte de sang séché; VAMS = microéchantillonnage volumétrique absorbant. Veuillez cliquer ici pour voir une version agrandie de cette figure.
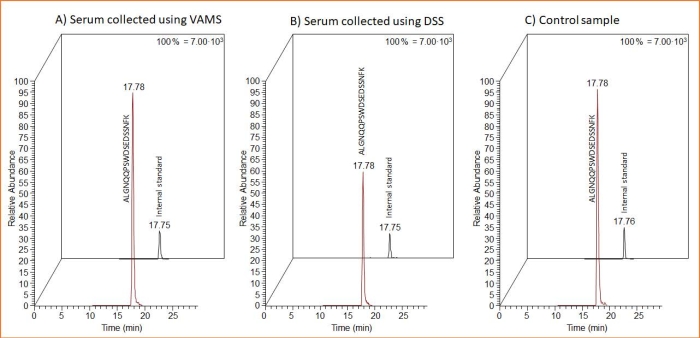
Figure 3 : Chromatogrammes MS représentatifs du peptide protéotypique et du peptide IS SIL après échantillonnage DSS et VAMS, ainsi que pour un échantillon de sérum enrichi ajouté directement dans la solution d’extraction. Les chromatogrammes MS montrent des échantillons de sérum de 10 μL enrichis de 1,5 μg/mL de ProGRP et appliqués sur (A) VAMS, (B) la carte d’échantillonnage de cellulose (pour le DSS) ou (C) directement sur le tampon d’extraction (échantillon témoin). Vingt-cinq microlitres de peptide SIL de 14 ng / ml sont ajoutés à tous les échantillons avant la capture de l’affinité peptidique. Abréviations : DSS = tache de sérum séché; VAMS = microéchantillonnage volumétrique absorbant; MS = spectrométrie de masse; ProGRP = peptide libérant de la progastrine; IS = norme interne; SIL = isotope stable. Veuillez cliquer ici pour voir une version agrandie de cette figure.
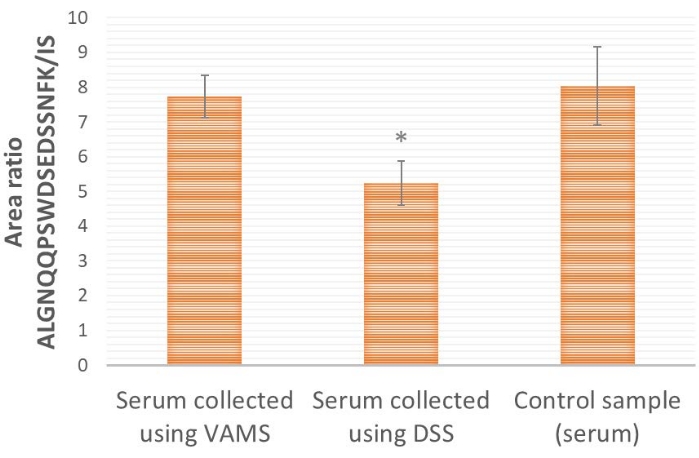
Figure 4 : Résultats représentatifs du rapport aire ALGNQQPSWDSEDSSNFK/IS pour les échantillons de sérum enrichis de ProGRP et appliqués (10 μL) sur VAMS, DSS ou directement sur la solution d’extraction (échantillon témoin). La concentration de ProGRP est de 1,5 μg/mL, n = 4 pour chaque condition; 25 μL de peptide SIL 14 ng / ml sont ajoutés à tous les échantillons avant la capture d’affinité peptidique. *indique que le rapport de surface est significativement différent des échantillons appliqués à la SMVA (test t bilatéral, p≤ 0,005). Les barres d’erreur sont ± écart-type. Abréviations : DSS = tache de sérum séché; VAMS = microéchantillonnage volumétrique absorbant; ProGRP = peptide libérant de la progastrine; IS = norme interne; SIL = isotope stable. Veuillez cliquer ici pour voir une version agrandie de cette figure.
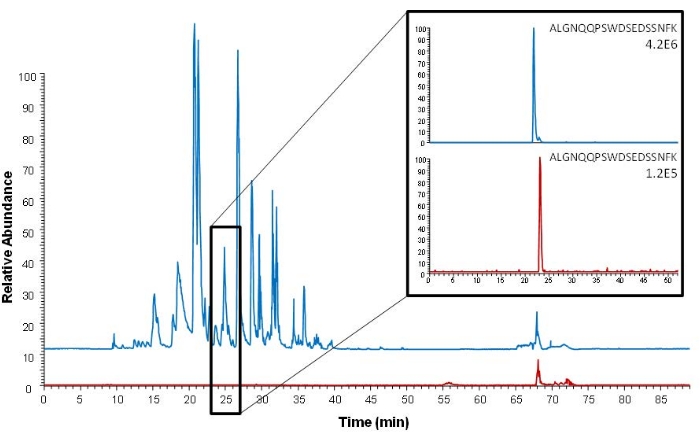
Figure 5 : Comparaison des chromatogrammes de pointe de base (analyse Orbitrap à balayage complet) après extraction de protéines intactes (bleu) et extraction de peptides épitopiques protéotypiques (rouge). Les chromatogrammes ioniques extraits du peptide épitopique protéotypique (ALGNQQPSWDSEDSSNFK, m/z 1005.45) sont représentés à droite. Un sérum enrichi de 150 ng de ProGRP mL−1 a été utilisé comme échantillon. Cette figure est tirée de Levernæs et al.14. Veuillez cliquer ici pour voir une version agrandie de cette figure.
Tableau supplémentaire S1 : Vue d’ensemble de la composition des tampons et des solutions et de la façon de les préparer. Veuillez cliquer ici pour télécharger ce fichier.
Discussion
Le protocole décrit contient des informations sur la façon de mener plusieurs étapes importantes dans l’analyse de biomarqueurs de faible abondance à partir de microéchantillons séchés (DSS et VAMS), y compris la préparation de billes de trypsine et de billes magnétiques enrobées d’anticorps. Sur la base de l’expérience antérieure, nous traitons toujours l’anticorps avec de l’acide avant l’immobilisation des billes afin d’améliorer l’orientation des anticorps15.
L’une des étapes critiques de cette procédure est la sélection du format de microéchantillonnage le plus approprié. Tout d’abord, il faut examiner si l’analyte en question peut être déterminé à partir du sang total, ou si la concentration est influencée par les cellules sanguines et doit être déterminée dans le sérum ou le plasma (comme pour l’analyte modèle, ProGRP).
Les approches à base de papier et de polymères présentent des avantages et des limites; pour ProGRP, VAMS offre un avantage évident en ce qui concerne la récupération de l’analyte après extraction de l’échantillonneur. Cependant, cela peut probablement être optimisé en utilisant une solution d’extraction différente pour les échantillons DSS. Néanmoins, il est important de prendre en compte cette interaction potentielle entre l’analyte et le matériel d’échantillonnage, car elle pourrait entraîner une variation analytique accrue et des limites de détection plus élevées. Comme l’IS utilisé est un peptide SIL et ajouté pour la première fois après la digestion, IS corrige les étapes suivant la digestion (par exemple, extraction d’affinité et analyse LC-MS/MS). La correction de l’IS n’est pas possible pour l’extraction du DSS/VAMS et l’étape de digestion.
Deux types de billes sont utilisés dans la procédure: les billes de trypsine pour la digestion après l’extraction de l’échantillon de sérum de l’échantillonneur, et les billes magnétiques enrobées d’anticorps pour la capture du peptide protéotypique après la digestion. L’une des principales raisons d’utiliser des billes de trypsine, en plus d’accélérer la digestion, est de minimiser l’activité résiduelle de la trypsine dans l’échantillon lors de la capture d’affinité. Ceci est important pour éviter la protéolyse tryptique de l’AcM lors de la capture d’affinité.
Les billes d’agarose ont été utilisées pour la préparation des billes de trypsine, tandis que les perles magnétiques ont été utilisées pour la préparation des billes enrobées d’anticorps. Les billes d’agarose sont moins chères que les billes magnétiques, mais ont une limitation selon laquelle la séparation des billes de la solution nécessite une centrifugation. Cela rend la séparation des perles et du surnageant moins efficace que lors de l’utilisation de perles magnétiques. De plus, l’automatisation du flux de travail est difficile à l’aide de perles d’agarose. Cependant, des billes magnétiques activées par le NHS sont disponibles et peuvent être utilisées pour un flux de travail de préparation d’échantillons plus rationalisé et automatisable.
Le microéchantillonnage est une tendance importante dans la bioanalyse des médicaments et des biomarqueurs. L’un des défis de l’approche actuelle est la quantité limitée de volume d’échantillon (10 μL), qui peut être particulièrement importante dans la détermination d’analytes de très faible abondance tels que ProGRP (pg/mL-faible niveau ng/mL). Cependant, ce défi peut être contourné à l’aide d’un équipement analytique de pointe. Pour ces analytes de faible abondance, le choix de la préparation de l’échantillon est crucial, et un nettoyage sélectif de l’échantillon par capture d’affinité basée sur les anticorps est le plus souvent nécessaire. Comme il a été démontré que la capture peptidique fournit des extraits plus propres et des limites de détection inférieures à celles de la capture de protéines (en utilisant le même anticorps)14, la présente méthode se concentre sur cette approche en combinaison avec le microéchantillonnage. Un autre avantage de l’approche de capture peptidique est que le peptide IS SIL corrige également l’étape de capture d’affinité.
Dans ce travail, un anticorps ciblant une protéine a été utilisé pour la capture de peptides. C’est un avantage car la disponibilité des anticorps prêts à l’emploi ciblant les protéines est plus élevée que celle des anticorps prêts à l’emploi ciblant les peptides protéotypiques. Cependant, pour qu’un anticorps anti-protéine capture efficacement un peptide protéotypique, l’épitope doit être intact après la digestion des protéines. De plus, pour de nombreux anticorps, l’épitope exact n’est pas connu, ce qui rend fastidieuse la recherche d’un anticorps anti-protéique. Cela limite le nombre d’anticorps anti-protéiques disponibles applicables à la capture de peptides. La procédure décrite est démontrée en utilisant le sérum comme matrice et le ProGRP comme analyte cible. La procédure est destinée à être applicable à d’autres matrices et à d’autres analytes cibles. Au lieu d’utiliser un anticorps anti-protéine disponible dans le commerce pour la capture d’affinité du peptide protéotypique, il est également possible d’utiliser des anticorps anti-peptidiques sur mesure. L’efficacité de nettoyage de la capture peptidique par rapport à la capture de protéines est illustrée à la figure 5. En échangeant les billes d’agarose utilisées pour la préparation des billes de trypsine avec des billes magnétiques, la procédure devrait également être compatible avec les postes de travail robotisés de préparation d’échantillons sur le marché.
Déclarations de divulgation
Les auteurs n’ont aucun conflit d’intérêts à divulguer.
Remerciements
Nous remercions vivement le professeur Elisabeth Paus de l’hôpital norvégien du radium (hôpital universitaire d’Oslo, Oslo, Norvège) pour avoir fourni la norme ProGRP et l’anticorps monoclonal anti-ProGRP, M18. Les frais de publication ont été couverts par une subvention du legat d’Apoteker Harald Conrad Thaulows. Trine Grønhaug Halvorsen et Léon Reubsaet sont partenaires du consortium National Network of Advanced Proteomics Infrastructure (NAPI), financé par le programme INFRASTRUKTUR du Conseil norvégien de la recherche (numéro de projet: 295910).
matériels
| Name | Company | Catalog Number | Comments |
| Acetic acid N-hydroxysuccinimide ester | Carbosynt (Staad, Switzerland) | FA33719 | Store in freezer below -20 °C |
| ALGNQQPSWDSEDSSNF[K_13C6 _15N2] (≥ 95%) | Innovagen (Lund, Sweden) | Not applicable | Store in freezer below -20 °C |
| Ammonium bicarbonate BioUltra (≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 09830-500G | |
| Aquasil C18 column, 3 µm, 50 mm x 1 mm | Thermo scientific (Waltham, MA, USA) | 77503-051030 | Analytical column compatible with 100% aqueous mobile phase |
| Benzamidine (≥ 95.0% ) | Sigma Aldrich (St. Louis, MO, USA) | 12072 | Store in fridge at 2-6 °C |
| Calsium chloride dihydrate (≥ 99% ) | Sigma Aldrich (St. Louis, MO, USA) | 223506-500G | |
| Centrifuge 5804 | Eppendorf (Hamburg, Tyskland) | 5804000010 | |
| Cloned ProGRP isoform 1 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Disodium hydrogenphosphate dihydrate (pro analysis) | Sigma Aldrich (St. Louis, MO, USA) | 30435-500G | |
| Disodium hydrogenphosphate dodecahydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06579.0500 | |
| Dynabeads M-280 tosylactivated 10 mL | Invitrogen (Carlsbad, USA) | 14204 | Store in fridge at 2-6 °C |
| DynaMag-2 | Invitrogen (Carlsbad, USA) | 123-21D | |
| Ethanolamine (pro analysis, ≥ 99%) | Sigma Aldrich (St. Louis, MO, USA) | #02400 | |
| Formic acid (≥ 99% ) for LC-MS | VWR International (Radnor, PA, USA) | 84865.260 | |
| FTA DMPK-C cellulose card | Whatman (Kent, UK) | WB129243 | DBS card |
| HPLC vials, clear glass, 1.5 mL, 32 x 11.6 mm, Clean Pack | Nerliens Meszansky (Oslo, Norge) | LPP 11 09 0519 | |
| Hulamixer sample mixer | Invitrogen (Carlsbad, USA) | 101561503016 | Sample mixer with end-over-end mixing and reciprocal rotation and vibration |
| Human serum from healty blood donors | Bloodbank, Ullevål, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Hydrochloric acid fuming 37% (Emsure for analysis) | Merck (Darmstadt, Tyskland) | 1.00317.1000 | |
| LC-MS/MS system: Ultimate 3000 system (Autosampler, WPS-3000TRS; Micropump, LPG-3400M; Flow manager, FLM-3300, MIC, 1X2P-10P) and TSQ Quantum access. Controlled by Xcalibur 2.2 SP1.48 | Thermo scientific (Waltham, MA, USA) | Not applicable | |
| LiChrosolv Acetonitrile hypergrade for LC-MS | Merck (Darmstadt, Tyskland) | 1.00029.2500 | |
| LL Biotrode, Combined glass electrode | Metrohm (Herisau, Sveits) | 6.0224.100 | |
| Magnetic stirrer, Type M10 | Franz Morat KG (Eisenbach, Germany) | 10236 | |
| Micro inserts, glass (31 x 6 mm, 0.1 mL) | VWR International (Radnor, PA, USA) | 548-0006 | |
| MilliQ integral 3 with Q-POD | Merck Millipore (Molsheim, France) | ZRXQ003T0 | For production of Type 1 water |
| monoclonal antibody M18 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in fridge at 2-6 °C |
| Neoteryx Mitra microsampler (10 μL) 4 sampler Clamshell | Fisher Scientific (Waltham, MA, USA) | NC1382947 | |
| NHS-activated sepharose beads 4 fast flow | Sigma Aldrich (St. Louis, MO, USA) | GE17-0906-01 | Agarose beads, store in fridge at 2-6 °C |
| Optifit, Refill pipet tips, 10 mL | Sartorius Biohit (Helsinki, Finland) | 613-2911 | |
| Optifit, Refill pipet tips, 10 μL | Sartorius Biohit (Helsinki, Finland) | 790012 | |
| Optifit, Refill pipet tips, 1,000 μL | Sartorius Biohit (Helsinki, Finland) | 791002 | |
| Optifit, Refill pipet tips, 200 μL | Sartorius Biohit (Helsinki, Finland) | 790202 | |
| pH glass electrode | Metrohm (Herisau, Sveits) | 6.0233.100 | |
| pH meter 744 | Metrohm (Herisau, Sveits) | 8.744.1003 | |
| Pipet 10 mL | Sartorius Biohit (Helsinki, Finland) | 725090 | |
| Pipet m10 µL | Sartorius Biohit (Helsinki, Finland) | 725020 | |
| Pipet m100 µL | Sartorius Biohit (Helsinki, Finland) | 725050 | |
| Pipet m1,000 µL | Sartorius Biohit (Helsinki, Finland) | 725070 | |
| Pipet m20 µL | Sartorius Biohit (Helsinki, Finland) | 725030 | |
| Potassium chloride (KCl ≥ 99.9%) | Sigma Aldrich (St. Louis, MO, USA) | P-3911 | |
| Potassium dihydrogenphosphate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.04873.0250 | |
| Protein LoBind Eppendorf tube 0.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0133 (0030 108.094) | |
| Protein LoBind Eppendorf tube 1.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0132 (0030 108.116) | |
| Protein LoBind Eppendorf tube 2.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0134 (0030 108.450) | |
| Protein LoBind Eppendorf tube 5.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0792 (0030108.302) | |
| Scissors | Sigma Aldrich (St. Louis, MO, USA) | Z186716-1EA | |
| Sodium azide (BioUltra; ≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 71289-5G | |
| Sodium chloride (for analysis) | Merck (Darmstadt, Tyskland) | 1.06404.1000 | |
| Sodium dihydrogenphosphate monohydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06346.0500 | |
| Sodium hydroxide (AnalaR NORMAPUR) | VWR International (Radnor, PA, USA) | 28244.295 | |
| Sodium tetraborate decahydrate (≥ 99. %) | Sigma Aldrich (St. Louis, MO, USA) | S9640-500G | |
| Spectrafuge Mini Centrifuge | LABNET International (Edison, NJ, USA) | C1301 | |
| Stirring magnet, 25 mm x 6 mm Ø, circular | Leybold (Cologne, Germany) | 666 851 | |
| Stuart Scientific SA8 vortex mixer | Stuart (Staffordshire, UK) | Z648531-1EA | |
| SuperClear centrifuge tubes (15 mL) | VWR International (Radnor, PA, USA) | 525-0150 | |
| SuperClear centrifuge tubes (50 mL) | VWR International (Radnor, PA, USA) | 525-0155 | |
| Thermomixer comfort 1.5 mL | Eppendorf (Hamburg, Tyskland) | 53,55,27,831 | Temperature controlled mixer |
| Trizma base (reagent grade, ≥ 99.0 %) | Sigma Aldrich (St. Louis, MO, USA) | T6066 | Tris(hydroxymethyl)aminometan (tris) |
| Trizma HCl (reagent grade, ≥ 99.0%) | Sigma Aldrich (St. Louis, MO, USA) | T3253-100G | Tris(hydroxymethyl)aminometan HCl (tris HCl) |
| Trypsin (TCPK-treated from bovine pancreas, 10,000-15,000 BAEE units/mg Protein) | Sigma Aldrich (St. Louis, MO, USA) | T8802 | Store in freezer below -20 °C |
| Tween 20 | Sigma Aldrich (St. Louis, MO, USA) | P7949-500ML | polysorbate 20 |
| Tweezers | Sigma Aldrich (St. Louis, MO, USA) | TEM-78511-27 | |
| Vial caps, white, 9 mm | Nerliens Meszansky (Oslo, Norge) | LPP 09 15 0981 | |
| Mitra microsampler with VAMS (Volumetric adsorptive microsampling) technology, 10 µL, 4-sampler clamshell | Neoteryx (Torrance, CA, USA) |
Références
- Bang, I. B. Fresenius. Zeitschrift für analytische Chemie. 52 (7), 521-523 (1913).
- Guthrie, R., Susi, A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics. 32 (3), 338-343 (1963).
- Laurell, C. B. A screening test for α1-antitrypsin deficiency. Scandinavian Journal of Clinical and Laboratory Investigation. 29 (3), 247-248 (1972).
- Thielmann, K., Aquino, A. M. Whole blood samples dried and stored on filter paper as substrate for the electrophoretic separation on hemoglobin S from hemoglobin A. A screening procedure. Clinica Chimica Acta. 35 (1), 237-238 (1971).
- Wada, Y., Fujita, T., Kidoguchi, K., Hayashi, A. Fetal hemoglobin variants in 80,000 Japanese neonates: High prevalence of Hb F Yamaguchi (AγT 80 Asp→Asn). Human Genetics. 72 (3), 196-202 (1986).
- Halvorsen, T. G., McKitterick, N., Kish, M., Reubsaet, L. Affinity capture in bottom-up protein analysis-overview of current status of proteolytic peptide capture using antibodies and molecularly imprinted polymers. Analytica Chimica Acta. 1182, 338714(2021).
- Halvorsen, T. G., Reubsaet, L. Antibody based affinity capture LC-MS/MS in quantitative determination of proteins in biological matrices. TrAC Trends in Analytical Chemistry. 95, Supplement C 132-139 (2017).
- Neubert, H., et al. Protein biomarker quantification by immunoaffinity liquid chromatography-tandem mass spectrometry: Current state and future vision. Clinical Chemistry. 66 (2), 282-301 (2020).
- Pan, S., et al. Mass spectrometry based targeted protein quantification: methods and applications. Journal of Proteome Research. 8 (2), 787-797 (2008).
- Enderle, Y., Foerster, K., Burhenne, J. Clinical feasibility of dried blood spots: Analytics, validation, and applications. Journal of Pharmaceutical and Biomedical Analysis. 130, 231-243 (2016).
- Londhe, V., Rajadhyaksha, M. Opportunities and obstacles for microsampling techniques in bioanalysis: Special focus on DBS and VAMS. Journal of Pharmaceutical and Biomedical Analysis. 182, 113102(2020).
- Denniff, P., Spooner, N. The effect of hematocrit on assay bias when using dbs samples for the quantitative bioanalysis of drugs. Bioanalysis. 2 (8), 1385-1395 (2010).
- Denniff, P., Spooner, N. Volumetric absorptive microsampling: A dried sample collection technique for quantitative bioanalysis. Analytical Chemistry. 86 (16), 8489-8495 (2014).
- Levernæs, M. C. S., et al. Immunocapture sample clean-up in determination of low abundant protein biomarkers-a feasibility study of peptide capture by anti-protein antibodies. RSC Advances. 9 (60), 34902-34911 (2019).
- Conradie, J. D., Govender, M., Visser, L. Elisa solid phase: Partial denaturation of coating antibody yields a more efficient solid phase. Journal of Immunological Methods. 59 (3), 289-299 (1983).
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationThis article has been published
Video Coming Soon