Method Article
Microamostragem em Análise de Proteínas de Baixa Abundância Baseada em Espectrometria de Massa
Neste Artigo
Resumo
Um protocolo é apresentado para a determinação de biomarcadores de baixa abundância a partir de amostras secas de soro exemplificadas com o biomarcador progastrina-releasing peptide (ProGRP). Esferas magnéticas revestidas com anticorpos são usadas para a limpeza seletiva e enriquecimento de um peptídeo proteotípico ProGRP. O peptídeo capturado é posteriormente analisado por cromatografia líquida-espectrometria de massas em tandem.
Resumo
Este trabalho apresenta um protocolo com descrições detalhadas para a limpeza eficiente de amostras de baixa abundância de proteínas secas. Isso é realizado usando proteólise baseada em esferas antes da determinação por captura de afinidade de peptídeos proteotípicos e cromatografia líquida acoplada à espectrometria de massas (LC-MS/MS). O procedimento pode ser aplicado tanto a amostras secas convencionais usando cartões de papel (por exemplo, amostras de sangue seco [DBSs] e manchas de soro secas [DSSs]), bem como amostras coletadas com métodos de amostragem mais recentes, como microamostragem absortiva volumétrica (VAMS). Além de descrever esse procedimento, a preparação de esferas de tripsina e esferas revestidas com anticorpos é apresentada passo a passo neste trabalho. As vantagens do procedimento apresentado são proteólise eficiente em termos de tempo usando esferas e limpeza robusta seletiva usando captura de afinidade peptídica. O procedimento atual descreve a determinação do biomarcador de câncer de pulmão de pequenas células (CPPC) de baixa abundância, o peptídeo liberador de progastrina (ProGRP), em soro seco (tanto DSSs quanto VAMS). Procedimentos detalhados para a preparação de contas facilitam a implementação do fluxo de trabalho em novas aplicações ou outros laboratórios. Demonstra-se que os resultados podem ser dependentes do material amostral; para o presente projeto, maiores intensidades de sinal foram observadas para amostras coletadas usando VAMS em comparação com DSSs.
Introdução
A microamostragem existe há mais de 100 anos, desde que Ivar Bang descreveu o monitoramento glicêmico de DBSs em 19131. Depois que Guthrie e Susi introduziram DBSs em 1963 para a determinação de fenilalanina em recém-nascidos2, a técnica tornou-se cada vez mais difundida. Os primeiros relatos de DBSs para amostragem e armazenamento de proteínas foram feitos no inícioda década de 19703,4, e uma década depois, na década de 1980, encontramos o primeiro relato de espectrometria de massas (MS) para a determinação de proteínas de DBSs5. Apesar dessa introdução inicial, foi somente após a virada do século que a determinação de MS de proteínas de DBSs e outras técnicas de microamostragem tornou-se mais difundida.
Em um contexto clínico, é de interesse determinar proteínas no diagnóstico e acompanhamento de doenças, bem como para fins de monitoramento de tratamento e doping. Essa determinação direcionada de analitos proteicos por EM a partir de pequenas quantidades de amostras secas ainda é um desafio e, muitas vezes, requer uma preparação extensiva da amostra antes da análise.
A determinação quantitativa direcionada de proteínas pela EM é comumente realizada aplicando a abordagem bottom-up, digerindo as proteínas para peptídeos antes da análise. Esse procedimento produz uma miríade de peptídeos, o que torna desafiadora a análise direta da amostra biológica digerida. Uma maneira de contornar isso é aplicar uma etapa de limpeza de afinidade seletiva antes da análise da SM antes ou depois da digestão 6,7,8. Dessa forma, a proteína de interesse (ou seu peptídeo proteotípico, se a etapa de captura de afinidade for realizada após a digestão) é seletivamente isolada da matriz amostral antes da análise, proporcionando limites de detecção inferiores9.
A microamostragem usando cartões DBS tem certas vantagens em comparação com amostras de sangue convencionais, incluindo baixo volume de amostras, amostragem menos invasiva e maior estabilidade de armazenamento. No entanto, a matriz da amostra é diferente e pode introduzir outros desafios na análise (por exemplo, matriz de amostra seca vs. líquida e sangue capilar vs. soro ou plasma)10,11. Outro desafio observado com EEP é o chamado efeito hematócrito, em que o hematócrito sanguíneo afeta o volume da amostra posteriormente processada para análise e, portanto, introduz variabilidade interindividual na análise12. Unidades de microamostragem mais recentes, como o VAMS introduzido em 201413, resolvem essa questão coletando um volume fixo de sangue em vez de uma gota de sangue.
Este protocolo descreve uma configuração para a análise de biomarcadores de baixa abundância a partir de microamostras secas. Após a eluição da amostra seca é digerida e, posteriormente, o peptídeo proteotípico é isolado por captura de afinidade peptídica. O analito modelo é o biomarcador SCLC ProGRP. Como o ProGRP não pode ser determinado de forma confiável a partir do sangue total, o soro foi usado como matriz da amostra. Resultados representativos tanto de DSSs quanto de amostras de soro coletadas usando VAMS são mostrados.
Protocolo
Soro de doadores de sangue saudáveis foi utilizado para o preparo das soluções-padrão. O uso de soro de doadores de sangue saudáveis foi realizado em estrita conformidade com a legislação norueguesa. Consentimento informado foi obtido de todos os sujeitos. As amostras de soro foram analisadas por métodos de acordo com as diretrizes e regulamentações pertinentes. O protocolo descrito é uma versão modificada do método descrito em trabalhoanterior14. Uma visão geral da composição de buffers e soluções e como prepará-los pode ser encontrada na Tabela Suplementar S1, enquanto a Tabela de Materiais contém materiais, equipamentos e reagentes usados neste protocolo.
1. Preparação de esferas magnéticas revestidas com anticorpos
- Calcule a quantidade de anticorpos necessária para preparar o número desejado de contas. Use 1 mg de anticorpo por 50 mg de esferas magnéticas.
NOTA: Normalmente, são utilizados 20 μL de uma suspensão de esferas de 20 mg/ml por amostra em experiências subsequentes (ver passo 5.1). - Calcule o volume de anticorpos necessário para preparar o número desejado de contas.
NOTA: O volume de anticorpos é dependente da concentração de anticorpos e precisa ser calculado para cada anticorpo. - Transfira o volume desejado de solução de anticorpos para um tubo de microcentrífuga de baixa ligação a proteínas de 5 mL. Por exemplo, se a solução de anticorpos contiver 1 mg/mL de anticorpo, use 0,4 mL para preparar 1,0 mL de suspensão de contas (20 mg de contas/mL com 1 mg de anticorpo/50 mg de contas).
NOTA: Os anticorpos devem estar em um tampão livre de amina. Use tubos de microcentrífuga de baixa ligação a proteínas para todas as soluções contendo proteínas para evitar a perda do analito devido à adsorção. - Adicione uma pequena barra de agitação magnética à solução de anticorpos e ajuste o pH para 2,5 sob agitação contínua. Use um medidor de pH com um microeletrodo para medir o pH e ajustar o pH por adição gradual de volumes definidos de 1,0 M HCl (comece adicionando porções de 10 μL de HCl 1,0 M e reduza o volume à medida que o pH se aproxima de 2,5). Registrar o volume total de HCl 1,0 M necessário para ajustar o pH a 2,5.
- Retire o microeletrodo e incube o anticorpo acidificado no gelo em um agitador magnético por 1 h.
NOTA: O tratamento ácido do anticorpo é realizado para promover a orientação correta dos anticorpos no talão. A concentração de HCl pode ser reduzida para 0,5 M ou 0,2 M HCl, dependendo da concentração de tampão na solução de anticorpos. - Neutralizar a solução de anticorpos. Use um medidor de pH com um microeletrodo para medir o pH e ajustar o pH para 7 por adição gradual de volumes definidos de NaOH 1,0 M (comece com uma porção de 10 μL e reduza o volume à medida que o pH se aproxima de 7). Registre o volume total de 1,0 M de NaOH adicionado.
NOTA: A concentração de NaOH deve ser a mesma que a concentração de HCl utilizada no passo 1.4. O NaOH é altamente corrosivo; utilizar equipamento de protecção, incluindo luvas e protecção ocular adequada. - Calcule o volume desejado de esferas magnéticas ativadas por tosila a serem usadas.
NOTA: Normalmente, recomenda-se usar 20 mg de contas/mL ao executar o acoplamento em pequena escala. Um mínimo de 5 mg de contas deve ser usado. - Misture bem a suspensão de esferas magnéticas em um misturador de vórtices e retire um volume contendo a quantidade desejada de suspensão de talão. Como exemplo, para preparar 1 mL de suspensão de contas, retire um volume contendo 20 mg de contas (667 μL se a concentração de contas for de 30 mg/mL).
- Coloque a suspensão do talão em um rack magnético por 1 min e retire o sobrenadante. Lavar as contas 2x com igual volume de Tipo 1 H2O (667 μL se for utilizada uma solução de esferas de 30 mg/ml para preparar 1 ml de esferas revestidas com anticorpos a 20 mg/ml). Misture com um misturador de vórtices após cada adição de solução de lavagem e coloque no rack magnético por 1 min antes de remover o sobrenadante.
- Adicione o seguinte às esferas magnéticas: anticorpo tratado com ácido, tampão borato 0,5 M (pH 9,5) (1/5 do volume total, pois a concentração final deve ser 0,1 M; isso equivale a 0,2 mL para preparar 1 mL de suspensão de cordão) e tampão de acoplamento para acoplamento de anticorpos (para preparar 1 mL de esferas magnéticas revestidas com anticorpos, o volume do tampão de acoplamento deve ser igual a 1 mL - volume de anticorpo tratado com ácido - 0,2 mL de tampão borato). Misture usando um misturador de vórtices.
NOTA: O volume de anticorpo tratado com ácido é igual ao volume de solução de anticorpos (0,4 mL na preparação de 1 mL de suspensão de esferas usando uma solução de 1 mg/mL de anticorpo) + o volume de HCl 1,0 M usado para ajustar o pH para 2,5 + o volume de NaOH 1,0 M usado para ajustar o pH para 7).
NOTA: A composição do tampão borato 0,5 M (pH 9,5) e do tampão de acoplamento para acoplamento de anticorpos pode ser encontrada na Tabela Suplementar S1. - Gire à temperatura ambiente durante a noite usando um misturador de amostras de ponta a ponta, de preferência com rotação e vibração recíprocas.
- Centrifugar por 10 min a 239 × g. Coloque o tubo sobre o ímã por 2 min e remova o sobrenadante.
- Lave as contas 2 x 2 h e uma vez durante a noite, girando em tampão de armazenamento para esferas de anticorpos à temperatura ambiente usando um misturador de amostras de ponta a ponta. Use o mesmo volume que o volume total na etapa 1.10. Coloque o tubo sobre o ímã por 1 min e remova o sobrenadante entre cada lavagem.
NOTA: A composição do buffer de armazenamento para esferas de anticorpos pode ser encontrada na Tabela Suplementar S1. - Conservar no tampão desejado (por exemplo, o mesmo tampão do passo 1.13) utilizando a concentração de reserva desejada de contas (normalmente 20 mg/ml). Conservar no frigorífico.
2. Preparo de 2 mL de contas imobilizadas com tripsina (20 mg/mL de contas)
- Adicionar 20 mL de HCl 1 mM a 2 mL de contas de agarose ativadas pelo NHS para lavar as contas.
- Misture e centrifuja a 2.655 × g por 5 min. Remova o sobrenadante.
- Adicionar 20 ml de tampão fosfato 0,1 M (pH 7,8). Misturar com misturador de vórtice e centrifugar a 2.655 × g por 5 min. Remova o sobrenadante.
NOTA: A composição do tampão fosfato 0,1 M (pH 7,8) pode ser encontrada na Tabela Suplementar S1. - Adicionar 2 mL de 20 mg/mL de tripsina (dissolvida em tampão de acoplamento a frio para acoplamento de tripsina).
NOTA: A composição do tampão de acoplamento para acoplamento de tripsina pode ser encontrada na Tabela Suplementar S1. Guarde o tampão no frigorífico. - Incubar por 25 min a 22 °C e 1.100 rpm usando um misturador com temperatura controlada. Centrifugar a 2.655 × g por 5 min. Remova o sobrenadante.
- Adicionar 2 mL de tampão modificador para a preparação de esferas de tripsina e incubar por 20 min a 22 °C e 1.100 rpm usando um misturador com temperatura controlada. Centrifugar a 2.655 × g por 5 min. Remova o sobrenadante.
NOTA: A composição do tampão de modificação para a preparação de contas de tripsina pode ser encontrada na Tabela Suplementar S1. Guarde o tampão no frigorífico. - Adicionar 10 mL de tampão bloqueador para a preparação de esferas de tripsina e incubar por 10 min a 22 °C e 1.100 rpm usando um misturador com temperatura controlada. Centrifugar a 2.655 × g por 5 min. Remova o sobrenadante.
NOTA: A composição do tampão de bloqueio para a preparação de contas de tripsina pode ser encontrada na Tabela Suplementar S1. Guarde o tampão no frigorífico. - Adicione 2 mL de tampão de armazenamento, misture usando um misturador de vórtice e guarde na geladeira até usar.
NOTA: A composição do buffer de armazenamento para contas de tripsina pode ser encontrada na Tabela Suplementar S1. Guarde o tampão no frigorífico.
3. Amostragem DSS/VAMS e posterior extração de soro seco
- Prepare padrões picando o soro com ProGRP (ou a proteína de interesse) no nível apropriado. Mantenha o volume de picos ≤ 1% do volume total.
NOTA: Aqui, uma solução-estoque de 295 μg/mL de ProGRP em água foi usada para a preparação de padrões de soro fortificado. - Misture os padrões em um misturador de vórtices.
- Aplicar 10 μL de soro (padrões cravados) em cartões DBS ou permitir que 10 μL de soro sejam coletados por VAMS (10 μL) usando as diretrizes do fabricante. Para DSS, certifique-se de que o ponto esteja dentro do círculo pontilhado.
- Deixe secar ao ar livre à temperatura ambiente durante, pelo menos, 2 horas.
- Corte todo o local e transfira-o para um tubo de microcentrífuga de 2 mL de baixa ligação a proteínas ou remova o VAMS do suporte e coloque-o em um tubo de microcentrífuga de baixa ligação a proteínas de 2 mL.
- Adicionar 1.000 μL de solução de bicarbonato de amônio (ABC) 100 mM. Extrair o soro seco do spot/VAMS durante 1 h a 22 °C utilizando um misturador com temperatura controlada a 1.000 rpm.
- Transferir o extrato para um novo tubo de microcentrífuga de 1,5 mL de baixa ligação a proteínas para proteólise tríptica.
4. Digestão de extratos de DSS/VAMS
- Utilizar 30 μL de contas de tripsina (tal como preparado na secção 2) por amostra. Transfira um volume contendo esferas de tripsina para todas as amostras para um novo tubo de microcentrífuga de 1,5 mL de baixa ligação a proteínas, centrifuga a 2.655 × g por 5 min e remova o sobrenadante.
- Lavar as esferas de tripsina 2x com 1 mL de ABC 50 mM frio, antes de ressuspender no mesmo volume que foi pipetado. Centrifugar a 2.655 × g por 5 min e retirar o sobrenadante entre os passos.
- Adicione 30 μL de esferas de tripsina lavadas a cada extrato de DSS/VAMS para iniciar a digestão.
- Incubar durante 2 h a 37 °C e 1.000 rpm utilizando um misturador com temperatura controlada ou similar. Centrifugar a 2.655 × g por 5 min e transferir o sobrenadante (não contas) para um novo tubo de microcentrífuga de 2,0 mL de baixa ligação a proteínas.
- Adicionar 25 μL de 14 ng/mL de solução de padrão interno (IS) contendo o peptídeo estável marcado com isótopos (SIL) ALGNQQPSWDSEDSSNF[K_13C6_15 N2] em solução ABC 100mM.
5. Captura do peptídeo ProGRP proteotípico usando esferas magnéticas revestidas com anticorpos
- Utilizar 20 μL de esferas revestidas com anticorpos (20 mg/ml, conforme preparado na secção 1) por extracção. Transfira todas as esferas revestidas com anticorpos para um novo tubo de microcentrífuga de baixa ligação a proteínas de 1,5 mL, coloque no ímã por 1 minuto e remova o tampão de armazenamento.
- Lavar as esferas revestidas com anticorpo magnético com 1 mL de solução salina tamponada com fosfato (PBS), pH 7,4, contendo polissorbato 20 a 0,05% e 2 x 1 mL de PBS antes de ressuspender no mesmo volume que foi pipetado. Misture em um misturador de vórtices e coloque no ímã por 1 min entre as trocas de tampão.
NOTA: PBS contém 137 mM NaCl, 2,7 mM KCl, 8 mM Na 2 HPO 4 e 1,8 mM KH2PO4. Recomenda-se preparar a solução em uma concentração de 10x para maior estabilidade. Para a composição de 100 mL de 10x PBS, consulte Tabela Suplementar S1. A diluição do PBS 10x 10x atingirá um pH de ~7,4. - Adicionar 20 μL de suspensão de esferas magnéticas lavadas a cada tubo de microcentrífuga de baixa ligação a proteínas contendo um extrato DSS/VAMS digerido e IS. Realizar a imunoextração por 1 h usando um misturador de amostras end-over-end à temperatura ambiente.
- Lavar as esferas magnéticas utilizando as seguintes soluções: 500 μL de PBS com 20 polissorbato a 0,05% (v/v), 400 μL de PBS, 300 μL de Tris HCl 10 mM (pH 7,4) e 300 μL de 100 mM ABC.
- Após a adição de cada solução de lavagem, remova o tubo de microcentrífuga de baixa ligação a proteínas com esferas e solução de lavagem do suporte magnético e inverta cuidadosamente até ficar homogêneo. Em seguida, coloque o tubo de microcentrífuga de baixa ligação a proteínas no ímã por 30 s, inverta por 30 s e coloque no ímã por 1 min. Retire a solução de lavagem.
- Gire a suspensão restante usando uma microcentrífuga. Coloque sobre o íman por 1 min e retire a solução de lavagem restante.
- Adicionar 15 μL de ácido fórmico a 2% (v/v) em Tipo 1 H2O a cada amostra e incubar durante 5 min a 22 °C e 1.000 rpm utilizando um misturador com temperatura controlada, ou similar, para eluír os péptidos capturados. Coloque o ímã por 1 min e transfira o eluato para um novo tubo de microcentrífuga de 1,5 mL de baixa ligação a proteínas. Repita uma vez e transfira o segundo eluato para o mesmo tubo de microcentrífuga de baixa ligação a proteínas que o primeiro eluato.
- Adicionar 20 μL de 100 mM ABC a cada eluato (volume total de 50 μL).
- Centrifugar (microcentrífuga) e transferir 40 μL do eluato para micropastilhas para frascos para cromatografia líquida de alta eficiência (HPLC).
6. Análise por LC-MS/MS
- Utilize um micro LC triplo quadrupolo MS com ionização por eletrospray para alta robustez.
- Preparar o sistema LC-MS/MS para a análise purgando as bombas com as fases móveis A (20 mM FA em H 2 O e MeCN, 95:5 v/v) e B (20 mM FA em H2O e MeCN, 5:95 v/v).
- Inserir a coluna analítica (C18, 50 mm x 1 mm de diâmetro interior [ID], partículas de 3 μm).
- Continuar a preparar o instrumento para análise, seguindo os procedimentos de arranque para o instrumento específico.
- No software do instrumento, ajuste a temperatura do forno da coluna para 25 °C e a vazão para 50 μL/min (fase A 100% móvel).
- Equilibre a coluna com a fase A móvel por pelo menos 15 min.
- Coloque as amostras no amostrador automático.
- Preparar o método do instrumento para análise do peptídeo tríptico específico do ProGRP ALGNQQPSWDSEDSSNFK e seu SI.
NOTA: Vários parâmetros do método são específicos do instrumento e devem ser otimizados no instrumento específico utilizado. Os detalhes dos parâmetros do método utilizados aqui são descritos nas etapas 6.9 a 6.11. - Para o programa de gradiente em LC, use as seguintes configurações: vazão: 50 μL/min; do tempo 0,0 a 3,0 min: 100% móvel fase A; do tempo 3,0 a 18,0 min: executar um gradiente linear de 0% a 50% da fase móvel B; do tempo 18,0 a 18,1 min: aumento da fase B móvel de 50% para 100%; do tempo 18,1 a 20,0 min: 100% móvel fase B; do tempo 20,0 a 20,1 min: diminuir a fase B móvel de 100% para 0%; do tempo 20,1 a 30 min: 100% móvel fase A para reequilibrar a coluna (use pelo menos 10 volumes de coluna).
- Para configurações de MS/MS, execute MS/MS no modo positivo usando configurações de instrumento que garantem ionização eficiente. Para seguir este protocolo, use uma tensão de pulverização de +4.000 V, uma temperatura capilar aquecida de 270 °C, nitrogênio como gás de folha (5 unidades arbitrárias) e argônio (2 mTorr) para fragmentação de dissociação induzida por colisão (CID). Se o instrumento permitir, direcione o fluxo de LC para desperdiçar os primeiros 2 min (0-2 min) e o último 1 min (29-30 min) da corrida, em vez de para o MS.
- Use transições de monitoramento de reação selecionadas (SRM) para (A) o peptídeo de assinatura (ALGNQQPSWDSEDSSNFK): 1.005,45→913.3, 1.005,45→1.028,3 e 1.005,45→1.398,5, e (B) o peptídeo IS SIL (ALGNQQPSWDSEDSSNF[K_13C6_15N2]): 1.009,45→921,3, 1.009,45→1.036,3 e 1.009,45→1.406,5. Use energia de colisão otimizada (35 V neste protocolo) para todas as transições monitoradas.
- Prepare uma sequência contendo as amostras a serem executadas usando o software disponível para seu sistema LC-MS/MS. Ajuste o volume de injeção para 10 μL.
NOTA: Certifique-se de adicionar amostras em branco e amostras de controle de qualidade conforme necessário. - Pressione "Run sequence" no software do instrumento para iniciar a sequência.
- Monitorar a área do pico do peptídeo tríptico ALGNQQPSWDSEDSSNFK, capturado por afinidade, específico para ProGRP, e seu peptídeo IS SIL.
NOTA: A seleção e confirmação do peptídeo de assinatura, ALGNQQPSWDSEDSSNFK, é descrita em outra publicação14.
Resultados
Uma visão geral do fluxo de trabalho analítico usando amostragem DSS e VAMS é mostrada na Figura 1. Exceto pelas diferenças no método de amostragem, os procedimentos são idênticos. As imagens do soro coletado pelos dois métodos de amostragem podem ser vistas na Figura 2.
Ambas as formas de amostragem (VAMS e DSS) são adequadas para a amostragem de soro contendo ProGRP. Isso pode ser visto na Figura 3 , onde cromatogramas MS do peptídeo proteotípico e do peptídeo IS SIL da amostragem de DSS e VAMS são mostrados. Além disso, inclui-se o cromatograma MS após a análise de uma amostra de controlo constituída por 10 μL de amostra de soro líquido fortificado processada da mesma forma que as amostras secas. Este último foi diluído no mesmo volume da solução de extração DSS/VAMS, submetido à digestão com esferas de tripsina e limpo por captura de afinidade peptídica.
Comparando a amostragem de VAMS e DSS (Figura 4), a VAMS fornece uma relação peptídeo/área de SI proteotípica mais alta do que a DSS. Isso indica que pode haver uma perda da proteína-alvo ProGRP para o papel usado para DSS (celulose pura). Ao comparar com uma amostra controle, onde o soro não é seco antes do processamento e análise adicionais (Figura 4), mostra-se que a VAMS fornece razões de área semelhantes às da amostra controle (teste t bicaudal, p≤ 0,65), indicando que não há perda para o material amostral, enquanto a DSS fornece uma razão de área significativamente menor (teste t bicaudal, p≤ 0,005), indicando perda para o material amostral.
Uma breve avaliação foi realizada usando o VAMS. A linearidade foi demonstrada de 10 a 1.000 ng/mL (R2 = 0,9996), com um limite de detecção (LOD, S/N = 3) de 6,7 ng/mL. A LOD é considerada satisfatória, pois a análise foi realizada em um quadrupolo triplo bastante antigo (2008) com uma coluna ID de 1 mm. A repetibilidade de todos os níveis com relação S/R > 10 também foi considerada satisfatória com uma DSR entre 7% e 17% (n = 3), utilizando-se a correção do EI.
A captura de afinidade pode ser realizada antes e depois da etapa de digestão, capturando a proteína de interesse ou seu peptídeo proteotípico. O procedimento atual descreve a captura de afinidade peptídica. Uma vantagem dessa abordagem em comparação com a captura de proteínas é que apenas o peptídeo de interesse é capturado, e uma limpeza de amostra ainda mais eficiente é alcançada. Isso é ilustrado na Figura 5, mostrando um cromatograma de varredura completa mais complexo com mais ruído após a captura de proteínas em comparação com a captura de peptídeos. As amostras analisadas na Figura 5 não são amostradas usando amostragem DSS ou VAMS; no entanto, o soro também é a matriz da amostra, e a captura de afinidade é realizada usando o mesmo anticorpo usado para a captura do peptídeo no procedimento descrito.
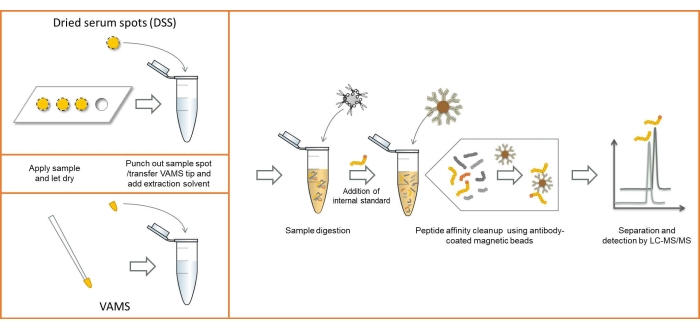
Figura 1: Visão geral do fluxo de trabalho analítico usando amostragem DSS e VAMS. Abreviações: DSS = mancha de soro seco; VAMS = microamostragem volumétrica absortiva; LC-MS/MS = cromatografia líquida-espectrometria de massas em tandem. Clique aqui para ver uma versão maior desta figura.
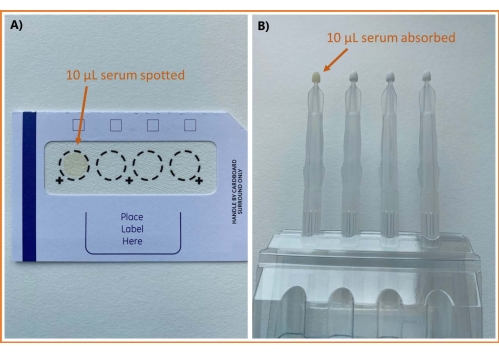
Figura 2: Imagens de soro amostrado usando diferentes métodos . (A) cartão de celulose DBS e (B) VAMS. Abreviações: DBS = sangue em papel-filtro; VAMS = microamostragem volumétrica absortiva. Clique aqui para ver uma versão maior desta figura.
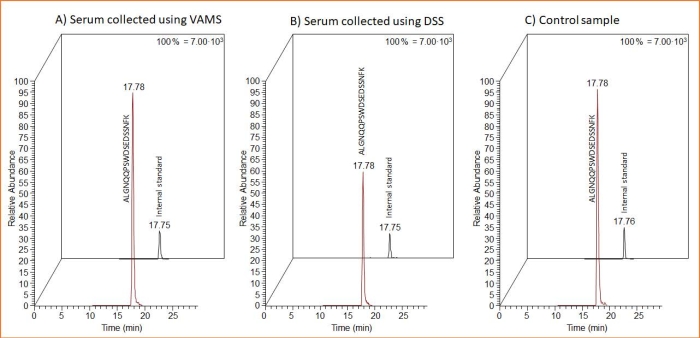
Figura 3: Cromatogramas MS representativos do peptídeo proteotípico e do peptídeo IS SIL após amostragem de DSS e VAMS, bem como para uma amostra de soro fortificada adicionada diretamente na solução de extração. Os cromatogramas MS mostram amostras de soro de 10 μL fortificadas com 1,5 μg/mL de ProGRP e aplicadas em (A) VAMS, (B) no cartão de amostragem de celulose (para DSS) ou (C) diretamente no tampão de extração (amostra controle). Vinte e cinco microlitros de 14 ng/mL é peptídeo SIL adicionados a todas as amostras antes da captura de afinidade peptídica. Abreviações: DSS = mancha de soro seco; VAMS = microamostragem volumétrica absortiva; MS = espectrometria de massas; ProGRP = peptídeo liberador de progastrina; SI = padrão interno; SIL = isótopo estável marcado. Clique aqui para ver uma versão maior desta figura.
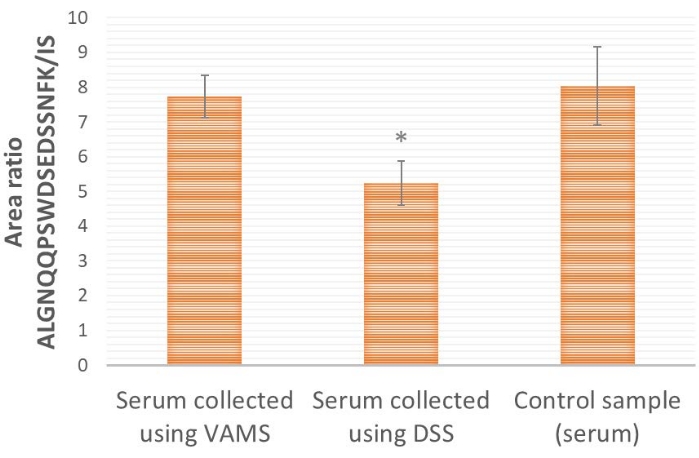
Figura 4: Resultados representativos da razão de área ALGNQQPSWDSEDSSNFK/IS para amostras de soro fortificadas com ProGRP e aplicadas (10 μL) em VAMS, DSS ou diretamente na solução de extração (amostra controle). A concentração de ProGRP é de 1,5 μg/mL, n = 4 para cada condição; 25 μL de peptídeo 14 ng/mL é SIL adicionado a todas as amostras antes da captura de afinidade peptídica. *indica que a razão de área é significativamente diferente das amostras aplicadas ao VAMS (teste t bicaudal, p≤ 0,005). As barras de erro são ± desvio padrão. Abreviações: DSS = mancha de soro seco; VAMS = microamostragem volumétrica absortiva; ProGRP = peptídeo liberador de progastrina; SI = padrão interno; SIL = isótopo estável marcado. Clique aqui para ver uma versão maior desta figura.
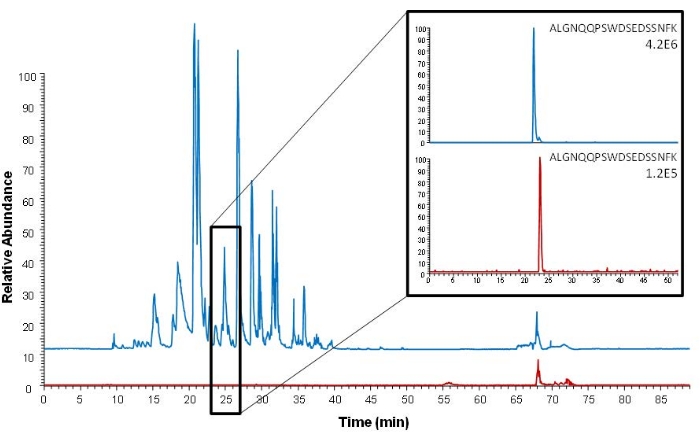
Figura 5: Comparação dos cromatogramas de pico de base (análise Orbitrap de varredura completa) após extração de proteína intacta (azul) e extração de peptídeo epitópico proteotípico (vermelho). Cromatogramas iônicos extraídos do peptídeo epítopo proteotípico (ALGNQQPSWDSEDSSNFK, m/z 1005.45) são mostrados à direita. O soro fortificado com 150 ng mL−1 de ProGRP foi usado como amostra. Esta figura é reproduzida de Levernæs et al.14. Clique aqui para ver uma versão maior desta figura.
Tabela suplementar S1: Uma visão geral da composição de buffers e soluções e como prepará-los. Clique aqui para baixar este arquivo.
Discussão
O protocolo descrito contém informações sobre como conduzir várias etapas importantes na análise de biomarcadores de baixa abundância a partir de microamostras secas (DSS e VAMS), incluindo a preparação de esferas de tripsina e esferas magnéticas revestidas com anticorpos. Com base na experiência prévia, sempre tratamos o anticorpo com ácido antes da imobilização do cordão para melhorar a orientação dos anticorpos15.
Uma das etapas críticas neste procedimento é a seleção do formato de microamostragem mais adequado. Em primeiro lugar, deve-se considerar se o analito em questão pode ser determinado a partir do sangue total, ou se a concentração é influenciada pelas células sanguíneas e tem de ser determinada no soro ou plasma (como para o analito modelo, ProGRP).
Tanto as abordagens baseadas em papel quanto em polímeros têm vantagens e limitações; para o ProGRP, o VAMS oferece uma vantagem clara em relação à recuperação do analito após a extração do amostrador. No entanto, isso provavelmente pode ser otimizado usando uma solução de extração diferente para as amostras de DSS. No entanto, esta potencial interacção entre a substância a analisar e o material de amostragem é importante ter em conta, uma vez que pode resultar num aumento da variação analítica e limites de detecção mais elevados. Como o IS usado é um peptídeo SIL e adicionado pela primeira vez após a digestão, o IS corrige as etapas após a digestão (por exemplo, extração de afinidade e análise de LC-MS/MS). A correção do SI não é possível para a extração do DSS/VAMS e para a etapa de digestão.
Dois tipos de esferas são usados no procedimento: esferas de tripsina para digestão após a extração da amostra de soro do amostrador e esferas magnéticas revestidas de anticorpos para captura do peptídeo proteotípico após a digestão. Uma das principais razões para o uso de esferas de tripsina, além de acelerar a digestão, é minimizar a atividade residual de tripsina na amostra durante a captura de afinidade. Isso é importante para evitar a proteólise tríptica do mAb durante a captura de afinidade.
Contas de agarose foram usadas para a preparação das esferas de tripsina, enquanto esferas magnéticas foram usadas para a preparação das esferas revestidas com anticorpos. As contas de agarose são mais baratas do que as contas magnéticas, mas têm uma limitação de que a separação das contas da solução requer centrifugação. Isso torna a separação de contas e sobrenadante menos eficiente do que quando se usa contas magnéticas. Além disso, a automação do fluxo de trabalho é difícil usando contas de agarose. No entanto, as esferas magnéticas ativadas pelo NHS estão disponíveis e podem ser usadas para um fluxo de trabalho de preparação de amostras mais simplificado e automatizado.
A microamostragem é uma tendência importante na bioanálise de fármacos e biomarcadores. Um desafio com a abordagem atual é a quantidade limitada de volume de amostra (10 μL), que pode ser de particular importância na determinação de analitos de baixíssima abundância como o ProGRP (pg/mL-baixo nível de ng/mL). No entanto, esse desafio pode ser contornado com o uso de equipamentos analíticos de última geração. Para esses analitos de baixa abundância, a escolha da preparação da amostra é crucial, e a limpeza seletiva da amostra por meio da captura de afinidade baseada em anticorpos é mais frequentemente necessária. Como a captura de peptídeos demonstrou fornecer extratos mais limpos e limites de detecção mais baixos do que a captura de proteínas (usando o mesmo anticorpo)14, o presente método se concentra nessa abordagem em combinação com microamostragem. Outra vantagem da abordagem de captura de peptídeos é que o peptídeo IS SIL também corrige a etapa de captura de afinidade.
Neste trabalho, um anticorpo direcionado a uma proteína foi usado para a captura do peptídeo. Esta é uma vantagem, uma vez que a disponibilidade de anticorpos de prateleira visando proteínas é maior do que anticorpos de prateleira visando peptídeos proteotípicos. No entanto, para que um anticorpo antiproteico capture eficientemente um peptídeo proteotípico, o epítopo precisa estar intacto após a digestão da proteína. Além disso, para muitos anticorpos, o epítopo exato não é conhecido, tornando a busca por um anticorpo antiproteico tediosa. Isso limita o número de anticorpos antiproteicos disponíveis aplicáveis para a captura de peptídeos. O procedimento descrito é demonstrado usando soro como matriz e ProGRP como analito alvo. O procedimento destina-se a ser aplicável a outras matrizes e outros analitos alvo. Em vez de usar um anticorpo antiproteico disponível comercialmente para a captura de afinidade do peptídeo proteotípico, é possível também usar anticorpos antipeptídeos feitos sob medida. A eficiência de limpeza da captura de peptídeos em comparação com a captura de proteínas é ilustrada na Figura 5. Ao trocar as esferas de agarose usadas para a preparação de contas de tripsina por esferas magnéticas, o procedimento também deve ser compatível com as estações de trabalho de preparação de amostras robóticas no mercado.
Divulgações
Os autores não têm conflitos de interesse a declarar.
Agradecimentos
Agradecemos imensamente à Profª Elisabeth Paus do Norwegian Radium Hospital (Oslo University Hospital, Oslo, Noruega) por fornecer o padrão ProGRP e o anticorpo monoclonal anti-ProGRP, M18. A taxa de publicação foi coberta por uma bolsa da Apoteker Harald Conrad Thaulows legat. Trine Grønhaug Halvorsen e Léon Reubsaet são parceiros no consórcio National Network of Advanced Proteomics Infrastructure (NAPI), que é financiado pelo programa INFRASTRUKTUR do Conselho de Pesquisa da Noruega (número do projeto: 295910).
Materiais
| Name | Company | Catalog Number | Comments |
| Acetic acid N-hydroxysuccinimide ester | Carbosynt (Staad, Switzerland) | FA33719 | Store in freezer below -20 °C |
| ALGNQQPSWDSEDSSNF[K_13C6 _15N2] (≥ 95%) | Innovagen (Lund, Sweden) | Not applicable | Store in freezer below -20 °C |
| Ammonium bicarbonate BioUltra (≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 09830-500G | |
| Aquasil C18 column, 3 µm, 50 mm x 1 mm | Thermo scientific (Waltham, MA, USA) | 77503-051030 | Analytical column compatible with 100% aqueous mobile phase |
| Benzamidine (≥ 95.0% ) | Sigma Aldrich (St. Louis, MO, USA) | 12072 | Store in fridge at 2-6 °C |
| Calsium chloride dihydrate (≥ 99% ) | Sigma Aldrich (St. Louis, MO, USA) | 223506-500G | |
| Centrifuge 5804 | Eppendorf (Hamburg, Tyskland) | 5804000010 | |
| Cloned ProGRP isoform 1 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Disodium hydrogenphosphate dihydrate (pro analysis) | Sigma Aldrich (St. Louis, MO, USA) | 30435-500G | |
| Disodium hydrogenphosphate dodecahydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06579.0500 | |
| Dynabeads M-280 tosylactivated 10 mL | Invitrogen (Carlsbad, USA) | 14204 | Store in fridge at 2-6 °C |
| DynaMag-2 | Invitrogen (Carlsbad, USA) | 123-21D | |
| Ethanolamine (pro analysis, ≥ 99%) | Sigma Aldrich (St. Louis, MO, USA) | #02400 | |
| Formic acid (≥ 99% ) for LC-MS | VWR International (Radnor, PA, USA) | 84865.260 | |
| FTA DMPK-C cellulose card | Whatman (Kent, UK) | WB129243 | DBS card |
| HPLC vials, clear glass, 1.5 mL, 32 x 11.6 mm, Clean Pack | Nerliens Meszansky (Oslo, Norge) | LPP 11 09 0519 | |
| Hulamixer sample mixer | Invitrogen (Carlsbad, USA) | 101561503016 | Sample mixer with end-over-end mixing and reciprocal rotation and vibration |
| Human serum from healty blood donors | Bloodbank, Ullevål, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in freezer below -20 °C |
| Hydrochloric acid fuming 37% (Emsure for analysis) | Merck (Darmstadt, Tyskland) | 1.00317.1000 | |
| LC-MS/MS system: Ultimate 3000 system (Autosampler, WPS-3000TRS; Micropump, LPG-3400M; Flow manager, FLM-3300, MIC, 1X2P-10P) and TSQ Quantum access. Controlled by Xcalibur 2.2 SP1.48 | Thermo scientific (Waltham, MA, USA) | Not applicable | |
| LiChrosolv Acetonitrile hypergrade for LC-MS | Merck (Darmstadt, Tyskland) | 1.00029.2500 | |
| LL Biotrode, Combined glass electrode | Metrohm (Herisau, Sveits) | 6.0224.100 | |
| Magnetic stirrer, Type M10 | Franz Morat KG (Eisenbach, Germany) | 10236 | |
| Micro inserts, glass (31 x 6 mm, 0.1 mL) | VWR International (Radnor, PA, USA) | 548-0006 | |
| MilliQ integral 3 with Q-POD | Merck Millipore (Molsheim, France) | ZRXQ003T0 | For production of Type 1 water |
| monoclonal antibody M18 | Radium hospital, Oslo University Hospital (Oslo, Norway) | Not applicable | Store in fridge at 2-6 °C |
| Neoteryx Mitra microsampler (10 μL) 4 sampler Clamshell | Fisher Scientific (Waltham, MA, USA) | NC1382947 | |
| NHS-activated sepharose beads 4 fast flow | Sigma Aldrich (St. Louis, MO, USA) | GE17-0906-01 | Agarose beads, store in fridge at 2-6 °C |
| Optifit, Refill pipet tips, 10 mL | Sartorius Biohit (Helsinki, Finland) | 613-2911 | |
| Optifit, Refill pipet tips, 10 μL | Sartorius Biohit (Helsinki, Finland) | 790012 | |
| Optifit, Refill pipet tips, 1,000 μL | Sartorius Biohit (Helsinki, Finland) | 791002 | |
| Optifit, Refill pipet tips, 200 μL | Sartorius Biohit (Helsinki, Finland) | 790202 | |
| pH glass electrode | Metrohm (Herisau, Sveits) | 6.0233.100 | |
| pH meter 744 | Metrohm (Herisau, Sveits) | 8.744.1003 | |
| Pipet 10 mL | Sartorius Biohit (Helsinki, Finland) | 725090 | |
| Pipet m10 µL | Sartorius Biohit (Helsinki, Finland) | 725020 | |
| Pipet m100 µL | Sartorius Biohit (Helsinki, Finland) | 725050 | |
| Pipet m1,000 µL | Sartorius Biohit (Helsinki, Finland) | 725070 | |
| Pipet m20 µL | Sartorius Biohit (Helsinki, Finland) | 725030 | |
| Potassium chloride (KCl ≥ 99.9%) | Sigma Aldrich (St. Louis, MO, USA) | P-3911 | |
| Potassium dihydrogenphosphate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.04873.0250 | |
| Protein LoBind Eppendorf tube 0.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0133 (0030 108.094) | |
| Protein LoBind Eppendorf tube 1.5 mL | Eppendorf (Hamburg, Tyskland) | 525-0132 (0030 108.116) | |
| Protein LoBind Eppendorf tube 2.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0134 (0030 108.450) | |
| Protein LoBind Eppendorf tube 5.0 mL | Eppendorf (Hamburg, Tyskland) | 525-0792 (0030108.302) | |
| Scissors | Sigma Aldrich (St. Louis, MO, USA) | Z186716-1EA | |
| Sodium azide (BioUltra; ≥ 99.5% ) | Sigma Aldrich (St. Louis, MO, USA) | 71289-5G | |
| Sodium chloride (for analysis) | Merck (Darmstadt, Tyskland) | 1.06404.1000 | |
| Sodium dihydrogenphosphate monohydrate (pro analysis) | Merck (Darmstadt, Tyskland) | 1.06346.0500 | |
| Sodium hydroxide (AnalaR NORMAPUR) | VWR International (Radnor, PA, USA) | 28244.295 | |
| Sodium tetraborate decahydrate (≥ 99. %) | Sigma Aldrich (St. Louis, MO, USA) | S9640-500G | |
| Spectrafuge Mini Centrifuge | LABNET International (Edison, NJ, USA) | C1301 | |
| Stirring magnet, 25 mm x 6 mm Ø, circular | Leybold (Cologne, Germany) | 666 851 | |
| Stuart Scientific SA8 vortex mixer | Stuart (Staffordshire, UK) | Z648531-1EA | |
| SuperClear centrifuge tubes (15 mL) | VWR International (Radnor, PA, USA) | 525-0150 | |
| SuperClear centrifuge tubes (50 mL) | VWR International (Radnor, PA, USA) | 525-0155 | |
| Thermomixer comfort 1.5 mL | Eppendorf (Hamburg, Tyskland) | 53,55,27,831 | Temperature controlled mixer |
| Trizma base (reagent grade, ≥ 99.0 %) | Sigma Aldrich (St. Louis, MO, USA) | T6066 | Tris(hydroxymethyl)aminometan (tris) |
| Trizma HCl (reagent grade, ≥ 99.0%) | Sigma Aldrich (St. Louis, MO, USA) | T3253-100G | Tris(hydroxymethyl)aminometan HCl (tris HCl) |
| Trypsin (TCPK-treated from bovine pancreas, 10,000-15,000 BAEE units/mg Protein) | Sigma Aldrich (St. Louis, MO, USA) | T8802 | Store in freezer below -20 °C |
| Tween 20 | Sigma Aldrich (St. Louis, MO, USA) | P7949-500ML | polysorbate 20 |
| Tweezers | Sigma Aldrich (St. Louis, MO, USA) | TEM-78511-27 | |
| Vial caps, white, 9 mm | Nerliens Meszansky (Oslo, Norge) | LPP 09 15 0981 | |
| Mitra microsampler with VAMS (Volumetric adsorptive microsampling) technology, 10 µL, 4-sampler clamshell | Neoteryx (Torrance, CA, USA) |
Referências
- Bang, I. B. Fresenius. Zeitschrift für analytische Chemie. 52 (7), 521-523 (1913).
- Guthrie, R., Susi, A. A simple phenylalanine method for detecting phenylketonuria in large populations of newborn infants. Pediatrics. 32 (3), 338-343 (1963).
- Laurell, C. B. A screening test for α1-antitrypsin deficiency. Scandinavian Journal of Clinical and Laboratory Investigation. 29 (3), 247-248 (1972).
- Thielmann, K., Aquino, A. M. Whole blood samples dried and stored on filter paper as substrate for the electrophoretic separation on hemoglobin S from hemoglobin A. A screening procedure. Clinica Chimica Acta. 35 (1), 237-238 (1971).
- Wada, Y., Fujita, T., Kidoguchi, K., Hayashi, A. Fetal hemoglobin variants in 80,000 Japanese neonates: High prevalence of Hb F Yamaguchi (AγT 80 Asp→Asn). Human Genetics. 72 (3), 196-202 (1986).
- Halvorsen, T. G., McKitterick, N., Kish, M., Reubsaet, L. Affinity capture in bottom-up protein analysis-overview of current status of proteolytic peptide capture using antibodies and molecularly imprinted polymers. Analytica Chimica Acta. 1182, 338714(2021).
- Halvorsen, T. G., Reubsaet, L. Antibody based affinity capture LC-MS/MS in quantitative determination of proteins in biological matrices. TrAC Trends in Analytical Chemistry. 95, Supplement C 132-139 (2017).
- Neubert, H., et al. Protein biomarker quantification by immunoaffinity liquid chromatography-tandem mass spectrometry: Current state and future vision. Clinical Chemistry. 66 (2), 282-301 (2020).
- Pan, S., et al. Mass spectrometry based targeted protein quantification: methods and applications. Journal of Proteome Research. 8 (2), 787-797 (2008).
- Enderle, Y., Foerster, K., Burhenne, J. Clinical feasibility of dried blood spots: Analytics, validation, and applications. Journal of Pharmaceutical and Biomedical Analysis. 130, 231-243 (2016).
- Londhe, V., Rajadhyaksha, M. Opportunities and obstacles for microsampling techniques in bioanalysis: Special focus on DBS and VAMS. Journal of Pharmaceutical and Biomedical Analysis. 182, 113102(2020).
- Denniff, P., Spooner, N. The effect of hematocrit on assay bias when using dbs samples for the quantitative bioanalysis of drugs. Bioanalysis. 2 (8), 1385-1395 (2010).
- Denniff, P., Spooner, N. Volumetric absorptive microsampling: A dried sample collection technique for quantitative bioanalysis. Analytical Chemistry. 86 (16), 8489-8495 (2014).
- Levernæs, M. C. S., et al. Immunocapture sample clean-up in determination of low abundant protein biomarkers-a feasibility study of peptide capture by anti-protein antibodies. RSC Advances. 9 (60), 34902-34911 (2019).
- Conradie, J. D., Govender, M., Visser, L. Elisa solid phase: Partial denaturation of coating antibody yields a more efficient solid phase. Journal of Immunological Methods. 59 (3), 289-299 (1983).
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados