Un abonnement à JoVE est nécessaire pour voir ce contenu. Connectez-vous ou commencez votre essai gratuit.
Method Article
Essai de viabilité des conidies de Trichoderma stromaticum à l’intérieur des macrophages dérivés de mononucléaires du sang périphérique humain
* Ces auteurs ont contribué à parts égales
Dans cet article
Résumé
La technique impliquant la phagocytose des conidies fongiques par les macrophages est largement utilisée pour les études évaluant la modulation des réponses immunitaires contre les champignons. L’objectif de ce manuscrit est de présenter une méthode d’évaluation de la phagocytose et des capacités de clairance des macrophages dérivés de mononucléaires du sang périphérique humain stimulés par des conidies de Trichoderma stromaticum .
Résumé
Les macrophages représentent une ligne de défense cruciale et sont responsables de la prévention de la croissance et de la colonisation des agents pathogènes dans différents tissus. La phagocytose conidiale est un processus clé qui permet d’étudier les événements cytoplasmiques et moléculaires impliqués dans les interactions macrophages-pathogènes, ainsi que de déterminer le moment de la mort des conidies internalisées. La technique impliquant la phagocytose des conidies fongiques par les macrophages est largement utilisée pour les études évaluant la modulation des réponses immunitaires contre les champignons. L’évasion de la phagocytose et la fuite des phagosomes sont des mécanismes de virulence fongique. Nous rapportons ici les méthodes qui peuvent être utilisées pour l’analyse de la phagocytose, de la clairance et de la viabilité des conidies de T. stromaticum , un champignon qui est utilisé comme agent de lutte biologique et de biofertilisant et qui est capable d’induire des infections humaines. Le protocole consiste en 1) la culture de Trichoderma , 2) le lavage pour obtenir des conidies, 3) l’isolement des cellules mononucléées du sang périphérique (PBMC) par la méthode de la solution de polysaccharose et la différenciation des PBMC en macrophages, 4) une méthode de phagocytose in vitro utilisant des lamelles de verre rondes et une coloration, et 5) un test de clairance pour évaluer la viabilité des conidies après phagocytose des conidies. En résumé, ces techniques peuvent être utilisées pour mesurer l’efficacité de la clairance fongique des macrophages.
Introduction
Le genre Trichoderma (Ordre : Hypocreales, Famille : Hypocreaceae) est composé de champignons saprophytes omniprésents qui sont des parasites d’autres espèces fongiques et sont capables de produire une gamme d’enzymes commercialement utiles1. Ces espèces fongiques sont utilisées pour la production de protéines hétérologues2, la production de cellulose3, d’éthanol, de bière, de vin et de papier4, dans l’industrie textile5, l’industrie alimentaire6 et dans l’agriculture comme agents de lutte biologique 7,8. Outre l’intérêt industriel pour ces espèces fongiques, le nombre croissant d’infections chez l’homme a donné à certaines espèces de Trichoderma le statut d’agents pathogènes opportunistes9.
Trichoderma spp. se développe rapidement en culture, avec des colonies initialement blanches et cotonneuses qui virent au jaune verdâtre au vert foncé10. Ils sont adaptés pour vivre dans une large gamme de conditions de pH et de température, et les espèces opportunistes sont capables de survivre à des pH et des températures physiologiques et, ainsi, de coloniser différents tissus humains 11,12,13. Il est important de noter que l’augmentation du taux d’infection de Trichoderma spp. peut être associée à des facteurs de virulence, qui ne sont pas bien étudiés. De plus, les études axées sur la compréhension de la réponse immunitaire contre les espèces opportunistes de Trichoderma sont encore rares.
Lors d’une infection, avec les neutrophiles, les macrophages représentent la ligne de défense responsable de la phagocytose et, ainsi, empêchent la croissance et la colonisation des agents pathogènes dans différents tissus. À l’aide de récepteurs de reconnaissance de formes, tels que les récepteurs de type Toll et les récepteurs de lectine de type C, les macrophages phagocytent les champignons et les transforment en phagolysosomes, favorisant ainsi une explosion respiratoire, la libération de cytokines pro-inflammatoires et la destruction des micro-organismes phagocytés14. Le mécanisme de la phagocytose, cependant, peut être affecté et évité par différentes stratégies microbiennes, telles que la taille et la forme des cellules fongiques ; la présence de capsules qui entravent la phagocytose ; diminution du nombre de récepteurs induisant la phagocytose ; le remodelage de la structure des fibres d’actine dans le cytoplasme ; entravant la formation de pseudopodes ; et le phagosome ou le phagolysosome s’échappent après le processus de phagocytose14.
De nombreux agents pathogènes, y compris Cryptococcus neoformans, utilisent les macrophages comme niche pour survivre dans l’hôte, disséminer et induire l’infection15. Le test de phagocytose et de clairance est utilisé pour évaluer la réponse immunitaire contre les agents pathogènes et pour identifier les stratégies microbiennes employées pour échapper au système immunitaire inné 15,16,17. Ce type de technique peut également être utilisé pour examiner la cinétique différentielle de la phagocytose, de l’acidification retardée des phagosomes et de l’éclatement oxydatif qui entraînent une réduction de la destruction fongique18.
Différentes méthodes peuvent être utilisées pour évaluer la phagocytose, la survie fongique et l’évasion du processus de maturation des phagosomes. Il s’agit notamment de la microscopie à fluorescence, qui est utilisée pour observer la phagocytose, la localisation cellulaire et les molécules produites lors de la phagocytose19 ; la cytométrie en flux, qui fournit des données quantitatives sur la phagocytose et permet d’évaluer les différents marqueurs impliqués dans le processus20,21 ; microscopie intravitale, qui est utilisée pour évaluer la capture microbienne et la maturation des phagosomes22 ; phagocytose médiée par les anticorps, qui est utilisée pour évaluer la spécificité du processus de phagocytose d’un agent pathogène23 ; et autres 24,25,26,27.
Le protocole présenté ici utilise une méthode courante, peu coûteuse et directe utilisant un microscope optique et un test de croissance sur plaque pour évaluer la phagocytose et la destruction des conidies fongiques. Ce protocole fournira aux lecteurs des instructions étape par étape pour effectuer le test de phagocytose et de clairance à l’aide de macrophages humains dérivés de mononucléaires du sang périphérique exposés à T. stromaticum. Les PBMC ont été utilisés parce que les conidies de Trichoderma sont appliquées comme biocontrôle contre les phytopathogènes et comme biofertilisant pour les cultures végétales dans le monde entier et ont causé plusieurs infections humaines, appelées tricholodermose. En outre, il n’existe que deux travaux antérieurs portant sur l’interaction entre les conidies Trichoderma et le système immunitaire humain, dans lesquels nous avons examiné les neutrophiles28 et l’autophagie dans les macrophages29. Cet article montre d’abord comment la phagocytose des conidies de T. stromaticum par des macrophages dérivés de PBMC peut être étudiée, puis comment la viabilité des conidies englouties peut être évaluée à l’aide de techniques simples basées sur la microscopie. Ce protocole pourrait faciliter davantage les recherches sur la réponse immunitaire associée aux macrophages ou les mécanismes liés à la modulation du système immunitaire.
Access restricted. Please log in or start a trial to view this content.
Protocole
Considérations éthiques et sujets humains
Toutes les expériences sur des humains décrites dans cette étude ont été menées conformément à la Déclaration d’Helsinki et aux lois fédérales brésiliennes et approuvées par le Comité d’éthique de l’Université d’État de Santa Cruz (code d’identification du projet : 550.382/2014).
Du sang périphérique humain a été prélevé sur des volontaires sains de la ville d’Ilhéus, Bahia, Brésil, non exposés à des activités professionnelles liées au champignon étudié. Les personnes ayant des problèmes de santé déclarés ou utilisant des médicaments ont été exclues. Tous les sujets ont volontairement accepté de participer et ont signé un formulaire de consentement éclairé avant d’être inclus dans cette étude.
1. Préparation des réactifs et des solutions
REMARQUE : Préparez les réactifs et solutions suivants avant de continuer. Reportez-vous au tableau des matériaux (TOM) pour obtenir des informations sur le fournisseur de réactifs et de matériaux.
- Préparez une solution saline équilibrée stérile tamponnée au phosphate 1x (PBS).
REMARQUE : Dans ce protocole, le PBS exempt d’endotoxines n’a pas été utilisé. - Préparer une gélose au dextrose de pomme de terre (PDA) et verser 20 ml dans chaque boîte de Pétri pour la culture de T. stromaticum . Préparez six assiettes avec PDA pour chaque donneur et utilisez une assiette pour chaque condition : 3 h, 24 h, 48 h, 72 h, 96 h et 120 h. De plus, utilisez trois plaques pour chaque témoin : trois pour le témoin Trichoderma et trois pour le témoin moyen R10. Utilisez des boîtes de Pétri de 60 mm x 15 mm ou 100 mm x 15 mm pour une récupération optimale des conidies.
- Stériliser 100% glycérol.
- Préparer un milieu R10 pour la culture cellulaire : milieu RPMI complété par 10 % de sérum de veau fœtal et 1 % d’antibiotique (pénicilline/streptomycine).
- Stériliser l’eau distillée pour la lyse cellulaire.
- Préparez de l’eau à pH 7,0 pour le processus de coloration.
REMARQUE : Si nécessaire, ajustez le pH à l’aide d’un pH-mètre et de solutions de 0,1 M/L de NaOH et de 0,1 M/L de HCl. - Stériliser la lamelle ronde en verre (13 mm) et la pince à épiler.
2. Culture et traitement de Trichoderma stromaticum
- Préparation d’une souche mère (M1) de T. stromaticum :
NOTA : Une souche mère (M1) est nécessaire pour s’assurer que toutes les expériences sont faites à partir de la culture de la même génération fraîche (F1).- Cultivez un inoculum de T. stromaticum dans des boîtes de Pétri avec PDA à 28 °C dans l’obscurité pendant 7 à 10 jours jusqu’à ce que les conidies soient observées et que la culture devienne verte.
- Laver la culture de T. stromaticum. Ajouter 3 à 5 mL de PBS à la surface de culture à l’aide d’une pipette. Récupérez le PBS de la plaque et distribuez-le à nouveau sur la culture pour éliminer progressivement les conidies à l’aide de la pipette. Répétez ce processus autant que nécessaire jusqu’à ce que la suspension devienne vert foncé.
REMARQUE : Alternativement, un lavage doux de la culture en ajoutant 3 à 5 ml de PBS dans la plaque, suivi d’un mouvement circulaire est suggéré jusqu’à ce que la suspension devienne verte pour récupérer les conidies. Avec des pipetages répétés, plus de conidies peuvent être collectées. - Transférez la suspension récupérée de la plaque dans un tube stérile de 15 ml à l’aide d’une pipette. Répétez les étapes 2.1.2 à 2.1.3 autant de fois que nécessaire pour obtenir plus de conidies.
- Centrifuger la suspension à 1 160 x g pendant 5 min à 12 °C, puis remettre la pastille en suspension dans 5 mL de PBS. Répétez cette étape (2.1.4) trois fois pour obtenir une suspension sans trait d’union.
REMARQUE : Pour remettre correctement la pastille en suspension, après la centrifugation, un bref vortex est recommandé. - Remettre en suspension la dernière pastille dans 2 à 3 mL de PBS et compter les conidies dans une chambre Neubauer en utilisant une dilution de 1 :100 ou 1 :1 000.
REMARQUE : Dans des conditions optimales, une concentration finale de 2 x 108 conidies/mL peut être obtenue de la culture. L’évaluation de la viabilité des conidies à l’aide de la méthode d’exclusion du bleu trypan est facultative. - Aliquotez la suspension dans des tubes stériles de 1,5 mL en ajoutant 0,5 mL de la suspension de conidies (à partir de l’étape 2.1.5) dans chaque tube. Ensuite, ajoutez 0,5 mL de glycérol stérile à 100 % pour obtenir des bouillons M1. Tourbillonnez brièvement, identifiez les tubes et stockez-les à −20 °C ou −80 °C.
- Culture de T. stromaticum et obtention de conidies pour l’expérience
- Plaque 10 μL de la suspension M1 (préparée à l’étape 2.1) dans un PDA à 28 °C dans l’obscurité pendant 7 à 10 jours jusqu’à ce que les conidies soient observées et que la culture devienne verte pour obtenir la nouvelle génération F1.
REMARQUE : Pour assurer une culture fraîche de T. stromaticum pour l’expérience, évaluer le temps nécessaire à la croissance du champignon et le temps nécessaire à la différenciation des macrophages. - Collectez les conidies en répétant les étapes 2.1.2 à 2.1.4.
- Remettre en suspension la dernière pastille dans 2 à 3 mL de PBS. Évaluez la viabilité des conidies à l’aide de la méthode d’exclusion du bleu trypan ou comptez les conidies comme mentionné à l’étape 2.1.5.
- Plaque 10 μL de la suspension M1 (préparée à l’étape 2.1) dans un PDA à 28 °C dans l’obscurité pendant 7 à 10 jours jusqu’à ce que les conidies soient observées et que la culture devienne verte pour obtenir la nouvelle génération F1.
3. Isolement des cellules mononucléées du sang périphérique (PBMC)
NOTA : Les PBMC sont obtenus par la méthode de la barrière de densité à l’aide d’une solution de polysaccharose de densité 1,077 g/mL30.
- Aliquote 15 mL de la solution de polysaccharose dans un tube de 50 mL pour chaque échantillon de donneur qui sera prélevé.
- Prélever 20 ml de sang de chaque donneur à l’aide de trois ou quatre tubes EDTA. Recruter un minimum de quatre donneurs par expérience. Ne pas mettre en commun le sang des donneurs ; Au lieu de cela, utilisez chaque échantillon séparément comme réplique biologique. Pour chaque donneur, transférez le sang dans un tube de 50 mL et ajoutez du PBS pour obtenir un volume final de 35 mL.
- Transférez lentement la suspension sanguine (étape 3.2) le long de la paroi du tube contenant la solution de polysaccharose (étape 3.1) pour former une suspension biphasique.
REMARQUE : Pour éviter le mélange du sang avec la solution de polysaccharose, ajoutez lentement le sang. L’utilisation d’un minimum de 7 mL de sang de chaque donneur pour l’isolement du PBMC est recommandée. - Centrifuger immédiatement le tube contenant la suspension biphasique à 1 600 x g pendant 30 min à 24 °C. Programmez la centrifugation des PBMC : utilisez l’accélération 1 et la décélération 0 pour éviter un arrêt brutal de la centrifugation.
- Observez la formation d’un anneau blanc contenant les PBMC après centrifugation. Les globules rouges et les granulocytes résident dans la couche inférieure, la couche suivante contient la solution de polysaccharose et les PBMC résident dans l’anneau blanc entre la solution de polysaccharose et le plasma (couche supérieure). Prélever l’anneau blanc en l’aspirant doucement à l’aide d’une pipette ou d’une pipette Pasteur stérile afin de ne pas attraper de globules rouges, de plasma ou de solution de polysaccharose, et transférer dans un tube de 15 ml.
- Ajouter le PBS dans le tube de 15 mL contenant les PBMC pour obtenir un volume final de 10 mL. Homogénéiser la suspension et centrifuger le tube à 1 600 x g pendant 30 min à 24 °C.
- Laver les cellules trois fois à 1 600 x g pendant 5 min à 24 °C avec 10 mL de PBS. Ensuite, remettre en suspension la dernière pastille dans 2 mL de milieu R10.
- Évaluez la viabilité cellulaire à l’aide de la méthode d’exclusion du bleu trypan et comptez les cellules dans une chambre de Neubauer.
4. Cinétique de phagocytose
REMARQUE : Les macrophages dérivés de mononucléaires du sang périphérique humain sont traités avec des conidies de T. stromaticum à une multiplicité d’infection (MOI) de 1 :10 ou seulement un milieu R10 comme témoin. La multiplicité de l’infection (MOI) représente le rapport entre les agents infectieux ajoutés aux cibles d’infection et est présentée sous forme de nombres absolus : MOI = agents :cibles31. Ici, nous utilisons 1 conidie (agent) de T. stromaticum pour 10 macrophages (cibles). Ensuite, les cellules sont incubées à 37 °C et 5 % de CO2 pendant différentes périodes (3 h, 24 h, 48 h, 72 h, 96 h et 120 h). Ensuite, une lamelle ronde en verre est utilisée pour visualiser au microscope les macrophages adhérents impliqués dans le processus de phagocytose. Une figure de la conception expérimentale est fournie (figure 1).
REMARQUE : L’utilisation de plaques à 24 puits est suggérée.
- Traitement des macrophages d’origine humaine avec des conidies à T. stromaticum
- Ajouter une lamelle ronde stérile en verre (13 mm) dans chaque puits à l’aide d’une pince à épiler stérile.
- Ajustez le volume de la suspension cellulaire obtenue aux étapes 3.7 à 3.8 pour plaquer 8 x 105 cellules par puits jusqu’à un volume final de 1 mL avec le milieu R10. Utilisez un microscope inversé pour évaluer la morphologie cellulaire.
REMARQUE : Les cellules doivent être en suspension dans le milieu et avoir une morphologie arrondie. - Incuber les cellules à 37 °C sous une atmosphère à 5% de CO2 pendant 7 jours, et remplacer le milieu par du milieu frais R10 tous les 2 jours pour la différenciation des monocytes en macrophages32. Observez la morphologie cellulaire à l’aide d’un microscope inversé. Les macrophages présenteront une morphologie fusiforme, avec des formes aplaties et allongées ; Une augmentation du rapport cytoplasmique et la présence de pseudopodes peuvent également être observées. Recherchez des macrophages adhérents dérivés de mononucléaires.
REMARQUE : Une très faible proportion de monocytes indifférenciés peut rester en suspension dans le milieu. - Retirez le milieu de chaque puits à l’aide d’une pipette et lavez les cellules avec 1 mL de PBS pour éliminer les débris et les cellules non adhérentes.
- Utiliser la suspension préparée à l’étape 2.2 pour préparer une nouvelle suspension de conidies de T. stromaticum à une concentration finale de 8 x 104 conidies/mL dans un milieu R10.
- Ajouter 1 mL de la suspension de conidies préparée à l’étape 4.1.5 dans chaque puits de traitement (3 h, 24 h, 48 h, 72 h, 96 h et 120 h) pour obtenir une inertie de 1 :10. Pour les témoins, ajouter seulement 1 mL de milieu R10 dans le puits.
- Testez les macrophages pendant 3 h avec des conidies de T. stromaticum à 37 °C sous une atmosphère à 5 % de CO2 . Au bout de 3 h, retirez le milieu et lavez les cellules pour éliminer les conidies non phagocytées.
- Ajouter 1 mL de milieu R10 dans chaque puits et incuber la plaque pendant différentes périodes (3 h, 24 h, 48 h, 72 h, 96 h et 120 h) à 37 °C sous une atmosphère à 5 % de CO2 .
- Coloration et analyse
- Retirer le milieu de chaque puits une fois l’incubation correspondante terminée (étape 4.1.8) et ajouter 1 mL de PBS dans ce puits.
- Retirez les lamelles de verre rondes des puits à l’aide d’une pince à épiler stérile et d’une aiguille pour colorier avec un kit de coloration.
REMARQUE : Alternativement, la coloration peut être effectuée à l’aide de la teinture May Grünwald-Giemsa33. - À chacune des lamelles de verre rondes, ajoutez le fixateur de taches (5 s), le colorant 1 (5 s), le colorant 2 (2 s) et l’eau tamponnée pH 7,0 (5 s), qui sont les composants du kit de coloration. Attendez qu’ils soient secs et fixez les lamelles sur une lame de verre à l’aide d’un agent de montage.
- Quantifier le résultat : Compter un total de 100 macrophages (Mø) pour chaque condition temporelle. À l’aide d’un microscope optique, comptez le nombre de macrophages avec des conidies phagocytées à l’aide d’un objectif 100x et d’une huile d’immersion (équation [1]).
 (1)
(1) - Obtenir le nombre de conidies phagocytées par macrophage : Corréler les conidies présentes dans 100 macrophages divisé par le nombre de macrophages ayant au moins une conidie phagocytée (équation [2])34.
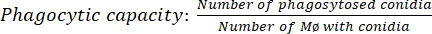 (2)
(2)
REMARQUE : Pour évaluer et compter les conidies, le logiciel ImageJ peut être utilisé35. - Photographiez la phagocytose de chaque échantillon et de chaque condition temporelle à l’aide d’objectifs 40x et 100x pour présenter les résultats.
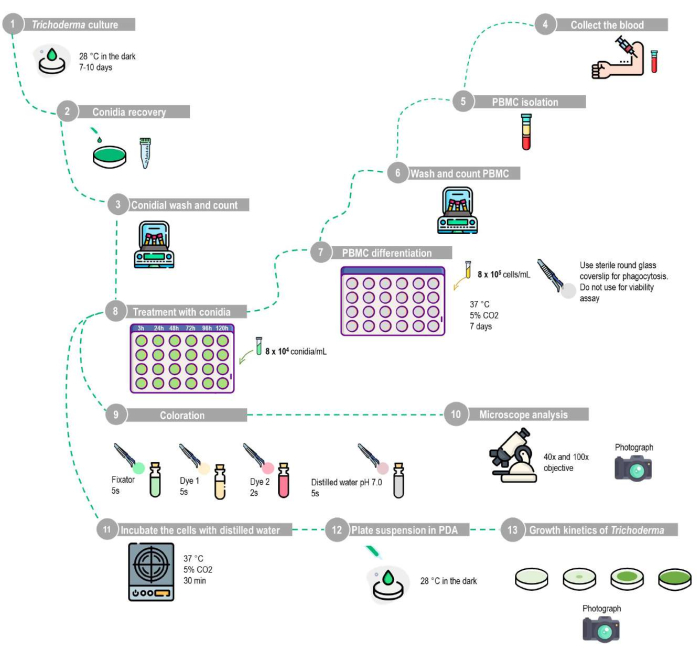
Figure 1 : Représentation schématique du test de phagocytose et de viabilité conidienne à l’aide de macrophages dérivés de mononucléaires du sang périphérique humain. (1 à 10) Dosage de phagocytose : Le T. stromaticum doit être cultivé en PDA, et les conidies sont récupérées en lavant la plaque avec du PBS. Les PBMC doivent être isolés par la méthode de la barrière de densité à l’aide du protocole décrit, cultivés dans des plaques à 24 puits avec des lamelles de verre rondes stériles pendant 7 jours pour la différenciation en macrophages, puis traités avec une inertie de 1 :10 avec différents intervalles de temps. Les lamelles de verre rondes sont retirées et colorées avec le kit de coloration, et les résultats sont analysés à l’aide de la microscopie optique. (1-8,11-13) Essai de viabilité des conidies : Après isolement, les PBMC sont cultivés dans des plaques à 24 puits sans lamelles de verre rondes pendant 7 jours pour la différenciation en macrophages, puis traités avec un moment d’inertie de 1 :10 pour différents intervalles de temps. Les cellules doivent être lysées par incubation avec de l’eau distillée ; la suspension est ensuite centrifugée, puis la pastille remise en suspension est plaquée en PDA pour analyser la cinétique de croissance de Trichoderma. Cette figure a été conçue à partir d’une base de données d’images. Veuillez cliquer ici pour voir une version agrandie de cette figure.
5. Test de viabilité conidiale après phagocytose
NOTA : Une figure du plan expérimental est fournie (Figure 1).
REMARQUE : Utilisez des plaques à 24 puits.
- Défiez les macrophages d’origine humaine avec des conidies de T. stromaticum .
- Répétez les étapes 4.1.2 à 4.1.8 pour différencier les monocytes et traiter les macrophages avec des conidies de T. stromaticum .
REMARQUE : N’utilisez pas de lamelles de verre rondes dans les puits. Utilisez les mêmes intervalles de temps que ceux utilisés pour doser la cinétique de phagocytose afin que la phagocytose puisse être corrélée à la viabilité conidiale. - Évaluer l’impact du milieu R10 sur la croissance de T. stromaticum en utilisant des puits avec la suspension préparée à l’étape 4.1.5 (milieu R10 + conidies) comme témoin.
- Répétez les étapes 4.1.2 à 4.1.8 pour différencier les monocytes et traiter les macrophages avec des conidies de T. stromaticum .
- Essai de viabilité conidique
- Retirer le milieu après chaque période d’incubation (3 h, 24 h, 48 h, 72 h, 96 h et 120 h) et laver les cellules deux fois avec du PBS pour éliminer les conidies qui n’ont pas été phagocytées.
REMARQUE : Le témoin contenant le milieu R10 + conidies ne doit pas être lavé. - Ajouter 0,5 mL d’eau distillée stérile dans chaque puits et incuber la plaque à 37 °C et 5 % de CO2 pendant 30 min. Après ce temps, observez la morphologie des cellules au microscope inversé pour vous assurer que les cellules ont été lysées.
- Récupérez la suspension et transférez-la dans des tubes de 1,5 ml. Centrifuger la suspension à l’aide d’une mini-centrifugeuse à 6 000 x g pendant 5 min à température ambiante.
- Jeter le surnageant avec précaution, remettre la pastille en suspension dans 10 μL d’eau distillée stérile et inoculer 10 μL de la suspension dans la plaque contenant du PDA à 28 °C dans l’obscurité.
- Préparer un témoin positif pour la croissance de T. stromaticum : Utiliser la suspension de conidies de T. stromaticum (étape 2.2) pour préparer une nouvelle suspension avec une concentration finale de 8 x 106 conidies/mL. Plaque 10 μL de cette suspension en PDA à 28 °C dans l’obscurité.
REMARQUE : 10 μL de cette suspension contiendront le même nombre de conidies (8 x 104) que celles utilisées pour infecter les macrophages dérivés de mononucléaires sanguins. La différence entre ce témoin positif et celui mentionné à l’étape 5.1.2 est que le témoin mentionné ci-dessus à l’étape 5.1.2 est utilisé pour évaluer l’impact possible du milieu R10 sur la croissance de Trichoderma au moment de la phagocytose. Ce contrôle positif à l’étape 5.2.5 utilisant la suspension de conidies de T. stromaticum recueillies dans le PBS représente un contrôle de la croissance de Trichoderma sans l’influence du milieu R10 pour refléter la façon dont le champignon se développe naturellement. À l’aide de ce contrôle, il est possible d’évaluer si le milieu R10 influence la croissance de Trichoderma . - Observez chaque jour la cinétique de croissance de T. stromaticum dans la PDA et photographiez la culture.
- Analyse : Deux points peuvent être utilisés pour évaluer les résultats : 1) le temps (en jours) nécessaire à la culture pour occuper toute la plaque de culture, et 2) le temps (en jours) jusqu’à l’apparition de la pigmentation verte caractéristique des conidies de T. stromaticum en culture.
- Retirer le milieu après chaque période d’incubation (3 h, 24 h, 48 h, 72 h, 96 h et 120 h) et laver les cellules deux fois avec du PBS pour éliminer les conidies qui n’ont pas été phagocytées.
6. Analyse statistique
- Utilisez un test de Kruskal-Wallis pour déterminer les différences statistiquement significatives entre les 8 groupes/traitements. Considérons p < 0,05 comme statistiquement significatif. Toutes les données sont présentées sous forme de moyennes ±écart-type (ET). Dans les figures, # indique une signification statistique à p < 0,05.
Access restricted. Please log in or start a trial to view this content.
Résultats
La technique impliquant la phagocytose des conidies fongiques par les macrophages est largement utilisée pour les études évaluant la modulation des réponses immunitaires contre les champignons. Nous avons utilisé la phagocytose des conidies de T. stromaticum pour évaluer la viabilité des conidies après phagocytose, puisque l’évasion de la phagocytose et la fuite des phagosomes sont des mécanismes de virulence fongique. Les chercheurs devraient effectuer ces techniques comme l’un des premiers essais...
Access restricted. Please log in or start a trial to view this content.
Discussion
Pour plusieurs agents pathogènes fongiques, y compris Aspergillus fumigatus, Cryptococcus, Candida albicans et d’autres, la phagocytose conidiale ou de levure est un processus clé qui permet d’étudier les événements cytoplasmiques et moléculaires dans les interactions macrophage-pathogène, ainsi que de déterminer l’heure de la mort des conidies internalisées14,39,40. La phagocytose est l...
Access restricted. Please log in or start a trial to view this content.
Déclarations de divulgation
Tous les auteurs ne déclarent aucun conflit d’intérêts.
Remerciements
Ce travail a été soutenu par les institutions financières brésiliennes suivantes : Fundação de Amparo à Pesquisa do Estado da Bahia (FAPESB) avec des subventions RED0011/2012 et RED008/2014. U.R.S., J.O.C. et M.E.S.M. reconnaissent la bourse accordée par le Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) et la FAPESB, respectivement.
Access restricted. Please log in or start a trial to view this content.
matériels
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tubes | Corning | CLS431470 | 15 mL centrifuge tubes, polypropylene, conical bottom with lid, individually sterile |
| 24-Well Flat Bottom Cell Culture Plate | Kasvi | K12-024 | Made of polystyrene with alphanumeric identification; The Cell Culture Plate is DNase, RNase and pyrogen-free and free of cytotoxic substances; Sterilized by gamma radiation; |
| Cell culture CO2 incubator | Sanyo | 303082 | A CO2 incubator serves to create and control conditions similar to a human body, thus allowing the in vitro growth and proliferation of different cell types. |
| Centrifuge Microtube (eppendorf type) 1.5 mL | Capp | 5101500 | Made from polypropylene, with a cap attached to the tube for opening and closing with just one hand. It has a polished interior against protein adhesion and for sample visibility, being free of DNase, RNase and Pyrogens |
| Circular coverslip 15 mm | Olen | K5-0015 | Circular coverslips are used for microscopy techniques in cell culture. Made of super transparent translucent glass; with thickness of 0.13 mm |
| Class II Type B2 (Total Exhaust) Biosafety Cabinets | Esco Lifesciences group | 2010274 | Airstream Class II Type B2 Biosafety Cabinets (AB2) provide product, operator and environmental protection and are suitable for work with trace amounts of toxic chemicals and agents assigned to biological safety levels I, II or III. In a Class II Type B2 cabinet, all inflow and downflow air is exhausted after HEPA/ULPA filtration to the external environment without recirculation across the work surface. |
| Dextrose Potato Agar medium | Merck | 145 | Potato Dextrose Agar is used in the cultivation and enumeration of yeasts and fungi |
| EDTA vacuum blood collection tube | FirstLab | FL5-1109L | EDTA is the recommended anticoagulant for hematology routines as it is the best anticoagulant for preserving cell morphology. |
| Entellan | Merck | 1.07961 | Fixative agent; Entellan is a waterless mounting medium for permanent mounting for microscopy. |
| Fetal Bovine Serum | Gibco | A2720801 | Fetal bovine serum (FBS) is a universal growth supplement of cell and tissue culture media. FBS is a natural cocktail of most of the factors required for cell attachment, growth, and proliferation, effective for most types of human and animal (including insect) cells. |
| Flaticon | database of images | ||
| Glycerol | Merck | 24900988 | The cryoprotectant agent glycerol is used for freezing cells and spores |
| Histopaque-1077 | polysucrose solution | ||
| Image J | Image analysis software | ||
| Microscopy slides | Precision | 7105 | Slide for Microscopy 26 x 76 mm Matte Lapped Thickness 1.0 to 1.2 mm. Made of special optical glass and packaged with silk paper divider with high quality transparency free of imperfections |
| Mini centrifuge | Prism | C1801 | The Prism Mini Centrifuge was designed to be extremely compact with an exceptionally small footprint. Includes 2 interchangeable quick-release rotors that spin up to 6000 rpm. An electronic brake provides quick deceleration and the self-opening lid allows easy access to the sample, reducing handling time. |
| Neubauer chamber | Kasvi | K5-0011 | The Neubauer Counting Chamber is used for counting cells or other suspended particles. |
| Panoptic fast | Laborclin | 620529 | Laborclin's panoptic fast c is a kit for quick staining in hematology |
| Penicillin/Streptomycin Solution - 10,000U | LGC- Biotechnology | BR3011001 | antibiotic is used in order to avoid possible contamination by manipulation external to the laminar flow. |
| Petri dish 90 x 15 mm Smooth | Cralplast | 18248 | Disposable Petri dish; Made of highly transparent polystyrene (PS); flat bottom; Smooth;Size: 90 x 15 mm. |
| Phosphate buffered saline (PBS) | thermo fisher Scientific | 10010001 | PBS is a water-based saline solution with a simple formulation. It is isotonic and non-toxic to most cells. It includes sodium chloride and phosphate buffer and is formulated to prevent osmotic shock while maintaining the water balance of living cells. |
| Pipette Pasteur 3 mL Sterile | Accumax | AP-3-B-S | STERILE ACCUMAX PASTEUR 3 ML PIPETTE with 3 mL capacity, made of transparent low-density polyethylene (LDPE) and individually sterile |
| Refrigerated Centrifuge | Thermo Scientific | TS-HM16R | The Thermo Scientific Heraeus Megafuge 16R Refrigerated Centrifuge is a refrigerated centrifuge with the user-friendly control panel makes it easy to pre-set the speed, RCF value, running time, temperature, and running profile. The Megafuge 16R can reach maximum speeds of 15,200 RPM and maximum RCF of 25,830 x g. |
| RPMI-1640 Medium | Merck | MFCD00217820 | HEPES Modification, with L-glutamine and 25 mM HEPES, without sodium bicarbonate, powder, suitable for cell culture |
| The single channel micropipettes | Eppendorf | Z683809 | Single-channel micropipettes are used to accurately transfer and measure very small amounts of liquids. |
| Tip for Micropipettor | Corning | 4894 | Capacity of 10 µL and 1,000 µL Autoclavable |
| Triocular inverted microscope | LABOMED | VU-7125500 | It allows you to observe cells inside tubes and bottles, without having to open them, thus avoiding contamination problems. |
Références
- Samuels, G. J. Trichoderma: A review of biology and systematics of the genus. Mycological Research. 100 (8), 923-935 (1996).
- Nevalainen, H., Peterson, R. Chapter 7 - Heterologous expression of proteins in Trichoderma. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Do Vale, L. H. F., Filho, E. X. F., Miller, R. N. G., Ricart, C. A. O., de Sousa, M. V. Chapter 16 - Cellulase systems in Trichoderma: An overview. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Ferreira, N. L., Margeot, A., Blanquet, S., Berrin, J. G. Chapter 17 - Use of cellulases from Trichoderma reesei in the twenty-first century part I: Current industrial uses and future applications in the production of second ethanol generation. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Puranen, T., Alapuranen, M., Vehmaanperä, J. Chapter 26 - Trichoderma enzymes for textile industries. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Kunamneni, A., Plou, F. J., Alcalde, M., Ballesteros, A. Chapter 24 - Trichoderma enzymes for food industries. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Mukherjee, P. K., Horwitz, B. A., Herrera-Estrella, A., Schmoll, M., Kenerley, C. M. Trichoderma research in the genome era. Annual Review of Phytopathology. 51 (1), 105-129 (2013).
- Mukherjee, M., et al. Trichoderma-plant-pathogen interactions: Advances in genetics of biological control. Indian Journal of Microbiology. 52 (4), 522-529 (2012).
- dos Santos, U. R., dos Santos, J. L. Trichoderma after crossing kingdoms: Infections in human populations. Journal of Toxicology and Environmental Health, Part B. 26 (2), 97-126 (2023).
- Asis, A., et al. Identification patterns of Trichoderma strains using morphological characteristics, phylogenetic analyses and lignocellulolytic activities. Molecular Biology Reports. 48 (4), 3285-3301 (2021).
- Antal, Z., et al. Comparative study of potential virulence factors in human pathogenic and saprophytic Trichoderma longibrachiatum strains. Acta Microbiologica et Immunologica Hungarica. 52 (3-4), 341-350 (2005).
- Hatvani, L., Manczinger, L., Vágvölgyi, C., Kredics, L. Trichoderma as a human pathogen. Trichoderma: Biology and Applications. Mukherjee, P. K., Horwitz, B. A., Singh, U. S., Mukherjee, M., Schmoll, M. , Wallingford, UK. (2013).
- Kredics, L., et al. Clinical importance of the genus Trichoderma: A review. Acta Microbiologica et Immunologica Hungarica. 50 (2-3), 105-117 (2003).
- Erwig, L. P., Gow, N. A. R. Interactions of fungal pathogens with phagocytes. Nature Reviews Microbiology. 14 (3), 163-176 (2016).
- Nicola, A. M., Casadevall, A. In vitro measurement of phagocytosis and killing of Cryptococcus neoformans by macrophages. Methods in Molecular Biology. 844, 189-197 (2012).
- Medina, E., Goldmann, O. In vivo and ex vivo protocols for measuring the killing of extracellular pathogens by macrophages. Current Protocols in Immunology. , Chapter 14, Unit 14 1-17 (2011).
- Drevets, D. A., Canono, B. P., Campbell, P. A. Measurement of bacterial ingestion and killing by macrophages. Current Protocols in Immunology. 109, 1-17 (2015).
- Gresnigt, M. S., et al. Differential kinetics of Aspergillus nidulans and Aspergillus fumigatus phagocytosis. Journal of Innate Immunity. 10 (2), 145-160 (2018).
- Steinberg, B. E., Grinstein, S. Analysis of macrophage phagocytosis: Quantitative assays of phagosome formation and maturation using high-throughput fluorescence microscopy. Methods in Molecular Biology. 531, 45-56 (2009).
- Yan, Q., Ahn, S. H., Fowler, V. G. Macrophage phagocytosis assay of Staphylococcus aureus by flow cytometry. Bio-Protocol. 5 (4), 1406(2015).
- Marr, K. A., Koudadoust, M., Black, M. Early events in macrophage killing of Aspergillus fumigatus conidia New flow cytometric viability assay. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1240-1247 (2001).
- Surewaard, B. G. J., Kubes, P. Measurement of bacterial capture and phagosome maturation of Kupffer cells by intravital microscopy. Methods. 128, 12-19 (2017).
- Siggins, M. K., et al. Differential timing of antibody-mediated phagocytosis and cell-free killing of invasive African Salmonella allows immune evasion. European Journal of Immunology. 44 (4), 1093-1098 (2014).
- Cannon, G. J., Swanson, J. A. The macrophage capacity for phagocytosis. Journal of Cell Science. 101 (4), 907-913 (1992).
- Harvath, L., Terle, D. A. Assay for phagocytosis. Methods in Molecular Biology. 115, 281-290 (1999).
- dos Santos, A. G., et al. Trichoderma asperelloides spores downregulate dectin1/2 and TLR2 receptors of mice macrophages and decrease Candida parapsilosis phagocytosis independent of the M1/M2 polarization. Frontiers in Microbiology. 8, 1681(2017).
- Souza, J. A. M., et al. Characterization of Aspergillus fumigatus extracellular vesicles and their effects on macrophages and neutrophils functions. Frontiers in Microbiology. 10, 2008(2019).
- Oliveira-Mendonça, L. S., et al. Inhibition of extracellular traps by spores of Trichoderma stromaticum on neutrophils obtained from human peripheral blood. Molecular Immunology. 141, 43-52 (2022).
- Oliveira-Mendonça, L. S., et al. Trichoderma stromaticum spores induce autophagy and downregulate inflammatory mediators in human peripheral blood-derived macrophages. Current Research in Microbial Sciences. 3, 100145(2022).
- Johnston, L., Harding, S. A., La Flamme, A. C. Comparing methods for ex vivo characterization of human monocyte phenotypes and in vitro responses. Immunobiology. 220 (12), 1305-1310 (2015).
- Abedon, S. T., Bartom, E. Multiplicity of infection. Brenner's Encyclopedia of Genetics. Second Edition. Maloy, S., Hughes, K. , Academic Press. Cambridge, MA. (2013).
- Rios, F. J., Touyz, R. M., Montezano, A. C. Isolation and differentiation of human macrophages. Methods in Molecular Biology. 1527, 311-320 (2017).
- Lombard, Y., Giaimis, J., Makaya-Kumba, M., Fonteneau, P., Poindron, P. A new method for studying the binding and ingestion of zymosan particles by macrophages. Journal of Immunological Methods. 174 (1-2), 155-165 (1994).
- Ghoneum, M., Gollapudi, S. Phagocytosis of Candida albicans by metastatic and non metastatic human breast cancer cell lines in vitro. Cancer Detection and Prevention. 28 (1), 17-26 (2004).
- Nunes, J. P. S., Dias, A. A. M. ImageJ macros for the user-friendly analysis of soft-agar and wound-healing assays. BioTechniques. 62 (4), 175-179 (2017).
- Alves-Filho, E. R., et al. The biocontrol fungus Trichoderma stromaticum downregulates respiratory burst and nitric oxide in phagocytes and IFN-gamma and IL-10. Journal of Toxicology and Environmental Health - Part A: Current Issues. 74 (14), 943-958 (2011).
- Slesiona, S., et al. Persistence versus escape: Aspergillus terreus and Aspergillus fumigatus employ different strategies during interactions with macrophages. PLoS One. 7 (2), 31223(2012).
- Johnston, S. A., May, R. C. Cryptococcus interactions with macrophages: Evasion and manipulation of the phagosome by a fungal pathogen. Cellular Microbiology. 15 (3), 403-411 (2013).
- Alonso, M. F., et al. The nature of the fungal cargo induces significantly different temporal programmes of macrophage phagocytosis. The Cell Surface. 8, 100082(2022).
- Brakhage, A. A., Bruns, S., Thywissen, A., Zipfel, P. F., Behnsen, J. Interaction of phagocytes with filamentous fungi. Current Opinion in Microbiology. 13 (4), 409-415 (2010).
- Dos Santos, U. R., et al. Exposition to biological control agent Trichoderma stromaticum increases the development of cancer in mice injected with murine melanoma. Frontiers in Cellular and Infection Microbiology. 10, 252(2020).
- Wang, G., et al. Exopolysaccharide from Trichoderma pseudokoningii induces macrophage activation. Carbohydrate Polymers. 149, 112-120 (2016).
- Xu, Y., et al. Exopolysaccharide from Trichoderma pseudokoningii promotes maturation of murine dendritic cells. International Journal of Biological Macromolecules. 92, 1155-1161 (2016).
- Schmoll, M., Esquivel-Naranjo, E. U., Herrera-Estrella, A. Trichoderma in the light of day - Physiology and development. Fungal Genetics and Biology. 47 (11), 909-916 (2010).
- Zhang, G., Li, D. Trichoderma longibrachiatum-associated skin inflammation and atypical hyperplasia in mouse. Frontiers in Medicine. 9, 865722(2022).
- Paredes, K., Capilla, J., Mayayo, E., Guarro, J. Virulence and experimental treatment of Trichoderma longibrachiatum, a fungus refractory to treatment. Antimicrobial Agents and Chemotherapy. 60 (8), 5029-5032 (2016).
- Perkhofer, S., Speth, C., Dierich, M. P., Lass-Flörl, C. In vitro determination of phagocytosis and intracellular killing of Aspergillus species by mononuclear phagocytes. Mycopathologia. 163 (6), 303-307 (2007).
Access restricted. Please log in or start a trial to view this content.
Réimpressions et Autorisations
Demande d’autorisation pour utiliser le texte ou les figures de cet article JoVE
Demande d’autorisationExplorer plus d’articles
This article has been published
Video Coming Soon