É necessária uma assinatura da JoVE para visualizar este conteúdo. Faça login ou comece sua avaliação gratuita.
Method Article
Ensaio de viabilidade de conídios de Trichoderma stromaticum dentro de macrófagos mononucleares derivados do sangue periférico humano
* Estes autores contribuíram igualmente
Neste Artigo
Resumo
A técnica envolvendo a fagocitose de conídios fúngicos por macrófagos é amplamente utilizada para estudos avaliando a modulação da resposta imune contra fungos. O objetivo deste artigo é apresentar um método para avaliar a fagocitose e a capacidade de depuração de macrófagos mononucleares de sangue periférico humano estimulados com conídios de Trichoderma stromaticum .
Resumo
Os macrófagos representam uma linha de defesa crucial e são responsáveis por prevenir o crescimento e a colonização de patógenos em diferentes tecidos. A fagocitose de conídios é um processo chave que permite a investigação dos eventos citoplasmáticos e moleculares envolvidos nas interações macrófagos-patógenos, bem como a determinação do tempo de morte de conídios internalizados. A técnica envolvendo a fagocitose de conídios fúngicos por macrófagos é amplamente utilizada para estudos avaliando a modulação da resposta imune contra fungos. A evasão da fagocitose e o escape dos fagossomos são mecanismos de virulência fúngica. Neste trabalho, relatamos os métodos que podem ser utilizados para a análise da fagocitose, depuração e viabilidade de conídios de T. stromaticum , um fungo que é usado como agente de biocontrole e biofertilizante e é capaz de induzir infecções humanas. O protocolo consiste em: 1) cultura de Trichoderma , 2) lavagem para obtenção de conídios, 3) isolamento de células mononucleares do sangue periférico (CMSP) pelo método da solução de polissacarose e diferenciação das CMSP em macrófagos, 4) método de fagocitose in vitro utilizando lamínulas de vidro redondo e coloração, e 5) ensaio de depuração para avaliar a viabilidade dos conídios após fagocitose dos conídios. Em resumo, essas técnicas podem ser usadas para medir a eficiência da depuração fúngica de macrófagos.
Introdução
O gênero Trichoderma (Ordem: Hypocreales, Família: Hypocreaceae) é composto por fungos ubíquos e saprofíticos, parasitas de outras espécies fúngicas e capazes de produzir uma variedade de enzimas comercialmente úteis1. Essas espécies fúngicas são utilizadas para a produção de proteínas heterólogas2, produção de celulose3, etanol, cerveja, vinho e papel4, na indústria têxtil5, na indústria alimentícia6 e na agricultura como agentes de controle biológico 7,8. Além do interesse industrial nessas espécies fúngicas, o crescente número de infecções em humanos tem conferido a algumas espécies de Trichoderma o status de patógenos oportunistas9.
cresce rapidamente em cultura, com colônias inicialmente brancas e cotonosas que se tornam amarelo-esverdeadas a verde-escuras10. Eles são adaptados para viver em uma ampla gama de condições de pH e temperatura, e as espécies oportunistas são capazes de sobreviver a pH e temperaturas fisiológicas e, assim, colonizar diferentes tecidos humanos 11,12,13. É importante ressaltar que o aumento na taxa de infecção de Trichoderma spp pode estar associado a fatores de virulência, que não são bem estudados. Além disso, estudos focados no entendimento da resposta imune contra espécies oportunistas de Trichoderma ainda são escassos.
Durante uma infecção, juntamente com os neutrófilos, os macrófagos representam a linha de defesa responsável pela fagocitose e, assim, impedem o crescimento e a colonização de patógenos em diferentes tecidos. Utilizando receptores de reconhecimento padrão, como receptores Toll-like e receptores de lectina tipo C, os macrófagos fagocitam fungos e os processam em fagolisossomos, promovendo burst respiratório, liberação de citocinas pró-inflamatórias e destruição dos microrganismos fagocitados14. O mecanismo de fagocitose, entretanto, pode ser afetado e evitado por diferentes estratégias microbianas, tais como o tamanho e a forma das células fúngicas; a presença de cápsulas que dificultam a fagocitose; diminuição do número de receptores indutores de fagocitose; a remodelação da estrutura das fibras de actina no citoplasma; dificultar a formação de pseudopódios; e escape do fagossomo ou fagolisossomo após o processo de fagocitose14.
Muitos patógenos, incluindo o Cryptococcus neoformans, utilizam macrófagos como nicho para sobreviver no hospedeiro, disseminar e induzir infecção15. O ensaio de fagocitose e depuração é utilizado para avaliar a resposta imune contra patógenos e identificar as estratégias microbianas empregadas para evadir o sistema imune inato 15,16,17. Esse tipo de técnica também pode ser usado para examinar a cinética diferencial de fagocitose, acidificação retardada do fagossomo e explosão oxidativa que resultam em redução da morte fúngica18.
Diferentes métodos podem ser utilizados para avaliar a fagocitose, a sobrevivência fúngica e a evasão do processo de maturação do fagossomo. Entre elas estão a microscopia de fluorescência, que é utilizada para observar a fagocitose, a localização celular e as moléculas produzidas durante a fagocitose19; a citometria de fluxo, que fornece dados quantitativos sobre a fagocitose e é utilizada para avaliar os diferentes marcadores envolvidos noprocesso20,21; microscopia intravital, que é utilizada para avaliar a captura microbiana e a maturação dofagossomo22; fagocitose mediada por anticorpos, que é usada para avaliar a especificidade do processo de fagocitose para um patógeno23; e outros 24,25,26,27.
O protocolo aqui apresentado emprega um método comum, de baixo custo e direto, usando microscópio óptico e ensaio de crescimento em placa para avaliar a fagocitose e a morte de conídios fúngicos. Este protocolo fornecerá aos leitores instruções passo a passo para a realização do ensaio de fagocitose e depuração utilizando macrófagos mononucleares de sangue periférico humano expostos ao T. stromaticum. As CMSP foram utilizadas porque os conídios de Trichoderma são aplicados como biocontrole contra fitopatógenos e biofertilizante para culturas vegetais em todo o mundo e têm causado diversas infecções humanas, denominadas Tricodermoses. Além disso, existem apenas dois trabalhos anteriores enfocando a interação entre conídios de Trichoderma e o sistema imunológico humano, nos quais examinamos neutrófilos28 e autofagia em macrófagos29. Este artigo mostra primeiramente como a fagocitose dos conídios de T. stromaticum por macrófagos derivados de CMSP pode ser estudada e, em seguida, como a viabilidade dos conídios engolidos pode ser avaliada usando técnicas simples baseadas em microscopia. Esse protocolo pode facilitar ainda mais as investigações sobre a resposta imune associada a macrófagos ou mecanismos relacionados à modulação do sistema imune.
Access restricted. Please log in or start a trial to view this content.
Protocolo
Considerações éticas e sujeitos humanos
Todos os experimentos com humanos descritos neste estudo foram conduzidos de acordo com a Declaração de Helsinque e as leis federais brasileiras e aprovados pelo Comitê de Ética da Universidade Estadual de Santa Cruz (código de identificação do projeto: 550.382/ 2014).
O sangue periférico humano foi coletado de voluntários saudáveis da cidade de Ilhéus, Bahia, Brasil, não expostos a atividades ocupacionais relacionadas ao fungo estudado. Foram excluídos os indivíduos com condições médicas de saúde referidas ou em uso de medicamentos. Todos os sujeitos concordaram voluntariamente em participar e assinaram o termo de consentimento livre e esclarecido antes de sua inclusão neste estudo.
1. Preparação dos reagentes e soluções
NOTA: Prepare os seguintes reagentes e soluções antes de prosseguir. Consulte a Tabela de Materiais (TOM) para obter as informações sobre o reagente e o fornecedor do material.
- Preparar uma solução salina estéril balanceada tamponada com fosfato 1x (PBS).
OBS: Neste protocolo, não foi utilizada PBS livre de endotoxina. - Preparar meio de batata-dextrose ágar (PDA) e despejar 20 mL em cada placa de Petri para a cultura de T. stromaticum . Preparar seis placas com BDA para cada doador e utilizar uma placa para cada condição: 3 h, 24 h, 48 h, 72 h, 96 h e 120 h. Além disso, utilizar três placas para cada controle: três para o controle Trichoderma e três para o controle do meio R10. Use placas de Petri de 60 mm x 15 mm ou 100 mm x 15 mm para uma ótima recuperação de conídios.
- Esterilizar 100% glicerol.
- Preparar meio R10 para cultura celular: meio RPMI suplementado com 10% de soro fetal bovino e 1% de antibiótico (penicilina/estreptomicina).
- Esterilizar água destilada para a lise celular.
- Preparar água em pH 7,0 para o processo de coloração.
NOTA: Se necessário, ajustar o pH utilizando um medidor de pH e soluções de NaOH 0,1 M/L e HCl 0,1 M/L. - Esterilizar lamínula de vidro redonda (13 mm) e pinças.
2. Cultura e processamento de Trichoderma stromaticum
- Preparação de um porta-mãe (M1) de T. stromaticum:
NOTA: É necessária uma matriz-mãe (M1) para garantir que todas as experiências são feitas a partir da cultura da mesma geração fresca (F1).- Cultivar um inóculo de T. stromaticum em placas de Petri com PCA a 28 °C no escuro por 7-10 dias até que os conídios sejam observados e a cultura fique verde.
- Lave a cultura de T. stromaticum. Adicionar 3-5 mL de PBS à superfície de cultura usando uma pipeta. Recolher o PBS da placa e novamente distribuí-lo sobre a cultura para remover gradualmente os conídios usando a pipeta. Repita esse processo o quanto for necessário até que a suspensão fique verde escura.
NOTA: Alternativamente, sugere-se uma lavagem suave da cultura adicionando 3-5 mL de PBS à placa seguida da realização de um movimento circular até que a suspensão fique verde para recuperar os conídios. Com pipetagem repetida, mais conídios podem ser coletados. - Transfira a suspensão recuperada da placa para um tubo estéril de 15 mL com uma pipeta. Repita as etapas 2.1.2-2.1.3 quantas vezes forem necessárias para obter mais conídios.
- Centrifugar a suspensão a 1.160 x g por 5 min a 12 °C e ressuspender o pellet em 5 mL de PBS. Repetir este passo (2.1.4) três vezes para obter uma suspensão sem hifas.
NOTA: Para ressuspender o pellet corretamente, após a centrifugação, recomenda-se um breve vórtice. - Ressuspender o pellet final em 2-3 mL de PBS e contar os conídios em câmara de Neubauer usando uma diluição de 1:100 ou 1:1.000.
NOTA: Em condições ótimas, uma concentração final de 2 x 108 conídios/mL pode ser recuperada da cultura. A avaliação da viabilidade dos conídios pelo método de exclusão do azul de tripano é opcional. - Aliquotar a suspensão em tubos estéreis de 1,5 ml, adicionando 0,5 ml da suspensão de conídios (do passo 2.1.5) a cada tubo. Em seguida, adicionar 0,5 mL de glicerol estéril a 100% para obter os estoques de M1. Vórtice brevemente, identifique os tubos e armazene a -20 °C ou -80 °C.
- Cultura de T. stromaticum e obtenção de conídios para o experimento
- Placa 10 μL da suspensão M1 (preparada na etapa 2.1) em BDA a 28 °C no escuro por 7-10 dias até que os conídios sejam observados e a cultura fique verde para obter a nova geração de F1.
NOTA: Para garantir uma cultura fresca de T. stromaticum para o experimento, avaliar o tempo necessário para o crescimento do fungo e o tempo necessário para a diferenciação de macrófagos. - Colete os conídios, repetindo as etapas 2.1.2-2.1.4.
- Ressuspender o pellet final em 2-3 mL de PBS. Avaliar a viabilidade dos conídios usando o método de exclusão do azul de tripano ou contar os conídios conforme mencionado na etapa 2.1.5.
- Placa 10 μL da suspensão M1 (preparada na etapa 2.1) em BDA a 28 °C no escuro por 7-10 dias até que os conídios sejam observados e a cultura fique verde para obter a nova geração de F1.
3. Isolamento de células mononucleares do sangue periférico (CMSP)
NOTA: As CMSP são obtidas pelo método de barreira de densidade utilizando uma solução de polissarosese de densidade 1,077 g/mL30.
- Alíquota de 15 mL da solução de polissacarose para um tubo de 50 mL para cada amostra doadora que será coletada.
- Coletar 20 mL de sangue de cada doador utilizando três a quatro tubos de EDTA. Recrutar um mínimo de quatro doadores por experimento. Não acumular o sangue dos doadores; em vez disso, use cada amostra separadamente como uma réplica biológica. Para cada doador, transferir o sangue para um tubo de 50 mL e adicionar PBS para obter um volume final de 35 mL.
- Transferir lentamente a suspensão de sangue (passo 3.2) ao longo da parede do tubo que contém a solução de polissarose, (passo 3.1), formando uma suspensão bifásica.
NOTA: Para evitar a mistura do sangue com a solução de polissacarose, adicione o sangue lentamente. Recomenda-se o uso de um mínimo de 7 mL de sangue de cada doador para o isolamento das CMSP. - Centrifugar imediatamente o tubo contendo a suspensão bifásica a 1.600 x g por 30 min a 24 °C. Programe a centrifugação dos PBMCs: use aceleração 1 e desaceleração 0 para evitar uma parada abrupta da centrifugação.
- Observe a formação de um anel branco contendo as CMSP após a centrifugação. As hemácias e granulócitos residem na camada inferior, a camada seguinte contém a solução de polissarose, e as CMSP residem no anel branco entre a solução de polisacarose e o plasma (camada superior). Recolher o anel branco aspirando suavemente com uma pipeta ou uma pipeta Pasteur estéril para não apanhar glóbulos vermelhos, plasma ou solução de polissarose, e transferir para um tubo de 15 ml.
- Adicione PBS ao tubo de 15 mL contendo as PBMCs para obter um volume final de 10 mL. Homogeneizar a suspensão e centrifugar o tubo a 1.600 x g por 30 min a 24 °C.
- Lavar as células três vezes a 1.600 x g por 5 min a 24 °C com 10 mL de PBS. Em seguida, ressuspenda o pellet final em 2 mL de meio R10.
- Avaliar a viabilidade celular usando o método de exclusão do azul de tripano e contar as células em uma câmara de Neubauer.
4. Cinética da fagocitose
NOTA: Os macrófagos mononucleares derivados do sangue periférico humano são tratados com conídios de T. stromaticum em uma multiplicidade de infecção (MOI) de 1:10 ou apenas meio R10 como controle. A multiplicidade de infecção (MOI) representa a razão dos agentes infecciosos adicionados aos alvos de infecção e é apresentada em números absolutos: MOI = agentes:alvos31. Aqui, usamos 1 conídio de T. stromaticum (agente) para 10 macrófagos (alvos). Em seguida, as células são incubadas a 37 °C e 5% CO2 por diferentes períodos de tempo (3 h, 24 h, 48 h, 72 h, 96 h e 120 h). Em seguida, uma lamínula de vidro redonda é usada para visualizar os macrófagos aderentes envolvidos no processo de fagocitose sob um microscópio. Uma figura de planejamento experimental é fornecida (Figura 1).
OBS: Sugere-se o uso de placas de 24 poços.
- Tratamento de macrófagos humanos com conídios de T. stromaticum
- Adicione uma tampa de vidro redonda estéril (13 mm) a cada poço usando uma pinça estéril.
- Ajustar o volume da suspensão celular obtido nas etapas 3,7-3,8 para placa 8 x 105 células por poço para um volume final de 1 mL com meio R10. Use um microscópio invertido para avaliar a morfologia celular.
NOTA: As células devem estar suspensas no meio e ter uma morfologia arredondada. - Incubar as células a 37 °C sob atmosfera de 5% de CO2 por 7 dias e substituir o meio por meio R10 fresco a cada 2 dias para diferenciação dos monócitos em macrófagos32. Observe a morfologia celular usando um microscópio invertido. Os macrófagos apresentarão morfologia fusiforme, com formas achatadas e estendidas; Pode-se observar aumento da razão citoplasmática e presença de pseudópodes. Procure macrófagos mononucleares aderentes.
NOTA: Uma proporção muito pequena de monócitos indiferenciados pode permanecer suspensa no meio. - Retire o meio de cada poço usando uma pipeta e lave as células com 1 mL de PBS para remover detritos e células não aderentes.
- Utilizar a suspensão preparada na etapa 2.2 para preparar uma nova suspensão de conídios de T. stromaticum numa concentração final de 8 x 104 conídios/ml em meio R10.
- Adicionar 1 mL da suspensão de conídios preparada na etapa 4.1.5 a cada poço de tratamento (3 h, 24 h, 48 h, 72 h, 96 h e 120 h) para obter um MOI de 1:10. Aos controles, adicionar apenas 1 mL de meio R10 ao poço.
- Desafiar os macrófagos por 3 h com conídios de T. stromaticum a 37 °C sob atmosfera de 5% de CO2 . Após 3 h, remova o meio e lave as células para remover os conídios não fagocitados.
- Adicionar 1 mL de meio R10 a cada poço e incubar a placa por diferentes tempos (3 h, 24 h, 48 h, 72 h, 96 h e 120 h) a 37 °C sob atmosfera de 5% de CO2 .
- Coloração e análise
- Retirar o meio de cada poço após a conclusão da incubação correspondente (passo 4.1.8) e adicionar 1 ml de PBS a esse poço.
- Remova as tampas de vidro redondas dos poços usando pinças estéreis e uma agulha para colorir com um kit de coloração.
NOTA: Alternativamente, a coloração pode ser feita usando a coloração May Grünwald-Giemsa33. - A cada uma das lamínulas de vidro redondo, adicione fixador de manchas (5 s), corante 1 (5 s), corante 2 (2 s) e água tamponada pH 7,0 (5 s), que são os componentes do kit de coloração. Aguarde até que estejam secos e fixe as lamínulas em uma lâmina de vidro usando o agente de montagem.
- Quantificar o resultado: Contar um total de 100 macrófagos (Mø) para cada condição de tempo. Usando um microscópio óptico, conte o número de macrófagos com conídios fagocitados usando uma objetiva de 100x e óleo de imersão (equação [1]).
 (1º)
(1º) - Obter o número de conídios fagocitados por macrófago: Correlacionar os conídios presentes em 100 macrófagos dividido pelo número de macrófagos com pelo menos um conídio fagocitado (equação [2])34.
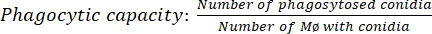 (2º)
(2º)
NOTA: Para avaliar e contar os conídios, pode-se utilizar o software ImageJ35. - Fotografar a fagocitose de cada amostra e condição de tempo usando objetivas de 40x e 100x para apresentar os resultados.
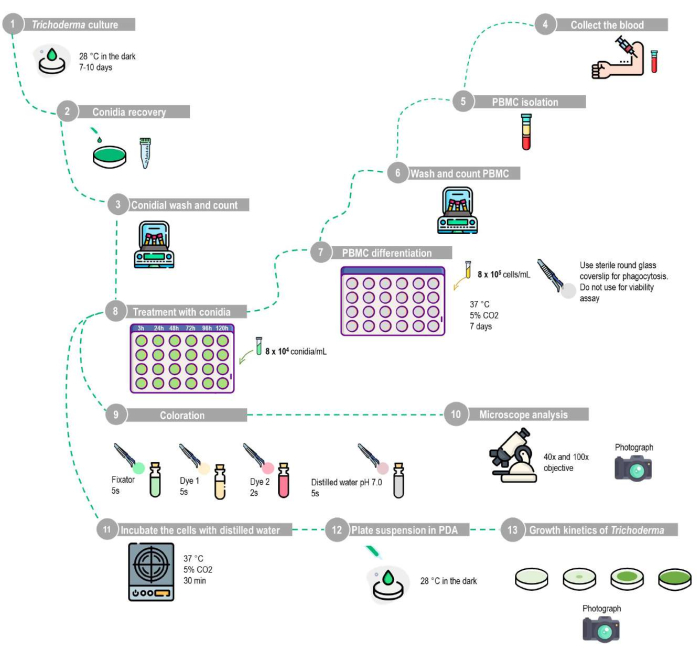
Figura 1: Representação esquemática da fagocitose e ensaio de viabilidade conidial utilizando macrófagos mononucleares derivados do sangue periférico humano. (1-10) Ensaio de fagocitose: O T. stromaticum deve ser cultivado em PCA, e os conídios são recuperados pela lavagem da placa com PBS. As CMSP devem ser isoladas pelo método de barreira de densidade usando o protocolo descrito, cultivadas em placas de 24 poços com lamínulas de vidro redondas estéreis por 7 dias para diferenciação em macrófagos e, em seguida, tratadas com MOI de 1:10 com diferentes intervalos de tempo. As lamínulas de vidro redondo são removidas e coradas com o kit de coloração, e os resultados são analisados por microscopia de luz. (1-8,11-13) Ensaio de viabilidade dos conídios: Após o isolamento, as CMSP são cultivadas em placas de 24 poços sem lamínulas redondas de vidro por 7 dias para diferenciação em macrófagos e, em seguida, tratadas com MOI de 1:10 para diferentes intervalos de tempo. As células devem ser lisadas por incubação com água destilada; a suspensão é então centrifugada e, em seguida, o pellet ressuspendido é plaqueado em BDA para analisar a cinética de crescimento de Trichoderma. Esta figura foi desenhada utilizando um banco de imagens. Clique aqui para ver uma versão maior desta figura.
5. Ensaio de viabilidade dos conídios após fagocitose
NOTA: Uma figura de planejamento experimental é fornecida (Figura 1).
NOTA: Use placas de 24 poços.
- Desafiar os macrófagos derivados do homem com conídios de T. stromaticum .
- Repita os passos 4.1.2-4.1.8 para diferenciar os monócitos e tratar os macrófagos com conídios de T. stromaticum .
OBS: Não utilize tampas de vidro redondas nos poços. Utilizar os mesmos intervalos de tempo utilizados para determinar a cinética da fagocitose para que a fagocitose possa ser correlacionada com a viabilidade conidial. - Avaliar o impacto do meio R10 no crescimento de T. stromaticum utilizando poços com a suspensão preparada na etapa 4.1.5 (meio R10 + conídios) como controle.
- Repita os passos 4.1.2-4.1.8 para diferenciar os monócitos e tratar os macrófagos com conídios de T. stromaticum .
- Ensaio de viabilidade conidial
- Remover o meio após cada período de incubação (3 h, 24 h, 48 h, 72 h, 96 h e 120 h) e lavar as células duas vezes com PBS para remover os conídios que não foram fagocitados.
NOTA: O controle contendo meio R10 + conídios não deve ser lavado. - Adicionar 0,5 mL de água destilada estéril a cada poço e incubar a placa a 37 °C e 5% CO2 por 30 min. Após esse tempo, observe a morfologia celular em microscópio invertido para garantir que as células tenham sido lisadas.
- Recolher a suspensão e transferi-la para tubos de 1,5 ml. Centrifugar a suspensão usando uma mini centrífuga a 6.000 x g por 5 min à temperatura ambiente.
- Eliminar cuidadosamente o sobrenadante, ressuspender o pellet em 10 μL de água destilada estéril e inocular 10 μL da suspensão na placa contendo PDA a 28 °C no escuro.
- Preparar um controlo positivo para o crescimento de T. stromaticum : Utilizar a suspensão de conídios de T. stromaticum (passo 2.2) para preparar uma nova suspensão com uma concentração final de 8 x 106 conídios/ml. Placa 10 μL desta suspensão em PDA a 28 °C no escuro.
NOTA: 10 μL desta suspensão conterá o mesmo número de conídios (8 x 104) que foi utilizado para infectar os macrófagos derivados mononucleares do sangue. A diferença entre este controle positivo e o mencionado no passo 5.1.2 é que o controle mencionado acima no passo 5.1.2 é usado para avaliar o possível impacto do meio R10 no crescimento de Trichoderma durante o tempo de fagocitose. Este controle positivo na etapa 5.2.5 utilizando a suspensão de conídios de T. stromaticum coletados em PBS representa um controle para o crescimento de Trichoderma sem a influência do meio R10 para refletir como o fungo cresce naturalmente. Com esse controle, é possível avaliar se o meio R10 influencia o crescimento de Trichoderma . - Observe a cinética de crescimento de T. stromaticum em PCA todos os dias e fotografe a cultura.
- Análise: Dois pontos podem ser utilizados para avaliar os resultados: 1) o tempo (em dias) necessário para que a cultura ocupe toda a placa de cultura e 2) o tempo (em dias) até o aparecimento da pigmentação verde característica dos conídios de T. stromaticum em cultura.
- Remover o meio após cada período de incubação (3 h, 24 h, 48 h, 72 h, 96 h e 120 h) e lavar as células duas vezes com PBS para remover os conídios que não foram fagocitados.
6. Análise estatística
- Utilizar o teste de Kruskal-Wallis para determinar diferenças estatisticamente significativas entre os 8 grupos/tratamentos. Considere-se p < 0,05 como estatisticamente significante. Todos os dados são apresentados como média ± desvio padrão (DP). Nas figuras, # indica significância estatística com p < 0,05.
Access restricted. Please log in or start a trial to view this content.
Resultados
A técnica envolvendo a fagocitose de conídios fúngicos por macrófagos é amplamente utilizada para estudos avaliando a modulação da resposta imune contra fungos. Utilizamos a fagocitose de conídios de T. stromaticum para avaliar a viabilidade dos conídios após fagocitose, uma vez que a evasão da fagocitose e o escape dos fagossomos são mecanismos de virulência fúngica. Os pesquisadores devem realizar essas técnicas como um dos primeiros ensaios ao investigar uma espécie de interesse clínico.
...Access restricted. Please log in or start a trial to view this content.
Discussão
Para vários patógenos fúngicos, incluindo Aspergillus fumigatus, Cryptococcus, Candida albicans e outros, a fagocitose de conídios ou leveduras é um processo chave que permite a investigação de eventos citoplasmáticos e moleculares nas interações macrófagos-patógenos, bem como a determinação do tempo de morte dos conídios internalizados 14,39,40. A fagocitose é o processo-chave na inter...
Access restricted. Please log in or start a trial to view this content.
Divulgações
Todos os autores declaram não haver conflitos de interesse.
Agradecimentos
Este trabalho foi financiado pelas seguintes instituições financeiras brasileiras: Fundação de Amparo à Pesquisa do Estado da Bahia (FAPESB) com processos RED0011/2012 e RED008/2014. U.R.S., J.O.C. e M.E.S.M. reconhecem a bolsa concedida pela Coordenação de Aperfeiçoamento de Pessoal de Nível Superior (CAPES) e FAPESB, respectivamente.
Access restricted. Please log in or start a trial to view this content.
Materiais
| Name | Company | Catalog Number | Comments |
| 15 mL centrifuge tubes | Corning | CLS431470 | 15 mL centrifuge tubes, polypropylene, conical bottom with lid, individually sterile |
| 24-Well Flat Bottom Cell Culture Plate | Kasvi | K12-024 | Made of polystyrene with alphanumeric identification; The Cell Culture Plate is DNase, RNase and pyrogen-free and free of cytotoxic substances; Sterilized by gamma radiation; |
| Cell culture CO2 incubator | Sanyo | 303082 | A CO2 incubator serves to create and control conditions similar to a human body, thus allowing the in vitro growth and proliferation of different cell types. |
| Centrifuge Microtube (eppendorf type) 1.5 mL | Capp | 5101500 | Made from polypropylene, with a cap attached to the tube for opening and closing with just one hand. It has a polished interior against protein adhesion and for sample visibility, being free of DNase, RNase and Pyrogens |
| Circular coverslip 15 mm | Olen | K5-0015 | Circular coverslips are used for microscopy techniques in cell culture. Made of super transparent translucent glass; with thickness of 0.13 mm |
| Class II Type B2 (Total Exhaust) Biosafety Cabinets | Esco Lifesciences group | 2010274 | Airstream Class II Type B2 Biosafety Cabinets (AB2) provide product, operator and environmental protection and are suitable for work with trace amounts of toxic chemicals and agents assigned to biological safety levels I, II or III. In a Class II Type B2 cabinet, all inflow and downflow air is exhausted after HEPA/ULPA filtration to the external environment without recirculation across the work surface. |
| Dextrose Potato Agar medium | Merck | 145 | Potato Dextrose Agar is used in the cultivation and enumeration of yeasts and fungi |
| EDTA vacuum blood collection tube | FirstLab | FL5-1109L | EDTA is the recommended anticoagulant for hematology routines as it is the best anticoagulant for preserving cell morphology. |
| Entellan | Merck | 1.07961 | Fixative agent; Entellan is a waterless mounting medium for permanent mounting for microscopy. |
| Fetal Bovine Serum | Gibco | A2720801 | Fetal bovine serum (FBS) is a universal growth supplement of cell and tissue culture media. FBS is a natural cocktail of most of the factors required for cell attachment, growth, and proliferation, effective for most types of human and animal (including insect) cells. |
| Flaticon | database of images | ||
| Glycerol | Merck | 24900988 | The cryoprotectant agent glycerol is used for freezing cells and spores |
| Histopaque-1077 | polysucrose solution | ||
| Image J | Image analysis software | ||
| Microscopy slides | Precision | 7105 | Slide for Microscopy 26 x 76 mm Matte Lapped Thickness 1.0 to 1.2 mm. Made of special optical glass and packaged with silk paper divider with high quality transparency free of imperfections |
| Mini centrifuge | Prism | C1801 | The Prism Mini Centrifuge was designed to be extremely compact with an exceptionally small footprint. Includes 2 interchangeable quick-release rotors that spin up to 6000 rpm. An electronic brake provides quick deceleration and the self-opening lid allows easy access to the sample, reducing handling time. |
| Neubauer chamber | Kasvi | K5-0011 | The Neubauer Counting Chamber is used for counting cells or other suspended particles. |
| Panoptic fast | Laborclin | 620529 | Laborclin's panoptic fast c is a kit for quick staining in hematology |
| Penicillin/Streptomycin Solution - 10,000U | LGC- Biotechnology | BR3011001 | antibiotic is used in order to avoid possible contamination by manipulation external to the laminar flow. |
| Petri dish 90 x 15 mm Smooth | Cralplast | 18248 | Disposable Petri dish; Made of highly transparent polystyrene (PS); flat bottom; Smooth;Size: 90 x 15 mm. |
| Phosphate buffered saline (PBS) | thermo fisher Scientific | 10010001 | PBS is a water-based saline solution with a simple formulation. It is isotonic and non-toxic to most cells. It includes sodium chloride and phosphate buffer and is formulated to prevent osmotic shock while maintaining the water balance of living cells. |
| Pipette Pasteur 3 mL Sterile | Accumax | AP-3-B-S | STERILE ACCUMAX PASTEUR 3 ML PIPETTE with 3 mL capacity, made of transparent low-density polyethylene (LDPE) and individually sterile |
| Refrigerated Centrifuge | Thermo Scientific | TS-HM16R | The Thermo Scientific Heraeus Megafuge 16R Refrigerated Centrifuge is a refrigerated centrifuge with the user-friendly control panel makes it easy to pre-set the speed, RCF value, running time, temperature, and running profile. The Megafuge 16R can reach maximum speeds of 15,200 RPM and maximum RCF of 25,830 x g. |
| RPMI-1640 Medium | Merck | MFCD00217820 | HEPES Modification, with L-glutamine and 25 mM HEPES, without sodium bicarbonate, powder, suitable for cell culture |
| The single channel micropipettes | Eppendorf | Z683809 | Single-channel micropipettes are used to accurately transfer and measure very small amounts of liquids. |
| Tip for Micropipettor | Corning | 4894 | Capacity of 10 µL and 1,000 µL Autoclavable |
| Triocular inverted microscope | LABOMED | VU-7125500 | It allows you to observe cells inside tubes and bottles, without having to open them, thus avoiding contamination problems. |
Referências
- Samuels, G. J. Trichoderma: A review of biology and systematics of the genus. Mycological Research. 100 (8), 923-935 (1996).
- Nevalainen, H., Peterson, R. Chapter 7 - Heterologous expression of proteins in Trichoderma. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Do Vale, L. H. F., Filho, E. X. F., Miller, R. N. G., Ricart, C. A. O., de Sousa, M. V. Chapter 16 - Cellulase systems in Trichoderma: An overview. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Ferreira, N. L., Margeot, A., Blanquet, S., Berrin, J. G. Chapter 17 - Use of cellulases from Trichoderma reesei in the twenty-first century part I: Current industrial uses and future applications in the production of second ethanol generation. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Puranen, T., Alapuranen, M., Vehmaanperä, J. Chapter 26 - Trichoderma enzymes for textile industries. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Kunamneni, A., Plou, F. J., Alcalde, M., Ballesteros, A. Chapter 24 - Trichoderma enzymes for food industries. Biotechnology and Biology of Trichoderma. Gupta, V. K., Schmoll, M., Herrera-Estrella, A., Upadhyay, R. S., Druzhinina, I., Tuohy, M. G. , Oxford, UK. (2014).
- Mukherjee, P. K., Horwitz, B. A., Herrera-Estrella, A., Schmoll, M., Kenerley, C. M. Trichoderma research in the genome era. Annual Review of Phytopathology. 51 (1), 105-129 (2013).
- Mukherjee, M., et al. Trichoderma-plant-pathogen interactions: Advances in genetics of biological control. Indian Journal of Microbiology. 52 (4), 522-529 (2012).
- dos Santos, U. R., dos Santos, J. L. Trichoderma after crossing kingdoms: Infections in human populations. Journal of Toxicology and Environmental Health, Part B. 26 (2), 97-126 (2023).
- Asis, A., et al. Identification patterns of Trichoderma strains using morphological characteristics, phylogenetic analyses and lignocellulolytic activities. Molecular Biology Reports. 48 (4), 3285-3301 (2021).
- Antal, Z., et al. Comparative study of potential virulence factors in human pathogenic and saprophytic Trichoderma longibrachiatum strains. Acta Microbiologica et Immunologica Hungarica. 52 (3-4), 341-350 (2005).
- Hatvani, L., Manczinger, L., Vágvölgyi, C., Kredics, L. Trichoderma as a human pathogen. Trichoderma: Biology and Applications. Mukherjee, P. K., Horwitz, B. A., Singh, U. S., Mukherjee, M., Schmoll, M. , Wallingford, UK. (2013).
- Kredics, L., et al. Clinical importance of the genus Trichoderma: A review. Acta Microbiologica et Immunologica Hungarica. 50 (2-3), 105-117 (2003).
- Erwig, L. P., Gow, N. A. R. Interactions of fungal pathogens with phagocytes. Nature Reviews Microbiology. 14 (3), 163-176 (2016).
- Nicola, A. M., Casadevall, A. In vitro measurement of phagocytosis and killing of Cryptococcus neoformans by macrophages. Methods in Molecular Biology. 844, 189-197 (2012).
- Medina, E., Goldmann, O. In vivo and ex vivo protocols for measuring the killing of extracellular pathogens by macrophages. Current Protocols in Immunology. , Chapter 14, Unit 14 1-17 (2011).
- Drevets, D. A., Canono, B. P., Campbell, P. A. Measurement of bacterial ingestion and killing by macrophages. Current Protocols in Immunology. 109, 1-17 (2015).
- Gresnigt, M. S., et al. Differential kinetics of Aspergillus nidulans and Aspergillus fumigatus phagocytosis. Journal of Innate Immunity. 10 (2), 145-160 (2018).
- Steinberg, B. E., Grinstein, S. Analysis of macrophage phagocytosis: Quantitative assays of phagosome formation and maturation using high-throughput fluorescence microscopy. Methods in Molecular Biology. 531, 45-56 (2009).
- Yan, Q., Ahn, S. H., Fowler, V. G. Macrophage phagocytosis assay of Staphylococcus aureus by flow cytometry. Bio-Protocol. 5 (4), 1406(2015).
- Marr, K. A., Koudadoust, M., Black, M. Early events in macrophage killing of Aspergillus fumigatus conidia New flow cytometric viability assay. Clinical and Diagnostic Laboratory Immunology. 8 (6), 1240-1247 (2001).
- Surewaard, B. G. J., Kubes, P. Measurement of bacterial capture and phagosome maturation of Kupffer cells by intravital microscopy. Methods. 128, 12-19 (2017).
- Siggins, M. K., et al. Differential timing of antibody-mediated phagocytosis and cell-free killing of invasive African Salmonella allows immune evasion. European Journal of Immunology. 44 (4), 1093-1098 (2014).
- Cannon, G. J., Swanson, J. A. The macrophage capacity for phagocytosis. Journal of Cell Science. 101 (4), 907-913 (1992).
- Harvath, L., Terle, D. A. Assay for phagocytosis. Methods in Molecular Biology. 115, 281-290 (1999).
- dos Santos, A. G., et al. Trichoderma asperelloides spores downregulate dectin1/2 and TLR2 receptors of mice macrophages and decrease Candida parapsilosis phagocytosis independent of the M1/M2 polarization. Frontiers in Microbiology. 8, 1681(2017).
- Souza, J. A. M., et al. Characterization of Aspergillus fumigatus extracellular vesicles and their effects on macrophages and neutrophils functions. Frontiers in Microbiology. 10, 2008(2019).
- Oliveira-Mendonça, L. S., et al. Inhibition of extracellular traps by spores of Trichoderma stromaticum on neutrophils obtained from human peripheral blood. Molecular Immunology. 141, 43-52 (2022).
- Oliveira-Mendonça, L. S., et al. Trichoderma stromaticum spores induce autophagy and downregulate inflammatory mediators in human peripheral blood-derived macrophages. Current Research in Microbial Sciences. 3, 100145(2022).
- Johnston, L., Harding, S. A., La Flamme, A. C. Comparing methods for ex vivo characterization of human monocyte phenotypes and in vitro responses. Immunobiology. 220 (12), 1305-1310 (2015).
- Abedon, S. T., Bartom, E. Multiplicity of infection. Brenner's Encyclopedia of Genetics. Second Edition. Maloy, S., Hughes, K. , Academic Press. Cambridge, MA. (2013).
- Rios, F. J., Touyz, R. M., Montezano, A. C. Isolation and differentiation of human macrophages. Methods in Molecular Biology. 1527, 311-320 (2017).
- Lombard, Y., Giaimis, J., Makaya-Kumba, M., Fonteneau, P., Poindron, P. A new method for studying the binding and ingestion of zymosan particles by macrophages. Journal of Immunological Methods. 174 (1-2), 155-165 (1994).
- Ghoneum, M., Gollapudi, S. Phagocytosis of Candida albicans by metastatic and non metastatic human breast cancer cell lines in vitro. Cancer Detection and Prevention. 28 (1), 17-26 (2004).
- Nunes, J. P. S., Dias, A. A. M. ImageJ macros for the user-friendly analysis of soft-agar and wound-healing assays. BioTechniques. 62 (4), 175-179 (2017).
- Alves-Filho, E. R., et al. The biocontrol fungus Trichoderma stromaticum downregulates respiratory burst and nitric oxide in phagocytes and IFN-gamma and IL-10. Journal of Toxicology and Environmental Health - Part A: Current Issues. 74 (14), 943-958 (2011).
- Slesiona, S., et al. Persistence versus escape: Aspergillus terreus and Aspergillus fumigatus employ different strategies during interactions with macrophages. PLoS One. 7 (2), 31223(2012).
- Johnston, S. A., May, R. C. Cryptococcus interactions with macrophages: Evasion and manipulation of the phagosome by a fungal pathogen. Cellular Microbiology. 15 (3), 403-411 (2013).
- Alonso, M. F., et al. The nature of the fungal cargo induces significantly different temporal programmes of macrophage phagocytosis. The Cell Surface. 8, 100082(2022).
- Brakhage, A. A., Bruns, S., Thywissen, A., Zipfel, P. F., Behnsen, J. Interaction of phagocytes with filamentous fungi. Current Opinion in Microbiology. 13 (4), 409-415 (2010).
- Dos Santos, U. R., et al. Exposition to biological control agent Trichoderma stromaticum increases the development of cancer in mice injected with murine melanoma. Frontiers in Cellular and Infection Microbiology. 10, 252(2020).
- Wang, G., et al. Exopolysaccharide from Trichoderma pseudokoningii induces macrophage activation. Carbohydrate Polymers. 149, 112-120 (2016).
- Xu, Y., et al. Exopolysaccharide from Trichoderma pseudokoningii promotes maturation of murine dendritic cells. International Journal of Biological Macromolecules. 92, 1155-1161 (2016).
- Schmoll, M., Esquivel-Naranjo, E. U., Herrera-Estrella, A. Trichoderma in the light of day - Physiology and development. Fungal Genetics and Biology. 47 (11), 909-916 (2010).
- Zhang, G., Li, D. Trichoderma longibrachiatum-associated skin inflammation and atypical hyperplasia in mouse. Frontiers in Medicine. 9, 865722(2022).
- Paredes, K., Capilla, J., Mayayo, E., Guarro, J. Virulence and experimental treatment of Trichoderma longibrachiatum, a fungus refractory to treatment. Antimicrobial Agents and Chemotherapy. 60 (8), 5029-5032 (2016).
- Perkhofer, S., Speth, C., Dierich, M. P., Lass-Flörl, C. In vitro determination of phagocytosis and intracellular killing of Aspergillus species by mononuclear phagocytes. Mycopathologia. 163 (6), 303-307 (2007).
Access restricted. Please log in or start a trial to view this content.
Reimpressões e Permissões
Solicitar permissão para reutilizar o texto ou figuras deste artigo JoVE
Solicitar PermissãoExplore Mais Artigos
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Todos os direitos reservados