Analyse des éléments nutritifs du sol : azote, phosphore et potassium
Source : Laboratoires de Margaret Workman et Kimberly Frye - Depaul University
Dans cette expérience, trois macronutriments de sol sont chimiquement extraite, combinée avec des réactifs à base de couleur, puis analysées à l’aide de couleurs pour déterminer la concentration des éléments nutritifs présente dans l’échantillon de sol.
Azote, phosphore et potassium sont les principaux composants des engrais de sol. Ces méthodes isolent chaque élément nutritif du sol dans une solution qui peut être analysée à l’aide de la turbidité et la couleur pour déterminer la concentration des nutriments présents dans l’échantillon de sol. Connaissant la concentration actuelle informe les scientifiques environnementaux d’une carence nutritionnelle ou d’excédent dans les sols utilisés pour soutenir la production végétale et donne également une idée générale dans les cycles biogéochimiques fondamentales d’un écosystème.
Lorsque chimiquement isolées du sol, éléments nutritifs peuvent être détectés à l’aide de cette technique. Azote et phosphore, trouve généralement sous forme de nitrates et de phosphates, sont extraites avec un extractant chimique qui lie l’élément nutritif d’intérêt. Une fois extrait du sol, chaque élément nutritif est cumulable avec un réactif connu qui provoque la solution nutritive remplacer une couleur de nutriments spécifiques dans une relation linéaire, avec une couleur plus foncée, ce qui indique une concentration accrue d’éléments nutritifs. Pour analyser la concentration de chaque substance nutritive, un réactif chimique serviront à la couleur de chaque échantillon avec une augmentation dans l’intensité de couleur indiquant l’augmentation de la concentration d’éléments nutritifs.
Dans les essais de nitrate élevé et moyen de gamme, cadmium métallique est utilisé pour réduire les nitrates (n °3–) en nitrites (NO2–). Le cadmium est contenu dans l’acheté 5 Nitraver (haute et moyenne gamme) et 6 Nitraver (gamme basse) oreillers de poudre.
PAS3– + Cd + 2 H+ → NO2– + Cd2 + + H2O
Les ions nitrites réagissent ensuite avec l’acide sulfanilique (dans un milieu acide contenu dans la poudre de NitraVer 5) pour former un sel de diazonium intermédiaire. Lorsqu’il est couplé avec l’acide gentisique (également contenue dans les 5 NitraVer), une solution de couleur ambre est formée. Intensité de la couleur de ce composé est directement proportionnelle à la concentration de nitrates de l’échantillon de l’eau et peut être quantifiée en utilisant la boîte de comparateur de couleur nitrate avec un disque de couleur ambre nitrate continue.
Pour le phosphore, le sodium molydate et pyrosulfate de potassium dans la poudre de réactif PhosVer 3 achetée réagissent avec les phosphates solubles réactifs pour former un complexe phospho-molybdate.
H 2 PO 4 – 12 Na2MoO4 + → BP12O403-
Le complexe est ensuite réduit par l’acide ascorbique (également contenue dans PhosVer 3 poudre) pour former une couleur bleu de molybdène. La couleur bleue est quantifiée à l’aide d’une boîte de comparateur de couleur de phosphate avec un disque de couleur bleue continue de phosphate.
Une boîte de comparateur de couleur est utilisée pour cette méthode. Cet outil fonctionne selon des intensités de couleur connue pour chaque concentration entre 0-50 mg/L. Un disque de couleur sur la boîte est tourné jusqu'à ce que la couleur dans les deux fenêtres matches (blancs et échantillons). Une fois que les couleurs correspondent, la concentration en éléments nutritifs (mg/L) s’affichera dans une fenêtre séparée plus faible sur la zone de comparaison de couleur. Ces boîtes sont assez robustes pour être utilisé avec les élèves à tous les niveaux jusqu'à cours introductif et peuvent facilement être transportés dans le cadre d’un sol de champ kit qui peut être utilisée à un emplacement de prélèvement d’échantillons pour tester. Ces méthodes permettent de base nutritive tests en laboratoire en classe sans nécessiter de coûteux pièces d’équipement qui n’est peut-être pas disponible. Pour assurer l’exactitude d’essai, les nitrates et les phosphates des solutions standards peuvent être utilisées à la place un échantillon dans les procédures avant de voyager au terrain ou au début de l’analyse des échantillons de sol en laboratoire.
Dans les tests de potassium, les ions de potassium combinent avec tétraphénylborate de sodium contenue dans la poudre de réactif de Potassium 3 achetée pour former de tétraphénylborate de potassium, un précipité blanc. Le précipité reste en suspension dans les échantillons, causant une augmentation de la turbidité.
AUCUN3– + Cd + 2 H+ ne NaB (C6H5)4 + K+ → Ko (C6H5)4 Na+
Une jauge de mesure de potassium est utilisée pour quantifier la quantité de turbidité qui est convertie à la concentration de potassium. La jauge d’huile a un point noir sur une extrémité qui est placée dans l’échantillon jusqu'à ce que le point n’est donc plus visible à travers le précipité blanc. La jauge est progressivement marquée pour indiquer une échelle de visibilité qui est ensuite convertie en concentration de potassium avec un tableau de conversion. Cette méthode est une procédure peu coûteuse avec équipement minimal qui peut être transporté vers un site d’échantillonnage en plein air et assez robuste pour être utilisé avec les étudiants de tout niveau jusqu'à cours introductif.
1. extraction de l’azote (des nitrates non3–)
- Allumez l’équilibre, la valeur d’un bateau de peser sur le dessus et zéro le solde.
- Utilisez une spatule pour peser 10 g de sol (séchées et tamisée) et transfert dans un bécher de 100 mL étiqueté.
- Peser à 0,1 g de sulfate de calcium et le transférer dans le bécher.
- À l’aide d’un 25 mL graduée mesure cylindre 20 mL d’eau désionisée et transfert dans le bécher.
- Répétez les étapes 1.1-1.4 pour chaque échantillon de sol d’azote.
- Mélanger soigneusement le contenu de chaque bécher avec une verge de remuer.
- Sécuriser les échantillons sur un plateau shaker et agiter pendant 1 min.
2. extraction du phosphore et du Potassium
- Allumer la balance, un bateau de peser la valeur sur le dessus et zéro le solde.
- Utilisez une spatule pour peser de 2 g de sol (séchées et tamisée) et transfert dans un bécher de 100 mL étiqueté.
- Utiliser une éprouvette graduée de 25 mL pour mesurer 20 mL de Mehlich 2 sols d’extraction dans le cylindre. Transférer le bécher.
- Répétez les étapes 2.1 à 2.3 pour chaque échantillon de phosphore et de potassium.
- Mélanger soigneusement le contenu de chaque bécher avec une verge de remuer.
- Obtenir des échantillons sur une table-plateau de table shaker et agiter pendant 5 min.
3. éléments nutritifs Extraction Filtration - cette étape se fera pour tous les trois analytes (nitrate, phosphate et potassium)
- Fixer une extrémité du tuyau entonnoir sur un jet sous vide.
- Fixez l’autre extrémité du tuyau sur le bras du côté du ballon.
- Assembler l’entonnoir en l’enclenchant ensemble cylindre et perforé le disque supérieur. Placez l’entonnoir assemblé sur le flacon de côté-bras en y insérant le bouchon en caoutchouc en haut du ballon pour garantir l’entonnoir sur le dessus.
- Placez 1 papier filtre propre sur le dessus de l’entonnoir.
- Allumez le jet sous vide.
- Versez lentement la solution extrait du sol dans l’entonnoir, ce qui permet de l’extrait s’écouler loin du sol, dans le fond du flacon entonnoir.
- Versez l’extrait filtré dans un bécher de 50 mL neuf, étiqueté. Ce filtrat est analysée comme c’est.
- Enlever entonnoir, jeter le papier-filtre et entonnoir de rinçage et fiole avec de l’eau désionisée. Jet d’air permet de sécher l’entonnoir et le ballon.
- Répétez les étapes de 3,3 à 3,7 pour chaque échantillon de sol.
4. analyse avec comparateur pour les nitrates
- Étiqueter une couleur Regarde un tube « S » pour l’échantillon et une autre couleur Regarde un tube « B » sont vides.
- Rincer soigneusement les deux tubes de Regarde un de couleur avec de l’eau désionisée. Secouer les tubes pour enlever l’eau de rinçage restants.
- Ajouter une petite quantité de l’extrait échantillon (préparée en étapes 1.1-1,7) environ ¼" de profondeur à la couleur Regarde un Tube marqué « S ». Boucher le tube avec un bouchon en caoutchouc et agiter pendant 3 s. jeter cette solution.
- Ajouter l’extrait d’échantillon à deux tubes jusqu'à ce que le ménisque soit alignée avec la marque de 5 mL sur les tubes (en bas de la zone givrée).
- Ajouter le contenu d’une gélule de 5 NitraVer au tube marqué « S ». Boucher et agiter le tube vigoureusement pendant exactement une minute.
- Placer immédiatement les tubes « S » et « B » en comparaison avec le tube « B » dans le trou extérieur et le tube « S » à l’intérieur trou.
- Attendre 5 min, puis maintenez le comparateur jusqu'à une source lumineuse. Tourner le disque jusqu'à ce que la couleur dans la fenêtre pour le tube « B » correspond à la couleur dans la fenêtre pour le tube « S ». Enregistrer la valeur de la concentration (mg/L) qui s’affiche dans la fenêtre inférieure de la boîte de comparateur de couleur.
- Répétez les étapes 4.1 à 4.7 pour toutes les répétitions et enregistrer la moyenne.
- Répétez l’étape 4,8 pour tous les échantillons de nitrate.
5. analyse avec comparateur pour le Phosphate
- À l’aide du compte-gouttes de 2,5 mL, ajouter 2,5 mL de l’extrait échantillon filtré (préparé en étapes 2.1-2,6) à une éprouvette graduée de 25 mL.
- Compléter au trait avec de l’eau désionisée, casquette avec bouchon, 25 mL et renverser pour mélanger.
- Étiqueter une couleur Regarde un tube « S » pour l’échantillon et une autre couleur Regarde un Tube « B » sont vides.
- Rincer soigneusement les deux tubes de Regarde un de couleur avec de l’eau désionisée. Secouer les tubes pour enlever l’eau de rinçage restants.
- Ajouter une petite quantité de l’extrait dilué environ ¼" profond à l’écoute de couleur tube marqué « S ». Bouchon du tube avec un bouchon en caoutchouc et agiter pendant quelques secondes puis jetez cette solution.
- Ajouter l’extrait d’échantillon à deux tubes jusqu'à ce que le ménisque soit alignée avec la marque de 5 mL sur les tubes (en bas de la zone givrée).
- Ajouter le contenu d’un PhosVer 3 au tube « S ». Boucher et agiter le tube vigoureusement pendant une minute.
- Placer immédiatement les tubes « S » et « B » en comparaison avec le tube « B » dans le trou extérieur et le tube « S » à l’intérieur trou.
- 3 min après avoir terminé l’étape 5,8, accueillir comparateur jusqu'à une source lumineuse. Tourner le disque jusqu'à ce que la couleur dans la fenêtre pour le tube « B » correspond à la couleur dans la fenêtre pour le tube « S ». Dans une zone d’affichage inférieure sur la boîte, le disque de couleur affiche simultanément la valeur de la concentration correspondant à l’intensité de la couleur choisie. Enregistrez la valeur de la concentration qui s’affiche dans la fenêtre.
- Répétez les étapes 5.1 à 5.10 pour toutes les répétitions et enregistrer la moyenne.
- Répétez l’étape 5.10 pour tous les échantillons de phosphore.
6. réactif et analyse pour le Potassium
- À l’aide d’une pipette de 1 mL, ajouter 3 mL d’extrait d’échantillon de potassium (préparé en étapes 2.1-2,6) à un cylindre de 25 mL.
- Ajouter l’eau distillée jusqu'à la marque de 21-mL sur le cylindre. Fermement le bouchon de la bouteille avec un bouchon en caoutchouc et inverser pour mélanger.
- Ajouter une gélule de réactif potassium 2 au cylindre.
- Ajouter 3 mL de solution d’EDTA alcaline au cylindre.
- Boucher la bouteille et inverser plusieurs fois pour mélanger. Laisser la solution au repos pendant 3 min.
- Ajouter le contenu d’une gélule de réactif 3 potassium.
- Fermement boucher la bouteille et agiter vigoureusement pendant 10 s.
- Laisser la solution au repos pendant 3 min comme une turbidité blanche se développe.
- Tout en regardant vers le bas dans le cylindre, introduire doucement la jauge de potassium verticalement dans la solution jusqu'à ce que le point noir n’est plus visible par le dessus de la bouteille.
- Maintenir la jauge dans cette position et faire tourner le cylindre, il peut donc être vu l’échelle de la jauge. Rechercher sur toute la surface de l’échelle de la jauge. Consigner le nombre sur l’échelle de la jauge d’huile où la surface de l’échantillon répond à l’échelle de la jauge.
- Répétez 6.1-6.10 pour toutes les répétitions et moyenne. Répétez 6.11 pour tous les échantillons de potassium.
- Consultez le tableau de conversion de potassium pour déterminer la concentration de potassium dans des échantillons de sol. Localisez la jauge de lecture sur la colonne de gauche et on enregistre la concentration mg/L correspondant à la colonne de droite.
Chaque analyse des éléments nutritifs se traduira par une concentration en mg/L.
Les concentrations de nitrates et de phosphates seront déterminées avec les boîtes de comparateur de couleurs et affichent le résultat dans la fenêtre.

Figure 1. Disques couleur exemple de nitrate (à gauche) et boîtes de comparateur de couleur (à droite) phosphate. Intensité des couleurs est sur le pourtour des disques et teneur en nutriments (mg/L) sont sur le bord interne des disques.
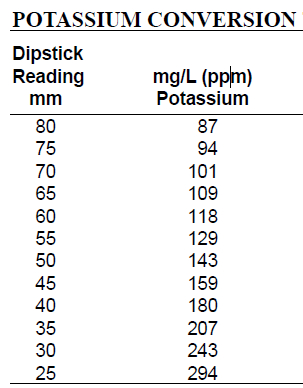
Tableau 1. Tableau de Conversion de potassium utilisé pour convertir le potassium jauge lecture en mg/L. Localisez la jauge de lecture sur la colonne de gauche et on enregistre la concentration mg/L correspondant à la colonne de droite.
| Azote | Phosphore | Potassium | |
| Plage de niveau des éléments nutritifs en ppm | |||
| Faible | 0-15 | 0-25 | 0-60 |
| Médium | 15-30 | 25-50 | 60-100 |
| Haute | 30 + | 50 + | 100 + |
Le tableau 2. Tableau des éléments nutritifs varie classés par catégories.
Déterminer les concentrations d’éléments nutritifs pour les nitrates, phosphates et potassium peut révéler un sol fonctionnement en ce qui concerne son utilisation prévue et comment les nutriments sont vélo à travers un sol. Un test de nutriments fournit un rapport de concentration des éléments nutritifs moyenne (mg/L) pour tous les nutriments testés. Dans un milieu agricole, sachant que la concentration d’éléments nutritifs peut aider les producteurs d’aliments savent quand il faut ajouter de l’engrais, pour ajouter combien et qui nutriments besoin complétée et en quelle quantité. Les sols constamment élevée en azote, par exemple, serait bons pour de plus en plus exigeants en azote des cultures comme le soja et le maïs. Des niveaux élevés d’azote sont également particulièrement utiles pour les plantes non florifères parce que l’azote est nécessaire pour toute partie verte des plantes. Des niveaux élevés d’azote peuvent supprimer floraison cependant, s’ils restent plus élevés que les niveaux de phosphore. Phosphore contrôle la floraison chez les plantes et est important pour toute floraison impliquant la production de plante ou de phosphore et la fructification des plantes est souvent ajouté aux sols ou directement aux plantes avant et Pendant la floraison et la fructification des étapes du cycle de vie afin d’accroître les rendements agricoles dans la plus grande importance de la récolte et des quantités accrues de production de fruits par plant. Potassium est impliqué dans la catalyse de nombreuses réactions chimiques nécessaires pour soutenir la vie végétale, y compris la régulation de la tolérance et l’humidité la sécheresse. Les sols de faible en potassium devront probablement être irrigué si l’amendement du sol n’est pas possible. Concentration des éléments nutritifs peut également indiquer à des carences nutritionnelles ou excédents qui peuvent nuire à la croissance des plantes. Si un nutriment est trop élevé, les modifications peuvent être effectuées pour réduire un excédent, comme l’ajout de paillis ou labourer le sol. Si les éléments nutritifs sont trop faibles pour soutenir la production de végétaux, la fertilisation peut être utilisée pour ajouter des éléments nutritifs en quantité nécessaire pour une culture spécifique. Sol nutritif faible peut aussi avoir des usages plus applicables aux gestionnaires des terres pour les loisirs ou développés (surfaces pavées ou construction de bâtiments) espaces.
Passer à...
Vidéos de cette collection:

Now Playing
Analyse des éléments nutritifs du sol : azote, phosphore et potassium
Environmental Science
215.5K Vues

Identification d'arbre : comment utiliser une clé dichotomique
Environmental Science
81.0K Vues

Enquête sur les arbres : méthode d'échantillonnage du quadrant centré sur un point
Environmental Science
49.3K Vues

Utilisation du SIG pour enquêter sur la foresterie urbaine
Environmental Science
12.5K Vues

Piles à combustible à membrane d'échange de protons
Environmental Science
22.0K Vues

Biocarburants : produire de l'éthanol à partir de matière cellulosique
Environmental Science
53.0K Vues

Tests pour identifier les aliments génétiquement modifiés
Environmental Science
89.4K Vues

Turbidité et solides totaux dans les eaux de surface
Environmental Science
35.8K Vues

Oxygène dissous dans les eaux de surface
Environmental Science
55.6K Vues

Nutriments dans les écosystèmes aquatiques
Environmental Science
38.8K Vues

Mesurer l'ozone troposphérique
Environmental Science
26.4K Vues

Détermination des NOx dans les gaz d'échappement des voitures à l'aide de la spectroscopie UV-VIS
Environmental Science
30.0K Vues

Analyse du plomb provenant du sol à l'aide de la spectroscopie d'absorption atomique
Environmental Science
125.2K Vues

Analyse du carbone et de l'azote des échantillons environnementaux
Environmental Science
29.3K Vues

Analyse des populations de vers de terre du sol
Environmental Science
16.4K Vues