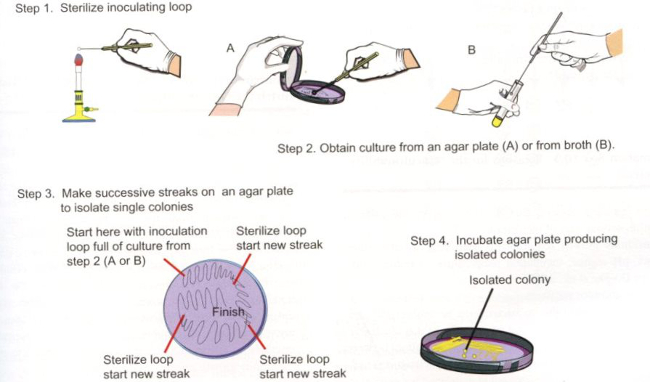
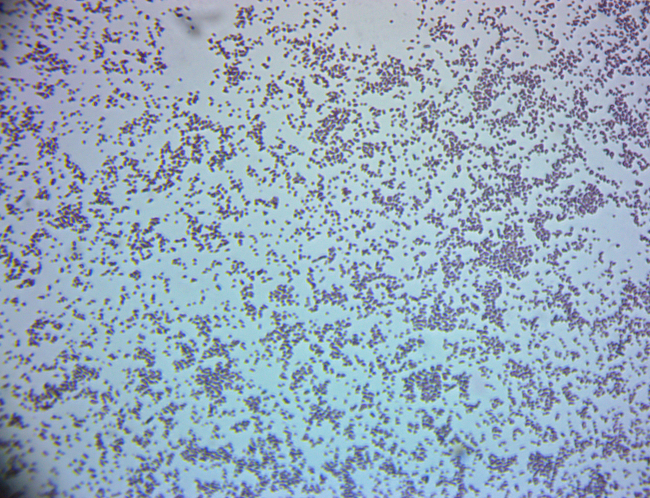
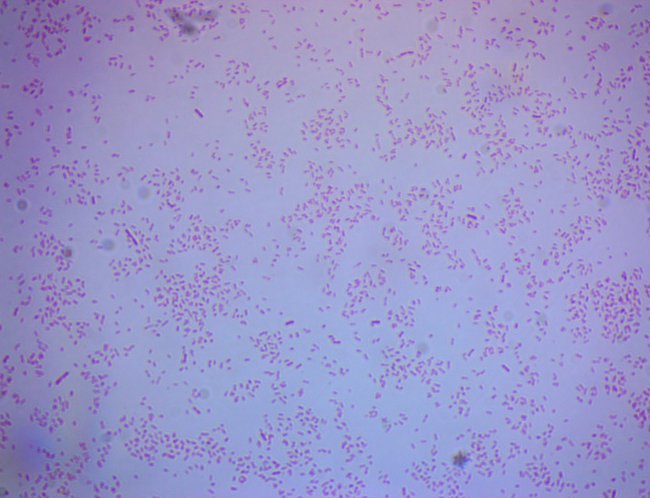
Coloration de Gram des bactéries provenant de sources environnementales
Vue d'ensemble
Source : Laboratoires du Dr Ian poivre et Dr Charles Gerba - Université de l’Arizona
Démonstration d’auteur : Luisa Ikner
Le spectre de la recherche en microbiologie environnementale est large dans la portée et l’application potentielle. Que le travail soit de laboratoire avec des isolats bactériens connus, ou en matière de prélèvement d’échantillons de sol ou d’eau contenant des isolats bactériens inconnus, la capacité de rapidement et visuellement discerner les populations cultivables d’intérêt reste très importante pour les microbiologistes environnementaux encore aujourd'hui avec l’abondance des techniques moléculaires disponibles pour utilisation. Cette vidéo démontrera une telle technique, appelée coloration de Gram.
Procédure
1. le prélèvement
- Recueillir des échantillons de sol et le transport au laboratoire pour analyse microbienne.
- Dans le laboratoire, peser un échantillon de 10 g à l’aide d’une balance analytique.
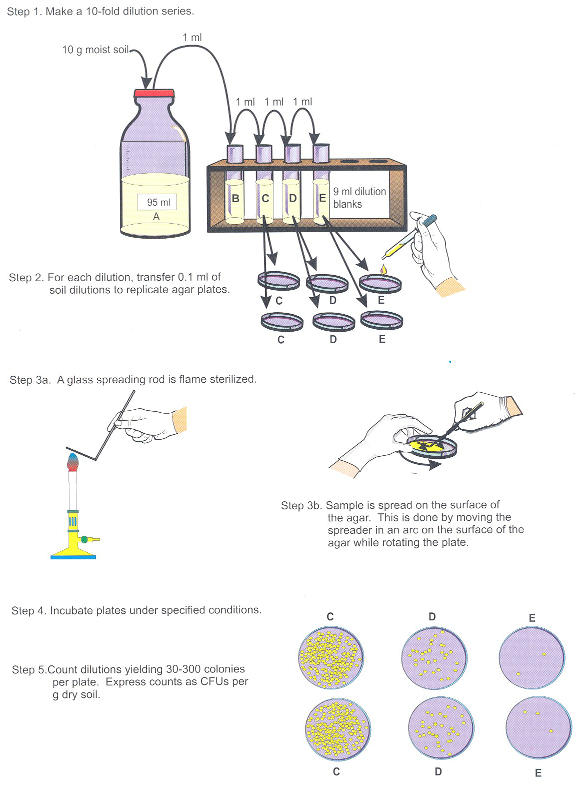
- Diluer l’échantillon 01:10 dans 95 mL d’une solution saline tamponnée au phosphate (10 pièces sol équivaut à 5 parties liquide aqueux) et vortex de mélanger (Figure 2, étape 1).
- Effectuer ultérieures 01:10 sur le sol des dilutions jusqu'à au moins 10-5 g / mL,
Applications et Résumé
La coloration de Gram est utilisée dans les nombreux sous-champs de la microbiologie environnementale et clinique. Les scientifiques de qualité de l’eau peuvent utiliser la coloration de Gram comme outil de confirmation pour la détection des bactéries fécales dans les échantillons d’eau. Les isolats bactériens provenant de sols sont Gram coloré afin de caractériser davantage les communautés du sol cultivable. Pour les microbiologistes environnementaux, coloration de Gram sida dans la catégorisation des pop...
Passer à...
Vidéos de cette collection:

Now Playing
Coloration de Gram des bactéries provenant de sources environnementales
Environmental Microbiology
100.2K Vues

Détermination de la teneur en humidité du sol
Environmental Microbiology
359.3K Vues

Technique aseptique en sciences de l'environnement
Environmental Microbiology
126.4K Vues

Visualisation des micro-organismes du sol grâce aux lames de contact et à la microscopie
Environmental Microbiology
42.2K Vues

Champignons filamenteux
Environmental Microbiology
57.3K Vues

Extraction d'ADN communautaire à partir de colonies bactériennes
Environmental Microbiology
28.8K Vues

Détection des micro-organismes environnementaux avec la réaction en chaîne par polymérase et l'électrophorèse sur gel
Environmental Microbiology
44.6K Vues

Analyse d'ARN d'échantillons environnementaux à l'aide de la RT-PCR
Environmental Microbiology
40.4K Vues

Quantification des micro-organismes et des virus environnementaux à l'aide de la qPCR
Environmental Microbiology
47.8K Vues

Analyse de la qualité de l'eau via des organismes indicateurs
Environmental Microbiology
29.5K Vues

Isolement des bactéries fécales à partir des échantillons d'eau par filtration
Environmental Microbiology
39.3K Vues

Détection de bactériophages dans des échantillons environnementaux
Environmental Microbiology
40.7K Vues

Culture et dénombrement des bactéries dans un échantillon de sol
Environmental Microbiology
184.3K Vues

Analyse de la courbe de croissance bactérienne et ses applications environnementales
Environmental Microbiology
295.9K Vues

Dénombrement des algues via une méthodologie de culture
Environmental Microbiology
13.8K Vues