Imagerie par résonance magnétique cardiaque
Vue d'ensemble
Source : Frederick W. Damen et Craig J. Goergen, Weldon School of Biomedical Engineering, Purdue University, West Lafayette, Indiana
Dans cette vidéo, le champ élevé, la formation image de résonance magnétique de petit-bore (MRI) avec la surveillance physiologique est démontrée pour acquérir des boucles fermées de cine du système cardio-vasculaire murine. Cette procédure fournit une base pour évaluer la fonction gauche-ventriculaire, visualiser les réseaux vasculaires, et quantifier le mouvement des organes dus à la respiration. Les modalités comparables d'imagerie cardiovasculaire chez les petits animaux comprennent l'échographie à haute fréquence et la tomographie micro-calculée (TDM); cependant, chaque modalité est associée à des compromis qui devraient être pris en considération. Tandis que l'ultrason fournit la résolution spatiale et temporelle élevée, les artefacts d'imagerie sont communs. Par exemple, les tissus denses (c.-à-d. le sternum et les côtes) peuvent limiter la profondeur de pénétration de l'imagerie, et le signal hyperéchoïque à l'interface entre le gaz et le liquide (c.-à-d. la pleuréson entourant les poumons) peut brouiller le contraste dans les tissus voisins. Micro-CT en revanche ne souffre pas d'autant d'artefacts dans le plan, mais a une résolution temporelle plus faible et un contraste limité de tissus mous. En outre, le micro-CT utilise le rayonnement de rayon X et exige souvent l'utilisation des agents de contraste pour visualiser la vascularisation, qui sont connues pour causer des effets secondaires à des doses élevées comprenant des dommages de rayonnement et des dommages rénaux. L'IRM cardiovasculaire fournit un bon compromis entre ces techniques en niant la nécessité d'ioniser le rayonnement et en offrant à l'utilisateur la possibilité d'imager sans agents de contraste (bien que les agents de contraste soient souvent utilisés pour l'IRM).
Ces données ont été acquises avec une séquence d'IRM de Fast Low Angle SHot (FLASH) qui a été fermée hors des pics R dans le cycle cardiaque et les plateaux expiratoires dans la respiration. Ces événements physiologiques ont été surveillés par des électrodes sous-cutanées et un oreiller sensible à la pression qui a été fixé contre l'abdomen. Pour s'assurer que la souris était bien réchauffée, une sonde de température rectale a été insérée et utilisée pour contrôler la sortie d'un ventilateur de chauffage sans assurance-IRM. Une fois que l'animal a été inséré dans le forage du scanner IRM et que les séquences de navigation ont été exécutés pour confirmer le positionnement, les avions d'imagerie flash fermés ont été prescrits et les données acquises. Dans l'ensemble, l'IRM à champ élevé est un outil de recherche puissant qui peut fournir un contraste de tissu mou pour l'étude des modèles de maladies animales de petite taille.
Principles
L'imagerie par résonance magnétique est une technique qui exploite les propriétés paramagnétiques des tissus pour visualiser le contraste des tissus mous. L'alésage d'une machine d'IRM est traditionnellement enveloppé à l'aide d'une bobine solénoïde qui fournit un champ magnétique homogène constant (B0) lorsqu'un courant électrique est appliqué. Dans l'imagerie murine de champ élevé présentée, une force de champ magnétique de 7 Tesla (T), qui est environ 140.000 fois celle du champ magnétique de la Terre et plus du double des forces cliniques communes de champ de balayage 3T et 1.5T, est employée. Ce champ magnétique homogène fait aligner les protons d'hydrogène inhérents à presque tous les tissus vivants à leurs axes de rotation. Ces vrilles peuvent alors être « inclinées » à l'aide d'ondes radiofréquences (RF) à un certain angle par rapport à l'axe de rotation (c.-à-d. l'angle de bascule). Comme les protons tentent alors de se détendre à leur orientation d'origine, la composante de leur spin perpendiculaire à leur axe principal induit un signal électrique détectable.
En outre, des gradients magnétiques peuvent être appliqués qui perturbent le champ magnétique principal et permettent des excitations RF spatialement isolées pour localiser le signal reçu. Spécifique aux méthodes décrites ici, la séquence FLASH utilise des excitations répétitives à faible angle de flip pour induire un modèle à état stable dans le mouvement des protons. Ce paradigme permet aux tissus qui sont intrinsèquement dynamiques, comme dans le système cardiovasculaire, d'être imagenés rapidement et d'obtenir des instantanés relativement stables dans le cycle cardiaque. En déclenchant la séquence FLASH avec des signaux physiologiques, des images du système cardio-vasculaire peuvent être acquises qui mettent en évidence les mouvements cardiaques, vasculaires et respiratoires.
Procédure
1. Préparation des animaux
- Identifiez la souris à imager dans sa cage et transférez-la à la chambre d'induction d'anesthésie.
- Anesthésiez la souris à l'aide d'isoflurane et confirmez le knockdown à l'aide d'une technique de pincement des orteils. Prenez la patte entre votre pouce et l'index et pincez fermement pour vérifier une réponse. Si l'animal retire son pied, vous devez attendre ou redoser avec anesthésie selon le protocole approuvé.
- Vérifiez que tous les membres du personnel entrant dans l'installation d'imagerie sont mm en toute sécurité. Cela comprend l'enlèvement de tout vêtement magnétique / accessoires, la confirmation d'aucun implant magnétique ou stimulateurs cardiaques, et l'enlèvement du métal contenant des piercings.
- Ouvrez le flux d'isoflurane au cône de nez dans la salle d'IRM. Cela permet de apprêté le tube plus long avec de l'anesthésique avant le transfert de la souris pour s'assurer que l'animal ne se réveille pas.
- Fermer le flux d'isoflurane à la chambre d'induction d'anesthésie et transférer la souris au stade d'imagerie. Placez la souris sur la scène de telle sorte que l'emplacement approximatif du cœur soit aligné avec le centre de l'aimant.
- Fixer le cône de nez et reconfirmer knockdown en utilisant la technique de pincement des orteils.
- Insérez les trois électrocardiogrammes conduit sous-cutanéeavec une tête à gauche et à droite du cœur et une à la base du membre arrière gauche.
- Insérez la sonde de température rectale à l'aide d'une gaine et d'un lubrifiant de sonde stérile.
- Placez le capteur de respiration d'oreiller sur la région épigastrique de l'abdomen et fixez-le en place à l'aide d'une plaque en carton. Le carton permettra d'assurer un signal sensible à la pression.
- Confirmez que tous les signaux physiologiques sont acquis par le biais du logiciel de surveillance à l'extérieur de la salle de scanner. Si une fréquence cardiaque, une fréquence respiratoire ou une température en dehors de la plage normale est détectée, faites une pause d'imagerie et évaluez si l'animal est correctement anesthésié. Si l'animal est en détresse, l'administration de l'anesthésie doit cesser et l'animal doit être retourné à la cage pour récupérer.
- Installez le module de chauffage et le ventilateur et commencez à réchauffer le flux d'air vers l'animal. Fixez tous les tubes d'air en place de sorte que l'air chaud souffle vers la souris à partir juste après la pointe de la queue.
- Placez la bobine de gradient sur l'animal et assurez-vous que tous les câbles/tubing sont fixés.
2. Imagerie par résonance magnétique cardiaque - Cette section peut être adaptée à d'autres applications.
- Accordez et assortiz la bobine de gradient à l'extérieur de l'alésage de l'aimant pour s'assurer que le signal maximal est détecté à partir du sujet.
- Insérez lentement le stade d'imagerie dans l'alésage de l'aimant de sorte que l'animal soit placé directement au centre de l'alésage. Cela comprend s'assurer que la bobine de gradient a un espacement égal le long de toutes les directions radiales. C'est la position où le champ magnétique principal sera le plus homogène.
- Exécutez un scanner localisateur/navigateur pour confirmer l'emplacement de la souris dans le scanner. Un segment du cœur devrait être visualisé dans les trois plans (c.-à-d. axial, sagittal, et coronal). Si ce n'est pas le cas, répétez le processus de repositionnement de la souris et d'exécution des balayages localisateurs/navigation jusqu'à ce que la position désirée soit atteinte.
- Configurez les paramètres de la séquence FLASH. Par exemple : TR/TE 8,0/2,0 ms, FA 20, FOV 35 x 35 mm, matrice-taille 192 x 192, et NEX 6. Ensuite, sélectionnez le déclencheur externe pour être "sur".
- Sur le logiciel de surveillance, configurez les déclencheurs externes de telle sorte que les séquences d'IRM sont commencées lors de l'identification des pics R dans les cycles cardiaques et pendant que la respiration est stable pendant la phase d'expiration. Comme ces deux conditions sont remplies, la séquence peut être exécuté en série et les données seront acquises.
- Prescrire et exécuter une tranche de séquence FLASH initiale dans la vue coronale de telle sorte que le plan de tranche suit l'axe de l'apex du cœur à travers la valve aortique. Cette boucle de cine initiale fournira une vue à deux chambres du cœur.
- En se référant aux résultats de la vue à deux chambres, prescrire et exécuter une nouvelle séquence FLASH le long de l'axe de la valve apex-aortique pour visualiser une vue à quatre chambres.
- Enfin, prescrire une tranche à axe court qui est perpendiculaire à l'axe de la valve apex-aortique à peu près à mi-chemin à travers le cœur. Les muscles papillaires doivent être nettement visibles dans la sortie de la boucle de cine à cet endroit.
- Des tranches supplémentaires peuvent être acquises parallèlement à celle-ci pour construire des volumes synchronisés dans le temps du cœur. Ces volumes sont créés en concaténant les boucles de cine adjacentes en post-traitement.
- Une fois l'imagerie terminée, transférez les données acquises à un endroit approprié pour analyse et retirez l'animal du scanner.
Résultats
La figure 1 montre une boucle de cine d'une vue à axe court du ventricule gauche, qui est directement perpendiculaire à l'axe de base-apex du coeur et à une position qui inclut les muscles papillaires.
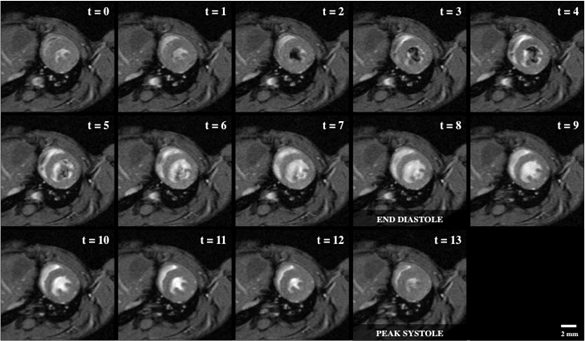
Figure 1: Imagerie par cycle sanguin lumineux d'un cœur de souris avec 14 instantanés de vue à axe court à travers le cycle cardiaque, y compris le diastole d'extrémité (t - 8) et le systole de pointe (t - 13). Les régions de signal de décrochage dans le lumen du ventricule gauche indiquent le mouvement rapide de sang, qui était à l'origine hors du plan et non marqué par l'excitation d'onde de RF.
La deuxième image représentative montre une vue de 4 chambres du cœur avec l'entrée de sang lumineux à travers les valves mitrales et tricuspides, qui s'écoule ntre ensuite à travers les valves aortiques et pulmonaires, respectivement.
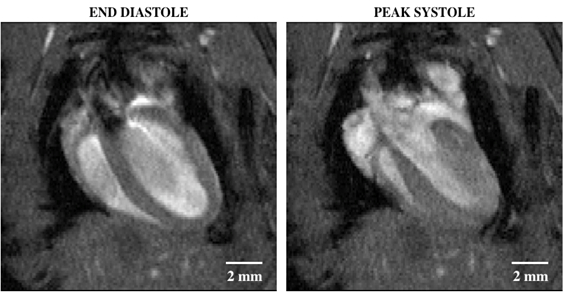
Figure 2: Imagerie de cine desang lumineux d'un coeur de souris avec une vue à quatre chambres montrant le diastole d'extrémité (gauche) et le systole de crête (droite). Les régions de signal de décrochage dans le lumen du ventricule gauche indiquent le mouvement rapide de sang, qui était à l'origine hors du plan et non marqué par l'excitation d'onde de RF.
Enfin, un troisième résultat représentatif est une projection d'intensité maximale (MIP) qui montre comment les tranches multiples peuvent être combinées spatialement pour visualiser le système cardiovasculaire de l'ensemble du corps de la souris.

Figure 3: Projection d'intensitémaximale d'une pile tridimensionnelle d'images de sang lumineux bidimensionnelles synchronisées dans le temps, montrant les régions thoraciques et abdominales d'une souris. Le cœur, le cava de veine inférieur, et le petit aneurysm aortique abdominal (cercle rouge) peuvent être vus de cette vue.
Applications et Résumé
Ici, l'IRM cardiaque est utilisée en conjonction avec le cœur et la respiration-gating pour acquérir des données de boucle de cine du coeur murine. Tandis que le coeur était au centre de la démonstration, d'autres régions du système cardio-vasculaire peuvent être imaged suivant la même méthodologie. Même si l'IRM ne souffre pas des mêmes artefacts couramment vus avec d'autres modalités d'imagerie, il y a un compromis notable avec la résolution spatiale obtenue par durée d'acquisition. Ce compromis est préoccupant lorsque la souris ne peut pas résister à de plus longues durées d'anesthésie, comme dans les modèles de maladies graves. Pourtant, l'IRM a l'avantage de visualiser le tissu sous-jacent sans le risque de dommages de rayonnement ionisantinhérents au micro-CT. Utilisant des techniques de MRI, une évaluation in vivo du cardio-vasculaire peut être exécutée, jetant la base pour des études longitudinales de la progression de la maladie et de la réponse associée de thérapie dans de petits modèles animaux.
Comme extension de la technique décrite, cette technologie peut être utilisée pour comparer la cinématique des cœurs sains par rapport aux cœurs malades. Les modèles murines de dysfonctionnement cardiaque peuvent être beaucoup plus contrôlés que ceux trouvés dans la clinique, permettant aux chercheurs d'identifier les facteurs spécifiques contribuant à la maladie cardiaque aussi bien que d'étudier le processus de retouche après des dommages mécaniques. En outre, un effort de recherche comparable peut être effectué avec un foyer vasculaire tel que celui avec la formation abdominale d'aneurysm aortique (AAA). Étant donné que le sang donne un signal de haute intensité selon les méthodes décrites, le contraste peut être exploité pour évaluer l'expansion d'un AAA et mesurer les changements aux propriétés biomécaniques du navire. Enfin, des études sur la vascularisation du cerveau peuvent être menées pour comparer les réponses angiogéniques aux lésions cérébrales traumatiques ou aux accidents vasculaires cérébraux. Idéalement, comme avec la plupart des images précliniques, des techniques telles que l'IRM cardiovasculaire de champ élevé peuvent améliorer notre compréhension des processus de maladie humaine ainsi que susciter l'innovation vers la prochaine génération de technologie diagnostique.
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Imagerie par résonance magnétique cardiaque
Biomedical Engineering
14.8K Vues

Imagerie d'échantillons biologiques par microscopie optique et confocale
Biomedical Engineering
35.8K Vues

Imagerie d'échantillons biologiques par MEB
Biomedical Engineering
23.8K Vues

Biodistribution des nanomédicaments : Application de la microscopie à balayage électronique
Biomedical Engineering
9.3K Vues

Imagerie par ultrasons à haute fréquence de l'aorte abdominale
Biomedical Engineering
14.5K Vues

Cartographie quantitative de la déformation d'un anévrisme de l'aorte abdominale
Biomedical Engineering
4.6K Vues

Tomographie photoacoustique pour l'imagerie du sang et des lipides dans l'aorte infrarénale
Biomedical Engineering
5.7K Vues

Simulations numériques de la dynamique des fluides du flux sanguin lors d'un anévrisme cérébral
Biomedical Engineering
11.8K Vues

Imagerie des anévrismes de l'aorte abdominale par fluorescence dans le proche infrarouge
Biomedical Engineering
8.3K Vues

Techniques de mesure non invasive de la pression artérielle
Biomedical Engineering
11.9K Vues

Acquisition et analyse d'un signal ECG (électrocardiographie)
Biomedical Engineering
105.8K Vues

Résistance à la traction des biomatériaux résorbables
Biomedical Engineering
7.5K Vues

Imagerie Micro-CT de la moelle épinière d'une souris
Biomedical Engineering
8.0K Vues

Visualisation de la dégénérescence de l'articulation du genou après une blessure non invasive du LCA chez le rat
Biomedical Engineering
8.2K Vues

Imagerie combinée SPECT et CT pour visualiser la fonctionnalité cardiaque
Biomedical Engineering
11.0K Vues