Biodistribution des nanomédicaments : Application de la microscopie à balayage électronique
Vue d'ensemble
Source : Peiman Shahbeigi-Roodposhti et Sina Shahbazmohamadi, Département de génie biomédical, Université du Connecticut, Storrs, Connecticut
Les nanoparticules ont été de plus en plus utilisées dans la recherche pour l'administration ciblée de médicaments et la libération contrôlée de médicaments. Bien que la plupart de ces particules aient été développées sous forme de particules polymères ou liposomiques en raison de leur biocompatibilité, la recherche actuelle tend à utiliser des nanoparticules métalliques et magnétiques. Ces nanoparticules métalliques ont été utilisées à l'origine comme agent de contraste en imagerie, mais des progrès récents ont montré à quel point elles pouvaient être importantes dans la livraison de médicaments et de gènes et dans la thérapeutique. Les nanoparticules d'or, d'argent et paramagnetic ont la plus grande part dans la recherche en cours. Il a été démontré qu'ils ont une bonne biocompatibilité et certaines variétés de nanoparticules magnétiques ont déjà été développées et distribuées sous forme de médicaments thérapeutiques ciblés.
Ces éléments lourds sont généralement représentés pour la recherche utilisant la fluorescence pour évaluer la livraison et la distribution, mais leurs poids atomiques sont de bonnes qualifications pour le contraste accru dans l'analyse électronique de rétrodiffusion utilisant un microscope électronique de balayage (SEM ). La spectroscopie à rayons X dispersive de l'énergie, qui utilise des rayons X caractéristiques émis lors de l'interaction du faisceau d'électrons avec l'échantillon pour identifier la composition chimique, peut également être utilisée avec le SEM. Ces méthodes ont les avantages d'une résolution accrue et d'une confiance accrue dans la détection, car l'EDS peut s'assurer que le sujet d'une image est de la bonne composition, tandis que les méthodes actuelles de fluorescence peuvent se détacher des nanoparticules et peuvent se faner rapidement pendant l'imagerie.
Cette démonstration examinera la distribution de nanoparticules métalliques dépendantes de la taille dans les organes du corps au fil du temps. Les organes excisés seront examinés avec SEM pour différentes tailles de particules à une plage de points de temps après la livraison de particules au corps.
Principles
Il est difficile de surestimer l'importance des nanoparticules (NP) pour les applications médicales. Ils sont utilisés comme médicaments, porteurs de drogue, agents de contraste, etc. Cependant, afin d'utiliser un certain type de nanoparticule, il est nécessaire de savoir comment et où il sera distribué dans chaque organe après l'application et combien de temps il faudra avant de quitter l'organe et, par la suite, le corps. C'est ce qu'on appelle sa biodistribution.
Le processus d'administration de médicaments nanoparticules peut varier considérablement dans sa complexité, des médicaments passifs qui ne ciblent pas le tissu, mais sont plutôt libérés dans l'ensemble du corps, à un ciblage plus activement manipulé des médicaments à un organe ou un emplacement très précis. La plupart des médicaments et des thérapies utiliseront le ciblage passif, qui montre toujours un grand succès en raison de la perméabilité et la rétention améliorées (effet EPR) dans les tumeurs avec de grandes quantités de flux sanguin et de grandes quantités de fuites vasculaires. Outre le ciblage passif, le ciblage actif peut être fait dans le traitement des nanoparticules par l'attachement de ligands spécifiques de tumeur-site, ou peut être fait après injection par le biais d'ajouter une force magnétique aux nanoparticules magnétiques. Ce champ magnétique tire les nanoparticules hors de la circulation sanguine vers la zone touchée, réduisant ainsi le temps de la médecine passe dans la circulation sanguine et augmentant la dose à la zone affectée. Ces différentes méthodes d'administration devraient affecter considérablement la distribution des nanoparticules après le traitement, et cette expérience vise à étudier à la fois leur distribution initiale et leur distribution au fil du temps.
Les méthodes actuelles de mesure de la distribution des nanoparticules impliquent généralement l'attachement des particules de fluorescence aux nanoparticules. Selon la concentration des nanoparticules, la taille de la zone cible et l'intensité de la fluorescence, les souris translucides peuvent être analysées à l'aide de l'imagerie optique alors qu'elles sont encore en vie pour déterminer si les particules se trouvent dans la bonne zone. La fluorescence post-mortem peut également être utilisée pour déterminer les niveaux de nanoparticules dans différents organes de souris. Cependant, ces méthodes n'ont pas la résolution des nanoparticules et l'affirmation que la fluorescence ne s'est pas détachée des nanoparticules.
La démonstration actuelle exploite la microscopie électronique rétrodiffusée (BEM) et la spectroscopie dispersive (EDS) pour comprendre la biodistribution des nanoparticules magnétoélectriques (MEN) en fonction de leur taille et du temps passé dans le Corps. Les MEN de l'échantillon sont des nanoparticules magnétoélectriques de baryum et de titane qui ont été introduites dans les organes de souris par injection, puis passivement ciblées sur les organes. Les souris ont été rendues inconscientes et leurs organes enlevés et préservés à 1 semaine, 4 semaines, et 8 semaines après injection. Les organes : le foie, la rate, les poumons, les reins et le cerveau, ont ensuite été sectionnés à l'aide d'une machine à microtomes et préparés à l'aide de méthodes de préparation d'échantillons décrites dans la vidéo éducative « SEM Imaging of Biological Samples ». En tant que mode de microscopie électronique de balayage (SEM), BEM et l'analyse EDS fournissent une analyse compositionnelle à haute résolution qui permet de détecter des nanoparticules individuelles aussi petites que 10 nm de diamètre. En attendant, cette démonstration peut illustrer comment différents détecteurs peuvent être utilisés pour détecter, confirmer et cartographier différents éléments et particules dans un environnement de recherche et aussi comment différents paramètres peuvent affecter l'image résultante.
Procédure
1. Injection de nanoparticules et récolte d'organes
- Injecter des nanoparticules dans une souris anesthésiée par voie intraveineuse pour permettre un ciblage passif.
- Aux moments souhaités, c'est-à-dire 1, 4 et 8 semaines, après l'injection, euthanasier les souris avec humanité selon les lignes directrices de l'American Veterinary Medical Association (AVMA).
- Ouvrez la cavité du corps et retirez chirurgicalement les organes d'intérêt. Placer les organes dans une formaline tamponnée de phosphate de 10 % dans un contenant de polypropylène jusqu'à la préparation de l'échantillon.
2. Préparation d'échantillons de tissus
- Utilisez des forceps pour transférer le tissu de la souris du fixatif en saline tamponnée par phosphate (PBS). Rock l'échantillon pendant 30 min, en remplaçant le PBS toutes les 10 min.
- Retirer le tissu et sécher à l'un des kimwipe. Placez-le ensuite dans un moule en plastique contenant un composé optimal de température de coupe (OCT). Conserver à -80 oC toute la nuit.
- Le lendemain, transférer l'échantillon au cryostat et fixer la température à -23 oC.
- Étiquetez les diapositives avec le type d'organe et la taille des nanoparticules, et placez-les sur une étagère dans le cryostat.
- Couvrir le mandrin cryostat avec OCT et placer l'échantillon sur le dessus. Baisser le piston extracteur sur l'échantillon et lui permettre d'équilibrer pendant 3-5 min.
- Montez le mandrin sur le porte-échantillon et orientez-le de sorte que la lame puisse couper directement à travers l'échantillon congelé. Amener l'échantillon près de la lame pour un revêtement rugueux. Fixer l'épaisseur à 30 m et trancher plusieurs sections jusqu'à ce qu'une tranche coupée uniformément soit produite.
- Passer à la face fine en diminuant l'épaisseur de la section à 7-8 m. Recueillir une section tranchée en appuyant sur une lame de verre étiquetée sur la tranche. Placez deux diapositives sur chaque toboggan et conservez-les dans un toboggan. Laisser sécher à température ambiante.
- Une fois secs, déshydrater les échantillons en trempant le glacière dans 50 % d'éthanol pendant 3 min pour enlever l'OCT. Transférer ensuite le support à 80% d'éthanol pendant 3 min avant de placer le rack dans un rapport de 1:1 de méthanol froid en acétone pendant 10 min à -20 oC.
- Retirez le toboggan et égouttez l'excédent de solvant sur un essuie-tout. Après 20 à 30 min, placez les glissières dans une boîte à glissières et conservez-les dans un congélateur à -20 oC jusqu'à l'imagerie.
3. Imagerie haute résolution à l'aide de SEM et EDS
- Préparer l'échantillon tel que décrit dans « SEM Imaging of Biological Samples ». Ensuite, chargez l'échantillon dans le SEM.
- Allumez le SEM et ajustez la distance de travail à environ 5 mm et la tension et le courant de faisceau accélérant à 25 keV, ce qui serait normalement trop élevé pour un échantillon biologique. Cependant, l'échantillon est enduit pour la conductivité et la protection.
- Commencez l'imagerie et zoomez sur un grossissement d'environ 1 000 à 2 000 X pour voir les structures qui contiendraient les nanoparticules. Notez que sans détection de rétrodiffusion (BSD), on ne peut pas les distinguer en dessous d'une certaine profondeur.
- Insérez le BSD sous les mêmes paramètres et déplacez la scène dans la direction z à la même distance de travail qu'auparavant.
- Commencez l'imagerie à environ le même grossissement et vérifiez que vous êtes en mesure de voir un contraste élevé en présence de nanoparticules. Enregistrer les images.
- Utilisez différentes configurations BSD (où les charges sur le détecteur s'alignent) pour choisir celle qui montre le contraste le plus élevé pour les nanoparticules.
- Zoom-in sur une zone de contraste élevé montrant une nanoparticule ou un amas de nanoparticules.
- Ouvrez la caméra 2nd de la chambre et regardez pendant que vous insérez l'EDS dans le système en appuyant sur le bouton vers le bas sur la pièce jointe SEM. Une fois que l'EDS est proche, mais ne touche pas le BSD ou le pistolet, relâchez le bouton.
- Ouvrez le programme aztèque sur l'ordinateur EDS (toujours au poste de travail) et acquérez une image de la SEM. Utilisez la méthode « point and shoot » pour cliquer sur une zone très dense en contraste et en nanoparticules.
- L'EDS montrera le spectre des rayons X caractéristiques à partir de ce point. Recherchez les pics de baryum et de titane à identifier sur le graphique. Cela confirme que ce que vous regardez sont en effet les nanoparticules et pas n'importe quel type de contamination.
- Retournez à l'échantillon et utilisez le logiciel Atlas pour cartographier les bordures de l'organe sur la diapositive. Sélectionnez le protocole "Organ" pour créer une image mosaïque de la zone, et laissez-le fonctionner (cela peut prendre quelques heures tout au plus).
- Une fois que l'image composite est créée et cousue par le logiciel, exportez-la comme un fichier Tif.
- Ouvrez le fichier Tif dans ImageJ, un logiciel open source, et ajustez les valeurs de seuil de contraste pour mettre en évidence les zones de contraste très élevé (c.-à-d. les nanoparticules). Utilisez des fonctions intégrées pour quantifier le volume de nanoparticules à l'aide de la taille de pixels définie dans le protocole Organ (devrait être d'environ 100 nm).
- Bien que cette procédure se réfère uniquement à l'échantillon d'une semaine du poumon de souris, cette procédure est répétée avec les échantillons d'autres semaines et d'autres organes pour compiler un graphique montrant la distribution.
- Après avoir calculé la biodistribution de chaque organe pour chaque semaine, les graphiques de biodistribution montreront les changements dans la biodistribution et la concentration des nanoparticules au cours des 8 semaines. Ceux-ci montrent la concentration maximale et fournissent également des informations sur le temps qu'il faut pour que les nanoparticules se dégagent de l'organe.
Résultats
Les images suivantes illustrent comment les données de biodistribution peuvent être extraites des images. Le contraste des nanoparticules est détecté à l'aide du détecteur d'ESB, comme le montre la figure 1. Les données EDS, qui sont présentées à la figure 2, montrent où les grappes de titane et de baryum correspondent à des zones à fort contraste dans les images recueillies à l'aide du détecteur d'ESB.

Figure 1 : Image électronique secondaire du poumon (à gauche) et image électronique de rétrodiffusion de la même zone (à droite).

Figure 2 : Données EDS, montrant des amas de titane et de baryum dans le milieu inférieur et le haut de l'image, correspondant aux zones de contraste élevé vu à l'aide du détecteur d'ESB.
Dans une image composite, comme le montre la figure 3, les cercles rouges indiquent les zones à fort contraste et suggèrent les emplacements contenant des nanoparticules. Le volume des zones de nanoparticules blanches peut alors être calculé et calculé en moyenne sur la taille de l'organe lui-même. Cela fournit un calcul de la zone occupée par les nanoparticules. Ensuite, les données de plusieurs organes sur plusieurs semaines peuvent être agrégées pour montrer la distribution moyenne des particules dans un micron carré de l'image. Ces données sont présentées à la figure 4, qui montre une diminution globale des nanoparticules de taille 30 nm au cours des 8 semaines, une indication de dégagement. Une autre chose à noter est l'augmentation de la concentration de nanoparticules dans le foie après 4 semaines. Cela donne des informations sur la façon dont le corps traite les nanoparticules, et la grande migration des particules vers le foie montrent que le corps peut traiter les nanoparticules comme des toxines. Il s'agit d'informations importantes à connaître lors du développement et de l'essai de nanoparticules in vivo.
De même, les données sur la répartition des organes de particules de différentes tailles sont présentées à la figure 5. Ce graphique montre comment la taille changeante des nanoparticules peut augmenter l'apport global dans les cellules des nanoparticules ou augmenter le taux de dégagement.

Figure 3 : Sections de l'image composite créée à l'aide du logiciel Atlas.
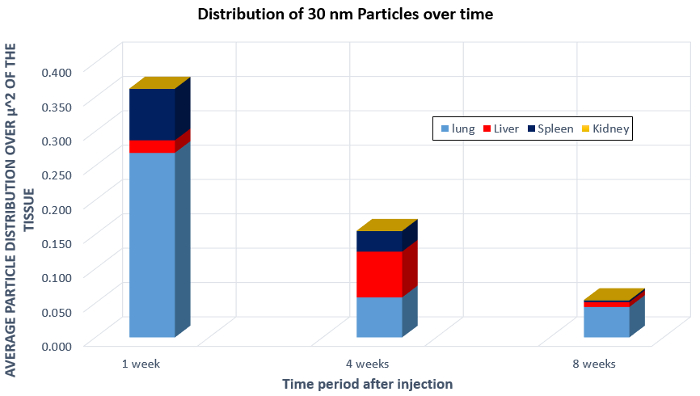
Figure 4 : Biodistribution de 30 nanoparticules nm dans le poumon, le foie, la rate et le rein après injection chez une souris.

Figure 5 : Biodistribution de nanoparticules de taille variable au fil du temps.
Applications et Résumé
Les nanoparticules sont largement utilisées dans la recherche en génie biomédical et ont des applications comme agents d'imagerie, de diagnostic et thérapeutiques. Par exemple, des nanoparticules sont en cours de développement pour l'administration de vaccins. En encapsulant le vaccin en nanoparticules, les composants du vaccin sont protégés contre la dégradation et stimulent la réponse immunitaire maximale.
Dans les applications d'imagerie par résonance magnétique, les nanoparticules métalliques sont souvent utilisées comme agents de contraste pour visualiser la structure et la fonction des tissus. Ce sont des sondes diagnostiques utiles dans la détection des plaques arthérosclérotiques.
Les nanoparticules qui intègrent des capacités diagnostiques et thérapeutiques sont appelées théranostiques. Il nanoparticules simultanément détecter les tumeurs à un stade précoce et de livrer des agents chimiothérapeutiques.
Cette expérience a démontré comment seM peut être utilisé afin de calculer la biodistribution des nanoparticules injectées dans le corps au fil du temps. Cette expérience peut être reproduite sur d'autres échantillons de nanoparticules ou cultures cellulaires qui ont des nanoparticules comme un moyen d'analyser les concentrations, la pénétration cellulaire, ou le dégagement des nanoparticules.
Cette démonstration s'est concentrée sur l'étude et la mesure de la biodistribution des nanoparticules à l'aide de SEM. Les résultats de ces mesures peuvent être importants dans de nombreux domaines. Les compagnies pharmaceutiques et les établissements de recherche peuvent utiliser ces études pour la recherche sur le développement de médicaments et les agents de contraste.
Liste des matériaux
| Nom | Société | Numéro de catalogue | Commentaires |
| Équipement | |||
| Tranche sectionnée (préparée avant) | |||
| Logiciel Open Source ImageJ | |||
| Rayon transversal SEM | Zeiss | ||
| Logiciel ATLAS 3-D SEM | Zeiss |
References
- Hadjikhani, Ali. "Nanofabrication and Spectroscopy of Magnetic Nanostructures Using a Focused Ion Beam." (2016).
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Biodistribution des nanomédicaments : Application de la microscopie à balayage électronique
Biomedical Engineering
9.3K Vues

Imagerie d'échantillons biologiques par microscopie optique et confocale
Biomedical Engineering
35.8K Vues

Imagerie d'échantillons biologiques par MEB
Biomedical Engineering
23.8K Vues

Imagerie par ultrasons à haute fréquence de l'aorte abdominale
Biomedical Engineering
14.5K Vues

Cartographie quantitative de la déformation d'un anévrisme de l'aorte abdominale
Biomedical Engineering
4.6K Vues

Tomographie photoacoustique pour l'imagerie du sang et des lipides dans l'aorte infrarénale
Biomedical Engineering
5.7K Vues

Imagerie par résonance magnétique cardiaque
Biomedical Engineering
14.8K Vues

Simulations numériques de la dynamique des fluides du flux sanguin lors d'un anévrisme cérébral
Biomedical Engineering
11.8K Vues

Imagerie des anévrismes de l'aorte abdominale par fluorescence dans le proche infrarouge
Biomedical Engineering
8.3K Vues

Techniques de mesure non invasive de la pression artérielle
Biomedical Engineering
11.9K Vues

Acquisition et analyse d'un signal ECG (électrocardiographie)
Biomedical Engineering
105.8K Vues

Résistance à la traction des biomatériaux résorbables
Biomedical Engineering
7.5K Vues

Imagerie Micro-CT de la moelle épinière d'une souris
Biomedical Engineering
8.0K Vues

Visualisation de la dégénérescence de l'articulation du genou après une blessure non invasive du LCA chez le rat
Biomedical Engineering
8.2K Vues

Imagerie combinée SPECT et CT pour visualiser la fonctionnalité cardiaque
Biomedical Engineering
11.0K Vues