Tests de sensibilité aux antibiotiques : Utilisation du ETEST pour déterminer la CMI de deux antibiotiques et évaluer la synergie des antibiotiques
Vue d'ensemble
Source: Anna Blàckberg1, Rolf Lood1
1 Département des sciences cliniques Lund, Division de médecine de l'infection, Centre biomédical, Université de Lund, 221 00 Lund Suède
La connaissance des interactions entre les antibiotiques et les bactéries est importante pour comprendre comment les microbes évoluent la résistance aux antibiotiques. En 1928, Alexander Fleming découvre la pénicilline, un antibiotique qui exerce sa fonction antibactérienne en interférant avec la régénération de la paroi cellulaire (1). D'autres antibiotiques avec divers mécanismes d'action ont été découverts par la suite, y compris des médicaments qui inhibent la réplication de l'ADN et la traduction des protéines chez les bactéries; cependant, aucun nouvel antibiotique n'a été développé ces dernières années. La résistance aux antibiotiques actuels a augmenté, ce qui a entraîné des maladies infectieuses graves qui ne peuvent pas être traitées efficacement (2). Ici, nous décrivons plusieurs méthodes pour évaluer la résistance aux antibiotiques dans les populations bactériennes. Chacune de ces méthodes fonctionne, quel que soit le mécanisme d'action des antibiotiques utilisés, parce que la mort bactérienne est le résultat mesuré. La résistance aux antibiotiques est non seulement rapidement disséminée spécifiquement dans les milieux hospitaliers, mais aussi dans toute la société. Afin d'étudier de tels moyens de résistance, différentes méthodes ont été développées, y compris le test Epsilomètre (E-test) et le test de dilution du bouillon (3).
Le test électronique est une méthode bien établie et un outil rentable qui quantifie les données de concentration inhibitrice minimale (MIC), la plus faible concentration d'un antimicrobien qui inhibe la croissance visible d'un micro-organisme. Selon la souche bactérienne et les antibiotiques utilisés, la valeur du MIC peut varier entre le sous-g/mL et le 4. Le test Électronique est effectué à l'aide d'une bande de plastique contenant un gradient antibiotique prédéfini, qui est imprimé avec l'échelle de lecture du MIC en 'g/mL. Cette bande est directement transférée sur la matrice d'agar lorsqu'elle est appliquée sur la plaque d'agar inoculée. Après l'incubation, une zone d'inhibition elliptique symétrique est visible le long de la bande à mesure que la croissance bactérienne est empêchée. LE MIC est défini par la zone d'inhibition, qui est le point de terminaison où l'ellipse croise la bande. Une autre méthode courante pour déterminer LE MIC est la méthode de dilution des microbroths. La dilution du microbroth incorpore différentes concentrations de l'agent antimicrobien ajouté à un milieu bouillon contenant des bactéries inoculées. Après l'incubation, le MIC est défini comme la plus faible concentration d'antibiotiques qui empêche la croissance visible (5). Il s'agit également d'une méthode quantitative qui peut être appliquée à plusieurs bactéries. Les inconvénients de cette méthode comprennent la possibilité d'erreurs lors de la préparation des concentrations des réactifs et le grand nombre de réactifs requis pour l'expérience. La mesure de la résistance aux antibiotiques est impérative du point de vue clinique et de la recherche, et ces méthodes in vitro d'étude de la résistance sont discutées et présentées ci-dessous.
Le profil de résistance pour une bactérie spécifique peut être appliqué afin d'optimiser le traitement antibiotique afin de déterminer si un patient bénéficierait d'un traitement combiné par rapport à un traitement unique. Pour l'utilisation de plus d'un antibiotique à la fois, il est impératif de connaître leurs interactions les uns avec les autres et s'ils ont un effet additif, synergique ou antagoniste. Un effet additif peut être vu lorsque l'effet articulaire des antibiotiques équivaut à la puissance des antibiotiques individuels administrés à dose égale. La synergie entre les antibiotiques, d'autre part, est présente lorsque l'effet articulaire des antibiotiques est plus puissant que si le médicament serait administré seul (6). L'application de combinaisons de traitement antimicrobien est utilisée pour éviter l'apparition de la résistance aux antimicrobiens afin d'améliorer l'effet du traitement antibiotique individuel (7). La connaissance de l'antagonisme est également aussi importante pour prévenir l'utilisation inutile de combinaisons d'antimicrobiens. La méthodologie de test électronique offre des moyens simples et de plusieurs façons de déterminer la synergie et l'antagonisme possibles entre les différents agents antimicrobiens. Afin de faire face à la prolifération des agents pathogènes résistants aux antibiotiques, la connaissance des mécanismes synergiques et antagonistes possibles de certains antibiotiques est importante, ce qui entraîne une efficacité clinique et lutte contre la multirésistance aux médicaments.
La détermination de la synergie à l'aide des tests e peut être divisée en deux approches générales : les tests croisés et non croisés. Bien que les deux tests de synergie s'appuient sur la connaissance antérieure des valeurs individuelles du MIC, les deux approches sont légèrement différentes en méthodologie et en approche conceptuelle. Dans un test de synergie non croisé, le premier antibiotique de la paire à être testé est placé sur une plaque d'agar inoculée avec des bactéries. Après avoir permis aux antibiotiques de la première bande infuser la plaque (par exemple après 1 heure), la bande est enlevée et une nouvelle bande contenant le deuxième antibiotique est placé au même endroit que le premier, en veillant à placer les deux valeurs MIC individuelles sur le dessus de chaque ot son. La zone d'inhibition qui en résulte peut ensuite être analysée comme décrite ci-dessus, et la synergie calculée sur la base de l'équation 1.
Équation 1 - Concentrations inhibitrices fractionnelles (FIC)
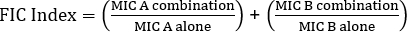
Les valeurs de la marque sont des valeurs qui démontrent une synergie.
Tout en récompensant l'examinateur avec des plaques faciles à analyser, la méthode est un peu laborieuse et longue en raison du changement de bandes, ainsi que la nécessité d'utiliser deux plaques par expérience. Au lieu de cela, un test croisé est souvent utilisé. Au lieu d'ajouter les deux bandes d'essai E différentes par la suite sur l'autre (après l'enlèvement de la première), les deux sont placés simultanément, mais sous la forme d'une croix (angle de 90 degrés), avec les deux valeurs MIC précédemment déterminées formant l'angle de 90 degrés. Par cette approche, une seule plaque est nécessaire par test de synergie, ainsi que moins de travail, ce qui en fait un choix préféré en dépit d'être un peu plus difficile à analyser. Les nouvelles valeurs du MIC dans l'approche combinée des antibiotiques peuvent être visualisées comme les zones d'inhibition modifiées, après quoi la synergie peut être déterminée par l'équation 1.
l'enlèvement de la première), les deux sont placés simultanément, mais sous la forme d'une croix (angle de 90 degrés), avec les deux valeurs MIC précédemment déterminées formant l'angle de 90 degrés. Par cette approche, une seule plaque est nécessaire par test de synergie, ainsi que moins de travail, ce qui en fait un choix préféré en dépit d'être un peu plus difficile à analyser. Les nouvelles valeurs du MIC dans l'approche combinée des antibiotiques peuvent être visualisées comme les zones d'inhibition modifiées, après quoi la synergie peut être déterminée par l'équation 1.
Au lieu d'utiliser une approche de plaque d'agar, une approche de microbroth peut souvent être préférentielle en raison de sa plus grande flexibilité (par exemple, la capacité de choisir des concentrations spécifiques d'antibiotiques en dehors des limites d'une bande de test électronique). En outre, les tests de microbroth sont suggérés pour être plus sensibles en raison de leur distribution uniforme d'antibiotiques dans une solution liquide, ne dépend pas de la dissociation dans une phase solide (plaque d'agar). Les puits dans une microplaque de 96 puits seront inoculés avec un nombre fixe de bactéries (106 cfu/mL : la concentration bactérienne peut être estimée par des mesures OD600 nm, des normes de turbidité, ou par des échantillons de placage de 10x dilutions bactériennes en série), et antibiotiques dans différentes dilutions seront ajoutés aux puits. De même, pour les bandes e-test MIC est déterminé comme l'intersection (bien / spot) avec la plus faible concentration d'antibiotiques inhibant la croissance visible des bactéries.
Objectif expérimental
- Le projet ci-dessous décrit les stratégies visant à déterminer les valeurs MIC de la pénicilline G et de la gentamicine du groupe G de Streptococcus par deux méthodes différentes, le test électronique et la dilution du microbroth. Pour l'essai électronique, les plaques d'agar De Mueller-Hinton inoculées avec le groupe G de Streptococcus ont été employées en combination avec des bandes de gradient de la pénicilline G et/ou de la gentamicine ; tandis que MH-broth avec 50% de sang de cheval lysé et 20 mg/mL -NAD ont été utilisés avec des antibiotiques solubles avec streptocoque groupe G dans une approche de microbroth.
Matériaux
- Colonies bactériennes sur une plaque d'agar de sang, stockées 7 jours dans 4 oC
- Plaques d'agar de sang
- 0.5 Norme McFarland
- 1% BaCl2
- 1% H2SO4
- Tube salin (2 mL)
- Applicateur à pointe de coton
- Plaques d'agar Mueller-Hinton (plaques MHA)
- Bouillon MH avec 50% de sang de cheval lysé et 20 mg/mL-NAD (MH-F)
- E-test pénicilline/gentamicin (ou antibiotiques d'intérêt) (BioMerieux, Marcy l'Etoile, France, Suède)
- Pénicilline/gentamicine (ou antibiotiques d'intérêt (poudre/solution))
Remarque : Les médias spécifiques utilisés pour la croissance bactérienne peuvent varier selon les espèces.
Procédure
1. Tests d'epsilomètre (E-tests)
-
arrangement
- Portez des gants et une blouse de laboratoire
- Préparer l'espace de travail en le stérilisant à l'aide de 70 % d'éthanol
- Recueillir les plaques d'agar Mueller-Hinton (plaques MHA)
-
Préparation d'une norme de turbidité McFarland no 0.5
- Préparer une solution de 1% de chlorure de baryum (BaCl2):
Ajouter 1 gramme de chlorure de baryum anhydre (BaCl2) dans 100 ml d'eau distillée. Vortex bien. - Préparer une solution de 1% d'acide sulfurique (H2SO4):
Ajouter 1 ml de H2SO4 concentré dans 99 ml d'eau distillée. Vortex bien. - Préparer une norme de turbidité McFarland no 0.5 :
50 l Solution BaCl2 en 5 ml de 1% H2SO4 solution. Vortex la solution bien pour obtenir une suspension turbide. - Gardez la norme de turbidité McFarland no 0.5 dans un tube recouvert de papier d'aluminium. Conserver à 25oC pendant un maximum de 6 mois. Vortex bien à une solution homogène avant utilisation.
- Préparer une solution de 1% de chlorure de baryum (BaCl2):
-
Préparation des plaques MHA
- Scrape Streptococcus groupe G bactéries de la plaque d'agar de sang à l'aide d'une boucle stérile. Mélanger dans 1mL de salin, et le vortex à une suspension de la bactérie.
- Comparez la suspension à une norme McFarland no 0.5 pour obtenir la même turbidité afin d'avoir la même taille d'inoculum pendant les expériences. Ajuster la concentration à l'aide d'un salin ou d'une bactérie supplémentaire.
- Inoculer les plaques MHA à l'aide d'un applicateur à pointe de coton stérile. Écouvillons la plaque délicatement pour couvrir la surface. Procédez avec l'une des trois méthodes décrites ci-dessous (1.4-1.6).
-
Test unique de résistance aux antibiotiques. Streptococcus groupe G, résistance à la pénicilline G ou gentamicine
- Placez une bande d'essai E (pénicilline G ou gentamicine) au centre de la plaque MHA (figure 1 A,B).
- Incuber pendant 18-20 heures, 37oC.
- Lisez les résultats. Le MIC est mesuré comme la zone d'inhibition qui croise la bande d'essai d'antibiotiques notée (Figure 1 C,D).

Figure 1 : Test électronique unique. Placement d'une bande E-test de A) pénicilline G et B) gentamicine sur une plaque d'agar Mueller Hinton recouverte de colonies bactériennes d'un groupe G streptocoques avant (A et B) et après (C et D) du jour au lendemain incubation à 37oC 5% CO2. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
-
Test de synergie inter-approche. Streptococcus groupe G, résistance à la pénicilline G et gentamicine.
- Placez deux bandes d'essai Électronique avec différents antibiotiques (p. ex. pénicilline G et gentamicine) sur la plaque MHA inoculée dans une formation croisée.
- Pour obtenir les résultats les plus précis, visez à placer la croix à un angle d'environ 90 degrés à l'intersection des échelles à leurs valeurs MIC, précédemment déterminées à l'essai unique de résistance aux antibiotiques (figure 2 A).
- Notez qu'une fois que les bandes sont placées sur la plaque d'agar, elles ne doivent pas être déplacées, puisque certains antibiotiques peuvent déjà avoir été absorbés par la plaque. Par conséquent, il est plus approprié de maintenir les bandes à un angle légèrement erroné (p. ex. 85 degrés) et jusqu'à 1-2 mm de la valeur réelle du MIC. Il est conseillé d'exécuter l'expérience en triplicate pour réduire ce problème.
- Incuber pendant 18-20 heures, 37oC.
- Lisez les résultats. Le MIC est mesuré comme la zone d'inhibition qui croise la bande d'essai antibiotique notée sur chaque bande de test Électronique respective (figure 2 B).
- Utilisez la formule pour la concentration inhibitrice fractionnaire (FIC) (Équation 1) afin de déterminer la synergie.
- Placez deux bandes d'essai Électronique avec différents antibiotiques (p. ex. pénicilline G et gentamicine) sur la plaque MHA inoculée dans une formation croisée.
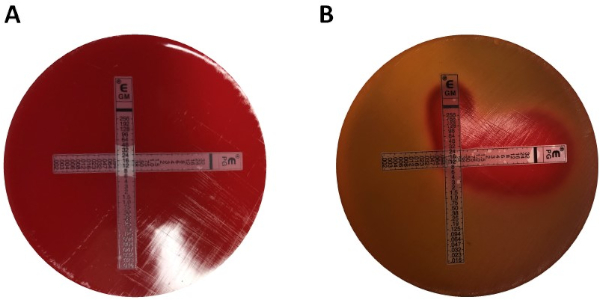
Figure 2 : Détection du synergisme - test croisé. Résultats des tests de synergie antimicrobienne s'est fait au MIC de la pénicilline G et de la gentamicine sur le groupe G de Streptococcus avant (A) et après (B) l'incubation pendant la nuit à 37 oC 5 % CO2. Un angle de 90 degrés est formé entre les deux valeurs MIC individuelles (pénicilline G : 0,094 g/mL, gentamicine : 8 g/mL). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
-
Approche non croisée de test de synergie. Streptococcus groupe G, résistance à la pénicilline G et gentamicine.
- Placez la bande e-test au centre de la plaque MHA (Figure 3 A,D).
- Marquez l'endroit où la valeur MIC précédemment déterminée se trouvait sur chaque bande.
- Incuber pendant 1 heure à température ambiante.
- Jeter la bande d'essai E pour chaque plaque MHA (Figure 3 B,E).
- Placez la deuxième bande d'essai électronique (contenant un antibiotique différent) sur la zone de la bande enlevée antérieure respectivement afin que leurs valeurs MIC correspondent à la marque et soient alignées.
- Incuber pendant 18-20 heures, 37oC.
- Lisez les résultats. Le MIC est mesuré comme la zone d'inhibition qui croise la bande d'essai antibiotique notée sur chaque bande de test Électronique respective (figure 3 C,F).
- Afin de déterminer la synergie, la formule de concentration inhibitrice fractionnaire (FIC) est utilisée (Équation 1).

Figure 3 : Détection du synergisme - test non croisé. Résultats des tests de synergie antimicrobienne s'estconcentré sur le MIC de la pénicilline G et de la gentamicine sur le groupe De Streptococcus G. A) bande de gentamicin (8 g/mL centré) au-dessus de la bactérie du groupe G de Streptococcus, B) Enlèvement de la bande de gentamicine, C ) Bande combinée de gentamicine / pénicilline G (0,094 g/mL centré) au-dessus de la bactérie Streptococcus groupe G, D) penicilline G bande (0,094 g/mL centré), E) Enlèvement de la penicilline G bande, F) Pénicilline combinée G / la bande de gentamicine (8 g/mL centré) sur le dessus des bactéries du groupe G de Streptococcus. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
2. Test de bouillon
-
arrangement
- Portez des gants et une blouse de laboratoire
- Préparer l'espace de travail en le stérilisant à l'aide de 70 % d'éthanol
- Recueillir 15mL de bouillon MH avec 50% de sang de cheval lysé et 20 mg/mL de NAD (MH-F)
-
(Facultatif) Effectuer un e-test [Protocole 1] pour déterminer le MIC sur le milieu solide
- Bien qu'elles soient facultatives, ces connaissances permettront une meilleure conception expérimentale (p. ex., les concentrations d'antibiotiques ajoutés peuvent être conçues pour entourer la valeur du MIC déterminée à partir de la plaque), ce qui améliorera les chances d'une expérience réussie.
-
Préparation d'un inoculum bactérien. Comme indiqué ci-dessus, la concentration bactérienne peut être estimée par des mesures OD nm ou des normes de turbidité McFarland
-
Méthode OD600 nm
- Obtenir une suspension bactérienne avec une concentration bactérienne établie
- Diluer la culture dans le bouillon MH-F pour obtenir un OD600 de 0,003
-
Méthode de turbidité McFarland
- Mettre 15 ml de bouillon MH-F dans un tube stérile.
- Inoculer le bouillon MH-F avec des bactéries (d'une assiette) à un niveau McFarland. Vortex la solution vigoureusement. Verser la solution dans un plat stérile Petri.
-
Méthode OD600 nm
-
Préparation des antibiotiques
- Déterminer la concentration d'antibiotiques souhaitées
- Identifier la valeur du MIC à partir du test E (p. ex. 0,125 g/mL pour la pénicilline G et 8 g/mL pour la gentamicine)
- Multipliez la valeur MIC de la plaque d'agar par 24-27, correspondant à quatre-sept dilutions en série 2x. Ce sera la concentration de départ d'antibiotiques. (ex. pour la pénicilline G, sept dilutions en série 2x : 0,125 g/mL x 27 à 16 g/mL; pour la gentamicine, quatre dilutions en série 2x 8 g/mL x 24 x 128 g/mL
- Multiplier la valeur de départ souhaitée 100x afin de déterminer générer une concentration en stock des antibiotiques (p. ex. stocks de 1,6 mg/mL de pénicilline G et de 12,8 mg/mL de gentamicine)
- Préparer une concentration de 100x stocks d'antibiotiques en conséquence
- Dissoudre les antibiotiques dans 10mL d'eau autoclaved, et le vortex pour générer une solution de stock (par exemple 16 mg de pénicilline G et 128 mg de gentamicine pour créer les stocks ci-dessus)
- Déterminer la concentration d'antibiotiques souhaitées
-
Ajouter des bactéries aux puits microplaques
- Aliquot 200 le bouillon MH-F contenant des bactéries inoculum aux puits dans les 3 premières rangées d'une plaque de microtiter de 96 puits pour une expérience dans le triplicate.
-
Ajouter des antibiotiques aux puits microplaques
- Ajouter 200 l de bouillon MH-F supplémentaire avec des bactéries à la première colonne de puits (A1, B1, C1) pour porter le volume total à 400 l.
- Ajouter 4 ll de la concentration en stock d'antibiotiques à la première colonne de puits. Étant donné que l'échantillon contient 400 L, il se traduira par une dilution 100x des antibiotiques.
- Générez une dilution en série 2x en transférant 200 bactéries/antibiotiques de A1 à A2, jusqu'à A11. Pipet vigoureusement entre les dilutions. Répétez l'étape pour des lignes supplémentaires.
- Retirez 200 L de la colonne 11 afin que le volume final dans tous les puits soit de 200 l.
- Laissez la dernière colonne (A12, B12, C12) sans antibiotiques, comme contrôles.
-
Déterminer les valeurs du MIC
- Incuber la plaque microtiter de 96 puits pendant 24 heures à 37oC sans trembler.
- La valeur du MIC est définie comme le dernier puits de la série de dilution qui ne présente aucune croissance visible des bactéries (figure 4). Cette valeur, cependant, ne peut être digne de confiance que si la taille d'inoculum d'origine était correcte.
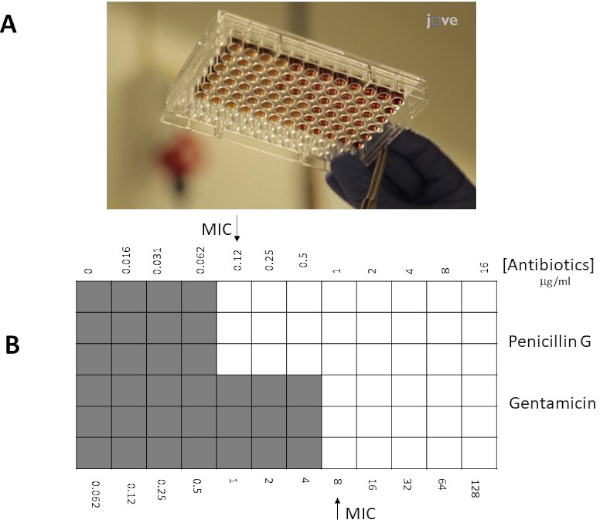
Figure 4 : Détermination du MIC par dilution du bouillon. MIC est ici défini comme le dernier puits qui montre la clarté (pas de croissance des bactéries) avant qu'il ne change la turbidité. Les lignes sont des doublons de la valeur MIC de la pénicilline G et les lignes sont des doublons de la valeur MIC de la gentamicine, à la fois par rapport à un isolat du groupe Streptococcus G. A) résultat expérimental réel, B) interprétation schématique des valeurs de A ( gris et pas de croissance; blanc et la croissance). Veuillez cliquer ici pour voir une version plus grande de ce chiffre.

Figure 5 : Procédure schématique de la série de dilution pour compter la concentration originale des bactéries. Les dilutions ont été effectuées telles que décrites (20 l diluées dans 180 l pour une série de dilution 10x), puis 10 L des rangées A-H sont plaquées sur deux plaques d'agar de sang distinctes comme indiqué. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
-
Déterminer la taille originale de l'inoculum
REMARQUE: Les essais de microbroth sont très sensibles pour la taille originale d'inoculum utilisée. Une taille excessive d'inoculum donnera un résultat faussement positif, puisque les antibiotiques ajoutés ne pourront plus inhiber la croissance à ce ratio. Par conséquent, il est essentiel de vérifier combien de bactéries ont été ajoutées aux micropuits. Bien que les données ne soient pas disponibles au moment de l'expérience (en raison du besoin d'incubation de 24 heures), elles serviront de contrôle. Si le nombre de bactéries ajoutées se situe dans la plage de concentration indiquée, les valeurs MIC peuvent être fiables. Si l'inoculum était trop haut ou trop bas, l'expérience doit être répétée.-
Diluer en série les bactéries
- Préparer une plaque de microtiter de 96 puits pour diluer la concentration bactérienne d'origine afin de déterminer la taille de l'inoculum. L'optimum est un volume de 200 L avec 105-6 bactéries. Pour effectuer les dilutions, d'abord aliquot 180 L stérile PBS à chaque puits en B-H (en triple1-3).
- Ensuite, ajoutez 100 'l de solution bactérienne à A (en triplicate 1-3).
- Générer une dilution en série 10x (en triplicate) en transférant 20 bactéries de A à B, pipet vigoureusement. Répétez les étapes pour C-H.
-
Plaquer les dilutions bactériennes pour la détermination de la taille de l'inoculum
- Marquez les plaques d'agar de sang selon la figure 5.
- Transférer 10 l de la dilution en série à la plaque selon la figure 5.
- Incuber la plaque à 37oC pendant 20-24 heures.
-
Déterminer la taille de l'inoculum bactérien
- Compter les nombres bactériens dans les endroits dans les colonies de 5-50 (figure 6).
- Calculer la taille initiale de l'inoculum en calculant la moyenne des échantillons triplicate, multiplier par le facteur de dilution (par exemple 10x pour les échantillons B, 100x pour les échantillons C, 1000x pour les échantillons D, etc.) et ensuite par 100 pour compenser le volume de repérage de 10 L, ce qui a pour résultat le taille de l'inoculum en cfu/mL. Si l'inoculum est dans 105-6 cfu/mL les données MIC peuvent être fiables.
-
Diluer en série les bactéries
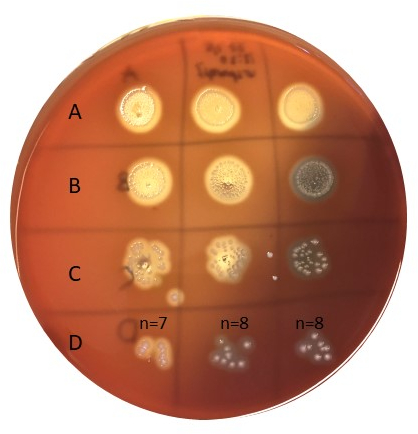
Figure 6 : Détermination de la taille de l'inoculum. Les bactéries inoculées selon la figure 5 ont été incubées pendant 20-24 heures à 37oC, puis comptées. La rangée D compte un bon nombre de colonies (p. ex. 5-50). Les échantillons en A ne sont pas dilués, B est dilué 10x, C est dilué 100x, et D est dilué 1000x, et seulement 10 L est plaqué dans chaque endroit. Veuillez cliquer ici pour voir une version plus grande de ce chiffre.
Résultats
Valeurs MIC en E-test
Les valeurs du MIC individuel ont été identifiées à la figure 1 comme étant de 0,094 g/mL pour la pénicilline G et de 8 g/mL pour la gentamicine. Pour les tests de synergie, les deux ont démontré une valeur MIC pour la pénicilline G de 0,064 g/mL (Figures 2, 3), tandis que la gentamicine avait un MIC 4 g/mL pour les essais croisés et non croisés. Notez qu'un léger écart entre les tests croisés et non croisés peut se produire en raison des différents temps d'incubation des bandes dans les deux paramètres.
Calcul de la synergie
L'équation pour FIC est la suivante:
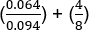 1,18 euros (pas de synergie)
1,18 euros (pas de synergie)
Détermination du MIC dans le bouillon
La nébulosité des puits a indiqué la croissance bactérienne, et donc aucune inhibition ne s'est produite. Le premier puits clair avec pénicilline G (figure 4) contenait 0,12 g/mL de pénicilline G, et c'était donc la valeur du MIC. Pour la gentamicine, le premier puits clair était présent à 8 g/mL de gentamicine. La valeur de la pénicilline G était légèrement plus élevée que lors de l'utilisation d'un test Électronique, en raison de la résolution plus élevée de la bande (par exemple sur la base d'une dilution en série de facteur 1,5x, et non d'un facteur 2x).
Taille d'inoculum
Pour déterminer la taille de l'inoculum, une approche telle qu'elle est décrite aux chiffres 5 et 6 a été utilisée. Les colonies ont été comptées dans la rangée D (1000x dilution), ajoutant jusqu'à 7, 8 et 8 dans la série triplicate avec une valeur moyenne de 7,67 cfu. Le nombre de colonies neeed à multiplier avec le facteur de dilution (par exemple 1000x), ainsi qu'avec 100 pour obtenir cfu/mL, donnant une taille d'inoculum d'environ 8 x 105, bien dans la taille d'inoculum ciblée de 105-6 cfu/mL.
Applications et Résumé
La résistance aux antibiotiques est un problème de santé mondial. Afin de déterminer les mécanismes de résistance des microbes, des méthodes de test de synergie et d'antagonisme avec différents antibiotiques sont cruciales. La méthode E-test est rapide, facile à reproduire, et peut être utilisée pour étudier n'importe quel potentiel synergique des thérapies combinées. La méthode de dilution du bouillon peut également être évaluée pour prédire l'activité bactéricide. Afin d'étudier les mécanismes de résistance de différents microbes, la connaissance des interactions antibiotiques synergiques et antagonistes est cruciale. La combinaison d'antibiotiques peut être une stratégie pour augmenter l'efficacité du traitement et faire face à une résistance aux antibiotiques. Dans les tests effectués ici, nous avons été en mesure de déterminer les valeurs MIC de la pénicilline G et la gentamicine pour le groupe G Streptococcus. Nous avons également démontré que les deux antibiotiques n'affichent pas d'effets synergiques, ne serait donc pas une option de traitement préférée pour de telles infections.
References
- Tan SY, Tatsumura Y. Alexander Fleming (1881-1955): Discoverer of penicillin. Singapore Medical Journal. 56 (7):366-7. (2015)
- Aminov RI. A brief history of the antibiotic era: lessons learned and challenges for the future. Frontiers in Microbiology. 1:134. (2010)
- Pankey GA, Ashcraft DS, Dornelles A. Comparison of 3 E-test (®) methods and time-kill assay for determination of antimicrobial synergy against carbapenemase-producing Klebsiella species. Diagnostic Microbiology and Infectious Disease. 77 (3):220-6. (2013)
- EUCAST: European Committee On Antimicrobial Susceptibility Testing (www.eucast.org).
- Wiegand I, Hilpert K, Hancock RE. Agar and broth dilution methods to determine the minimal inhibitory concentration (MIC) of antimicrobial substances. Nature Protocols. 3 (2):163-75. (2008)
- Doern CD, When does 2 plus 2 equal 5? A review of antimicrobial synergy testing. Journal of Clinical Microbiology. 52 (12):4124-28. (2014)
- Worthington RJ, Melander C. Combination approaches to combat multi-drug resistant bacteria. Trends in Biotechnology. 31 (3):177-84. (2013)
Tags
Passer à...
Vidéos de cette collection:

Now Playing
Tests de sensibilité aux antibiotiques : Utilisation du ETEST pour déterminer la CMI de deux antibiotiques et évaluer la synergie des antibiotiques
Microbiology
93.9K Vues

Création d'une colonne de Winogradsky : une méthode pour enrichir les espèces microbiennes dans un échantillon de sédiments.
Microbiology
129.9K Vues

Dilutions en série et ensemencement des géloses : numération des micro-organismes
Microbiology
317.1K Vues

Cultures enrichies : Cultiver des micro-organismes aérobies et anaérobies dans des milieux sélectifs et différentiels
Microbiology
132.2K Vues

Cultures pures et ensemencement des géloses : isolement des colonies bactériennes pures à partir d'un échantillon mixte
Microbiology
166.4K Vues

Séquençage de l'ARNr 16S : une technique basée sur la PCR pour l'identification d'espèces bactériennes
Microbiology
189.7K Vues

Courbes de croissance : Générer des courbes de croissance en comptant les unités formant colonies (UFC) et en mesurant l'absorbance
Microbiology
297.9K Vues

Microscopie et coloration : Gram, Capsule et endospores.
Microbiology
364.1K Vues

Test de la plaque : méthode de détermination de la charge virale exprimée en unités formant des plaques
Microbiology
186.5K Vues

Transformation des cellules E. coli en utilisant le chlorure de calcium
Microbiology
87.1K Vues

Conjugaison : méthode de transfert de la résistance à l'ampicilline du donneur à l'hôte E. coli
Microbiology
38.4K Vues

Transduction via bactériophage : méthode de transfert de la résistance à l'ampicilline du donneur au receveur E. coli
Microbiology
29.1K Vues