A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
שיטת התרבות העובר שלמים מכרסמים באמצעות Rotator מסוג התרבות מערכת בקבוק
In This Article
Summary
טכניקה שלמים תרבות העובר מאפשר לנו עכבר התרבות עוברי חולדה לשעבר vivo מצב בתקופות מוגבל המתאים בשלבים midgestation. בפרוטוקול הווידאו הזאת, אנחנו מדגימים את הנהלים תקן של התרבות שלנו עובר שלם חולדה לאחר E12.5 באמצעות המפרק מסוג התרבות מערכת בקבוק.
Abstract
העובר שלמים תרבות (WEC) הטכניקה פותחה בשנת 1950 על ידי בניו של וחבריו, והגיש בקשה בביולוגיה התפתחותית 1. למרות התפתחות וצמיחה של עוברי יונקים תלויים באופן קריטי על תפקוד השליה, WEC הטכניקה מאפשרת לנו עכבר התרבות עוברי חולדה מצב vivo לשעבר בתקופות מוגבל המתאים בשלבים עובריים midgestation במהלך היום (ה ') 6.5-E12.5 ב עכבר או E8.5-E14.5 בחולדה 2, 3, 4. ב WEC, אנחנו יכולים ישירות ליעד המבוקש תחומי עוברים באמצעות קנס זכוכית הנימים כי עוברי ניתן להשפיע מתחת למיקרוסקופ. לכן, WEC מכרסם הוא טכניקה שימושית מאוד כאשר אנו רוצים ללמוד תהליכים התפתחותיים הדינמי של עוברי יונקים postimplanted. עד כה, מספר סוגים של מערכות WEC פותחו 1. בין אלה, את הכתף מסוג התרבות מערכת בקבוק הוא הפופולרי ביותר מתאים לתרבות לטווח ארוך של עוברים ב midgestation, כלומר, לאחר E9.5 ואת E11.5 של העכבר חולדה, בהתאמה 1. בפרוטוקול הווידאו הזאת, אנחנו מדגימים את הנהלים הרגילה שלנו של WEC עכברוש לאחר E12.5 באמצעות מודל מזוקק של מערכת המפרק המקורי, אשר תוכנן על ידי ניו Cockroft 5, 6, ו להציג יישומים שונים של טכניקת WEC ללימודי התפתחותי יונקים הביולוגיה.
Protocol
1. הגדרת מערכת WEC
- המשותף קרום 0.22 מיקרומטר מסנן צינור סיליקון מפרצון בתוך מערכת WEC).
- פתח את השסתום של גליל גז המכיל O 2 (95%) ו - CO 2 (5%). תזרים את תערובת גז לתוך התוף דרך בקבוק המכיל מים מבעבעים autoclaved.
- התאם את עוצמת הזרימה של התערובת דלק 50 סמ"ק.
- הכנס את בואו צינור סיליקון לתוך בקבוק המים לבדוק את זרימת תערובת הגזים.
- סובב את התוף במהירות של 20 סל"ד / min.
2. הכנת בינוני תרבות
- עכברוש להפשיר מיד, centrifuged (IC) בסרום על 37.0 מעלות צלזיוס ב). הוסף את D-גלוקוז (2 מ"ג / מ"ל) לתוך בסרום מופשר בכוס 100 מ"ל autoclaved. בינוני התרבות צריכים להיות מוכנים ברמה התרבות העיקרי (למשל, באמצעות מכסה המנוע).
- הוסף לאנטיביוטיקה antimycotic (100x) נוזל סרום עם 1: 400 דילול.
- לאדות isoflurane הנותרים (עקב ההרדמה של חולדות במהלך איסוף דם) מן הנסיוב למשך 20 דקות בטמפרטורת החדר (RT) ג).
- לעקר את המדיום תרבות באמצעות 0.45 קרום מסנן מיקרומטר.
- יוצקים 3.0 מ"ל של המדיום בבקבוק כל תרבות לאטום את החלק העליון של כל בקבוק עם פקק סיליקון, מכוסה בנייר אלומיניום (ראה נ"צ. 14) ד).
- הכן שלוש או ארבע צלחות פטרי המכילות לרשות הדואר מלוחים של Tyrode).
3. הרדמה של החולדה ובידוד של הרחם
- הרדימי עכברוש מתוזמן בהריון שאיפה עמוקה עם הרדמה או Parenteral.
- נקו את אזור הבטן של חולדה בהריון הרדים עם אתנול 70%.
- תרימי את העור עם מלקחיים exteriorize את דופן הבטן על ידי חיתוך העור עם מספריים גדולות ו).
- תרימי את דופן הבטן עם זוג מלקחיים ולעשות בצורת U חתכים האורך גדול על דופן הבטן במספריים גדולים עד g רמת החזה).
- דובי משם את המעי לצד שמאל עם זוג מלקחיים ולחשוף קצה אחד של הרחם קשור השחלה.
- תרים את הקצה של הרחם עם זוג מלקחיים ולחתוך את המיקום בין הרחם לשחלות במספריים גדולים.
- קח את הרחם מן החולדה בהריון על ידי חיתוך שומן סביב הרחם עד לקצה השני של הרחם.
- מעבירים את הרחם כדי בצלחת פטרי המכילה תמיסת מלח של Tyrode.
- להרדים את העכברוש על ידי הממשל יתר של חומרי הרדמה או פריקה צוואר הרחם לאחר הסרת הרחם.
4. הסרת עוברים מן הרחם
- בקצרה לשטוף את הרחם מלוחים של Tyrode ולהעביר אותו בצלחת פטרי השני עם צמד מצוין מלקחיים ח).
- תחת מיקרוסקופ המשקפת, להרים את קיר הרחם עם זוג מלקחיים בסדר וחתך את קיר הרחם בבית מול צד mesometrium חיבור עם כלי דם באמצעות מספריים עיניים ישר.
- הכנס את קצה מספריים עיניים ישר אל תוך החלל שבין קיר הרחם decidua. חותכים את דופן הרחם longitudinally בצד antimesometrial.
- סבך decidua בצד mesometrial ו conceptuses נפרד מן הרחם באמצעות שני זוגות מלקחיים בסדר i).
- העברת conceptuses כדי בצלחת פטרי השלישי עם טפטפת זכוכית מעוקר עם קוטר מתאים.
5. Dissection של עוברי חולדה
- להוסיף אחת קצה microforceps לתוך decidua ולעשות חתך רוחבי על decidua סביב conceptus עם שני זוגות מלקחיים.
- הכנס את קצות מלקחיים לתוך decidua בצד השליה לעשות שני חתכים על האורך decidua למעלה.
- הסר את decidua בצד השליה ידי קריעה על כך עם שני זוגות מלקחיים. הסר את decidua שנותרו עם שני זוגות מלקחיים.
- תרימי הממברנה של רייכרט, לעשות חתך אופקי על זה, להפריד את הקרום מן conceptus בצד אנטי השליה.
- עושים חור קטן על שק החלמון ליד ראשו של העובר עם שני זוגות מלקחיים, וחתך את שק החלמון עם זוג מספריים עיניים מעוקל. חשוב לא לפגוע בכלי הדם הגדולים.
- תרימי את amnion באתר סביב ראשו של העובר עם שני זוגות מלקחיים בסדר, בעדינות לשלוף את העובר מתוך שק החלמון על ידי קריעת h amnion). גופתו של העובר צריך להיות שלף של שק החלמון כדי להגדיל את אספקת החמצן לעובר בשלב midgestation.
6. העובר שלמות תרבות
- בדוק נזקים על השליה, שק החלמון, ואת מצבם של פעימות הלב ואת זרימת הדם.
- להיות מודע לא למתוח את חבל הטבור, העברתהעובר על בקבוק תרבות עם טפטפת זכוכית מעוקר. נשיאה של מעל מלוחים של Tyrode על בקבוקי תרבות צריך להיות כמה שפחות.
- הסרת התוספת הלא חור סיליקון מהתוף rotator. חבר את בקבוק תרבות עם תקע עם חור אל התוף מסובב של מערכת WEC בניצב. היזהר שלא לשים בכוח על התוף לכיוונים מתאימים מאז תוף rotator הוא ציוד עדין מאוד. הבקבוקים המכילים את העובר גזור מועברים תרבות אחד אחד; פתיחת הדלת הקדמית של החממה צריך להיות ממוזער, כדי למנוע את הטמפרטורה בחממה יורדת י).
- לאחר 10 שעות של תרבות, להגדיל את היקף הזרימה של התערובת דלק של עד 75 סמ"ק עד 100 סמ"ק לאחר 24 שעות (טבלה 1).
- המדיום תרבות יש לשנות סביב 24 שעות על ידי העברת העובר תרבותי לתוך בקבוק תרבות חדשה עם המדיום מוכן טרי. להגדיל את נפח זרימת עד 125 סמ"ק לאחר שעה 34 ועד 150 סמ"ק לאחר 48 שעות (טבלה 1)
- מדי פעם לבדוק את מצבם של העוברים בתרבית על ידי ספירת קצב פעימות הלב (כלומר, 120-150/min הוא אופטימלי) ועל ידי התבוננות זרימת הדם. אם יש צורך לספור את מספר somites לשפוט את הצמיחה של עוברים מלוחים של Tyrode. בהתפתחות נורמלית, אחד somite הוא הוסיף תוך שעתיים.
- WEC כאשר הוא סיים, להפסיק אספקת תערובת גז לנתק את צינור היניקה ואת קרום מסנן כדי למנוע חזרה לזרום לתוך צינור היניקה מהבקבוק מבעבע.
7. הערות
- הטמפרטורה בתוך המערכת WEC נשמר כל הזמן על 37.0-37.5 ° C.
- עכברוש 100% IC בסרום משמש באופן שגרתי WEC שלנו עוברים חולדה ועכבר, והמשיך ב -20 מעלות לפני השימוש.
- אנו לרכוש עכברוש IC בסרום, אשר נאסף חולדות מורדמים עם isoflurane.
- בקבוקי פנויה זמינים גם מן Ikemoto ריקה. בקבוקים אטמי סיליקון יש autoclaved.
- Dissection של עוברי צריך להתבצע בכל RT כי שמירה של עוברים בטמפרטורה נמוכה או גבוהה במהלך דיסקציה להשפיע על התפתחות שלאחר מכן ב WEC.
- כלים לניתוח הם מעוקרים ידי חום יבש.
- העור ואת דופן הבטן צריך לחתוך בנפרד, כדי למנוע זיהום של שערות לתוך צלחת האפשרי. אנו שינוי מספריים מלקחיים גדולים עם זוג חדש של אותם כאשר אנו לגזור את העור לבודד את הרחם, בהתאמה.
- בעזרת מלקחיים שקצותיהם בסדר חשוב מאוד לנתח רקמות בהחלט. אנו ידני לחדד את קצות מלקחיים עם אבן שמן מכונות.
- אנו משתמשים צד אחד של מלקחיים כמו סכין כדי למנוע לחץ עודף על עוברים.
- כאשר הטמפרטורה בתוך המערכת WEC פוחתת ידי פתיחת הדלת שוב ושוב, אנו ממשיכים להדליק את האור כדי לשמור על הטמפרטורה בתוך המערכת.
8. נציג תוצאות
איור 1 מציג נהלים של דיסקציה של העובר חולדה עוברי חולדה תרבותי.
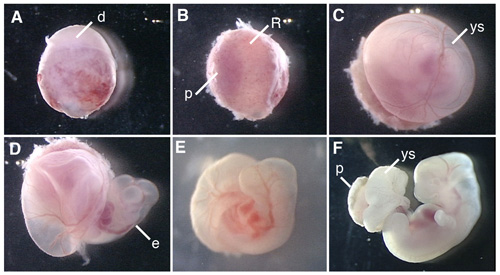
באיור 1. תרבות העובר שלמים של העובר E12.5 את העכברוש. (א) conceptus גזור מן הרחם של חולדה בהריון. (ב) הסרת decidua בצד השליה. (ג) הסרת קרום של רייכרט. (ד) פתיחת שק החלמון. (ה) העובר עכברוש culturing בבקבוק במשך 6 שעות לאחר תחילת WEC. (ו) העובר עכברוש תרבותי עבור 42 שעות. ד, decidua; R; קרום של רייכרט, p, השליה, ys, שק חלמון, דואר, העובר.
| 0 hr | 12 שעות | 24 שעות | 36 שעות | 48 שעות | |
| E12.5 עכברוש העובר | 95% 50 סמ"ק | 95% 75 סמ"ק (10 שעות) | 95% 100 סמ"ק | 95% 125 סמ"ק (34 שעות) | 95% 150 סמ"ק |
טבלה 1. מצב חמצן אופטימלית.
Discussion
ישנם שני שלבים קריטיים WEC מכרסם להצלחה. ראשית, הליך לנתיחה צריך להיות מדויק ולא עוברים נזק, בעיקר כלי הדם. שנית, ההליך צריך להיות מהר ככל האפשר כי החמצן מזין אינם מסופקים דרך השליה לאחר במנותק מן הרחם. זה קריטי עוברים יותר. במקרה של WEC עכברוש לאחר E12.5, אנחנו צריכים להעביר ...
Disclosures
Acknowledgements
אנו מודים למר האג'ימה Ichijo עצות עבור וידאו הקלטה מועיל עבור עריכת וידאו. כמו כן, אנו מודים Drs.Yuji Tsunekawa ו Kaichi Yoshizaki עבור עוזר סוג הקלטה וידאו. עבודה זו נתמכת על ידי KAKENHI על B המדען הצעיר על תחומי המדע, מולקולרית המוח עדיפות מ MEXT של יפן. אנו מכירים את התמיכה של גלובל COE תוכנית "יסוד Translational המרכז לחקר מדעי המוח גלובל" מ MEXT של יפן המחקר Core למדע וטכנולוגיה Evolutional ו (CREST) מתוך מדעי החברה היפנית למדע וטכנולוגיה של היפנים הסוכנות וטכנולוגיה (JST) .
Materials
| Name | Company | Catalog Number | Comments | |
| שם | סוג | חברה | מספר קטלוגי | הערה |
| הגדרת WEC | ||||
| WEC המערכת (10-0310) | כלי | Ikemoto ריקה | 010-0310 | עוד דגם קטן הוא גם זמין. |
| הסיליקון תקע ללא חור | כלי | Ikemoto ריקה | 010-032-08 | |
| תערובת גז גליל | כלי | ניקו Sanso | - | מכיל 95% חמצן, פחמן דו חמצני & 5%. סדר מותאם אישית. |
| גז הרגולטור | כלי | אונו Seisakusho | WR-11 | |
| 0.22 מיקרומטר לסנן Millex GS | כלי | Millipore | SLGS033SS | |
| הרדמה ובידוד של הרחם | ||||
| מספריים גדול | כלי | Napox | B-7H | |
| מצבטים | כלי | Napox | A-3-2 | |
| צלחת פטרי סילוק (90 מ"מ x 15 מ"מ) | כלי | Iwaki | SH90-15 | עמוק סוג מאכל הוא הטוב ביותר לניתוח. |
| Isoflurane | מגיב | אבוט | B506 | עבור הרדמה |
| Pentobarbital נתרן | מגיב | שרינג פלאו לבריאות בעלי חיים | - | עבור הרדמה |
| של מלח Tyrode | מגיב | - | - | לדברי כפרוטוקול ב Ref. 2. שמור על 4 ° C. |
| מתוזמן בהריון Sprague-Dawley עכברוש | בעל חיים | צ'ארלס ריברס מעבדות יפן | - | |
| הכנת בינוני תרבות | ||||
| בקבוק זכוכית תרבות | כלי | Ikemoto ריקה | 010-032-05 | |
| תרבות סילוק בקבוק | כלי | Ikemoto ריקה | 010-032-06 | |
| הסיליקון תקע עם חור | כלי | Ikemoto ריקה | 010-032-07 | |
| רדיד אלומיניום | כלי | כל חברה | - | |
| מעוקר שקית | כלי | Hogy | HM-26 | עבור בקבוקי תרבות |
| מעוקר שקית | כלי | Hogy | HM-14 א | עבור אטמי סיליקון |
| 0.45 מיקרומטר לסנן Millex HA | כלי | Millipore | SLHA033SS | |
| 50 מ"ל צינור חרוטי | כלי | בקטון דיקינסון | 352070 | |
| 100 מ"ל כוס | כלי | Iwaki | TE-32 | |
| עכברוש IC בסרום | מגיב | צ'ארלס ריברס מעבדות יפן | - | עיין: מר Kunihiko Morisaki, טל: +81- (0) 45-474-9336, פקס: +81- (0) 45-474-9340 |
| D (+), גלוקוז | מגיב | Wako | 041-00595 | |
| לאנטיביוטיקה antimyotic נוזלי | מגיב | Gibco | 15240 | |
| Dissection של עוברים | ||||
| עיניים מספריים ישר | כלי | Napox | MB50-7 | עבור חיתוך דופן הרחם |
| עיניים מספריים מעוקל | כלי | Napox | MB54-2 | עבור חיתוך שק החלמון |
| מלקחיים # 5 | כלי | מרץ | T6715 | |
| מלקחיים # 5F | כלי | רגינה | T6819 | |
| זכוכית פיפטה | כלי | - | - | בעבודת יד באמצעות פיפטה פסטר. |
| מעוקר שקית | כלי | Hogy | HM-4 | עבור pipettes זכוכית |
| המשקפת מיקרוסקופ | כלי | לייקה | Mz7s | |
| אור | כלי | לייקה | CLS 150XD | |
| שמן האבן | כלי | אושידה יוקו | 833-2000 | עבור השחזה של מלקחיים |
| מכונת שמן | כלי | אושידה יוקו | 835-0000 | עבור השחזה של מלקחיים |
References
- New, D. A. T., Copp, A. J., Cockroft, D. L. Intoroduction. In mammalian postimplantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 1-14 (1990).
- Cockroft, D. L., Copp, A. J., Cockroft, D. L. Dissection and culture of post implantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 15-40 (1990).
- Morris-Kay, G. M. Postimplantation mammalian embryos. Essential Developmental Biology A Practical Approach. , 55-66 (1993).
- Fujinaga, M., Tuan, R. S., Lo, C. W. In vitro culture of rodent embryos during the early postimplantation period. Developmental Biology Protocols. , 53-76 (2000).
- Eto, K., Takakubo, F. Improved development of rat embryos in culture during the period of craniofacial morphogenesis. J. Craniofac. Genet. Dev. Biol. 5, 351-355 (1985).
- New, D. A., Cockroft, D. L. A rotating bottle culture method with continuous replacement of the gas phase. Experientia. 35, 138-140 (1979).
- Osumi-Yamashita, N., Ninomiya, Y., Eto, K. Mammalian craniofacial embryology in vitro. Int. J. Dev. Biol. 41, 187-194 (1997).
- Inoue, T., Nakamura, S., Osumi, N. Fate mapping of the mouse prosencephalic neural plate. Dev. Biol. 219, 373-383 (2000).
- Nomura, T., Holmberg, J., Frisen, J., Osumi, N. Pax6-dependent boundary defines alignment of migrating olfactory cortex neurons via the repulsive activity of ephrin A5. Development. 133, 1335-1345 (2006).
- Inoue, Y. U., Asami, J., Inoue, T. Genetic labeling of mouse rhombomeres by Cadherin-6::EGFP-BAC transgenesis underscores the role of cadherins in hindbrain compartmentalization. Neurosci. Res. 63, 2-9 (2009).
- Calegari, F., Huttner, W. B. An inhibition of cyclin-dependent kinases that lengthens, but does not arrest, neuroepithelial cell cycle induces premature neurogenesis. J. Cell Sci. 116, 4947-4955 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Arai, Y. Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. J. Neurosci. 25, 9752-9761 (2005).
- Takahashi, M., Nomura, T., Osumi, N. Transferring genes into cultured mammalian embryos by electroporation. Dev. Growth Differ. 50, 485-497 (2008).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved