Zum Anzeigen dieser Inhalte ist ein JoVE-Abonnement erforderlich. Melden Sie sich an oder starten Sie Ihre kostenlose Testversion.
Method Article
Die Methode der Nager Whole Embryo Culture mit der Rotator-type Bottle Kultur-System
In diesem Artikel
Zusammenfassung
Whole Embryo Kultur Technik ermöglicht es uns, Kultur Maus und Ratte Embryonen Ex vivo Zustand während begrenzter Zeiträume entsprechend midgestation Stufen. In diesem Video-Protokoll, demonstrieren wir unsere Standard-Verfahren der Ratte ganze Embryo Kultur nach E12.5 mit dem Rotor-Typ Flasche Kultur-System.
Zusammenfassung
Whole Embryo Culture (WEC) Technik hat im Jahr 1950 ist schon von New und seine Kollegen entwickelt und angewendet für Entwicklungsbiologie 1. Obwohl die Entwicklung und das Wachstum von Säugetieren Embryonen hängt entscheidend von der Funktion der Plazenta sind, ermöglicht WEC Technik uns zur Kultur Maus und Ratte Embryonen ex vivo Zustand während begrenzter Zeiträume entsprechend midgestation Stadien während der embryonalen Tag (E) 6,5-E12.5 in der Maus oder E8.5-E14.5 in der Ratte 2, 3, 4. In WEC, können wir direkt Bereichen von Embryonen mit feinen Glaskapillaren gewünschte Ziel, weil Embryonen unter dem Mikroskop manipuliert werden kann. Daher ist Nagetier WEC sehr nützliche Technik, wenn wir auf dynamische Entwicklungsprozesse postimplanted Säugerembryonen studieren wollen. Up to date, haben verschiedene Typen von WEC-Systeme bereits 1 entwickelt. Unter denen ist die Rotor-Typ Flasche Kultursystem beliebtesten und eignet sich für langfristige Kultur der Embryonen midgestation, dh nach E9.5 und E11.5 in der Maus und Ratte, bzw. 1. In diesem Video-Protokoll, demonstrieren wir unsere Standard-Verfahren der Ratte WEC nach E12.5 mit einem verfeinerten Modell der ursprünglichen Rotator System, das von Neu-und Cockroft 5, 6 entwickelt wurde, und stellen verschiedene Anwendungen der WEC-Technik für ein Studium in Säugetier-Entwicklung Biologie.
Protokoll
1. Einrichten des WEC-System
- Joint ein 0,22 um Membranfilter mit dem Einlass Silikonschlauch im WEC-System a).
- Öffnen Sie das Ventil einer Gasflasche mit O 2 (95%) und CO 2 (5%). Durchfluss des Gasgemisches in die Trommel über die sprudelnde Flasche mit Wasser autoklaviert.
- Passen Sie den Volumenstrom des Gasgemisches zu 50 cc.
- Legen Sie die aus lassen Silikonschlauch in eine Flasche Wasser und überprüfen Sie die Strömung von Gas-Gemisch.
- Drehen Sie die Trommel mit einer Geschwindigkeit von 20 U / min.
2. Vorbereitung des Kulturmediums
- Thaw Ratte sofort zentrifugiert (IC) Serum bei 37,0 ° C b). Add D-Glucose (2 mg / ml) in Serum aufgetaut in einer autoklavierten 100 ml Becher. Kulturmedium sollte in der primären Kultur Ebene (z. B. mit einer Kapuze) hergestellt werden.
- Add Antibiotika-Antimykotikum (100X) Flüssigkeit, um das Serum mit 1: 400 Verdünnung.
- Vaporize verbleibenden Isofluran (wegen Anästhesie von Ratten während der Blutentnahme) aus dem Serum für 20 Minuten bei Raumtemperatur (RT) c).
- Sterilisieren des Kulturmediums mit einem 0,45 um Membranfilter.
- Gießen Sie 3,0 ml des Mediums in jeder Kultur Flasche und verschließen Sie oben auf jeder Flasche mit einem Silizium-Stecker, mit Alufolie abgedeckt (vgl. Rz. 14) d).
- Bereiten Sie drei oder vier zur Verfügung Petrischalen mit Tyrode-Salzlösung e).
3. Anästhesie der Ratte und der Isolation der Gebärmutter
- Anesthetize einer zeitlich trächtigen Ratten tief mit inhalativen oder parenterale Anästhetika.
- Reinigen Sie den Bauchbereich des narkotisierten trächtigen Ratten mit 70% Ethanol.
- Pick-up die Haut mit einer Pinzette und exteriorisieren der Bauchdecke, indem man die Haut mit großen Scheren f).
- Pick-up die Bauchdecke mit einer Pinzette und machen U-förmigen großen Längsschnitten auf der Bauchdecke mit großen Scheren bis zur Brustwirbelsäule g).
- Bär weg den Darm auf der linken Seite mit einer Pinzette und setzen Sie ein Ende des Uterus mit dem Eierstock.
- Pick-up am Ende des Uterus mit einer Pinzette und schneiden Sie die Position zwischen der Gebärmutter und Eierstöcke mit großen Scheren.
- Nehmen Sie die Gebärmutter von trächtigen Ratten, indem das Fett um die Gebärmutter bis zum anderen Ende der Gebärmutter.
- Übertragen Sie die Gebärmutter auf eine Petrischale mit Tyrode-Salzlösung.
- Euthanize der Ratte durch übermäßige Gabe von Anästhetika oder Genickbruch nach dem Entfernen der Gebärmutter.
4. Beseitigung von Embryonen aus der Gebärmutter
- Kurz spülen die Gebärmutter in Tyrode-Salzlösung und überträgt es auf die zweite Petrischale mit einer feinen Pinzette h).
- Unter einem Binokular, pick up der Gebärmutterwand mit einer feinen Pinzette und schneiden Sie die Gebärmutterwand an der gegenüberliegenden Seite der Mesometrium Verbindung mit Blutgefäßen mittels ophthalmologischen geraden Schere.
- Legen Sie die Spitze des ophthalmologischen geraden Schere in den Raum zwischen der Gebärmutterwand und decidua. Cut der Gebärmutterwand längs der antimesometrial Seite.
- Clump der Decidua am mesometrial Seite und separaten conceptuses aus der Gebärmutter mit zwei Paaren von feinen Pinzette i).
- Transfer conceptuses zum dritten Petrischale mit einer sterilisierten Glaspipette mit einem geeigneten Durchmesser.
5. Präparation Rattenembryonen
- Legen Sie eine Spitze der microforceps in die Dezidua und machen einen Querschnitt über die decidua rund um die Fruchtblase mit zwei Pinzetten.
- Legen Sie die Spitzen der Pinzette in die Decidua an der Plazenta Seite und machen Sie zwei Längsschnitten auf der Decidua an die Spitze.
- Entfernen Sie die Decidua an der Plazenta Seite durch Herausreißen, die mit zwei Pinzetten. Entfernen Sie die restlichen decidua mit zwei Pinzetten.
- Pick up Reichert-Membran, machen ein horizontaler Schnitt auf sie, und trennen Sie die Membran von der Fruchtblase bei der Anti-Plazenta-Seite.
- Machen Sie ein kleines Loch auf dem Dottersack in der Nähe des Kopfes des Embryos mit dem zwei Pinzetten, und schneiden Sie den Dottersack mit einem Paar von ophthalmologischen gebogene Schere. Es ist wichtig, nicht zu größeren Blutgefäße schädigen.
- Pick-up das Amnion an der Stelle um den Kopf des Embryos mit den beiden Paaren von feinen Pinzette und ziehen Sie vorsichtig den Embryo aus dem Dottersack durch Zerreißen der Amnion h). Der Körper des Embryos sollte aus dem Dottersack gezogen werden, um die Sauerstoffversorgung für den Embryo im Stadium midgestation erhöhen.
6. Whole Embryo Kultur
- Überprüfen Sie Schäden an der Plazenta, Dottersack, und der Zustand der Herzschlag und Blutkreislauf.
- Im Bewusstsein der nicht Dehnen der Nabelschnur, Transferder Embryo zu einer Kultur-Flasche mit einem sterilisierten Glaspipette. Carry over von Tyrode-Salzlösung zur Kultur-Flaschen sollten so wenig wie möglich.
- Entfernen Sie eine nicht-Loch-Silizium-Stecker aus der Rotator Trommel. Verbinden Sie die Kultur-Flasche mit einem Stopfen mit einem Loch für den Rotator Trommel der WEC-System senkrecht. Achten Sie darauf, nicht zu zwingen, auf die Trommel gelegt in ungeeigneten Richtungen, da der Rotor Trommel ist ein sehr feines Gerät. Die Flaschen mit den präparierten Embryonen sind zur Kultur einer nach dem anderen übertragen; Öffnung der Tür des Inkubators sollten minimiert werden, um die Temperatur des Inkubators vermeiden, ist zurückgegangen j werden).
- Nach 10 h Kultur, erhöhen Sie den Volumenstrom des Gasgemisches bis zu 75 ccm und bis zu 100 ccm nach 24 h (Tabelle 1).
- Das Kulturmedium sollte etwa 24 Stunden durch die Übertragung der kultivierten Embryonen in eine neue Kultur-Flasche mit frisch zubereiteten Medium gewechselt werden. Erhöhen Sie den Volumenstrom bis 125 ccm nach 34 Stunden und bis zu 150 ccm nach 48 h (Tabelle 1)
- Überprüfen Sie gelegentlich den Zustand der kultivierten Embryonen durch Zählen Herzfrequenz (dh 120-150/min ist optimal) und durch Beobachtung die Durchblutung. Bei Bedarf zählen die Anzahl der Somiten, um das Wachstum der Embryonen in Tyrode-Salzlösung zu beurteilen. In der normalen Entwicklung ist eine Somiten in zwei Stunden zugegeben.
- Wenn WEC abgeschlossen ist, stoppen Lieferung von Gas-Gemisch und ziehen Sie das Zuleitungsrohr und der Membranfilter zu vermeiden, zurück in das Zuleitungsrohr an der sprudelnden Flasche.
7. Hinweise
- Die Temperatur im Inneren des WEC-System ist ständig auf 37,0-37,5 ° C gehalten
- 100% Ratte IC Serum wird routinemäßig in unserer WEC für Ratten-und Mäuse-Embryonen verwendet werden, und bei -20 ° C vor dem Gebrauch.
- Wir kaufen Ratte IC Serum, das von Ratten, die mit Isofluran gesammelt wird.
- Einweg-Flaschen sind auch aus Ikemoto Rika zur Verfügung. Flaschen und Silikonstopfen sollten autoklaviert werden.
- Dissection von Embryonen bei RT durchgeführt werden, da die Aufrechterhaltung von Embryonen bei niedrigen oder hohen Temperaturen während der Präparation spätere Entwicklung beeinflussen in WEC.
- Werkzeuge für die Dissektion sind durch trockene Hitze sterilisiert.
- Die Haut und Bauchwand getrennt geschnitten werden, um eine Kontamination der Haare in eine Schale wie möglich zu vermeiden. Wir wechseln ein paar große Schere und Pinzette mit einem neuen Paar von ihnen, wenn wir die Haut schneiden und zu isolieren, die Gebärmutter, bzw..
- Mit einer Pinzette, deren Spitzen in Ordnung ist sehr wichtig für Gewebe sicher zu sezieren. Wir manuell schärfen den Spitzen der Pinzette mit einem Stein und Maschinenöl.
- Wir verwenden eine Seite der Pinzette wie ein Messer, um Überdruck von Embryonen zu vermeiden.
- Wenn die Temperatur im Inneren des WEC-System durch das Öffnen der Tür immer wieder abnimmt, arbeiten wir weiter an der Ampel links auf die Temperatur im Inneren des Systems zu halten.
8. Repräsentative Ergebnisse
Abbildung 1 zeigt Verfahren der Zerlegung des Rattenembryo und kultivierten Ratte Embryonen.
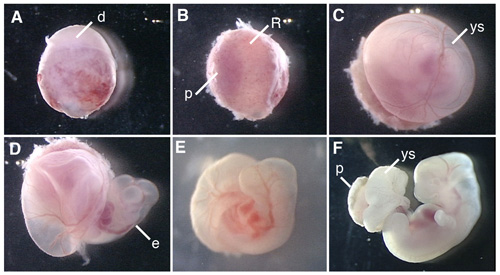
Abbildung 1. Whole Embryo Kultur der E12.5 Rattenembryo. (A) A conceptus aus der Gebärmutter der schwangeren Ratten seziert. (B) Entfernung von der Dezidua in der Plazenta Seite. (C) Entfernung von Reichert-Membran. (D) Eröffnung der Dottersack. (E) Die Rattenembryo Kultivierung in der Flasche für 6 Stunden nach Beginn der WEC. (F) Die Rattenembryo für 42 h kultiviert. d, decidua; R; Reichert-Membran, p, Plazenta, ys, Dottersack, e, Embryo.
| 0 Std. | 12 Stunden | 24 Stunden | 36 h | 48 Stunden | |
| E12.5 Rattenembryo | 95% 50 cc | 95% 75 ccm (10 h) | 95% 100 cc | 95% 125 ccm (34 hr) | 95% 150 cc |
Tabelle 1. Optimale Sauerstoff Zustand.
Diskussion
Es gibt zwei kritische Schritte in Nagetier WEC für den Erfolg. Erstens sollte die Dissektion Verfahren genau nicht zu beschädigen Embryonen, vor allem die Blutgefäße. Zweitens sollte das Verfahren so schnell wie möglich sein, da Sauerstoff und Nährstoffen nicht mehr versorgt werden über die Plazenta nach der Isolierung aus der Gebärmutter. Dies ist entscheidend für ältere Embryonen. Im Fall der Ratte WEC nach E12.5, sollten wir seziert Embryonen in Kultur-Flaschen Transfer innerhalb von 30 Minuten.
Offenlegungen
Danksagungen
Wir danken Herrn Hajime Ichijo für Video-Aufzeichnung und hilfreiche Ratschläge für die Bearbeitung des Videos. Wir danken auch Drs.Yuji Tsunekawa und Kaichi Yoshizaki für Art-Assistent für Video-Aufzeichnung. Diese Arbeit wird durch KAKENHI am Young Scientist B und auf die vorrangigen Bereiche-Molecular Brain Science aus MEXT von Japan unterstützt. Wir erkennen die Unterstützung der Global COE Program "Basic und Translational Research Center for Global Brain Science" von MEXT Japans und der Core Research für Entwicklungskreis Science and Technology (CREST) aus der japanischen Science and Technology Corporation aus Japan Science and Technology Agency (JST) .
Materialien
| Name | Company | Catalog Number | Comments | |
| Name | Typ | Firma | Catalog Number | Kommentar |
| Einrichten WEC | ||||
| WEC-System (10-0310) | Werkzeug | Ikemoto Rika | 010-0310 | Ein weiteres kleines Modell ist ebenfalls erhältlich. |
| Silicon-Stecker, ohne ein Loch | Werkzeug | Ikemoto Rika | 010-032-08 | |
| Gas-Gemisch Zylinder | Werkzeug | Nikko Sanso | - | Mit 95% Sauerstoff und 5% Kohlendioxid. Benutzerdefinierte Reihenfolge. |
| Gasregler | Werkzeug | Ono Seisakusho | WR-11 | |
| 0,22 um Filter Millex GS | Werkzeug | Millipore | SLGS033SS | |
| Anästhesie und Isolierung der Gebärmutter | ||||
| Große Schere | Werkzeug | Napox | B-7H | |
| Zange | Werkzeug | Napox | A-3-2 | |
| Entsorgung Petrischale (90 mm x 15 mm) | Werkzeug | Iwaki | SH90-15 | Deep-Typ Gericht ist der beste für die Präparation. |
| Isofluran | Reagens | Abbott | B506 | Für Anästhesie |
| Pentobarbital-Natrium | Reagens | Schering-Plough Animal Health | - | Für Anästhesie |
| Tyrode-Salzlösung | Reagens | - | - | Nach wie das Protokoll in Ref. 2. Sparen Sie bei 4 ° C. |
| Timed-trächtigen Sprague-Dawley Ratten | Tier | Charles Rivers Laboratories in Japan | - | |
| Vorbereitung des Kulturmediums | ||||
| Kultur Glasflasche | Werkzeug | Ikemoto Rika | 010-032-05 | |
| Entsorgung Kultur Flasche | Werkzeug | Ikemoto Rika | 010-032-06 | |
| Silicon-Stecker mit Loch | Werkzeug | Ikemoto Rika | 010-032-07 | |
| Aluminiumfolie | Werkzeug | Jedes Unternehmen, | - | |
| Autoklavieren Tasche | Werkzeug | Högy | HM-26 | Für Kultur-Flaschen |
| Autoklavieren Tasche | Werkzeug | Högy | HM-14A | Für Silikonstopfen |
| 0,45 um Filter Millex HA | Werkzeug | Millipore | SLHA033SS | |
| 50 ml konischen Rohr | Werkzeug | Becton Dickinson | 352070 | |
| 100 ml Becher | Werkzeug | Iwaki | TE-32 | |
| Rat IC Serum | Reagens | Charles Rivers Laboratories in Japan | - | Siehe: Mr. Kunihiko Morisaki, TEL: +81- (0) 45-474-9336, Fax: +81- (0) 45-474-9340 |
| D (+)-Glucose | Reagens | Wako | 041-00595 | |
| Antibiotika-antimyotic Flüssigkeit | Reagens | Gibco | 15240 | |
| Dissection von Embryonen | ||||
| Ophthalmic gerade Schere | Werkzeug | Napox | MB50-7 | Zum Schneiden der Gebärmutterwand |
| Ophthalmic gebogene Schere | Werkzeug | Napox | MB54-2 | Zum Schneiden der Dottersack |
| Zange # 5 | Werkzeug | Kraft | T6715 | |
| Zange # 5F | Werkzeug | Regine | T6819 | |
| Glaspipette | Werkzeug | - | - | Made by Hand mit Pasteurpipette. |
| Autoklavieren Tasche | Werkzeug | Högy | HM-4 | Für Glas-Pipetten |
| Binokulares Mikroskop | Werkzeug | Leica | Mz7s | |
| Licht | Werkzeug | Leica | CLS 150XD | |
| Oil Stein | Werkzeug | Uchida Yoko | 833-2000 | Zum Schärfen der Zange |
| Maschinenöl | Werkzeug | Uchida Yoko | 835-0000 | Zum Schärfen der Zange |
Referenzen
- New, D. A. T., Copp, A. J., Cockroft, D. L. Intoroduction. In mammalian postimplantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 1-14 (1990).
- Cockroft, D. L., Copp, A. J., Cockroft, D. L. Dissection and culture of post implantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 15-40 (1990).
- Morris-Kay, G. M. Postimplantation mammalian embryos. Essential Developmental Biology A Practical Approach. , 55-66 (1993).
- Fujinaga, M., Tuan, R. S., Lo, C. W. In vitro culture of rodent embryos during the early postimplantation period. Developmental Biology Protocols. , 53-76 (2000).
- Eto, K., Takakubo, F. Improved development of rat embryos in culture during the period of craniofacial morphogenesis. J. Craniofac. Genet. Dev. Biol. 5, 351-355 (1985).
- New, D. A., Cockroft, D. L. A rotating bottle culture method with continuous replacement of the gas phase. Experientia. 35, 138-140 (1979).
- Osumi-Yamashita, N., Ninomiya, Y., Eto, K. Mammalian craniofacial embryology in vitro. Int. J. Dev. Biol. 41, 187-194 (1997).
- Inoue, T., Nakamura, S., Osumi, N. Fate mapping of the mouse prosencephalic neural plate. Dev. Biol. 219, 373-383 (2000).
- Nomura, T., Holmberg, J., Frisen, J., Osumi, N. Pax6-dependent boundary defines alignment of migrating olfactory cortex neurons via the repulsive activity of ephrin A5. Development. 133, 1335-1345 (2006).
- Inoue, Y. U., Asami, J., Inoue, T. Genetic labeling of mouse rhombomeres by Cadherin-6::EGFP-BAC transgenesis underscores the role of cadherins in hindbrain compartmentalization. Neurosci. Res. 63, 2-9 (2009).
- Calegari, F., Huttner, W. B. An inhibition of cyclin-dependent kinases that lengthens, but does not arrest, neuroepithelial cell cycle induces premature neurogenesis. J. Cell Sci. 116, 4947-4955 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Arai, Y. Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. J. Neurosci. 25, 9752-9761 (2005).
- Takahashi, M., Nomura, T., Osumi, N. Transferring genes into cultured mammalian embryos by electroporation. Dev. Growth Differ. 50, 485-497 (2008).
Nachdrucke und Genehmigungen
Genehmigung beantragen, um den Text oder die Abbildungen dieses JoVE-Artikels zu verwenden
Genehmigung beantragenThis article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. Alle Rechte vorbehalten