このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
腱板断型ボトルの培養システムを使用してげっ歯類全胚培養の方法
要約
全胚培養法は、培養マウスやラットの胚に連絡することができます生体外で条件。このビデオプロトコルでは、ローテータ型ボトルの培養系を用いて12.5日後にラットの全胚培養の私達の標準的な手順を示しています。
要約
全胚培養(WEC)技術は、新しいと彼の同僚によって1950年代に開発され、発生生物学1に適用されている。開発と哺乳類の胚の成長は、胎盤の機能に深く依存しているが、WECの技術は、胚の日中の妊娠中期の段階に対応する限られた期間の培養マウスやラットの胚ex vivoでの条件(E)が6.5 - E12.5に連絡することができますマウスまたはラット2、3、4のE8.5 - E14.5。胚を顕微鏡下で操作できるので、WECでは、我々が直接微細なガラスキャピラリーを用いた胚の所望の領域をターゲットにすることができます。我々はpostimplanted哺乳類胚のダイナミックな発生過程を研究する場合したがって、齧歯類のWECは、非常に有用な技術である。最新の、WECシステムのいくつかのタイプは、1が開発されている。これらのうち、ローテーター型ボトル培養系は、それぞれ1マウス及びラットにおけるE9.5およびE11.5、後に、最も人気があり、妊娠中期、すなわちにおける胚の長期培養に適しています。このビデオプロトコルでは、我々は、新規およびコックロフト5で設計されたオリジナルのローテータのシステム、洗練されたモデルを使用して12.5日後に6をラットのWECの私達の標準的な手順を示し、そして哺乳類の発達の研究にWECの技術の様々なアプリケーションを紹介生物学。
プロトコル
1。 WECシステムのセットアップ
- )WECシステム内の入口シリコンチューブ〜0.22μmのメンブランフィルタージョイント。
- O 2(95%)とCO 2(5%)を含むガスのボンベの バルブを開きます。オートクレーブ水を含む、バブルボトルを経由してドラム内に混合ガスを流し込む。
- 50ccのために混合ガスの流量を調整します。
- 外は水のボトルにシリコンチューブを聞かせて混合ガスの流れをチェックアウト挿入。
- 20回転/分の速度でドラムを回転させる。
2。培地の調製
- 融解ラット直ちに遠心分離(IC)血清37.0℃においてB)。オートクレーブした100mlのビーカーに解凍した血清中にD -グルコース(2 mg / mL)を追加します。培地は初代培養のレベル(例えば、フードを使用して)で準備する必要があります。
- 400希釈:1の血清に抗生物質 - 抗真菌剤(100倍)液体を追加。
- 室温で20分間血清(RT)c)から(採血時のラットの麻酔に起因する)、残りのイソフルランを気化。
- 0.45μmのメンブランフィルターを用いて培養液を滅菌する。
- 各培養瓶の培地3.0 mlを注ぐとシリコンプラグでそれぞれのボトルの上部をシール、アルミホイルで覆われ(文献14参照)D)。
- )タイロードの生理食塩水の電子を含む3つまたは4つの処分ペトリ皿を準備します。
3。子宮のラットと分離の麻酔
- 吸入または経口麻酔薬で深く時限妊娠ラットを麻酔。
- 70%エタノールで麻酔妊娠したラットの腹部領域をクリーニングします。
- ピンセットで皮膚を拾うと大きなハサミf)を使用して皮膚をカットして腹壁を露出させる。
- ピンセットで腹壁をピックアップして)胸椎レベルのgに大きなハサミで腹壁上にU字型の大規模な縦断的切開を占めている。
- ピンセットで左側に腸を持って行ってしまうと卵巣に接続されている子宮の一端を公開。
- ピンセットで子宮の端を拾うと大きなはさみで子宮と卵巣の間に位置をカット。
- 子宮のもう一方の端まで、子宮の周りの脂肪をカットすることで妊娠ラットから子宮を取り出してください。
- タイロードの生理食塩水を含むペトリ皿に子宮を転送する。
- 子宮を除去した後、麻酔薬の過剰投与や頸椎脱臼によりラットを安楽死させる。
4。子宮から胚の除去
- 簡単に言うとタイロードの生理食塩水で子宮をすすぎ、細かい鉗子H)のペアで2ペトリ皿に移す。
- 双眼顕微鏡下で、微細なピンセットで子宮壁をピックアップし、眼科まっすぐはさみを使用して血管を使用して接続し子宮間膜の反対側で子宮壁をカット。
- 子宮壁と脱落膜との間の空間に眼科ストレートはさみの先端を挿入します。 antimesometrial側に沿って長手方向に子宮壁をカット。
- mesometrial側の脱落膜および微細な鉗子i)の 2組を使用して子宮とは別のconceptuses塊。
- 適切な直径を持つ滅菌ガラスピペット3番目のシャーレにconceptusesを転送する。
5。ラットの胚の解剖
- 脱落膜にmicroforcepsいずれかの先端を挿入し、鉗子の二組の受胎産物の周りに脱落膜上に横切開を行います。
- 胎盤側に脱落膜に鉗子の先端を挿入し、上部に脱落膜上の2つの縦切開を行います。
- 鉗子の二組のことをリッピングにより、胎盤側の脱落膜を取り外します。鉗子の二組の残りの脱落を削除します。
- 、ライヘルトの膜を拾うことで水平方向の切開を行うこと、および抗胎盤側で受胎産物から膜を分離する。
- 鉗子の二組の胚の頭部近くに卵黄嚢に小さな穴を確認し、眼科曲線ハサミで卵黄嚢をカット。主要な血管を損傷しないことが重要です。
- 微細な鉗子の二組の胚の頭の周りのサイトで羊膜をピックアップ、そして静かに)羊膜hを引き裂くことによって卵黄嚢から胚を引き出します。胚の体は妊娠中期の段階で胚のための酸素の供給を増やすために卵黄嚢から撤退すべきである。
6。全胚培養
- 胎盤、卵黄嚢、そして心臓の拍動と血液循環の状態で損害賠償を確認してください。
- へその緒をストレッチではないの自覚し、転送滅菌ガラスピペットで培養ボトルへの胚。培養ボトルにタイロードの生理食塩水のキャリーオーバーは可能な限り少ないはずです。
- 回転体ドラムから非穴シリコンプラグを取り外します。垂直にWECシステムの回転子ドラムに穴をプラグで培養ボトルを接続してください。回転子のドラムが非常に微細な機器であるため、不適当な方向にドラムに力を入れるように注意してください。解剖胚を含むボトルは1つで文化いずれかに転送され、インキュベーターのフロントドアの開口部は、インキュベーターの温度を避けるために最小限に抑える必要がありますjを減少させる)。
- 文化の10時間後、最大75 ccと24時間(表1)後に最大100 ccの混合ガスの流量を増加させる。
- 培地は、調製したばかりの培地を使用して新しい培養瓶に培養胚を転送することにより、24時間のまわりに変更する必要があります。 34時間後に最大125 ccの流量を増加し、48時間後に最大150のcc(表1)
- 時折ハートビートレートを(すなわち、120-150/minが最適である)カウントすることにより、血液の循環を観測することによって培養胚の状態を確認してください。必要に応じてタイロードの生理食塩水で胚の成長を判断する体節の数を数えます。通常の開発では、一方の体節が2時間に追加されます。
- WECが終了すると、混合ガスの供給を停止し、入口管およびバブリング瓶からインレットチューブに逆流を防ぐために、フィルタ膜を切断。
7。ノート
- WECシステム内部の温度は常に37.0から37.5℃に保持され
- 100パーセントラットIC血清は、日常的にラットおよびマウス胚のための私達のWECで使用され、使用前に-20℃に保たれている。
- 我々は、イソフルランで麻酔したラットから収集されたラットIC血清を、購入。
- 使い捨ての瓶は、池本理化からも利用できます。ボトルとシリコンのプラグはオートクレーブする必要があります。
- 解剖中に低温または高温での胚の維持がWECで、その後の発展に影響を与えるので、胚の解剖は、室温で行ってください。
- 解剖のためのツールは、乾熱で滅菌されています。
- 皮膚と腹壁はできるだけ皿に毛の汚染を避けるために別々にカットする必要があります。我々は皮膚をカットし、子宮を分離するときに我々はそれぞれ、それらの新しいペアで大きなハサミとピンセットのペアを変更してください。
- そのヒントうまくある鉗子を使用すると、確かに組織を分析する非常に重要です。我々は、手動で石と機械油と鉗子の先端をシャープに。
- 我々は、胚へ過剰な圧力を避けるために、ナイフのような鉗子の片側を使用してください。
- WECシステム内部の温度が何度も扉を開くことによって減少したとき、我々は、システム内の温度を保つためにライトをオンにし続ける。
8。代表的な結果
図1は、ラット胚と培養ラット胚の解剖の手順を示しています。
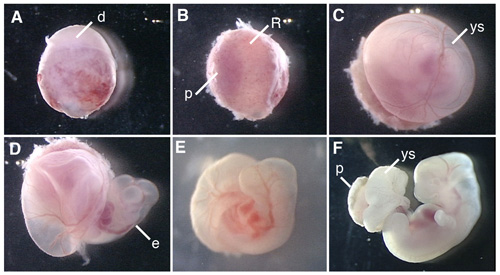
図1。E12.5ラット胚の全胚培養。 (A)胎児は、妊娠ラットの子宮から解剖。胎盤側の脱落膜の(B)の除去。ライヘルトの膜の(C)除去。 (D)卵黄嚢を開く。 WECの開始後6時間ボトルで(E)ラット胚の培養。 (F)ラットの胚は、42時間培養。 D、脱落膜、R、ライヒェルトの膜、P、胎盤、YS、卵黄嚢、電子、胚。
| 0時間 | 12時間 | 24時間 | 36時間 | 48時間 | |
| E12.5ラット胚 | 95パーセント50ccの | 95パーセント75のcc (10時間) | 95パーセントを100cc | 95パーセント125のcc(34時間) | 95パーセント150ccの |
表1。最適な酸素状態。
ディスカッション
成功のための齧歯類のWECの2つの重要なステップがあります。最初に、解剖の手順は、しないように、特に被害の胚、血管に正確でなければなりません。酸素と栄養がもはや子宮からの分離後の胎盤を介して供給されていないので、第二、手続きはできるだけ早くする必要があります。これは古い胚にとって非常に重要です。 E12.5後のラットのWECのケースでは、我々は30分以内に培養ボトルに?...
開示事項
謝辞
我々は、ビデオを編集するためのビデオ録画および有用な助言のために氏肇輝に感謝。我々はまた、ビデオ録画のための親切なアシスタントのためDrs.Yuji恒川とカイチ吉崎に感謝。この作業は若手Bで、日本の文部科学省から重点領域 - 分子脳科学に関する科研費でサポートされています。我々は日本の文部科学省と日本の科学技術振興機構(JST)から日本の科学とテクノロジー社から戦略的創造科学技術(CREST)のためのコアの研究から、グローバルCOEプログラム"グローバル脳科学のための基本とトランスレーショナルリサーチセンター"のサポートを認める。
資料
| Name | Company | Catalog Number | Comments | |
| の名前 | タイプ | 会社 | カタログ番号 | コメント |
| WECの設定 | ||||
| WECシステム(10〜0310) | ツール | 池本リカ | 010-0310 | 別のスモールモデルも用意されています。 |
| 穴のないシリコンプラグ | ツール | 池本リカ | 010-032-08 | |
| 混合ガスのシリンダー | ツール | 日光山荘 | - | 酸素95%と5%の二酸化炭素を含む。カスタムオーダー。 |
| ガスレギュレータ | ツール | 小野製作所 | WR - 11 | |
| 0.22μmのフィルターマイレクスGS | ツール | ミリポア | SLGS033SS | |
| 麻酔と子宮の分離 | ||||
| 大きなはさみ | ツール | Napox | B - 7H | |
| 鉗子 | ツール | Napox | - 3 - 2 | |
| 廃棄ペトリ皿 (90ミリメートル× 15ミリメートル) | ツール | いわき市 | SH90 - 15 | 深型シャーレは、解剖に最適です。 |
| イソフルレン | 試薬 | アボット | B506 | 麻酔のための |
| ペントバルビタールナトリウム | 試薬 | シェリングプラウアニマルヘルス | - | 麻酔のための |
| タイロードの生理食塩水 | 試薬 | - | - | 文献[プロトコルとしてよると。 2。 4℃で保存℃、 |
| 時限妊娠Sprague - Dawleyラット | 動物 | チャールズ川ラボラトリーズジャパン | - | |
| 培地の調製 | ||||
| 文化ガラス瓶 | ツール | 池本リカ | 010-032-05 | |
| 処分の培養瓶 | ツール | 池本リカ | 010-032-06 | |
| 穴付きシリコン栓 | ツール | 池本リカ | 010-032-07 | |
| アルミ箔 | ツール | どのような企業 | - | |
| オートクレーブ袋 | ツール | カル | HM - 26 | 培養ボトル用 |
| オートクレーブ袋 | ツール | カル | HM - 14A | シリコンプラグ用 |
| 0.45μmのフィルターマイレクスHA | ツール | ミリポア | SLHA033SS | |
| 50 mlコニカルチューブ | ツール | ベクトンディッキンソン | 352070 | |
| 100mlのビーカー | ツール | いわき市 | TE - 32 | |
| ラットIC血清 | 試薬 | チャールズ川ラボラトリーズジャパン | - | 、氏邦彦森崎:を参照してください。 TEL:+81-(0)45-474-9336、FAX:+81-(0)45-474-9340 |
| D(+) - グルコース | 試薬 | 和光 | 041から00595 | |
| 抗生物質antimyotic液体 | 試薬 | ギブコ | 15240 | |
| 胚の解剖 | ||||
| 眼科ストレートはさみ | ツール | Napox | MB50 - 7 | 子宮壁を切断するための |
| 眼科曲がったはさみ | ツール | Napox | MB54 - 2 | 卵黄嚢を切断するための |
| 鉗子#5 | ツール | 活力 | T6715 | |
| 鉗子#5F | ツール | レギ | T6819 | |
| ガラスピペット | ツール | - | - | パスツールピペットを用いて手で作ら。 |
| オートクレーブ袋 | ツール | カル | HM - 4 | ガラスピペットを用 |
| 双眼顕微鏡 | ツール | ライカ | Mz7s | |
| 軽 | ツール | ライカ | CLS 150XD | |
| 石油石 | ツール | 内田洋行 | 833-2000 | 鉗子のシャープニング用 |
| マシン油 | ツール | 内田洋行 | 835-0000 | 鉗子のシャープニング用 |
参考文献
- New, D. A. T., Copp, A. J., Cockroft, D. L. Intoroduction. In mammalian postimplantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 1-14 (1990).
- Cockroft, D. L., Copp, A. J., Cockroft, D. L. Dissection and culture of post implantation embryos. In Mammalian Postimplantation Embryos A Practical Approach. , 15-40 (1990).
- Morris-Kay, G. M. Postimplantation mammalian embryos. Essential Developmental Biology A Practical Approach. , 55-66 (1993).
- Fujinaga, M., Tuan, R. S., Lo, C. W. In vitro culture of rodent embryos during the early postimplantation period. Developmental Biology Protocols. , 53-76 (2000).
- Eto, K., Takakubo, F. Improved development of rat embryos in culture during the period of craniofacial morphogenesis. J. Craniofac. Genet. Dev. Biol. 5, 351-355 (1985).
- New, D. A., Cockroft, D. L. A rotating bottle culture method with continuous replacement of the gas phase. Experientia. 35, 138-140 (1979).
- Osumi-Yamashita, N., Ninomiya, Y., Eto, K. Mammalian craniofacial embryology in vitro. Int. J. Dev. Biol. 41, 187-194 (1997).
- Inoue, T., Nakamura, S., Osumi, N. Fate mapping of the mouse prosencephalic neural plate. Dev. Biol. 219, 373-383 (2000).
- Nomura, T., Holmberg, J., Frisen, J., Osumi, N. Pax6-dependent boundary defines alignment of migrating olfactory cortex neurons via the repulsive activity of ephrin A5. Development. 133, 1335-1345 (2006).
- Inoue, Y. U., Asami, J., Inoue, T. Genetic labeling of mouse rhombomeres by Cadherin-6::EGFP-BAC transgenesis underscores the role of cadherins in hindbrain compartmentalization. Neurosci. Res. 63, 2-9 (2009).
- Calegari, F., Huttner, W. B. An inhibition of cyclin-dependent kinases that lengthens, but does not arrest, neuroepithelial cell cycle induces premature neurogenesis. J. Cell Sci. 116, 4947-4955 (2003).
- Osumi, N., Inoue, T. Gene transfer into cultured mammalian embryos by electroporation. Methods. 24, 35-42 (2001).
- Arai, Y. Role of Fabp7, a downstream gene of Pax6, in the maintenance of neuroepithelial cells during early embryonic development of the rat cortex. J. Neurosci. 25, 9752-9761 (2005).
- Takahashi, M., Nomura, T., Osumi, N. Transferring genes into cultured mammalian embryos by electroporation. Dev. Growth Differ. 50, 485-497 (2008).
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved