Method Article
FISH לאבחון גנטי טרום השרשה
In This Article
Summary
מאמר זה מתאר את הבחירה של בדיקות מתאים FISH מתא בודד, טכניקות הפצת עבור גרעינים blastomere, וב הכלאה באתרו ניקוד האות, להחיל אבחון גנטי טרום השרשה (PGD) בסביבה קלינית.
Abstract
טרום השרשה אבחון גנטי (PGD) מהווה חלופה הוקמה לאבחון טרום לידתי, והיא כרוכה בחירת ההשתלה טרום עוברים מקבוצה שנוצר על ידי טכנולוגיה רבייה סייעה (ART). בחירה זו עשויה להידרש בגלל המחלה monogenic משפחתית (סיסטיק פיברוזיס למשל), או כי אחד מבני הזוג נושא התארגנות כרומוזום (למשל טרנסלוקציה דו סטרי הדדי). PGD זמין לזוגות שעברו ילדים מושפעים הקודם, ו / או במקרה של rearrangements כרומוזום, הפלות חוזרות או חוסר פוריות. גירוי השחלות ביציות aspirated הבאים מופרית על ידי טבילה ב בזרע במבחנה (IVF) או על ידי הזרקת תא זרע intracytoplasmic של הפרט (ICSI). טרום השרשה מחשוף בשלב עוברי הם ביופסיה, בדרך כלל על ידי הסרת תא בודד ביום 3 לאחר ההפריה, והתא ביופסיה נבדק כדי לקבוע את מצב גנטי של העובר. הקרינה הכלאה באתרו (FISH) על הגרעינים קבוע של תאים ביופסיה עם יעד ספציפי בדיקות ה-DNA היא הטכניקה של בחירה כדי לזהות חוסר איזון כרומוזום קשור rearrangements כרומוזום, וכדי לבחור עוברי נקבה במשפחות עם מחלה X-linked שבהם לא קיימת אין מוטציה ספציפית הבדיקה. FISH שימש גם כדי עוברים מסך aneuploidy כרומוזום ספונטנית (הידוע גם בשם PGS או PGD-AS) על מנת לנסות לשפר את היעילות של הרבייה סייעה, עם זאת, ערך מנבא של מבחן זה באמצעות הפצת הטכניקה FISH המתואר כאן צפוי להיות נמוך בלתי מתקבל על הדעת בידיו של רוב האנשים, והוא אינו מומלץ לשימוש קליני שגרתי. אנו מתארים את הבחירה של בדיקות מתאים FISH מתא בודד, טכניקות הפצת עבור גרעינים blastomere, וב הכלאה באתרו ניקוד האות, להחיל PGD בסביבה קלינית.
Protocol
1. Lysing ואת הפצת גרעין מ Blastomere ביופסיה
- תמוגה Cell חיץ של תאים מתפשט (0.2% Tween20 ב 0.01 M HCl, pH 2.0) יש להכין 24 שעות מראש ומאוחסנים ב -20 ° C. הכן 100 מ"ל ו 20 מ"ל לסנן לתוך מיכל 30 מ"ל אוניברסלי סטרילי באמצעות מזרק סטרילי 20 מ"ל ולסנן מזרק. לוותר על 1 aliquots מ"ל לתוך צינורות 10-15 1.7 מ"ל microcentrifuge סטרילית, סגור את התווית צינורות לפני ההקפאה. מומלץ יש שתי קבוצות שונות לשימוש, האצווה חדשים האצווה הקודם, אשר נבדק יכול לשמש אם קבוצה חדשה אינה משביעת רצון.
- הפשירו את מאגר תמוגה בטמפרטורת החדר 30 דקות לפני ההליך ביופסיה. למטרות מעשיות את טמפרטורת העבודה יהיה בין בטמפרטורת החדר הטמפרטורה יד.
- ציון עיגול קטן (בקוטר של כ 5 מ"מ) בחלק התחתון של שקופית אמין מצופה (למשל Genetix) באמצעות עט היהלומים מראש תווית את השקופית עם מספר התיק, מספר שקופיות ייחודית, ותאריך ביופסיה. השתמש שקופית נפרדת עבור כל blastomere לפי סדר מספרי, ועל תווית עם מספר העובר. שקופיות צריך להיות מסומן בעיפרון קשה כגון 4H, וגם "מחק" עם כפפת לטקס כדי להסיר כל אבק גרפיט.
- המקום נפח קטן של חיץ תמוגה בתוך המעגל.
- מעבירים את blastomere ביופסיה לתוך המאגר תמוגה. אם יש צורך להוסיף למאגר תמוגה במעגל עד התא מתחיל lyse, התא צריך lyse לחלוטין הציטופלסמה לפזר לפני מתייבש חיץ.
- שים את הגרעין כדי לוודא שהוא נשאר בתוך המעגל הוא לא איבד, אם התא אין גרעין או יש גרעינים רבים, ביופסיה תא אחר.
- השאירו את השקופית אוויר יבש בטמפרטורת החדר.
2. בשנת הכלאה באתרו של גרעין יחיד Blastomere
- הכן סדרת אתנול (70, 90 ו - 100%) מורכב במים מזוקקים סטריליים.
- הפעל והגדר את גוש חם (למשל Hybaid Omnislide או Vysis Hybrite) ל 75 ° C.
- הפשירו בדיקות, מערבולת, ו צנטריפוגות. ריאגנטים צריך להיות עדים ומאומת יהיה נכון לפני ממציאה את התערובת בדיקה. פיפטה כרכים כפי שצוינו על ידי היצרן כדי לפצות את התערובת בדיקה צינור 0.65 מ"ל סטרילי microcentrifuge ו מערבולת צנטריפוגות לפני השימוש. הנפח הכולל של התערובת בדיקה צריך להיות מספיק כדי לאפשר 2 μL לכל גרעין להיבדק מעוגלות עד μL 10 הקרוב כדי לאפשר מרווח בטיחות.
- טרום לשטוף את השקופיות בצנצנות coplin באמצעות פוספט שנאגרו מלוחים (PBS) (pH 7.0: 0.14 M NaCl, KCl 3 מ"מ, 10 mM Na 2 HPO 4, 2 מ"מ KH 2 PO 4) במשך 5 דקות בטמפרטורת החדר.
- שטפו את השקופיות פעמיים מים מזוקקים סטריליים.
- מייבשים את השקופיות עם הסדרה אתנול (70, 90, ו - 100%) עבור כל 2 דקות בטמפרטורת החדר אוויר יבש. ודא שקופיות שקועים לחלוטין אם בכלל אבק גרפיט צף אל פני השטח, לספוג עם טישו נקי.
- הקלט את המיקום של גרעין בתוך מעגל על ידי הדמיה באמצעות מיקרוסקופ לעומת שלב.
- מייבשים עם אתנול 100% עבור 2 דקות בטמפרטורת החדר אוויר יבש.
- החל 2 μL של תערובת בדיקה, ולכסות עם 9 x 9 מ"מ coverslip (1 / 4 של 18 x 18 מ"מ coverslip מס '1).
- חותם את הקצוות של coverslip עם גומי מלט (למשל מסטיק פרה, פרה הגהה).
- Codenature את השקופיות על גוש חם 75 מעלות צלזיוס למשך 5 דקות, ולאחר מכן להכליא את השקופיות לילה (16-20 שעות) בתא humidified על 37 ° C. תערובות בדיקה מורכב כולו בדיקות centromere (כלומר לסקס צמודות מקרים) ייתן תוצאה משביעת רצון לאחר 60 דקות של הכלאה.
- הכן אמבט מים עם צנצנות coplin מספיק חום כדי 71 ° C.
- הכן ציטראט 0.4x מלוחים סטנדרטי (SSC) פתרון לשטוף מחמירים (pH 7.0 בשעה 71 ° C, 0.06 M NaCl, 6 מ"מ C 6 H 5 O 7 Na 3 0.2 H 2 O) חום המים באמבטיה.
- לוותר על 50 מ"ל של לשטוף מחמירים לכל coplin צנצנת נדרש לבדוק כי הטמפרטורה היא 71 מעלות צלזיוס מיד לפני השימוש באמצעות מדחום נקי.
- הסר בזהירות את המלט גומי משקופית כל לשטוף את coverslip באמצעות% 4x SSC/0.05 Tween20 (pH 7.0) בטמפרטורת החדר.
- שטפו את השקופיות בכביסה 0.4x SSC מחמירים על 71 מעלות צלזיוס למשך 5 דקות. שטפי לא יותר מ 6 שקופיות צנצנת coplin.
- שטפו את השקופיות Tween20 SSC/0.05% 4x בטמפרטורת החדר למשך 2 דקות.
- אם התערובת בדיקה כוללת בדיקה שכותרתו בעקיפין (ים), לנקז את השקופיות של נוזל עודף וליישם 20 μL של נוגדן מצומדות fluorescently תחת מרובע 20 מ"מ x 20 של Parafilm.
- דגירה בתא humidified על 37 מעלות צלזיוס למשך 15 דקות.
- הסר את Parafilm ולשטוף פעם Tween20 SSC/0.05% 4x בטמפרטורת החדר למשך 2 דקות.
- לשטוף פעמיים עבור 2 דקות ב PBSלא בטמפרטורת החדר ומסננים את השקופיות.
- החל 6 μL של DAPI / Vectashield (160 ננוגרם של 4 ',6-diamidino-2-phenylindole dihydrochloride ב 1 מ"ל של מדיום Vectashield הרכבה, וקטור Laboratories) ל 22 מ"מ x 22 לא. 0 coverslip ו להפוך את השקופית על coverslip.
- כתם וסוגרים את הקצוות של coverslip עם מסמר לכה ברורה.
3. ניתוח באמצעות מיקרוסקופ פלואורסצנטי מאובזר כראוי עם מסננים מתאימים עבור בדיקות משומשים.
- ציון אותות ידי להדמיה ישירה באמצעות מיקרוסקופ פלואורסצנטי, רווק הלהקה עוברים מסננים לכל fluorochrome ב assay. כל גרעין צריך להיות הבקיע שני האנליסטים. קו מנחה כללי צריך להוביל מניה של אות אחת שבה שני אותות צפופים הם פחות מאחוז אחד מושלם (האות רוחב) בנפרד, עם זאת, פסק הדין מבוסס על ניסיון צריך להיות למימוש לפרש את האותות משתנה, בעוצמה גודל ההפרדה.
- שימוש בתוכנות הדמיה (למשל איזיס, MetaSystems, Altlussheim, גרמניה; CytoVision, Genetix) כדי ללכוד תמונה של גרעין לאישור האבחנה החזותית ועל התמונה בארכיון במסגרת תוכנית אבטחת האיכות במעבדה.
4. נציג תוצאות:
Metaphase גרעינים שלבי הביניים של לימפוציטים בתרבית דם היקפיים צריכים להיבדק כדי לוודא שנבחרו בדיקות ספציפיות הכרומוזומים טרנסלוקציה, אינפורמטיבי עבור breakpoints (בדיקות subtelomere צריך להכליא רק את קטעי translocated ואת החללית centromere (ים) ממוקדת פלח (s)) ואת אותות גרעינים שלבי הביניים צריך להיות בהיר בדידים. ניקוד מספר אותות עבור כל בדיקה גרעינים 100 שלבי הביניים של כל אחד מבני הזוג, מומלץ להעריך את היעילות של assay. במקרה זה 2 אותות דורגו ב -95% -99% של גרעיני עבור כל בדיקה. איור 1 מציג metaphase ו גרעין שלבי הביניים מתוך כהכנה טרנסלוקציה הדדית בין זרועות קצרות של כרומוזומים 5 ו - 9.
אותות גרעינים שלבי הביניים מתוך בלסטומרים העובר צריך להיות בהיר בדידה הבקיע באמצעות נפרדים לעבור הלהקה מסננים את הצבעים. איור 2 מראה גרעין blastomere עם דפוס אות רגיל (2 עותקים לכל לוקוסים נבדק) עולה בקנה אחד עם כרומוזום משלים רגיל או מאוזן על כרומוזום 5 ו -9, ו - גרעין עם דפוס אות חריג בקנה אחד עם מוצר מאוזן של טרנסלוקציה כי יש monosomy (עותק אחד) עבור מגזר translocated של כרומוזום 5 ו טריזומיה (3 עותקים) עבור מגזר translocated של כרומוזום 9.
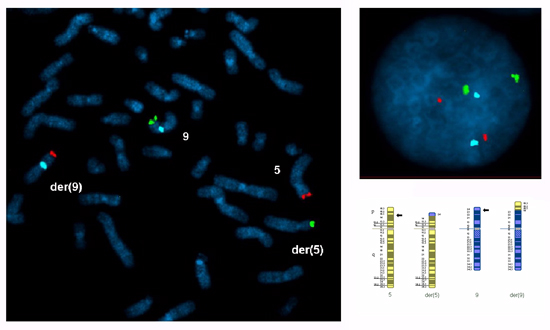
איור 1 התפשטות metaphase ו גרעין שלבי הביניים שהוכן בתרבית לימפוציטים דם היקפיים מן הספק של טרנסלוקציה הדדית בין זרועות קצרות של כרומוזומים 9 ו - 5 עם נקודות עצירה ב 5p14.3 ו 9p24.1:. 46, XY, t (5 : 9) (p14.3;. p24.1) איש לא (5, 9) (5ptel48-, 9ptel30 +; 9ptel30-, 5ptel48 +, 9cen +). בדיקות FISH נבחרו בשני מגזרים translocated (5p14.3 → 5pter, אדום Cytocell subtelomere5ptel48 TexasRed; 9p24.1 → 9pter, ירוק Cytocell subtelomere 9ptel30 FITC) והמגזר ממוקדת של כרומוזום 9 (9p24.1 → 9qter, כחול אבוט CEP 9 אלפא לווין SpectrumAqua).
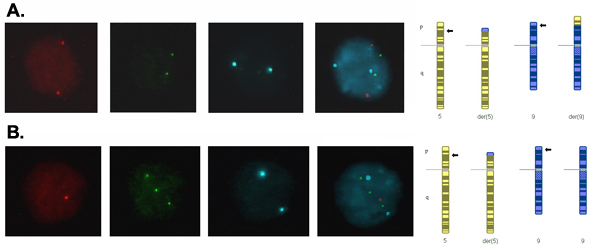
איור 2. אותות גרעינים blastomere שלבי הביניים מיום-3 עוברי שנתפסו באמצעות מסנן שונה עבור כל fluorochrome ו התמזגו ויצרו תמונה מורכבת. (א) שני אותות בדיקה עבור כל המצביעים שני עותקים של מוקד אחד, אשר עולה בקנה אחד עם משלים רגיל או מאוזן של כרומוזומים טרנסלוקציה. (ב) אות אחת אדום, שלושה אותות ירוק שני אותות כחול המעיד על עותק אחד של המגזר translocated של כרומוזום 5, שלושה עותקים של המגזר translocated של כרומוזום 9 ושני עותקים של המגזר ממוקדת של כרומוזום 9, אשר עולה בקנה אחד עם סמוכים -1 הפרדה של טרנסלוקציה וכתוצאה מכך מוצר מאוזן עם monosomy עבור 5p14.3 → 5pter ו טריזומיה עבור 9p24.1 → 9pter.
Discussion
היישום של הקרינה הכלאה באתרו (FISH) לתא עובר יחיד (blastomere) מציב אתגרים מיוחדים הן המעשיים והן הפרשנות של תבנית האות. התא ביופסיה צריך להתפשט בתוך השטח שהוגדרו מראש על השקופית כדי להקל FISH לוקליזציה הבאה שלה; זהירות קיצוניים צריך לנקוט כדי להבטיח התא lysed, כי הציטופלסמה כבר התפזרו, וכי גרעין גלוי שלם;, וכפי האבחון תלוי בתוצאות מתא בודד זה, הבקיע מחמירים פרשנות ההנחיות צריך להיות מיושם. עם זאת, בידיים מנוסות, דגים היא טכניקה חזקה לאבחון גנטי טרום השרשה (PGD) בפרקטיקה הקלינית. העיקרון של PGD על ידי FISH היא יעד ספציפי DNA בדיקות שכותרתו עם fluorochromes או haptens שונים שניתן להשתמש בהם כדי לזהות את המספר עותק של לוקוסים ספציפי, ובכך לזהות חוסר איזון כרומוזום קשור הפרדה meiotic של rearrangements כרומוזום (1), כולל Robertsonian טרנסלוקציות, טרנסלוקציות הדדיות, תנוחות הפוכות, ו rearrangements מורכב (2). דגים יכולים לשמש גם כדי לבחור בעוברים נקבה במשפחות עם מחלה X-linked, אשר לא קיימת בדיקה מוטציה ספציפית (3, 4). עוד שנוי במחלוקת, דגים שימש גם למסך עבור aneuploidy כרומוזום סדיר על מנת לנסות לשפר את היעילות של הרבייה סייעה (5, 6), עם זאת, ערך מנבא של מבחן זה באמצעות FSIH צפוי להיות נמוך בלתי מתקבל על הדעת אצל רוב האנשים של ידיים זה לא מומלץ לשימוש קליני שגרתי (7). מאמר זה מתמקד בהיבטים הטכניים ואת המגבלות של FISH להחיל אבחנה תא בודד קליניים.
שיטות להפצת ותיקון בלסטומרים יחיד כוללים מתנול / חומצה אצטית (5, 8), Tween / HCl (9), וכן שילוב של Tween / HCl, מתנול / חומצה אצטית (10). וריאציות כוללות טיפול hypotonic של תאים לפני הפצת ו / או עכלן וטיפול paraformaldehyde לאחר קיבוע. השיטה צריכה להיות מאומת כראוי עבור במעבדה (14). השיטה Tween / HCl מתואר בפירוט במאמר זה. השיטה Tween / HCl היא פשוטה מבחינה טכנית לשעתקו מאוד במעבדות שונות. בשיטה זו ניתן להשתמש כדי להכין גרעינים יחיד לאבחון FISH להגדרה סקס rearrangements כרומוזום עם דיוק האבחון המקובל (7).
תערובות Probe ניתן לשלב שכותרתו ישירות שכותרתו בעקיפין בדיקות, ועל בדיקות של יצרנים שונים. בדיקות עבור אזורים ידוע כרומוזום צורות (11, 12), או אלה ידועים צולבות להכליא באופן משמעותי עם כרומוזומים אחרים (13) יש להימנע, אם כי ניתן להשתמש בו אם הוכח להיות ספציפיים מתאים PGD על ידי בדיקה מוקדמת על שני בני הזוג הרבייה . Fluorochromes זמין / haptens ואסטרטגיות בדיקות להפלות כוללים: טקסס אדום (TR), isothiocyanate והעמסת (FITC), SpectrumGreen (Vysis), SpectrumOrange (Vysis), SpectrumAqua, בדיקות biotinylated מזוהה עם TR-avidin, FITC-avidin, או סי-5 streptavidin (דמיינו באמצעות מסנן FarRed), שילוב של בדיקות אדום וירוק כדי לייצר אות צהוב, סיבוב שני של הכלאה וצבע third שנוצר על ידי לכידת רציפים של SpectrumOrange באמצעות TexasRed ומסנן SpectrumGold).
מערכת בדיקה המכיל שלושה בדיקות, ספציפית עבור האזורים centromere של הכרומוזומים X ו-Y ואחד autosome, מומלץ קביעת הזוויג (14), בדיקה אוטוזומלית משמש להקים ploidy ובכך להבדיל בין טריזומיה X (2n, 47 , XXX) ו triploidy (3N, 69, XXX), ובין tetrasomy X (48, XXXX) ו tetraploidy (4n, 92, XXXX). בדיקה טיפוסי להגדיר להחיל הגדרה זו תמהיל AneuVysion אבוט המכיל אלפא לווין X, Y, ו - 18 וקבוצה זו בדיקה הוכח פולימורפיזם יש שיעור נמוך מאוד, ולכן טיפול טרום לעבוד למעלה השותפים הרבייה לא נדרש (14).
תמהיל בדיקה עבור סידור מסוים צריך: באופן אידיאלי לכלול בדיקות לפחות מספיק כדי לזהות את כל המוצרים הצפויה של ארגון מחדש עם חוסר האיזון כרומוזום. אם זה לא אפשרי, בדיקה מתערבב בו את המוצרים מאוזן מבלי שיבחינו כבר העריכו להיות בלתי קיימא הריון מוכרות יש סבירות נמוכה מאוד שכיחות עשוי להיות מקובל (14). להיבדק על metaphases לימפוציטים בתרבית משני השותפים הרבייה. לפחות עשרה מתפשט metaphase יש לבחון על סגוליות הבדיקה, פולימורפיזמים ו צולבות הכלאה, ועבור המוביל התארגנות כרומוזום, על מנת להבטיח כי בדיקות להכליא כצפוי על פלחים שונים של התארגנות. בנוסף, לפחות 100 גרעינים שלבי הביניים של ההכנות האלה צריך להיות הבקיע להעריך סגוליות האות, בהירות, ו discreteness (14).
קוםrcial PGS ערכות בדיקה זמינים (למשל אבוט MultiVysion PB או PGT), מיקוד הכרומוזומים נמצא לרוב להיות aneuploid במוצרים ההתעברות, ו הכולל בדיקה אחת לכל כרומוזום ממוקדות. בדרך כלל הגרעין עשוי להיות הכלאה שנייה עם בדיקות נוספות עבור כרומוזומים מתן assay עבור 13 כרומוזומים, 15, 16, 18, 21, 22, ו - XY (14). ערך החיזוי של הבדיקה באמצעות הפצת הטכניקה FISH המתואר כאן צפוי להיות נמוך בלתי מתקבל על הדעת בידיים של רוב האנשים וזה לא מומלץ לשימוש קליני שגרתי (7, 15).
טכניקות כגון הכלאה גנומית השוואתי (CGH) להחיל תאים בודדים מסוגלים לבדוק את מספר עותק של כל כרומוזום (ווילטון et al. 2001), ושימוש פולימורפיזמים נוקלאוטיד יחיד (SNP) מערכים ניתוח כמותי (וולס ואח' . 2008) או genotyping "karyomapping" (Handyside et al. 2009) מבטיחות טכניקות חלופיות כדי לזהות aneuploidy כרומוזום. עם זאת, מגבלת הרזולוציה והדיוק של חוסר איזון קטע להישאר ברור וסביר להניח כי דגים תמשיך להיות הטכניקה של בחירה עבור rearrangements כרומוזום מקטעים קטנים מעורבים.
Disclosures
Materials
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Hydrochloric Acid, 2.5L | VWR | 101254H | ||
| Sodium Chloride, 5Kg | VWR | 443827W | ||
| Potassium Chloride, 250g | VWR | 26764.232 | ||
| di-Sodium Hydrogen Orthophosphate Anhydrous, 500g | VWR | 102494C | ||
| Potassium Dihydrogen Orthophosphate, 500g | VWR | 10203 4B | ||
| Sodium Hydroxide Pellets, 500g | VWR | 28245.265 | ||
| Tween20, 500mL | VWR | 663684B | ||
| Ethanol, 2.5L | VWR | 8.18760.2500 | Duty Paid | |
| Tri-Sodium Citrate, 5Kg | VWR | 27833.363 | ||
| Cow Gum, 250mL | Cow Proofings Ltd. | No longer available | Old stocks can still be found in art shops | |
| DAPI/Antifade ES, 0.125μg/mL, 500ul | Cytocell | DES500L | 150μl vial rec’d with each Cytocell TEL Probe | |
| Nail Varnish, 12mL | Boots | 10088316001 | ||
| Amine-coated Slides, 25 | Genetix | K2615 | ||
| DAPI, 0.1mL | Sigma-Aldrich | D-9542 | ||
| Vectashield, 10mL | Vector Laboratories | H1000 | ||
| Texas-Red-avidin, 0.001mL | Vector Laboratories | A-2016 | ||
| FITC-avidin, 0.001mL | Vector Laboratories | A-2011 | ||
| Cy-5 Streptavidin, 0.001mL | GE Healthcare | PA45001 | ||
| Microcentrifuge Tubes, 1.75mL, box of 500 | Thistle Scientific | AX-MCT-175-C | ||
| Microcentrifuge Tubes, 0.6mL, box of 1000 | Thistle Scientific | AX-MCT-060-C-CS | ||
| 30ml Universal Containers, box of 400 | Sterilin | 128B | Available from NHS Supply Chain, Cat No. KCP053 | |
| Hot Block | ||||
| Spirit Burner Spirit Burner Socket Spirit Burner Wick | VWR VWR VWR | 451-0107 451-3112 451-3111 | ||
| Plugged Glass Pipettes | Fisher Scientific | PMK-300-052R | ||
| Dissecting Microscope | Wild Heerbrugg | |||
| Tissues, 100boxes | NHS SUPPLY CHAIN | MJT058 | ||
| Metal Culture Trays | ||||
| Plastic Melamine Trays | VWR | 682-009 | ||
| Oven | ||||
| Mouth Pipette Mouthpiece | Scientific Laboratory Supplies | HAE3700 | ||
| Tubing | ||||
| Syringe Filter, 0.2μm pore size, 25mm diameter | Fisher Scientific | FDM-340-010U | ||
| Diamond Pen | VWR | 818-0021 | ||
| Hot Block for Slides | Thermo Hybaid | HBOSBB | ||
| Hybridization Chamber | ||||
| Tissue Roll | NHS SUPPLY CHAIN | MJT004 | ||
| Schieferdecker Jar | VWR | 631-9313 | ||
| Coplin Jar | VWR | 631-9331 | ||
| Forceps, Fine | VWR | 232-2123 | ||
| Forceps, Blunt | VWR | 232-2113 | ||
| 1000mL Beaker | VWR | 213-1642 | ||
| Phase Contrast Microscope | Nikon | E200 | ||
| Fibre-free Blotting Cards, box of 100 | Fisher Scientific (Raymond Lamb) | SDE1 | ||
| Blue-Frosted Microscope Slides, box of 100 | Scientific Laboratory Supplies | MIC3022 | ||
| Coverslips, 18x18mm, No. 1, box of 200 | Scientific Laboratory Supplies | MIC3110 | ||
| Coverslips, 22x22mm, No. 0, box of 200 | Scientific Laboratory Supplies | MIC3104 | ||
| Coverslips, 22x50mm, No. 0, box of 100 | Scientific Laboratory Supplies | MIC3206 | ||
| 1mL Syringe, box of 100 | NHS Supply Chain | FWC045 | ||
| 1mL Pipette Tip, 10racks of 1000 | Thistle Scientific | AX-T-1000-C-L-R | ||
| Incubator | LEEC | |||
| Waterbath | Grant | W22 | ||
| Alcohol Thermometer | Various sources available | |||
| pH Meter | Jenway | 3305 | ||
| pH Electrode | VWR | 662-1759 | BNC Plug to fit Jenway pH meter 3305 | |
| Heated Stirrer | Bibby | HC502 | ||
| 1mL Pasteur Pipettes, box of 500 | Scientific Laboratory Supplies | PIP4202 | ||
| Parafilm, 50mm x 75m | VWR | 291-1214 |
References
- Scriven, P. N., Handyside, A. H., Ogilvie, C. M. Chromosome translocations: segregation modes and strategies for preimplantation genetic diagnosis. Prenat. Diagn. 18, 1437-1449 (1998).
- Mackie Ogilvie, C., Scriven, P. N., Harper, J. C. Preimplantation genetic diagnosis for chromosome rearrangements. Preimplantation Genetic Diagnosis. , 194-201 (2009).
- Harper, J. C., Coonen, E., Ramaekers, F. C. S., Delhanty, J. D. A., Handyside, A. H., Winston, R. M. L., Hopman, A. H. N. Identification of the sex of human preimplantation embryos in two hours using an improved spreading method and fluorescent in situ hybridisation using directly labelled probes. Hum. Reprod. 9, 721-724 (1994).
- Mackie Ogilvie, C., Scriven, P. N., Harper, J. C. Preimplantation genetic diagnosis for sex-linked diseases and sex-selection for non-medical reasons. Preimplantation Genetic Diagnosis. , 230-235 (2009).
- Munné, S., Lee, A., Rosenwaks, Z., Grifo, J., Cohen, J. Diagnosis of major chromosome aneuploidies in human preimplantation embryos. Hum. Reprod. 8, 2185-2192 (1993).
- Mackie Ogilvie, C., Scriven, P. N., Harper, J. C. Preimplantation genetic diagnosis for infertility (preimplantation genetic screening). Preimplantation Genetic Diagnosis. , 203-229 (2009).
- Scriven, P. N., Bossuyt, P. M. Diagnostic accuracy: theoretical models for preimplantation genetic testing of a single nucleus using the fluorescence in situ hybridization technique. Hum Reprod. Cytogenetics. 5, 394-400 (2010).
- Coonen, E., Dumoulin, J. C., Ramaekers, F. C., Hopman, A. H. Optimal preparation of preimplantation embryo interphase nuclei for analysis by fluorescence in-situ hybridization. Hum. Reprod. 9, 533-537 (1994).
- Dozortsev, D. I., McGinnis, K. T. An improved fixation technique for fluorescence in situ hybridization for preimplantation genetic diagnosis. Fertil. Steril. 76, 186-188 (2001).
- Hsu, L. Y., Benn, P. A., Tannenbaum, H. L., Perlis, T., Carlson, A. D. Chromosomal polymorphisms of 1, 9, 16, and Y in 4 major ethnic groups: a large prenatal study. Am. J. Med. Genet. 26, 95-101 (1987).
- Shim, S. H., Pan, A., Huang, X. L., Tonk, V. S., Varma, S. K., Milunsky, J. M., Wyandt, H. E. FISH variants with D15Z1. J. Assoc. Genet. Technol. 29, 146-151 (2003).
- Knight, S. J., Flint, J. Perfect endings: a review of subtelomeric probes and their use in clinical diagnosis. J. Med. Genet. 37, 401-409 (2000).
- Thornhill, A. R., de Die-Smulders, C. E., Geraedts, J. P., Harper, J. C., Harton, G. L., Lavery, S. A., Moutou, C., Robinson, M. D., Schmutzler, A. G., Scriven, P. N., Sermon, K. D., Wilton, L. ESHRE PGD Consortium (PGS) ESHRE PGD Consortium 'Best practice guidelines for clinical preimplantation genetic diagnosis (PGD) and preimplantation genetic screening (PGS)'. Hum. Reprod. 20, 35-48 (2005).
- Munné, S., Wells, D., Cohen, J. Technology requirements for preimplantation genetic diagnosis to improve assisted reproduction outcomes. Fertil. Steril. 94, 408-430 (2010).
- Wilton, L., Williamson, R., McBain, J., Edgar, D., Voullaire, L. Birth of a healthy infant after preimplantation confirmation of euploidy by comparative genomic hybridization. N. Engl. J. Med. 345, 1537-1541 (2001).
- Wells, D., Alfarawati, S., Fragouli, E. Use of comprehensive chromosomal screening for embryo assessment: microarrays and CGH. Mol. Hum. Reprod. 14, 703-710 (2008).
- Handyside, A. H., Harton, G. L., Mariani, B., Thornhill, A. R., Affara, N., Shaw, M. A., Griffin, D. K. Karyomapping, a universal method for genome wide analysis of genetic disease based on mapping crossovers between parental haplotypes. J. Med. Genet. 47, 651-658 (2010).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved