Method Article
Pre-implantasyon Genetik Tanı için FISH
Özet
Bu makale, tek hücreli FISH, blastomer çekirdeklerinin yayılmasını teknikleri, in situ hibridizasyon ve klinik bir ortamda pre-implantasyon genetik tanı (PGD) uygulanan sinyal puanlama için uygun probların seçim açıklamaktadır.
Özet
Pre-implantasyon genetik tanı (PGD), doğum öncesi tanı için kurulmuş bir alternatif ve Yardımla üreme teknolojileri (ART) tarafından oluşturulan bir kohort pre-implantasyon embriyoların seçiminde içerir. Bu seçim, çünkü ailevi monogenik hastalığı (örneğin, kistik fibrozis), veya bir ortak bir kromozom taşır, çünkü (örneğin iki yönlü karşılıklı translokasyon) olabilir. PGT kromozom düzenlerinde, tekrarlayan düşükler, kısırlık durumunda önceki etkilenen çocuklar ve / veya çiftler için kullanılabilir. Oosit aşağıdaki over stimülasyonu semen (IVF), in vitro daldırma veya intrasitoplazmik enjeksiyonu (ICSI) bireysel bir spermatozoa tarafından döllenir aspire. Pre-implantasyon bölünme-dönem embriyoların genellikle 3. gün sonrası döllenme tek bir hücrenin kaldırılması suretiyle, biyopsi, biyopsi hücre, embriyonun genetik durum kurmak için test edilir. Floresan in situ hibridizasyon (FISH) sabit hedef spesifik DNA probları ile biyopsi hücrelerinin çekirdekleri X'e bağlı bir hastalık olduğu kromozom düzenlerinde ile ilişkili kromozom dengesizliği tespit etmek ve aile içinde kadın embriyolar seçmek için tercih edilen bir tekniktir mutasyon-özel test. BALIK Yardımla üreme etkinliğini denemek ve geliştirmek amacıyla da spontan kromozom anöploidi (PGS veya PGD-AS olarak bilinen) için ekran embriyolar kullanılır olmuştur, ancak, yayma ve FISH tekniği kullanarak bu testin prediktif değeri burada açıklanan çoğu kişinin elinde kabul edilemeyecek kadar düşük olması muhtemeldir ve bu rutin klinik kullanım için tavsiye edilmez. Biz tek hücreli FISH, blastomer çekirdeklerinin yayılmasını teknikleri, in situ hibridizasyon ve klinik bir ortamda PGT uygulanan sinyal puanlama için uygun probların seçim açıklar.
Protokol
1. Parçalama ve biyopsi blastomer Nucleus Yayılma
- Yayılan hücreleri (% 0.2 Tween20 0,01 M HCl, pH 2.0) için hücre lizis tamponu 24 saat önceden hazırlanan ve -20 ° C'de saklanan olmalıdır 20 ml steril bir şırınga ve şırınga filtresi kullanarak 30 ml steril evrensel konteyner içine 100 ml ve 20 ml filtre hazırlayın. 10-15 1.7 ml steril mikrosantrifüj tüpler içine 1 ml alikotları koyun, kapatın ve önce donmaya karşı tüpler etiket. Bu, yeni bir toplu iş tatmin edici olup olmadığını test edilmiş ve kullanılabilir kullanımı iki farklı gruplar halinde, yeni bir parti ve bir önceki toplu, olması tavsiye edilir.
- Defrost biyopsi işlemi 30 dakika önce oda sıcaklığında lizis tamponu. Pratik amaçlar için çalışma sıcaklığı, oda sıcaklığı ve el sıcaklık arasında olacaktır.
- Bir elmas kalem ve ön-etiket durumunda numarası, benzersiz slayt numarası ve biyopsi tarihinden ile slayt kullanarak bir amin kaplı slayt (örneğin Genetix) alt kısmında küçük bir daire (yaklaşık 5 mm çapında) Puan. Ayrı bir sayısal sırayla her blastomer slayt ve embriyo sayısı ile etiket kullanın. Slaytlar gibi 4H gibi sert bir kalemle etiketli ve herhangi bir grafit toz kaldırmak için bir lateks eldiven ile "lekelenen" olmalıdır.
- Daire içinde küçük bir hacim lizis tamponu yerleştirin.
- Biyopsi blastomer lizis tamponu içine aktarın. Hücre lyse başlayıncaya kadar gerekli daire içinde lizis tamponu eklerseniz; hücre tamamen lyse ve sitoplazma tampon kurumadan dağıtmak.
- Daire içinde kalır ve kayıp olduğunu sağlamak için çekirdeğin dikkat edin; hücre çekirdeğinde veya çoklu çekirdeklerin yoksa, başka bir hücreye biyopsi.
- Slayt oda sıcaklığında kurumaya bırakın.
2 Tek bir blastomer Nucleus Situ Hibridizasyon
- Steril distile su içinde yapılan etanol serisi (70, 90 ve% 100) hazırlayın.
- Açın ve 75 için sıcak bloğu (örneğin Hybaid Omnislide veya Vysis Hybrite) ° C
- Defrost probları, vorteks, santrifüj ve. Reaktifler tanık ve prob karışımı yapmadan önce doğru bir şekilde kontrol edilmelidir. Pipet 0.65 mL steril mikrosantrifüj tüp ve kullanımdan önce vorteks ve santrifüj prob karışımı telafi etmek için üretici tarafından belirtilen birimleri. Sondası karışımın toplam hacmi çekirdeği başına 2 mcL test ve bir güvenlik marjı izin için en yakın 10 mcL kadar yuvarlanır için yeterli olmalıdır.
- Coplin kavanozlarda oda sıcaklığında 5 dakika. Kullanarak fosfat tamponlu salin (PBS) (0.14 M NaCl, 3 mM KCl, 10 mM Na 2 HPO 4, 2 mM KH 2 PO 4 pH 7.0) Ön yıkama slaytlar
- Slaytları iki kez steril distile su ile durulayın.
- Etanol serisi (70, 90, ve% 100) ile oda sıcaklığı ve hava-kuru her biri 2 dakika için slaytlar dehydrate. Emin olun slaytlar tam dalmış ve eğer herhangi bir yüzeye grafit toz yüzer, temiz bir mendil ile ıslatın.
- Bir faz kontrast mikroskop ile görselleştirme daire içinde çekirdeğin konumunu kaydedin.
- Oda sıcaklığında ve kuru hava az 2 dakika süreyle% 100 etanol ile dehydrate.
- 2 mcL prob karışımı uygulayın ve 9 x 9 mm lamel (18 x 18 mm no.1 lamel dörtte biri) ile kaplayın.
- Kauçuk çimento (İnek Prova örneğin İnek Sakız) ile lamel kenarlarında Seal.
- 75 sıcak bir blok slaytlar Codenature ° C, daha sonra 5 dakika ve 37 nemlendirilmiş bir odasında (16-20 saat) bir gecede slayt melezleşme ° C. Sentromer probları (cinsiyete bağlı durumlar için yani) tamamen oluşur Probe karışımları melezleşme 60 dakika sonra tatmin edici bir sonuç verecektir.
- 71 ile yeterli coplin kavanoz ve ısı ° C olan bir su banyosu hazırlayın
- 0.4x standart tuzlu sitrat (SSC) sıkı bir yıkama çözeltisi (pH 7.0 az 71 ° C, 0.06 M NaCl, 6 mM C 6 H 5 Na 3 O 7 .2 H 2 O) ve ısı su banyosu hazırlayın .
- Coplin kavanoz başına sıkı yıkama 50 ml Uygulama ve sıcaklık 71 olup olmadığını kontrol edin ° C hemen temiz bir termometre kullanarak kullanmadan önce.
- Her bir slayt kauçuk çimento dikkatlice çıkartın ve oda sıcaklığında% 4x SSC/0.05 Tween20 (pH 7.0) kullanarak lamel durulayın.
- 71 0.4x SSC sıkı yıkama slaytlar yıkayın ° C, 5 dk. Coplin kavanoz başına fazla 6 slayt yıkayın.
- 4x SSC/0.05% Tween20 slaytlar, oda sıcaklığında 2 dakika süreyle yıkayın.
- Prob karışımı dolaylı etiketli prob (ler) varsa, aşırı sıvı kaydırağı boşaltma ve Parafilm bir 20 x 20 mm kare altında floresan konjuge antikor 20 mcL uygulayın.
- 37 nemlendirilmiş bir odasında ° C'de 15 dk.
- Parafilm çıkartın ve oda sıcaklığında 2 dakika süreyle% 4x SSC/0.05 Tween20 kez yıkayın.
- 2 dakika süreyle PBS bir iki kez yıkayınt oda sıcaklığında ve slaytlar drenaj.
- Hayır, 22 x 22 mm DAPI / Vectashield (4 160 ng ',6-diamidino-2-phenylindole dihidroklorür Vectashield montaj orta, Vector Laboratuvarlar 1 ml) 6 mcL uygulayın. 0 lamel ve lamel üzerinde slayt ters.
- Leke ve şeffaf tırnak cilası ile lamel kenarlarında mühür.
3. Floresan Mikroskobu kullanılarak analiz uygun Kullanılan Problar için uygun filtreler ile donatılmıştır.
- Bir floresan mikroskop ve tahlil her florokrom için tek bant-geçiren filtreler kullanılarak doğrudan görselleştirme Puan sinyaller. Her çekirdeğinde iki analistler tarafından atılırsa olmalıdır. Genel bir kural iki yakın aralıklı sinyaller daha az bir etki alanı dışında (sinyal genişliği) tek bir sinyal puanlama yol; ancak, deneyime dayalı kararı büyüklük, yoğunluk, değişik sinyaller ve ayırma yorumlamak olunması gerekmektedir.
- Görüntüleme yazılımı kullanın (örneğin, İsis, MetaSystems, Altlussheim, Almanya; CytoVision, Genetix) görsel tanı onay için çekirdek bir görüntü yakalamak için, bir laboratuvar kalite güvencesi planının bir parçası olarak görüntü arşivleme için.
4. Temsilcisi Sonuçlar:
Metafaz ve interfaz çekirdekleri kültürlü periferik kan lenfositleri seçilen probları (subtelomere probları transloke segment ve sentromer probu (ler) merkezli sadece melezleşme kesmenoktaları için bilgilendirici, translokasyon kromozom için özel olduğunu onaylamak için muayene edilmelidir segment (ler)) ve interfaz çekirdekleri sinyalleri parlak ve ayrık olmalıdır. 100 interfaz çekirdeği her sonda her bir ortak işaretlerinin sayısı, puanlama testinin etkinliğini değerlendirmek için tavsiye edilir. Bu durumda 2 sinyal 95% -99% çekirdeğinin her sonda skorlandı. Şekil 1 kromozom 5 ve 9 kısa kolları arasında karşılıklı translokasyon için bir hazırlık metafaz ve interfaz çekirdeğinde gösterir.
Embriyonun blastomer interfaz çekirdekleri sinyaller parlak ve ayrık olmak ve kullanılan renkler için ayrı bir bant geçiren filtreler kullanılarak attı. Şekil 2 blastomer kromozom 5 ve 9 için normal ya da dengeli bir kromozom normal sinyal tutarlı bir deseni (test edilen tüm lokuslar için 2 kopya) ve anormal bir sinyal deseni ile translokasyon dengesiz bir ürün ile tutarlı bir çekirdek ile çekirdeği gösterir kromozom 5 ve kromozom 9 transloke segment için trizomi (3 nüsha) transloke segment için monozomi (bir nüsha).
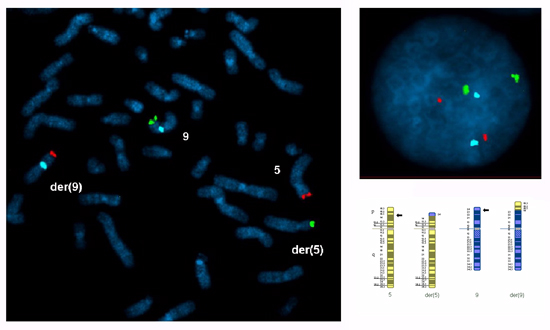
Şekil 1 A metafaz yayıldı ve kısa kromozom 5 silah ve 5p14.3 ve 9p24.1 kesme noktaları ile 9 arasında bir karşılıklı translokasyon taşıyıcısı kültürlü periferik kan lenfositleri hazırlanan bir interfaz çekirdeğinde: 46, XY, t (5 9) (p14.3; p24.1) ish t (5, 9) (5ptel48-9ptel30 +; 9ptel30, 5ptel48 + 9cen +). FISH probları hem transloke segmentleri için seçilmiştir (5p14.3 → 5pter, kırmızı Cytocell subtelomere5ptel48 TexasRed; 9p24.1 → 9pter, yeşil Cytocell subtelomere 9ptel30 FITC) ve kromozom 9 merkezli segment (9p24.1 → 9qter, mavi Abbott CEP 9 alfa uydu SpectrumAqua).
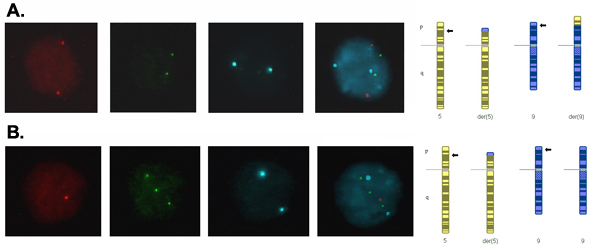
Şekil 2 gün-3 embriyolar interfaz blastomer çekirdekleri. Sinyaller her florokrom ve kompozit bir görüntü oluşturmak için birleşti için farklı bir filtre kullanılarak ele geçirdi. (A), normal ya da dengeli translokasyon kromozomlar için bir tamamlayıcı ile tutarlı her lokus, iki nüsha gösteren her sonda için iki sinyal. (B) Bir kırmızı sinyal, üç yeşil sinyalleri ve 5. kromozomun transloke segmentinde bir kopyasını, komşu ile tutarlı kromozom 9 transloke segmentinde üç nüsha ve iki nüsha kromozom 9, merkezli segmentinde gösteren iki mavi sinyal 9p24.1 → 9pter 5p14.3 → 5pter ve trizomi monozomi dengesiz bir ürün olarak ortaya çıkan translokasyonu -1 segregasyon.
Tartışmalar
Tek bir embriyo hücresi (blastomer) in situ hibridizasyon (FISH) floresan uygulama, pratik ve sinyal paterni yorumlanması hem de özel zorluklar sunulur . Biyopsi hücre slayt, yerelleştirme aşağıdaki BALIK kolaylaştırmak için önceden tanımlanmış bir alan içinde yayılır; hücre sitoplazmasında dağınık olduğunu, parçalanmış olduğunu sağlanmasında çok dikkatli alınması gerekir, ve bu çekirdeğin Tanı bu tek hücre, sıkı puanlama ve yorumlama kurallar uygulanmalıdır sonuçlarına bağlı olarak, görünür ve bozulmamış. Ancak, deneyimli ellerde, BALIK pre-implantasyon genetik tanı (PGD) klinik uygulamada sağlam bir tekniktir. FISH ile PGT prensibi farklı fluorochromes veya hapten etiketli hedef-spesifik DNA probları özel lokusların kopya sayısı tespit etmek için kullanılan olabilir ve böylece Robertsonian kromozom düzenlerinde mayotik segregasyon (1) ile ilişkili kromozom dengesizliği, algılamak için translokasyonlar, karşılıklı translokasyonlar, inversiyon ve karmaşık düzenlenmeleri (2). BALIK da herhangi bir mutasyon-spesifik bir test (3, 4) olduğu, X-bağlantılı hastalığı olan ailelerde kadın embriyolar seçmek için kullanılabilir. Daha tartışmalı BALIK da yardımlı üreme (5, 6) etkinliğini denemek ve geliştirmek için sporadik kromozom anöploidi ekrana kullanılır olmuştur vardır; Ancak, FSIH kullanarak bu testi prediktif değer olarak kabul edilemeyecek kadar düşük olması için muhtemel olan çoğu kişinin elleri ve rutin klinik kullanımı (7) için tavsiye edilmez. Bu makale, klinik, tek hücreli tanı uygulanan FISH teknik yönlerini ve sınırlamalar üzerinde yoğunlaşmaktadır.
Tek blastomer yayma ve düzeltme yöntemleri, metanol / asetik asit (5, 8), Tween / HCl (9) ve Tween / HCl ve metanol / asetik asit (10) bir kombinasyonu içerir. Çeşitlemeler fiksasyon sonra ve / veya pepsin ve paraformaldehid tedavisi yayılıyor önce hücre hipotonik tedavi içerir. Bu yöntem uygun laboratuar (14) için kontrol edilmelidir. Tween / HCl yöntemi bu makalede ayrıntılı olarak açıklanmıştır. Tween / HCl yöntemi farklı laboratuvarlarda teknik olarak basit ve son derece tekrarlanabilir. Bu yöntem, kabul edilebilir bir tanısal doğruluk (7) ile cinsiyet tayini ve kromozom düzenlenmeleri FISH tanı için tek çekirdekleri hazırlamak için kullanılabilir.
Probe karışımları, farklı üreticilerin, doğrudan etiketli ve dolaylı olarak etiketlenmiş probları, ve problar birleştirebilirsiniz. Hem üreme ortakları önceden test PGT için özel ve uygun olduğu gösterildiği takdirde kullanılabilir olsa da bilinen polimorfik kromozom bölgeleri için sondalar (11, 12), ya da bilinen diğer kromozom (13) ile anlamlı bir çapraz melezleşme kaçınılmalıdır . Ayrımcı problar için kullanılabilir fluorochromes / hapten ve stratejileri şunlardır: Texas Kırmızı (TR), floresein izotiyosiyanat (FITC) SpectrumGreen (Vysis), SpectrumOrange (Vysis), SpectrumAqua, TR-avidin ile tespit biotinlenmiş probları, FITC avidin, ya da Cy-5 streptavidin (bir FarRed filtre kullanılarak görüntülendi), sarı renkli bir sinyal üretmek için, bir melezleşme ikinci) TexasRed ve SpectrumGold filtre kullanarak SpectrumOrange sıralı yakalama tarafından oluşturulan yuvarlak ve üçüncü bir renk, kırmızı ve yeşil probları bir karışımı.
, X ve Y kromozomları ve autosome bir sentromer bölgeler için özel üç probları, içeren bir prob seti, cinsiyet tayini (14) için tavsiye edilir; otozomal prob (2n, 47, trizomi X ayırt ploidi ve böylece kurmak için kullanılır XXX) ve triploidi (3n, 69, XXX) ve tetrazomi X (48, XXXX) ve tetraploidy (4n, 92, XXXX) arasında. Bu prob seti, çok düşük polimorfizm oranı olduğu gösterilmiştir ve bu nedenle tedavi öncesi çalışma üreme ortakları; tipik bir prob seti bu ayarı uygulanan alfa-uydu, X, Y ve 18 içeren Abbott AneuVysion karışımı (14) gerekli değildir.
Herhangi bir özel düzenlenmesi için prob karışımı gerekir: İdeal olarak, kromozom dengesizlik ile düzenlenmesi beklenen tüm ürünleri tespit etmek için en azından yeterli probları içerir. Bu mümkün değilse, prob tanınabilir bir gebelik cansız undetected dengesiz ürünler değerlendirilecek ve çok düşük prevalansı (14) kabul edilebilir olması muhtemel olduğu karıştırır. Hem de üreme ortaklarından kültürlü lenfosit metafaz üzerinde test edilecek. En az on metafaz yayılır prob özgüllük, polimorfizmleri ve çapraz hibridizasyon probları olarak yeniden düzenlenmesi farklı kesimleri bekleniyor melezleşme sağlamak için incelenir ve kromozom taşıyıcı için, olmalıdır. Buna ek olarak, bu hazırlıkların en az 100 interfaz çekirdekleri sinyal özgüllük, parlaklık ve Bağımsızlık (14) değerlendirmek için atılır gerekir.
Commercial PGS prob setleri mevcuttur (örneğin Abbott MultiVysion PB veya PGT), en sık anlayışının ürünleri anöploidi olarak bulundu kromozom hedefleme ve tek başına bir hedef kromozom prob oluşan. Genellikle çekirdeğin kromozom 13, 15, 16, 18, 21, 22, ve XY (14) için bir test sağlayan ek kromozomlar için ikinci bir hibridizasyon probları ile olabilir. Yayılması ve burada açıklanan FISH tekniği kullanarak bu testin prediktif değeri çoğu kişinin elinde kabul edilemeyecek kadar düşük olması muhtemeldir ve bu, rutin klinik kullanım (7, 15) için tavsiye edilmez.
Gibi tek hücrelere uygulanan karşılaştırmalı genomik hibridizasyon (CGH) gibi teknikler (2001. Wilton ve ark) her kromozom kopya sayısı için test edebilmek ve tek nükleotid polimorfizmleri (SNP) diziler ve kantitatif analiz (Wells ve ark. 2008) ya da "karyomapping" genotipleme (Handyside ve ark 2009) kromozom anöploidi tespit etmek için alternatif teknikler umut vericidir . Ancak, segmenti dengesizlik için çözünürlük sınırı ve doğruluğu belirsiz ve FISH tekniği küçük segmentleri içeren kromozom düzenlerinde tercih olmaya devam edecektir muhtemeldir.
Açıklamalar
Malzemeler
| Material Name | Type | Company | Catalogue Number | Comment |
|---|---|---|---|---|
| Name | Company | Catalog Number | Comments | |
| Hydrochloric Acid, 2.5L | VWR | 101254H | ||
| Sodium Chloride, 5Kg | VWR | 443827W | ||
| Potassium Chloride, 250g | VWR | 26764.232 | ||
| di-Sodium Hydrogen Orthophosphate Anhydrous, 500g | VWR | 102494C | ||
| Potassium Dihydrogen Orthophosphate, 500g | VWR | 10203 4B | ||
| Sodium Hydroxide Pellets, 500g | VWR | 28245.265 | ||
| Tween20, 500mL | VWR | 663684B | ||
| Ethanol, 2.5L | VWR | 8.18760.2500 | Duty Paid | |
| Tri-Sodium Citrate, 5Kg | VWR | 27833.363 | ||
| Cow Gum, 250mL | Cow Proofings Ltd. | No longer available | Old stocks can still be found in art shops | |
| DAPI/Antifade ES, 0.125μg/mL, 500ul | Cytocell | DES500L | 150μl vial rec’d with each Cytocell TEL Probe | |
| Nail Varnish, 12mL | Boots | 10088316001 | ||
| Amine-coated Slides, 25 | Genetix | K2615 | ||
| DAPI, 0.1mL | Sigma-Aldrich | D-9542 | ||
| Vectashield, 10mL | Vector Laboratories | H1000 | ||
| Texas-Red-avidin, 0.001mL | Vector Laboratories | A-2016 | ||
| FITC-avidin, 0.001mL | Vector Laboratories | A-2011 | ||
| Cy-5 Streptavidin, 0.001mL | GE Healthcare | PA45001 | ||
| Microcentrifuge Tubes, 1.75mL, box of 500 | Thistle Scientific | AX-MCT-175-C | ||
| Microcentrifuge Tubes, 0.6mL, box of 1000 | Thistle Scientific | AX-MCT-060-C-CS | ||
| 30ml Universal Containers, box of 400 | Sterilin | 128B | Available from NHS Supply Chain, Cat No. KCP053 | |
| Hot Block | ||||
| Spirit Burner Spirit Burner Socket Spirit Burner Wick | VWR VWR VWR | 451-0107 451-3112 451-3111 | ||
| Plugged Glass Pipettes | Fisher Scientific | PMK-300-052R | ||
| Dissecting Microscope | Wild Heerbrugg | |||
| Tissues, 100boxes | NHS SUPPLY CHAIN | MJT058 | ||
| Metal Culture Trays | ||||
| Plastic Melamine Trays | VWR | 682-009 | ||
| Oven | ||||
| Mouth Pipette Mouthpiece | Scientific Laboratory Supplies | HAE3700 | ||
| Tubing | ||||
| Syringe Filter, 0.2μm pore size, 25mm diameter | Fisher Scientific | FDM-340-010U | ||
| Diamond Pen | VWR | 818-0021 | ||
| Hot Block for Slides | Thermo Hybaid | HBOSBB | ||
| Hybridization Chamber | ||||
| Tissue Roll | NHS SUPPLY CHAIN | MJT004 | ||
| Schieferdecker Jar | VWR | 631-9313 | ||
| Coplin Jar | VWR | 631-9331 | ||
| Forceps, Fine | VWR | 232-2123 | ||
| Forceps, Blunt | VWR | 232-2113 | ||
| 1000mL Beaker | VWR | 213-1642 | ||
| Phase Contrast Microscope | Nikon | E200 | ||
| Fibre-free Blotting Cards, box of 100 | Fisher Scientific (Raymond Lamb) | SDE1 | ||
| Blue-Frosted Microscope Slides, box of 100 | Scientific Laboratory Supplies | MIC3022 | ||
| Coverslips, 18x18mm, No. 1, box of 200 | Scientific Laboratory Supplies | MIC3110 | ||
| Coverslips, 22x22mm, No. 0, box of 200 | Scientific Laboratory Supplies | MIC3104 | ||
| Coverslips, 22x50mm, No. 0, box of 100 | Scientific Laboratory Supplies | MIC3206 | ||
| 1mL Syringe, box of 100 | NHS Supply Chain | FWC045 | ||
| 1mL Pipette Tip, 10racks of 1000 | Thistle Scientific | AX-T-1000-C-L-R | ||
| Incubator | LEEC | |||
| Waterbath | Grant | W22 | ||
| Alcohol Thermometer | Various sources available | |||
| pH Meter | Jenway | 3305 | ||
| pH Electrode | VWR | 662-1759 | BNC Plug to fit Jenway pH meter 3305 | |
| Heated Stirrer | Bibby | HC502 | ||
| 1mL Pasteur Pipettes, box of 500 | Scientific Laboratory Supplies | PIP4202 | ||
| Parafilm, 50mm x 75m | VWR | 291-1214 |
Referanslar
- Scriven, P. N., Handyside, A. H., Ogilvie, C. M. Chromosome translocations: segregation modes and strategies for preimplantation genetic diagnosis. Prenat. Diagn. 18, 1437-1449 (1998).
- Mackie Ogilvie, C., Scriven, P. N., Harper, J. C. Preimplantation genetic diagnosis for chromosome rearrangements. Preimplantation Genetic Diagnosis. , 194-201 (2009).
- Harper, J. C., Coonen, E., Ramaekers, F. C. S., Delhanty, J. D. A., Handyside, A. H., Winston, R. M. L., Hopman, A. H. N. Identification of the sex of human preimplantation embryos in two hours using an improved spreading method and fluorescent in situ hybridisation using directly labelled probes. Hum. Reprod. 9, 721-724 (1994).
- Mackie Ogilvie, C., Scriven, P. N., Harper, J. C. Preimplantation genetic diagnosis for sex-linked diseases and sex-selection for non-medical reasons. Preimplantation Genetic Diagnosis. , 230-235 (2009).
- Munné, S., Lee, A., Rosenwaks, Z., Grifo, J., Cohen, J. Diagnosis of major chromosome aneuploidies in human preimplantation embryos. Hum. Reprod. 8, 2185-2192 (1993).
- Mackie Ogilvie, C., Scriven, P. N., Harper, J. C. Preimplantation genetic diagnosis for infertility (preimplantation genetic screening). Preimplantation Genetic Diagnosis. , 203-229 (2009).
- Scriven, P. N., Bossuyt, P. M. Diagnostic accuracy: theoretical models for preimplantation genetic testing of a single nucleus using the fluorescence in situ hybridization technique. Hum Reprod. Cytogenetics. 5, 394-400 (2010).
- Coonen, E., Dumoulin, J. C., Ramaekers, F. C., Hopman, A. H. Optimal preparation of preimplantation embryo interphase nuclei for analysis by fluorescence in-situ hybridization. Hum. Reprod. 9, 533-537 (1994).
- Dozortsev, D. I., McGinnis, K. T. An improved fixation technique for fluorescence in situ hybridization for preimplantation genetic diagnosis. Fertil. Steril. 76, 186-188 (2001).
- Hsu, L. Y., Benn, P. A., Tannenbaum, H. L., Perlis, T., Carlson, A. D. Chromosomal polymorphisms of 1, 9, 16, and Y in 4 major ethnic groups: a large prenatal study. Am. J. Med. Genet. 26, 95-101 (1987).
- Shim, S. H., Pan, A., Huang, X. L., Tonk, V. S., Varma, S. K., Milunsky, J. M., Wyandt, H. E. FISH variants with D15Z1. J. Assoc. Genet. Technol. 29, 146-151 (2003).
- Knight, S. J., Flint, J. Perfect endings: a review of subtelomeric probes and their use in clinical diagnosis. J. Med. Genet. 37, 401-409 (2000).
- Thornhill, A. R., de Die-Smulders, C. E., Geraedts, J. P., Harper, J. C., Harton, G. L., Lavery, S. A., Moutou, C., Robinson, M. D., Schmutzler, A. G., Scriven, P. N., Sermon, K. D., Wilton, L. ESHRE PGD Consortium (PGS) ESHRE PGD Consortium 'Best practice guidelines for clinical preimplantation genetic diagnosis (PGD) and preimplantation genetic screening (PGS)'. Hum. Reprod. 20, 35-48 (2005).
- Munné, S., Wells, D., Cohen, J. Technology requirements for preimplantation genetic diagnosis to improve assisted reproduction outcomes. Fertil. Steril. 94, 408-430 (2010).
- Wilton, L., Williamson, R., McBain, J., Edgar, D., Voullaire, L. Birth of a healthy infant after preimplantation confirmation of euploidy by comparative genomic hybridization. N. Engl. J. Med. 345, 1537-1541 (2001).
- Wells, D., Alfarawati, S., Fragouli, E. Use of comprehensive chromosomal screening for embryo assessment: microarrays and CGH. Mol. Hum. Reprod. 14, 703-710 (2008).
- Handyside, A. H., Harton, G. L., Mariani, B., Thornhill, A. R., Affara, N., Shaw, M. A., Griffin, D. K. Karyomapping, a universal method for genome wide analysis of genetic disease based on mapping crossovers between parental haplotypes. J. Med. Genet. 47, 651-658 (2010).
Yeniden Basımlar ve İzinler
Bu JoVE makalesinin metnini veya resimlerini yeniden kullanma izni talebi
Izin talebiThis article has been published
Video Coming Soon
JoVE Hakkında
Telif Hakkı © 2020 MyJove Corporation. Tüm hakları saklıdır