A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
ניתוח כמותי של השפעת כל סוג Hemagglutinins ויראלי ו Neuraminidases באמצעות נוגדנים יוניברסל מבחני כתם פשוט חריץ
* These authors contributed equally
In This Article
Erratum Notice
Summary
שיטה פשוטה כתם חריץ פותחה עבור כימות של hemagglutinin שפעת ויראלי neuraminidase באמצעות נוגדנים אוניברסלי מיקוד רצפים שימור ביותר שלהם מזוהה באמצעות ניתוחים ביואינפורמטיקה. גישה חדשנית זו עשויה לספק חלופה שימושי להגדרה כמותית של hemagglutinin כל נגיפיים neuraminidase.
Abstract
Hemagglutinin (HA) ו neuraminidase (NA) הם שני חלבונים פני השטח של נגיפי שפעת אשר ידועים תפקיד חשוב במחזור החיים ויראלי הגיוס של 1,2 התגובות מגן החיסון. כאשר המטרה העיקרית נוגדנים מנטרלים, HA משמש כיום גם את הסמן חיסון שפעת הפוטנציאל נמדדת immunodiffusion רדיאלי יחיד (SRID) 3. עם זאת, התלות של SRID על הזמינות של antisera המקביל תת ספציפיים הגורמים מינימום של 2-3 חודשים עיכוב לשחרורו של חיסון כל חדש. יתר על כן, למרות העדויות כי NA גם גורם החסינות 4, כמות NA בחיסונים לשפעת אינה סטנדרטית אך בשל חוסר של ריאגנטים המתאימים או שיטה אנליטית 5. לכן, שיטות חלופיות פשוט מסוגל לכימות אנטיגנים HA ו NA רצויות לשחרור מהיר, בקרת איכות טובה יותר של החיסונים לשפעת.
אזורים שמורים אוניברסלי ב שפעת כולם זמינים HA ו NA רצפים זוהו על ידי מנתח ביואינפורמטיקה 6-7. אחת ברצף (יועד Uni-1) זוהה epitope רק את נשמרת אוניברסלית של HA, הפפטיד היתוך 6, בעוד שני רצפים שימור זוהו neuraminidases, אחד קרוב באתר הפעיל האנזימטית (יועד HCA-2) ואת קרובים אחרים הסופית-N (יועד HCA-3) 7. פפטידים אלו רצפים של חומצות אמיניות היו מסונתז ומשומשים לחסן ארנבות לייצור נוגדנים. נוגדנים נגד epitope Uni-1 של HA היה מסוגל להיקשר 13 subtypes של שפעת A HA (H1-H13) ואילו נוגדנים נגד HCA-2 ו HCA-3 אזורים של NA היו מסוגלים מחייב את כל 9 תת NA. כל הנוגדנים הראו סגוליות מדהים נגד רצפים ויראלי כפי שמעידים התצפית שלא לחצות תגובתיות לחלבונים allantoic זוהה. נוגדנים אלה אוניברסלי שימשו אז לפתח כתם מבחני חריץ לכמת HA ו NA של שפעת חיסונים ללא צורך antisera ספציפי 7,8. דגימות חיסון יושמו על קרום PVDF באמצעות מנגנון כתם חריץ יחד עם סטנדרטים התייחסות בדילול לריכוזים שונים. לצורך זיהוי של HA, דגימות תקן היו בדילול הראשון טריס שנאגרו מלוחים (TBS) המכיל אוריאה 4M בעוד למדידת NA הם מדולל TBS המכילה 0.01% Zwittergent התנאים האלה שיפרה בצורה משמעותית את רגישות הזיהוי. בעקבות גילוי של HA ו NA על ידי אנטיגנים immunoblotting עם נוגדנים אוניברסלי שלהם, בעוצמות האות היו לכמת ידי צפיפות. סכומי HA ו NA בחיסונים חושבו לאחר מכן באמצעות עקומת סטנדרט הוקמה עם עוצמות אות הריכוזים השונים של הפניות בשימוש.
בהתחשב בכך נוגדנים אלה נקשרים epitopes אוניברסלי HA או NA, החוקרים מעוניינים יכול להשתמש בהם ככלי מחקר immunoassays מלבד כתם חריץ בלבד.
Protocol
1. הכנה של ריאגנטים וציוד
- לפני שמתחילים את ההליך כתם חריץ, להכין 20_mls של פתרון אוריאה 4M ב-טריס בופר סליין (20 mM טריס, 137 mM NaCl, pH 7.6) (TBS) עבור hemagglutinin, או ארכיאולוגיות, כתם חריץ, או 20_mls של 0.01% Zwittergent פתרון TBS עבור neuraminidase, או NA, כתם חריץ. בעוד אוריאה 4M יש להכין טרי בכל פעם, פתרון 10% מניות Zwittergent ב DH 2 O היא יציבה במשך לפחות 6 חודשים בטמפרטורת החדר, ולכן יכול להיות מדולל ל% 0.01 ב TBS לפני כל assay.
- הכן 2000 של ה-MLS חיץ כביסה ידי הוספת Tween-20 לפתרון כפות לריכוז סופי של 0.1%. הכן 80 MLS של חיץ חסימת ידי המסת אבקת חלב רזה (סופג חלב ללא שומן כיתה יבש) לריכוז סופי של 5% w / v כביסה חיץ.
- הפעל את קרום PVDF (טרום לחתוך בגודל 9 12 ס"מ x) מתנול למשך 15 שניות, ואחריו 2 דקות ולשטוף ב DDH 2 O. משרים את הממברנה ב TBS עד לשימוש. טרום רטוב 3 גיליונות של Bio-Dot-SF מסנן נייר כפות עד בשימוש.
2. הכנת החיסון דגימות שפעת רגילה התייחסות HA חריץ כתם
התייחסות שפעת חיסון סטנדרטים עם תוכן מראש HA המתאים זני החיסון להיבדק התקבלו המרכז ביולוגי הערכה ומחקר (CBER / ה-FDA, ארה"ב) או המכון הלאומי רגיל ביולוגית Control (NIBSC, בריטניה) משמשים כימות HA על ידי כתם חריץ. החוקרים יכולים גם להכין את הסטנדרטים שלהם אנטיגן באמצעות נהלים הוקמה כמתואר הפניות 9 ו -10.
- עבור אנטיגנים HA התייחסות חיסון דגימות מבחן: לדלל את אנטיגן התייחסות HA המניות אוריאה 4M / TBS על הריכוזים הבאים: 0, 0.0938, 0.1875, 0.375, 0.75, 1.5, 3 ו - 6 HA מיקרוגרם / מ"ל. מערבבים היטב. ואז, לדלל חיסון מבחן דוגמאות לשימוש האדם המתקבל יצרני חיסונים או תוצרת בית למטרות המחקר המדעי אוריאה 4M / כפות ומערבבים היטב. בעוד כפילויות של אנטיגן ההתייחסות דגימות החיסון ניתן להפעיל, triplicates עדיפים. הכן 3 דילולים של כל דגימה (פי 2 הבדל) כדי לאפשר את ריכוז מדגם ליפול בתוך עקומת הסטנדרטי. הכן 450 μl μl או 650 של אנטיגן כל התייחסות או חיסון מבחן מדגם דילול לרוץ כפילויות או triplicates בהתאמה. שפעת חד ערכי חיסונים ניתן לבדוק בשיטה זו כתם חריץ. התוכן HA של אנטיגנים התייחסות נקבע קודם לכן באמצעות SRID המהווה את מבחן סטנדרטי המשמשים כיום ההכנות חיסון שפעת. התוכן נקבע על ידי HA SRID שימש את הריכוז הראשוני אנטיגן התייחסות HA מניות להכנת דילולים עבור עקומת חריץ כתם סטנדרטי.
3. הכנת החיסון דגימות שפעת רגילה התייחסות NA חריץ כתם
התייחסות שפעת חיסון הסטנדרטים המתאימים זני החיסון להיבדק התקבלו המרכז ביולוגי הערכה ומחקר (CBER / ה-FDA, ארה"ב) או המכון הלאומי רגיל ביולוגית Control (NIBSC, בריטניה) ומשמשים כימות NA על ידי כתם חריץ. התוכן NA של דגימות אלה התייחסות נקבע על ידי ניתוח SDS-PAGE של דגימות deglycosylated בשילוב עם ניתוח צפיפות סריקה, כפי שתואר לעיל 9, בשינויים קלים 10. בקיצור, התייחסות deglycosylated החיסון דגימות (5 מיקרוגרם) היו מעורבים עם חיץ מדגם טעון על הג'ל. הג'ל היה לרוץ mA 20 דקות בערך 90 עד לצבוע מעקב לרוץ רק מתוך הג'ל, ואחריו מכתים Sypro. כימות צפיפות של חלבונים בוצע באמצעות מערכת ג'ל Fluorchem תיעוד (אלפא Innotech). כמות NA נקבע על בסיס יחס של חלבונים NA את החלבונים הכולל כפי שנקבע על ידי assay לורי. דגימות הפניה מוכן בשיטה זו ניתן להשתמש ב כתם חריץ כימות של התוכן NA בדגימות חיסון מיצרני החיסונים.
- עבור אנטיגנים NA התייחסות חיסון דגימות מבחן: לדלל את המניות אנטיגן NA התייחסות 0.01% Zwittergent / TBS על הריכוזים הבאים: 0, 0.039, 0.078, 0.1562, 0.3125, 0.625, 1.25, 2.5, 5 ו - 10 מיקרוגרם NA / ml. מערבבים היטב. ואז, לדלל חיסון מבחן דוגמאות לשימוש האדם המתקבל יצרני חיסונים או תוצרת בית למטרות המחקר המדעי 0.01% Zwittergent / כפות ומערבבים היטב. בעוד כפילויות של אנטיגן ההתייחסות דגימות החיסון ניתן להפעיל, triplicates עדיפים. הכן 3 דילולים של כל דגימה (פי 2 הבדל) כדי לאפשר את ריכוז מדגם ליפול בתוך עקומת הסטנדרטי. הכן 450 μl μl או 650 של אנטיגן כל התייחסות או חיסון מבחן מדגם דילול לרוץ כפילויות או triplicates בהתאמה. שפעת חד ערכי חיסונים ניתן לבדוק שנינותש בשיטה זו כתם חריץ.
4. האסיפה של המנגנון SF ביו דוט Microfiltration ו סופג של דגימות על PVDF קרום
- להרכיב לנקות קודם מיובשים Bio-Dot מנגנון SF Microfiltration. מניחים את צלחת תמיכה אטם סעפת לתוך ואקום במקום אטם איטום על top.Place 3 לחלח גיליונות נייר ביו דוט לסנן SF על אטם, ואחריו הקרום PVDF מראש ספוג. מניחים את תבנית המדגם על גבי הממברנה ואת אצבע להדק את ארבעת הברגים באמצעות דפוס מעבר אלכסוני על מנת להבטיח יישום אחיד של הלחץ על פני הממברנה.
- ודא כי שסתום 3-way מוגדר לחשוף את סעפת ואקום למקור ואקום רק לפני הפעלת המשאבה ולחבר את הוואקום.
- הפעל את המשאבה ולהתחבר מנגנון ביו דוט. ודא כי שסתום זרימת ממוקמת ברמה מתחת בארות מדגם לניקוז מהיר ונכון של הדגימות בשלבים הבאים.
- חזור על השלב בורג הידוק באמצעות דפוס מעבר אלכסוני. הידוק הברגים בעוד ואקום מוחל מבטיח חותם חזק ומונע זיהום הכלאה בין בארות.
- שנה את שסתום זרימת לחשוף את סעפת ואקום לאוויר לכבות את המשאבה.
- החלת 100 μl של כפות לכל הבארות באמצעות pipettor רב על רעננותם הממברנה ובכך להבטיח מחייב אחיד של האנטיגן. יש להקפיד, כדי למנוע היווצרות של בועות ליישם את הפתרון באמצע הבאר, קרוב לתחתית ככל האפשר, על מנת לכסות את חריץ שווה. פרץ כל בועת אוויר הציג בטעות עם קצה pipettor.
- שנה את שסתום זרימת לחשוף את סעפת לאוויר והן ואקום, להפעיל את המשאבה, ובעדינות לנקז את המאגר מהבארות ידי לשים אצבע על הנמל חשוף לאוויר כדי לווסת את כמות האבק.
- שנה את שסתום זרימת לחשוף את סעפת לאוויר בהקדם למאגר יש סחוט לגמרי מבארות כל. כבה את המשאבה או לנתק את ואקום.
- החלת 200 μl של תקן זה או מדגם דילול חיסון לכל טוב. דגימות Pipet אחד בכל פעם, במרכז כל טוב, קרוב לתחתית ככל האפשר, לטפל כדי למנוע החדרת בועות אוויר. פרץ כל בועת אוויר הציג בטעות עם קצה pipettor. שימי 200 μl של חיץ מדגם דילול (אוריאה 4M / TBS או 0.01% Zwittergent / TBS) בבארות בשימוש על מנת להבטיח ואקום ראוי בארות בשימוש.
- כוונו את שסתום זרימת לחשוף את סעפת לאוויר והן ואקום. הפעל את המשאבה (או מחדש את ואקום) בעדינות לאפשר דגימות כדי לרוקן לחלוטין מהבארות על ידי שליטה על כמות האבק באצבע אחת מעל הנמל חשוף לאוויר. הסר את האצבע מנמל כדי לשחרר את הוואקום בהקדם את כל הדגימות יש סחוט.
- מיד להוסיף 200 μl של כפות זה גם באמצעות pipettor רב. החלת ואקום עדין לנקז ולשטוף את הבארות על ידי שליטה על כמות האבק באצבע אחת מעל הנמל חשוף לאוויר.
- חזור על השלב לשטוף המתואר בשלב 4.11. ברגע בארות יש סחוט לגמרי, לשחרר את הברגים של תבנית המדגם לכבות את ואקום כדי למנוע overdrying הבארות. מיד להמשיך להסיר את הקרום.
- מניחים את הממברנה לתוך חסימת חיץ דגירה לילה ב 4 ° C, עם נדנדה עדין. השתמש מספיק חיץ חסימת כדי לכסות לחלוטין את הממברנה.
5. Immunoblotting של אנטיגנים HA ו NA
- לאחר דגירה לילה חיץ חסימה, לשטוף את הממברנה פעמיים במשך 5 דקות עם% TBS/0.1 Tween-20 חיץ כביסה. לכל כביסות ו incubations, להבטיח את הממברנה מכוסה כולו פתרון.
- דגירה הממברנה עם נוגדן ארנבת אוניברסלי נגד HA (כגון Uni-1) או NA (כגון HCA-2 או HCA-3) מדולל ב 5% w / v BSA כביסה חיץ במשך שעה אחת בטמפרטורת החדר, עם עדינה נדנדה. ריכוזי נוגדנים אופטימלית צריך להיקבע עבור כל מניה נוגדן. דילולים של 1:4000 של ארנבת אנטי סרום נתן תוצאות אופטימליות עבור נוגדנים שהוזכרו לעיל.
- לשטוף את הממברנה שלוש פעמים, בטמפרטורת החדר עם נדנדה עדין למשך 15 דקות בכל פעם, כדי להסיר כל הנוגדנים מאוגד העיקרי.
- דגירה הממברנה עם נוגדן נגד ארנב HRP-מצומדות משנית. השתמש דילול 1:50000 של התיש Thermo ImmunoPure נגד ארנב IgG, נוגדן peroxidase מצומדות בחסימת חיץ דגירה בטמפרטורת החדר למשך 30 דקות עם נדנדה עדין.
- לשטוף את הממברנה שלוש פעמים, נדנדה במשך 15 דקות בכל פעם, בטמפרטורת החדר עם חיץ כביסה כדי להסיר כל הנוגדנים מאוגד משני.
- לשטוף את הממברנה עם כפות במשך 5 דקות עם נדנדה עדין כדי להסיר שאריות אבקת Tween-20 מעל פני קרום.
- הכינו את המצע עם 3 מ"ל של כל אחד reagent מהמערב Supersignal ערכת דורה תשתית מורחבת משך מן Thermo Scientific ומערבבים היטב.
- מניחים את קרום על ממחטת נייר יבש בעדינות כדי להסיר כל חיץ עודף כפות.
- מעבירים את קרום למיכל יבש להוסיף את המצע כדי לכסות את הממברנה כולה. דגירה 5 דקות עם נדנדה עדין, בטמפרטורת החדר.
- הסר את המצע על ידי עודף בעדינות סופג את הממברנה על נייר.
- לחשוף את הממברנה לסרט chemiluminescence. משך החשיפה יהיה צריך להיות מותאם, כדי למנוע הרוויה אות אבל יהיו בדרך כלל נע בין 10 שניות עד 10 דקות.
- בצע ניתוחים צפיפות על הסרט פותח באמצעות הדמיה ג'ל מנגנון כגון מערכת Fluorchem תיעוד ג'ל (אלפא Innotech) הבאים הוראות היצרן. ערכי צפיפות עבור כל קבוצה של משכפל של אנטיגנים התייחסות חיסון דגימות הבדיקה בממוצע אז. בעוד הסטנדרטים אנטיגן דגימות החיסון ניתן להריץ כפילויות, triplicates עדיפים. ערכי צפיפות עבור משכפל צריך להיות דומה מאוד. הבדלים משמעותיים בין משכפל להצביע על בעיה טכנית סבירה במהלך ההליך. עקומת ריכוז תלויי הסטנדרטי הוא הוקם על ידי התוויית ערכי צפיפות בממוצע לעומת הסכום (ב ng) של HA או אנטיגן NA לשים כל חריץ, מרמת ההתייחסות. שימוש הולם המתאים עקומת כיול ב immunoassays הוא קריטי לכימות HA ו NA במדויק. רגרסיה לינארית, מתקבל על ידי התוויית התגובה (Y) לעומת ריכוז (x) באמצעות החלק הליניארי של עקומת התגובה (y = mx + b) היא השיטה הפשוטה ביותר כימות של analytes. אם יש מגוון רחב יותר של analytes נחשב לצורך חישוב ריכוז, הלוגיסטי four פרמטר (4PL) מודל immunoassays המקובל כיום יש להשתמש. מגוון של תוכנה זמין עבור חוקרים מעוניינים לבחון. במקרה של assay תיאר כתם חריץ, להמיר את ציר x ערכים להיכנס בהיקף מאפשרת עקומת להתאים מודל 4-PL ושימוש רגרסיה משתנה מדרון שאינו ליניארי כדי לחשב את כמויות מחק של HA ו NA ב דגימות החיסון נבדק אפשרי ובכך. לפיכך, אנו משתמשים באופן שגרתי מודל זה עבור ניתוחים שלנו. כמו חיסון דגימות הבדיקה היו מדולל אוריאה או 4M / TBS או 0.01% Zwittergent / TBS לפני שהוא מחק על הממברנה, הגורם לדילול עבור כל דגימה צריכה להילקח בחשבון כדי לקבוע את HA ו NA התוכן של המבחן המקורי חיסון דגימות. הוא הציע כי כל מדגם חיסון מבחן להתנהל בשלושה דילולים שונים (פי 2 הפרש) על מנת להגדיר את אחד הערכים צפיפות ליפול בתוך עקומת הסטנדרטי. ערכי צפיפות גבוהה יותר בטווח עקומה סטנדרטית לכל דילולים בדקו דגימות של החיסון צריך להיות מדולל נוספת HA מדויק או כימות NA. אם הערכים הם מתחת צפיפות סוף הנמוך ביותר של העקומה, דגימות המבחן צריך להיות מדולל ב גורם הדילול נמוכה יותר.
6. נציג תוצאות:
מנתח ביואינפורמטיקה של שפעת כולם זמינים רצפים HA אישר את הסופית של N-למקטע HA2 (הפפטיד היתוך) כאזור רק שימור של HA. איור 1 מציג את שיעור שימור לכל תפקיד חומצת אמינו רצף קונצנזוס מזוהה. שתי וריאציות זוהו על עמדות 2 (L-> אני) ו -12 (G-> N) של 14 N-מסוף חומצות אמינו של HA2, אבל וריאציות כאלה נמצאו לא להשפיע על הכריכה בין נוגדנים לבין גרסאות פפטיד 6 . Uni-1 epitope (GLFGAIAGFIEGGW) נבחרה לפתח נוגדן אוניברסלי נגד HA. נוגדן זה הוכיח סגוליות מדהים של רצפי ויראלי הוא מסוגל מחייב 13 תתי סוגים שונים של שפעת A HA (H1-H13) (איור 2).
שימוש בגישה דומה, שני רצפים שימור אוניברסלית זוהו שפעת הכל, של NA אחד קרוב לאתר פעיל enzymatically (HCA-2) (איור 3A) והשני בתחנה הסופית-N (HCA-3) (איור 3 ב) . פפטידים אלו רצפים של חומצות אמיניות שימשו אנטיגנים לייצר נוגדנים נגד NA אוניברסלי. נוגדנים נגד epitopes שניהם היו מסוגלים מחייב את כל 9 תתי סוגים של NA והראה מעט מאוד צולבות תגובתיות לחלבונים allantoic או הסלולר, ובכך הוכחת סגוליות גבוהה עבור ויראלי רצפים NA (איור 4).
איור 5 מציג סקירה של שיטת חריץ כתם על כימות של שפעת HA ו NA.
דוגמאות של HA ו NA חריץ אנטיגן ניתוח כתם מוצגים איורים 6 ו -7. איור 6 א ו - 6C מציג תוצאות נציג לאחר זיהוי של האנטיגן HA ב תקן חיסון שפעת התייחסות דגימות החיסון בהתאמה. כל המדגם (רגיל או חיסון) היה לרוץ לשכפל, בבארות הסמוכות. כפילויות צריך להראות similar זיהוי עוצמות הבאות. אופטימיזציה של דילולים נוגדן, הדגירה זמן חשיפה ייתכן שתידרש בהתאם נוגדנים בשימוש.
דוגמה של עקומת סטנדרט טיפוסי שהושג בעקבות זיהוי של ריכוזים שונים של HA מתוך מדגם התייחסות החיסון הסטנדרטי הוא שמוצג באיור 6B. ריכוז אנטיגן HA הוא יחסי עוצמת האות הבאה זיהוי chemiluminescence של כתם חריץ ומתאים מודל 4-PL עקומת הולם בטווח זה ריכוז (0.0938-6 מיקרוגרם HA / ml).
איור 7 מציג תוצאות נציג זיהוי של האנטיגן NA ב תקן חיסון שפעת התייחסות בדגימות החיסון. ניתוח צפיפות הראה כי עוצמת האות המתקבל על ידי גילוי אנטיגן NA ב דילולים שונים של תקן חיסון הפניה על ידי כתם חריץ הוא יחסי הריכוז של NA (איור 7 א). עקומת תקן וכתוצאה מתאים מודל 4-PL עבור מגוון זה ריכוז (0.039-10 מיקרוגרם NA / ml), כפי שמוצג באיור 7B. איור מראה 7C דוגמה של ניתוח חריץ כתם של התוכן NA בדגימות חיסון שפעת. כל המדגם היה assayed בשני עותקים, בבארות הסמוכות.

באיור 1. שיעור שימור epitope Uni-1 באזור היתוך פפטיד של HA שפעת.
מנתח ביואינפורמטיקה של שפעת כולם זמינים רצפים HA אישר כי הפפטיד היתוך (הממוקם בתחנה הסופית-N של למקטע HA2) הוא האזור היחיד נשמרת אוניברסלית של HA. ראוי לציין, כי שתי וריאציות בעמדה 2 (L-> אני) ו -12 (G-> N) נמצאו לא להשפיע על נוגדן מחייב 6. נוגדן אוניברסלי המסוגל 13 תת מחייב שונים של שפעת A HA (H1-H13) פותח באמצעות Uni-1 epitope (GLFGAIAGFIEGGW).
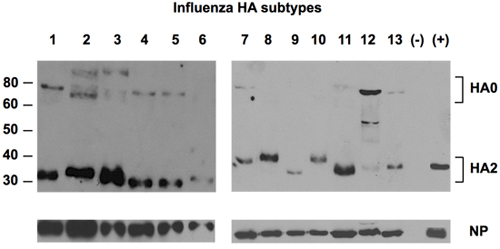
איור 2. איתור של 13 תת של HA על ידי נוגדן אוניברסלי נגד HA.
נוזלים Allantoic של 13 תת וירוסים של שפעת מופצות בביצים embryonated היו מופרדים ב SDS-PAGE, ואחריו זיהוי של חלבונים HA באמצעות נוגדן אוניברסלי נגד epitope Uni-1 של HA. חלבון NP זוהה כמו טעינה מלאה באמצעות ארנב polyclonal NP-נוגדן ספציפי. בקרה שלילית (-) היה נוזל allantoic מן הביצים נגוע. בקרה חיובית (+) היה סטנדרטי התייחסות של H1 מן NIBSC, בריטניה
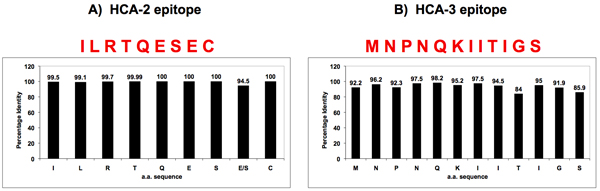
איור 3. הומולוגיה רצף של שפעת A של NA ליד אתר פעיל enzymatically ואת N-הסופית.
שני רצפים שימור אוניברסלית זוהו שפעת A של NA ידי ביואינפורמטיקה, אחד ממוקם בסמוך לאתר הפעיל האנזימטית (HCA-2) (לוח א '), השני בתחנה הסופית-N (HCA-3) (לוח ב'). פפטידים אלו רצפים שימור חומצת אמינו היו מסונתז ו המשמש לייצור נוגדנים נגד NA אוניברסלי.

איור 4. איתור של 9 תת של NA NA על ידי נוגדנים.
נוזלים Allantoic של תשעה תת NA של שפעת וירוסים מופצות בביצים embryonated היו מופרדים ב SDS-PAGE, ואחריו זיהוי של חלבונים NA באמצעות HCA-2 (לוח א ') HCA-3 (לוח ב') נוגדנים. חלבון NP זוהה כמו טעינה מלאה באמצעות נוגדן ארנבת polyclonal NP-ספציפיים (לוח ג). בקרה שלילית (-) היה נוזל allantoic מן הביצים נגוע. בקרה חיובית (+) היה נוזל allantoic מתובל rNA1 של A / ניו Caledonia/20/99 ומישש עם antisera המקביל.

איור 5. תרשים זרימה של הליך חריץ כתם על quantitation של אנטיגנים HA ו NA בחיסונים לשפעת.
מאגרים הדרושים דילול מדגם כמו גם לרחצה חוסם את קרום כתם חריץ מוכנים הראשון הממברנה PVDF וניירות לסנן הדרושים הרכבה של המנגנון SF ביו דוט Microfiltration מראש ספוג. חיסון נגד שפעת רגילה דגימות הפניה מדולל מאגרים האופטימלי עבור HA או זיהוי NA על ידי כתם חריץ. מנגנון ביו דוט SF Microfiltration מורכב על פי הוראות היצרן דגימות מוחלים על הממברנה PVDF. HA ו NA אנטיגנים מזוהים באמצעות נוגדנים נגד אנטיגן אחד אוניברסלי. ניתוח צפיפות מבוצעת על האותות שהתקבלו chemiluminescence quantitation של HA ו NA בדגימות שנבדקו.
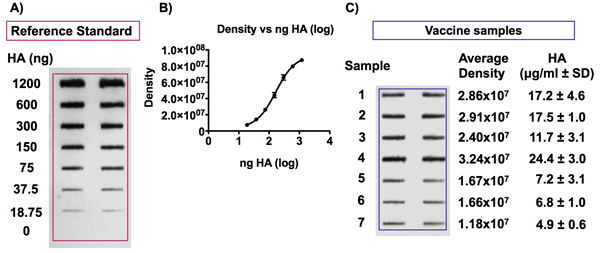
איור 6. גילוי האנטיגן HA בדגימות חיסון שפעת ועייןence סטנדרטי.
לוח מראה כתם נציג שהושג בעקבות immunodetection של האנטיגן HA. אנטיגן ההתייחסות HA היה מדולל לריכוזים מ מיקרוגרם 0-6 HA / ml לבין החיסונים היו מדולל כדי בריכוז של 0.375 מיקרוגרם HA / מ"ל ב 4M אוריאה / TBS לפני מוחל על קרום PVDF עם מנגנון SF ביו דוט Microfiltration . אנטיגן HA זוהה לאחר מכן באמצעות נוגדן Uni-1 אוניברסלי. לוח ב 'מציג דוגמה של עקומת סטנדרט מתקבל על ידי גילוי אותות של ריכוזי HA שונים מהתקן התייחסות החיסון. עוצמת האות היא יחסית ריכוז HA ו העקום מתאים מודל 4-PL.
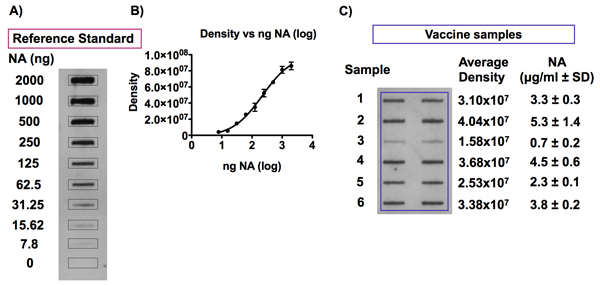
איור 7. גילוי האנטיגן NA בחיסון דגימות שפעת רגילה התייחסות.
לוח ונציג B להראות אותות המתקבלים בעקבות זיהוי של NA ב תקן חיסון שפעת התייחסות בדילול לריכוזים NA בטווח שבין 0 ל 10 NA מיקרוגרם / מ"ל ב 0.01% Zwittergent / TBS ו עקום וכתוצאה 4-PL סטנדרטי הבאים מנתחת צפיפות. דוגמה אופיינית של אותות chemiluminescence זוהה בעקבות ניתוח חריץ כתם של אנטיגן NA בדגימות חיסון שפעת מוצגת בלוח ג דגימות שפעת החיסון היו בדילול ריכוז של 1 מיקרוגרם HA / מ"ל ב 0.01% Zwittergent / TBS והיו מחק על PVDF קרום באמצעות מנגנון ביו דוט SF Microfiltration. דילולים של רמת הפניה המקביל החיסון, עם ריכוזים הנעים בין 0 ל 2.5 NA מיקרוגרם / מ"ל, נכללו על כתם זהה על מנת ליצור עקומת תקן quantitation של האנטיגן NA בדגימות החיסון. אנטיגן NA זוהה עם הנוגדן HCA-2 אוניברסלי נגד NA צפיפות וניתוח של אותות chemiluminescence שהושגו בוצעה. כמות NA במדגם כל חיסון יכול להיות מחושב על עקומת סטנדרט 4-PL מתקבל על ידי זוממים את עוצמת האות ערכים לעומת ריכוז NA בתקן התייחסות החיסון.
Discussion
קביעה כמותית של שפעת נגיפית HA ו NA הם קריטיים עבור מחקר ופיתוח החיסון שכן אלה שני חלבונים פני השטח הם מרכיבים נגיפיים החשוב ביותר גרימת התגובה החיסונית 6-11. שיטות אימונולוגיות דיווחו בעבר לצורך זיהוי של חלבונים אלה דורשים מאמץ נוגדנים ספציפיים. כתם פשוט, לשחזור מ...
Disclosures
Acknowledgements
המחברים מבקשים להודות לגברת מוניקה Tocchi לבדיקה העריכה של כתב היד. AMH הוא נתמך על ידי מלגה מהמלך Abdulaziz University, דרך סעודיה תרבות הלשכה בקנדה.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב או ציוד | חברה | מספר קטלוגי | תגובות |
|---|---|---|---|
| Bio-Dot-SF Apparatus Microfiltration | Bio-Rad | 170-6542 | |
| Bio-Dot-SF נייר סינון | Bio-Rad | 162-0161 | |
| Immobilon-FL העברת קרום (PVDF) | Millipore | IPFL00010 | |
| לשאוב אבק | Millipore | WP6111560 | |
| Chemiluminescence BioMax אור קולנוע | קודאק | 178 8207 | |
| FluorChem ג'ל מערכת תיעוד | אלפא Innotech | 29-008-1896X | |
| ארנב נוגדנים נגד יוניברסל HA ו NA אנטיגנים | Uni-1 (HA) HCA-2, HCA-3 (NA) | נוגדנים זמינים דרך MTA או יכול להיות שנוצר על ידי חוקרים מעוניינים פי הנהלים שתוארו לעיל 6,7. | |
| התייחסות שפעת חיסון אנטיגן | CBER / או ה-FDA NIBSC | ||
| חיסון נגד שפעת דגימות | זמין בדרך כלל ברוב המדינות | ||
| דשן | סיגמא אולדריץ | U1250 | |
| דטרגנט Zwittergent 3-14 | Calbiochem | 693017 | |
| Tween-20 | פישר סיינטיפיק | BP337-500 | |
| סופג חוסם כיתה ללא שומן יבש החלב | Bio-Rad | 170-6404 | |
| ImmunoPure נגד ארנב עיזים IgG, (H + L), peroxidase מצומדות | Thermo Scientific | 31460 | |
| SuperSignal המערבית דורה Extended תשתית משך | Thermo Scientific | 34075 |
References
- Webster, R. G., Bean, W. J. Genetics of influenza virus. Annu Rev Genet. 12, 415-431 (1978).
- Skehel, J. J., Wiley, D. C. Receptor binding and membrane fusion in virus entry: the influenza hemagglutinin. Annu Rev Biochem. 69, 531-569 (2000).
- Wood, J. M. The influence of the host cell on standardisation of influenza vaccine potency. Dev Biol Stand. 98, 183-188 (1999).
- Sylte, M. J., Suarez, D. L. Influenza neuraminidase as a vaccine antigen. Curr Top Microbiol Immunol. 333, 227-241 (2009).
- Bright, R. A., Neuzil, K. M., Pervikov, Y., Palkonyay, L. WHO meeting on the role of neuraminidase in inducing protective immunity against influenza infection. Vaccine. 27, 6366-6369 (2008).
- Chun, S. Universal antibodies and their applications to the quantitative determination of virtually all subtypes of the influenza A viral hemagglutinins. Vaccine. 26, 6068-6076 (2008).
- Gravel, C. Qualitative and quantitative analyses of virtually all subtypes of influenza A and B viral neuraminidases using antibodies targeting the universally conserved sequences. Vaccine. 28, 5774-5784 (2010).
- Li, C. A simple slot blot for the detection of virtually all subtypes of the influenza A viral hemagglutinins using universal antibodies targeting the fusion peptide. Nat Protoc. 5, 14-19 (2010).
- Harvey, R., Wheeler, J. X., Wallis, C. L., Robertson, J. S., Engelhardt, O. G. Quantitation of haemagglutinin in H5N1 influenza viruses reveals low haemagglutinin content of vaccine virus NIBRG-14 (H5N1). Vaccine. 26, 6550-6554 (2008).
- Li, C. Application of deglycosylation and electrophoresis to the quantification of influenza viral hemagglutinins facilitating the production of 2009 pandemic influenza (H1N1) vaccines at multiple manufacturing sites in China. Biologicals. 38, 284-289 (2010).
- Johansson, B. E., Pokorny, B. A., Tiso, V. A. Supplementation of conventional trivalent influenza vaccine with purified viral N1 and N2 neuraminidases induces a balanced immune response without antigenic competition. Vaccine. 20, 1670-1674 (2002).
- Hashem, A. Universal antibodies against the highly conserved influenza fusion peptide cross-neutralize several subtypes of influenza A virus. Biochem Biophys Res Comm. , (2010).
Erratum
Formal Correction: Erratum: Quantitative Analyses of all Influenza Type A Viral Hemagglutinins and Neuraminidases using Universal Antibodies in Simple Slot Blot Assays
Posted by JoVE Editors on 11/13/2012. Citeable Link.
An author's affiliation was omitted from the publication of Quantitative Analyses of all Influenza Type A Viral Hemagglutinins and Neuraminidases using Universal Antibodies in Simple Slot Blot Assays.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved