Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Количественный анализ всех гриппа типа Вирусный Hemagglutinins и нейраминидазы использованием универсального антител в простом Анализы Blot Слот
* Эти авторы внесли равный вклад
В этой статье
Erratum Notice
Резюме
Простой метод блот слот был разработан для количественной оценки гриппа вирусного гемагглютинина и нейраминидазы с использованием универсальных антител ориентации их наиболее сохраняется последовательности, выявленных в ходе анализа биоинформатики. Этот инновационный подход может обеспечить полезную альтернативу количественное определение всех вирусных гемагглютинина и нейраминидазы.
Аннотация
Hemagglutinin (HA) and neuraminidase (NA) are two surface proteins of influenza viruses which are known to play important roles in the viral life cycle and the induction of protective immune responses1,2. As the main target for neutralizing antibodies, HA is currently used as the influenza vaccine potency marker and is measured by single radial immunodiffusion (SRID)3. However, the dependence of SRID on the availability of the corresponding subtype-specific antisera causes a minimum of 2-3 months delay for the release of every new vaccine. Moreover, despite evidence that NA also induces protective immunity4, the amount of NA in influenza vaccines is not yet standardized due to a lack of appropriate reagents or analytical method5. Thus, simple alternative methods capable of quantifying HA and NA antigens are desirable for rapid release and better quality control of influenza vaccines.
Universally conserved regions in all available influenza A HA and NA sequences were identified by bioinformatics analyses6-7. One sequence (designated as Uni-1) was identified in the only universally conserved epitope of HA, the fusion peptide6, while two conserved sequences were identified in neuraminidases, one close to the enzymatic active site (designated as HCA-2) and the other close to the N-terminus (designated as HCA-3)7. Peptides with these amino acid sequences were synthesized and used to immunize rabbits for the production of antibodies. The antibody against the Uni-1 epitope of HA was able to bind to 13 subtypes of influenza A HA (H1-H13) while the antibodies against the HCA-2 and HCA-3 regions of NA were capable of binding all 9 NA subtypes. All antibodies showed remarkable specificity against the viral sequences as evidenced by the observation that no cross-reactivity to allantoic proteins was detected. These universal antibodies were then used to develop slot blot assays to quantify HA and NA in influenza A vaccines without the need for specific antisera7,8. Vaccine samples were applied onto a PVDF membrane using a slot blot apparatus along with reference standards diluted to various concentrations. For the detection of HA, samples and standard were first diluted in Tris-buffered saline (TBS) containing 4M urea while for the measurement of NA they were diluted in TBS containing 0.01% Zwittergent as these conditions significantly improved the detection sensitivity. Following the detection of the HA and NA antigens by immunoblotting with their respective universal antibodies, signal intensities were quantified by densitometry. Amounts of HA and NA in the vaccines were then calculated using a standard curve established with the signal intensities of the various concentrations of the references used.
Given that these antibodies bind to universal epitopes in HA or NA, interested investigators could use them as research tools in immunoassays other than the slot blot only.
протокол
1. Приготовление реагентов и оборудования
- Перед началом процедуры слот-блот, подготовить 20_mls 4 М раствор мочевины в трис-буферный солевой раствор (20 мМ Tris, 137 мМ NaCl, рН 7,6) (TBS) для гемагглютинин или HA, слот пятно, или 20_mls от 0,01% Zwittergent решение в TBS для нейраминидазы или НД, слот пятно. Хотя 4M мочевины следует приготовить свежую каждый раз, 10% Zwittergent маточного раствора в дН 2 O стабилен в течение не менее 6 месяцев при комнатной температуре и поэтому может быть разбавлен до 0,01% в TBS перед каждым анализом.
- Подготовка 2000 мл промывочного буфера, добавив Твин-20, чтобы решение TBS до конечной концентрации 0,1%. Подготовка 80 мл блокирующего буфера путем растворения обезжиренное сухое молоко (промокательной сорт сухого обезжиренного молока) до конечной концентрации 5% вес / в стиральных буфера.
- Активировать PVDF мембраны (нарезанные на 9 х 12 см, размер) в метаноле в течение 15 секунд, а затем 2 минуты промыть в DDH 2 O. Замочите мембраны в TBS до использования. Предварительно мокрой 3 листа Био-Dot SF фильтровальную бумагу в TBS, пока используется.
2. Подготовка вакцины против гриппа образцы и эталон для ГК слот пятно
Вакцина против гриппа эталонов с заранее заданными HA содержание соответствующих вакцинных штаммов для тестирования были получены из Центра биопрепаратов оценке и исследованиям (СБЕР / FDA, США) и Национального института биологических Стандартные и контроля (NIBSC, Великобритания) и используются для количественного HA по слотам пятно. Следователи также могут подготовить свои собственные стандарты антигена с использованием установленных процедур, как описано в ссылках 9 и 10.
- Для HA ссылкой антигенов и тестовых образцов вакцины: Развести антиген HA ссылкой акций 4M мочевины / TBS в следующих концентрациях: 0, 0,0938, 0,1875, 0,375, 0,75, 1,5, 3 и 6 мкг HA / мл. Хорошо перемешайте. Затем, развести испытания вакцины образцы для человека получить вакцину производителей или собственного производства научно-исследовательских целях в 4M мочевины / TBS и хорошо перемешать. Хотя дубликаты антиген ведения и образцы вакцины может быть запущен, трем образцам являются предпочтительными. Подготовка 3 разведений каждого образца (2-кратное различие), чтобы образец концентрации, чтобы подпадать под стандартной кривой. Подготовка 450 мкл или 650 мкл каждого антигена ссылки или испытание вакцины разведения образцов для запуска дубликаты или трем образцам соответственно. Моновалентная гриппа вакцины могут быть проверены с помощью этого метода пятно слот. Содержание ГК ссылкой антигенов ранее определяли с помощью SRID который в настоящее время используется стандартный тест для подготовки вакцины против гриппа. Содержание HA определяется SRID была использована в качестве исходной ссылкой антиген фондовом HA концентрации для подготовки разведений для слота пятно стандартной кривой.
3. Подготовка вакцины против гриппа образцы и эталон для Н. А. слот пятно
Вакцина против гриппа эталонов соответствующих вакцинных штаммов для тестирования были получены из Центра биопрепаратов оценке и исследованиям (СБЕР / FDA, США) и Национального института биологических Стандартные и контроля (NIBSC, Великобритания) и используются для количественного Н.А. по слотам пятно. Содержание НС этих контрольных образцов определяли по SDS-PAGE анализа deglycosylated образцов в сочетании с денситометрии сканирования анализ, как описано выше 9, с небольшими изменениями 10. Короче говоря, deglycosylated вакцины контрольных образцов (5 мкг) смешивали с образцами буфера и погружены на гель. Гель работать при токе 20 мА в течение примерно 90 мин, пока отслеживания красителя просто запустить из геля, а затем окрашивание Sypro. Денситометрии количественного белков было проведено с использованием документации Fluorchem гелевой системы (Альфа Иннотек). Количество Н.А. была определена на основе соотношения белков НС общего белка, как это определено анализа Лоури. Ссылка образцах, изготовленных с помощью этого метода можно использовать в слоте пятном для количественной оценки содержания НС в вакцины образцы вакцины производителям.
- Для Н. А. ссылкой антигенов и тестовых образцов вакцины: Развести антиген Н. А. ссылкой акции в 0,01% Zwittergent / TBS в следующих концентрациях: 0, 0,039, 0,078, 0,1562, 0,3125, 0,625, 1,25, 2,5, 5 и 10 мкг NA / мл. Хорошо перемешайте. Затем, развести испытания вакцины образцы для человека получить вакцину производителей или собственного производства научно-исследовательских целях в 0,01% Zwittergent / TBS и хорошо перемешать. Хотя дубликаты антиген ведения и образцы вакцины может быть запущен, трем образцам являются предпочтительными. Подготовка 3 разведений каждого образца (2-кратное различие), чтобы образец концентрации, чтобы подпадать под стандартной кривой. Подготовка 450 мкл или 650 мкл каждого антигена ссылки или испытание вакцины разведения образцов для запуска дубликаты или трем образцам соответственно. Моновалентная гриппа вакцин может быть проверена остроумияч этот метод слот пятно.
4. Ассамблея Био-Dot SF аппарата Микрофильтрация и промокательной образцов на PVDF мембраны
- Соберите предварительно очищенные и высушенные Био-Dot SF Микрофильтрация аппарата. Место пластины Прокладка поддержки в вакуумном коллекторе и место уплотнительную прокладку на top.Place 3 смоченной листов Био-Dot SF фильтровальную бумагу за прокладку, после чего предварительно пропитанных мембран PVDF. Место пример шаблона в верхней части оболочки и пальцами затяните четыре винта с диагональной пересечения шаблон для обеспечения единообразного применения давления на поверхности мембраны.
- Убедитесь, что 3-ходовой клапан установлен подвергать вакуумной многообразия источником вакуума лишь перед включением насоса и подключения вакуума.
- Включите насос и подключиться к био-Dot аппарата. Убедитесь, что поток клапан находится на уровне ниже образец скважин для быстрого и надлежащего дренажа образцов в следующих шагах.
- Повторите винт затяжки шаг, используя диагональные пересечения узор. Затяжки винтов в то время как вакуум применяется обеспечивает жесткий уплотнение и предотвращает перекрестное загрязнение между скважинами.
- Изменение потока клапана подвергать вакуумного многообразия в воздух и выключить насос.
- Применяют по 100 мкл TBS для всех скважин с помощью многоканальной пипетки, чтобы увлажняет мембраны обеспечивая таким образом равномерное связывание антигена. Необходимо соблюдать осторожность, чтобы избежать образования пузырьков и применять решение в середине хорошо, как можно ближе к нижней насколько это возможно, для того, чтобы покрыть слот равномерно. Съемки любой воздушный пузырь случайно ввел с пипетки чаевые.
- Изменение потока клапана раскрыть многообразие как воздух и вакуум, включить насос, и аккуратно слить буфер из скважин, положив палец на порт на воздухе, чтобы регулировать количество вакуума.
- Изменение потока клапана раскрыть многообразие в воздух, как только буфер полностью слита из всех лунок. Выключите насос и не отключайте вакуум.
- Применить 200 мкл каждого стандарта или разбавления вакцины образца в каждую лунку. Внесите образцы по одному за раз, в центре каждой лунки, как можно ближе к нижней насколько это возможно, заботясь, чтобы избежать введения пузырьков воздуха. Съемки любой воздушный пузырь случайно ввел с пипетки чаевые. Положите 200 мкл разведения образцов буфер (4M мочевины / TBS или 0,01% Zwittergent / TBS) в неиспользуемых скважин для обеспечения надлежащего вакуума скважин в использовании.
- Отрегулируйте клапаном подвергать многообразия как воздушных, так и вакуум. Включите насос (или восстановить вакуум) и мягко позволяют образцы полностью вытечь из скважин, контролируя количество вакуумных одним пальцем через порт контакте с воздухом. Удалить палец из порта, чтобы освободить вакуум, как только все образцы исчерпан.
- Сразу же добавить 200 мкл TBS в каждую лунку помощью многоканальной пипетки. Применить нежная вакуума процедить и мыть скважин, контролируя количество вакуумных одним пальцем через порт контакте с воздухом.
- Повторите шаг мыть, описанных в пункте 4.11. Как только скважины полностью разряжен, ослабьте винты пример шаблона и выключить вакуум, чтобы избежать пересушивания скважин. Немедленно принять меры для исключения мембраны.
- Место мембрану в блокирующем буфере и инкубировать в течение ночи при 4 ° С, с нежным качалки. Используйте достаточно блокирующего буфера, чтобы полностью покрыть мембрану.
5. Иммуноблоттинг ГК и Н. А. антигенов
- После инкубации в течение ночи в блокирующем буфере, мыть мембраны дважды в течение 5 минут с TBS/0.1% Твин-20 промывочным раствором. Для всех стирок и инкубации, убедитесь, мембрана полностью покрыта раствором.
- Инкубируйте мембраны с универсальным антител кролика против HA (например, Uni-1) или Анонимных Наркоманов (например, HCA-2 или HCA-3) разводят в 5% вес / BSA в стиральных буфера в течение одного часа при комнатной температуре, с нежным качалки. Оптимальная концентрация антител, должны быть определены для каждого антитела акций. Растворы 1:4000 кролика анти-сыворотки дал оптимальные результаты для вышеупомянутых антител.
- Вымойте мембраны в три раза, при комнатной температуре с нежным качалке в течение 15 минут каждый раз, для удаления несвязанного первичных антител.
- Инкубируйте мембраны с HRP-сопряженных анти-кролик вторичными антителами. Используйте 1:50000 разведение коз Thermo ImmunoPure анти-IgG кролика, пероксидазы конъюгированных антител в блокирующем буфере и инкубировать при комнатной температуре в течение 30 минут с нежным качалки.
- Вымойте мембраны в три раза, покачиваясь в течение 15 минут каждый раз, при комнатной температуре промывочным буфером для удаления несвязанного вторичных антител.
- Вымойте мембраны с TBS в течение 5 минут с нежным качалка для удаления остатков Твин-20 моющего средства от поверхности мембраны.
- Подготовка субстрата с 3 мл каждого гeagent от Supersignal Запад Дура расширенный комплект Субстрат Продолжительность от Thermo Scientific и хорошо перемешать.
- Место мембраны на сухую бумажную салфетку, чтобы аккуратно удалите излишки буфера TBS.
- Передача мембраны сухую емкость и добавить подложку, чтобы покрыть всю мембрану. Выдержите 5 минут с нежным раскачивание, при комнатной температуре.
- Удалите избыток субстрата, аккуратно промокательной мембрана на тонкой папиросной бумаге.
- Expose мембраны хемилюминесценции фильма. Длина экспозиции должны быть оптимизированы, чтобы избежать насыщения сигнала, но обычно находится в пределах от 10 секунд до 10 минут.
- Выполните денситометрии анализы на проявленной пленки использованием аппарата гель визуализации, таких как документация Fluorchem гелевой системы (Альфа Иннотек) в соответствии с инструкциями производителя. Значений плотности для каждого набора реплик ссылкой антигенов и тестовых образцов вакцины затем усредняются. Хотя антиген стандарты и образцы вакцины могут быть запущены в двух экземплярах, трем образцам являются предпочтительными. Плотность значения для репликации должны быть очень похожи. Значительные различия между повторяет указывают вероятные технические проблемы во время процедуры. Зависит от концентрации стандартной кривой устанавливается путем построения усредненных значений плотности от суммы (в нг) ГК или Н. А. антиген положить в каждую ячейку, от эталонного стандарта. Используя соответствующие установки калибровочной кривой в иммунологических имеет решающее значение для количественной HA и NA точно. Линейная регрессия, полученные путем построения ответа (у) в зависимости от концентрации (х) с использованием линейного участка кривой отклика (у = тх + б) простой метод для количественного определения аналитов. Если широкий спектр аналитов считается для концентрации расчета, четыре параметра логистики (4PL) модель для иммунологических принятых в настоящее время должны быть использованы. Разнообразное программное обеспечение доступно для заинтересованных исследователей, чтобы рассмотреть. В случае описанного блоттинга слот, преобразование оси абсцисс значения в логарифмическом масштабе позволяет кривую в соответствии с 4-PL модели и использование переменной склоне нелинейной регрессии для расчета уничтожены количества HA и NA в испытанных образцов вакцины, таким образом, это возможно. Поэтому мы регулярно использовать эту модель для нашего анализа. Как тестовых образцов вакцины разводят в любом 4M мочевины / TBS или 0,01% Zwittergent / TBS до того, как уничтожены на мембране, коэффициент разбавления для каждого образца должны быть приняты во внимание для определения HA и NA содержание первоначального испытания Вакцина образцов. Предполагается, что каждый образец испытания вакцины будет работать на трех различных разведениях (2-кратное различие), чтобы для одного набора значений плотности, чтобы подпадать под стандартной кривой. Плотность ценности выше, чем стандартный диапазон кривой для всех протестированных разведения вакцины образцы необходимо разбавить для точного HA и NA количественной оценке. Если плотность значения ниже самого низкого конца кривой, образцы следует развести по более низкой фактор разведения.
6. Представитель Результаты:
Биоинформатика анализ всех доступных гриппа HA последовательностей подтвердил N-конце HA2 субъединицы (слияние пептид), как только консервативная область ГК. На рисунке 1 показана сохранения скорости для каждого положении аминокислоты выявленных консенсусной последовательности. Два варианта были определены в положениях 2 (L-> I) и 12 (G-> N) из 14 N-концевых аминокислот HA2, но такие изменения были признаны не влияют на связь между антителами и пептидных вариантов 6 . Uni-1 эпитопа (GLFGAIAGFIEGGW) была выбрана для разработки универсальных антител против ГА. Это антитело продемонстрировали замечательную специфичность для вирусных последовательностей и способен связывать до 13 различных подтипов гриппа HA (H1-H13) (рис. 2).
Используя аналогичный подход, два универсальных сохраняется последовательности были идентифицированы у всех грипп, Н. А. одна близко к ферментативно активный центр (HCA-2) (рис. 3а), а другой на N-конце (HCA-3) (рис. 3б) . Пептиды с этими аминокислотных последовательностей использовали в качестве антигенов для создания универсальных антител к NA. Антитела против обоих эпитопы, способные связываться с все 9 подтипов НА и показали очень мало перекрестная реактивность к аллантоисную или клеточных белков, что свидетельствует о высокой специфичностью в отношении вирусных последовательностей Н. А. (рис. 4).
На рисунке 5 показан обзор методов слот пятном для количественной оценки гриппа HA и NA.
Примеры HA и NA антиген слот-блот-анализа показаны на рисунках 6 и 7. Рис 6A и 6C показывает, представитель результаты после обнаружения HA антигена в ссылку гриппа стандартные вакцины и вакцины образцов соответственно. Каждый образец (стандартный или вакцины) был запущен в двух экземплярах, в соседних скважинах. Дубликаты должны показать similaГ интенсивности после обнаружения. Оптимизация антител разведения, инкубации и время экспозиции может потребоваться в зависимости от антител используется.
Пример типичной стандартной кривой, полученной после выявления различных концентрациях ГК из стандартного образца ссылкой вакцина показана на рисунке 6B. Концентрации антигена HA пропорциональна интенсивности сигнала следующие хемилюминесценции обнаружения слот пятно и соответствует 4-PL подгонки кривой модель этого диапазона концентраций (0,0938 до 6 мкг HA / мл).
Рисунок 7 показывает, представитель результатов обнаружения антигена НС в эталон вакцины против гриппа и вакцин образцов. Плотность анализ показал, что интенсивность сигнала, полученного путем обнаружения антигена Н. А. в различных разведений стандартной вакциной ссылкой на слот пятно пропорциональна концентрации NA (рис. 7а). В результате стандартной кривой соответствует 4-PL модель этого диапазона концентраций (0,039 до 10 мкг NA / мл), как показано на рисунке 7B. Рис 7C показан пример анализа слот-блот-НС в содержании образцов вакцины против гриппа. Каждый образец анализировали в двух экземплярах, в соседних скважинах.

Рисунок 1. Сохранение скорости Uni-1 эпитопа в районе слияния пептида гриппа HA.
Биоинформатика анализ всех доступных гриппа HA последовательностей подтвердил, что слияние пептид (расположен на N-конце HA2 подразделения) является единственным универсальным консервативной области ГК. Обратите внимание, что две вариации в положении 2 (L-> I) и 12 (G-> N) было установлено, не влияют на антитела 6. Универсальных антител, способных связываться 13 различных подтипов гриппа HA (H1-H13) был разработан с использованием Uni-1 эпитопа (GLFGAIAGFIEGGW).
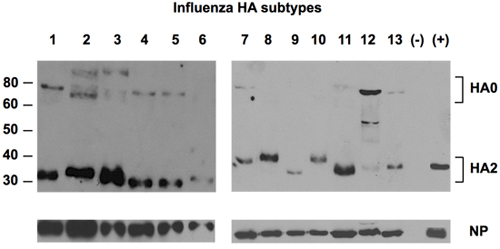
Рисунок 2. Обнаружение 13 подтипов HA всеобщим антител против ГА.
Аллантоисной жидкости из 13 подтипов вируса гриппа А распространяется в куриных эмбрионов фракционировали в SDS-PAGE, после обнаружения HA белков, используя универсальные антитела против Uni-1 эпитопа ГК. Н. П. белок был обнаружен как загрузка управления с использованием поликлональных кролика NP-специфических антител. Отрицательный контроль (-) была аллантоисной жидкости из незараженных яиц. Положительный контроль (+) была ссылка стандарт Н1 от NIBSC, Великобритания
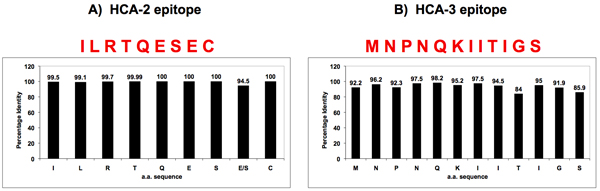
Рисунок 3. Последовательности гомологии гриппа Н. А. возле ферментативно активного центра и N-конца.
Два универсально сохраняется последовательности были выявлены при гриппе парламента Армении по биоинформатике, один из которых расположен рядом ферментативных активного центра (HCA-2) (группы), другие на N-конце (HCA-3) (группа Б). Пептиды с этим сохраняется аминокислотных последовательностей были синтезированы и используются для создания универсальных антител к NA.

Рисунок 4. Обнаружение 9 подтипов NA NA антителами.
Аллантоисной жидкости из девяти подтипов НА вируса гриппа А распространяется в куриных эмбрионов фракционировали в SDS-PAGE, после обнаружения белков Н. А. использования HCA-2 (группа А) и HCA-3 (группа B) антител. Н. П. белок был обнаружен как загрузка управления с использованием поликлональных кролика NP-специфических антител (Группа С). Отрицательный контроль (-) была аллантоисной жидкости из незараженных яиц. Положительный контроль (+) был аллантоисной жидкости подсыпали rNA1 А / Новая Caledonia/20/99 и исследовали с соответствующей сыворотки.

Рисунок 5. Блок-схема процедуры пятно слот для количественного определения HA и NA антигенов в противогриппозных вакцин.
Буферов необходимо для разведения образцов, а также для мытья и блокирование мембраны слот пятно сначала подготовить и PVDF мембраны и фильтра документы, необходимые для сборки Био-Dot аппарата микрофильтрации SF предварительно пропитанной. Вакцина против гриппа и эталонных образцов стандартных разводят в оптимальном буферов для HA и NA обнаружения слот пятно. Био-Dot SF микрофильтрации аппарат собран в соответствии с инструкциями изготовителя и образцов применяются на мембрану PVDF. HA и NA антигены обнаружены с помощью универсальных антител против каждого антигена. Денситометрии анализ проводится по хемилюминесценции сигналов, полученных для количественного определения HA и NA в тестируемых образцах.
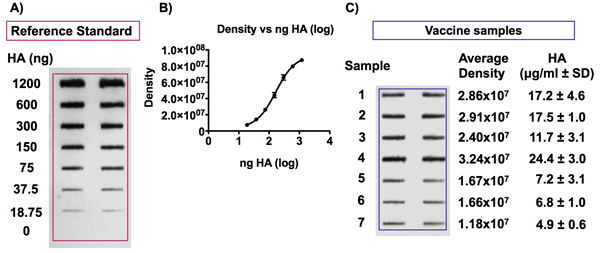
Рисунок 6. Обнаружение HA антигена в образцах вакцины против гриппа и обратитесьENCE стандарта.
Группа показывает, представитель пятно получены следующие иммунодетекции антигена HA. Антигена HA ссылкой разбавляют до концентрации от 0 до 6 мкг HA / мл и вакцин разбавляют до концентрации 0,375 мкг HA / мл в 4M мочевины / TBS лишь после этого используются мембраны PVDF с Био-Dot аппарата микрофильтрации SF . Антигена HA тогда обнаружены с помощью Uni-1 универсальный антител. Группа B показывает пример стандартной кривой, полученной путем обнаружения сигналов различной концентрации ГК из эталона вакцины. Интенсивность сигнала пропорциональна концентрации ГК и кривая соответствует 4-PL модели.
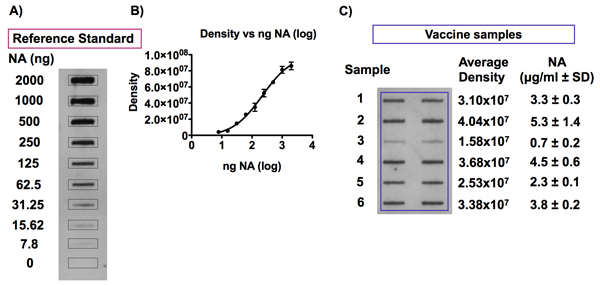
Рисунок 7. Обнаружение антигена НС в вакцины против гриппа образцов и эталонного стандарта.
Группа А и В показывают, представитель сигналов, полученных после обнаружения НС в ссылку вакцины против гриппа стандартных разбавляют до Н. А. концентрациях от 0 до 10 мкг NA / мл в 0,01% Zwittergent / TBS и в результате 4-PL стандартной кривой следующие денситометрии анализов. Примером типичного сигналы хемилюминесценции выявлена после анализа слот-блот-антиген Н. А. в образцах вакцины против гриппа показана в панели образцов C. Вакцина против гриппа разбавляли до концентрации 1 мкг HA / мл в 0,01% Zwittergent / TBS и были уничтожены на PVDF мембраны использованием Био-Dot SF микрофильтрации аппарата. Растворы соответствующего эталона вакцины, в концентрациях от 0 до 2,5 мкг NA / мл, были включены в тот же пятно с целью установления стандартной кривой для количественного определения антигена НС в вакцине образцов. Антиген Н. был обнаружен с HCA-2 универсальных антител против Н. А., денситометрия анализа сигналов, полученных хемилюминесценции была выполнена. Количество НС в каждой вакцины образец может быть рассчитана на 4-PL стандартной кривой, полученной путем построения значений интенсивности сигнала от концентрации НС за эталон вакцины.
Обсуждение
Количественное определение вирусной гриппа HA и NA имеют решающее значение для исследований и разработки вакцины, так как эти две поверхностные белки являются наиболее важными компонентами вирусной вызывать иммунный ответ 6-11. Ранее сообщалось, иммунологические методы обнаружен?...
Раскрытие информации
Благодарности
Авторы хотели бы поблагодарить г-жа Моника Tocchi для редакционного обзора рукописи. AMH поддерживается стипендии от короля Абдель Азиза университета, через Саудовской Аравии культурного бюро в Канаде.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагентов или оборудования | Компания | Номер в каталоге | Комментарии |
|---|---|---|---|
| Био-Dot SF Микрофильтрация аппарата | Bio-Rad | 170-6542 | |
| Био-Dot SF Фильтровальная бумага | Bio-Rad | 162-0161 | |
| Immobilon-ФЗ передача мембрана (PVDF) | Millipore | IPFL00010 | |
| Вакуум-насос | Millipore | WP6111560 | |
| Хемилюминесценция BioMax свет фильм | Кодак | 178 8207 | |
| FluorChem Гель Документация системы | Альфа Иннотек | 29-008-1896X | |
| Универсальные антитела кролика против HA и NA антигенов | Uni-1 (HA), HCA-2, ГЛК-3 (NA) | Антитела, которые доступны через MTA или могут быть получены заинтересованными исследователями в порядке, описанной ранее 6,7. | |
| Вакцина против гриппа ссылкой антигена | СБЕР / FDA или NIBSC | ||
| Образцы Вакцина против гриппа | Обычно имеются в большинстве стран | ||
| Мочевина | Sigma-Aldrich | U1250 | |
| Zwittergent 3-14 моющих средств | Calbiochem | 693017 | |
| Твин-20 | Fisher Scientific | BP337-500 | |
| Blotting класса Blocker обезжиренное сухое молоко | Bio-Rad | 170-6404 | |
| ImmunoPure Коза Anti-IgG кролика, (H + L), пероксидазы конъюгированная | Thermo Scientific | 31460 | |
| SuperSignal Запад Дура Расширенный Продолжительность субстрата | Thermo Scientific | 34075 |
Ссылки
- Webster, R. G., Bean, W. J. Genetics of influenza virus. Annu Rev Genet. 12, 415-431 (1978).
- Skehel, J. J., Wiley, D. C. Receptor binding and membrane fusion in virus entry: the influenza hemagglutinin. Annu Rev Biochem. 69, 531-569 (2000).
- Wood, J. M. The influence of the host cell on standardisation of influenza vaccine potency. Dev Biol Stand. 98, 183-188 (1999).
- Sylte, M. J., Suarez, D. L. Influenza neuraminidase as a vaccine antigen. Curr Top Microbiol Immunol. 333, 227-241 (2009).
- Bright, R. A., Neuzil, K. M., Pervikov, Y., Palkonyay, L. WHO meeting on the role of neuraminidase in inducing protective immunity against influenza infection. Vaccine. 27, 6366-6369 (2008).
- Chun, S. Universal antibodies and their applications to the quantitative determination of virtually all subtypes of the influenza A viral hemagglutinins. Vaccine. 26, 6068-6076 (2008).
- Gravel, C. Qualitative and quantitative analyses of virtually all subtypes of influenza A and B viral neuraminidases using antibodies targeting the universally conserved sequences. Vaccine. 28, 5774-5784 (2010).
- Li, C. A simple slot blot for the detection of virtually all subtypes of the influenza A viral hemagglutinins using universal antibodies targeting the fusion peptide. Nat Protoc. 5, 14-19 (2010).
- Harvey, R., Wheeler, J. X., Wallis, C. L., Robertson, J. S., Engelhardt, O. G. Quantitation of haemagglutinin in H5N1 influenza viruses reveals low haemagglutinin content of vaccine virus NIBRG-14 (H5N1). Vaccine. 26, 6550-6554 (2008).
- Li, C. Application of deglycosylation and electrophoresis to the quantification of influenza viral hemagglutinins facilitating the production of 2009 pandemic influenza (H1N1) vaccines at multiple manufacturing sites in China. Biologicals. 38, 284-289 (2010).
- Johansson, B. E., Pokorny, B. A., Tiso, V. A. Supplementation of conventional trivalent influenza vaccine with purified viral N1 and N2 neuraminidases induces a balanced immune response without antigenic competition. Vaccine. 20, 1670-1674 (2002).
- Hashem, A. Universal antibodies against the highly conserved influenza fusion peptide cross-neutralize several subtypes of influenza A virus. Biochem Biophys Res Comm. , (2010).
Erratum
Formal Correction: Erratum: Quantitative Analyses of all Influenza Type A Viral Hemagglutinins and Neuraminidases using Universal Antibodies in Simple Slot Blot Assays
Posted by JoVE Editors on 11/13/2012. Citeable Link.
An author's affiliation was omitted from the publication of Quantitative Analyses of all Influenza Type A Viral Hemagglutinins and Neuraminidases using Universal Antibodies in Simple Slot Blot Assays.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеСмотреть дополнительные статьи
This article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены