A subscription to JoVE is required to view this content. Sign in or start your free trial.
Method Article
מבחני Biophysical לחקור את תכונות מכניות של גרעין התא שלבי הביניים: מסננים תשתית יישומים מניפולציה Microneedle
In This Article
Summary
אנו מציגים שתי עצמאית, מיקרוסקופ מבוססי כלים למדידת דפורמציות גרעיני cytoskeletal המושרה, תאים בודדים חיים חסיד בתגובה לבקשה מאמץ עולמי או מקומי. טכניקות אלו משמשות כדי לקבוע קשיחות גרעיני (כלומר, deformability) וכן לחקור העברת כוח תאיים בין הגרעין לבין cytoskeleton.
Abstract
בתאים אוקריוטים ביותר, הגרעין הוא אברון הגדול הוא בדרך כלל 2 עד 10 פעמים נוקשה יותר cytoskeleton שמסביב; וכתוצאה מכך, את התכונות הפיסיקליות של גרעין לתרום באופן משמעותי התנהגות ביומכנית הכולל של תאים בתנאים פיזיולוגיים ופתולוגיים. לדוגמה, נודדות נויטרופילים הפולשים תאים סרטניים, נוקשות גרעיני יכול להוות מכשול מרכזי במהלך extravasation או מעבר דרך מקומות צרים בתוך רקמות. 1 מצד שני, את הגרעין של תאים ברקמות פעיל מכנית כגון שריר דורש תמיכה מבנית מספיק לעמוד בפני הלחץ המכני חוזרות. חשוב לציין, בגרעין היא משולבת בתוך האדריכלות הסלולר: הוא מחובר פיזית cytoskeleton שמסביב, אשר היא דרישה קריטית עבור התנועה תאיים ומיצוב של הגרעין, למשל, בתאים מקוטב, גרעינים הסינפטי בצמתים neuromuscular, או תאים נודדים. 2 באופן לא מפתיע, מוטציות חלבונים מעטפת הגרעין כגון lamins ו nesprins, אשר לשחק תפקיד קריטי בקביעת קשיחות גרעיני Nucleo-cytoskeletal צימוד, הוכחו לאחרונה תוצאה במספר מחלות אנושיות, כולל שמיר, ניוון שרירים דרייפוס, איבר-המחוך ניוון שרירים, קרדיומיופתיה מורחבים. 3 כדי לחקור את הפונקציה biophysical של מגוון חלבונים מעטפת הגרעין ואת ההשפעה של מוטציות ספציפיות, פיתחנו שיטות ניסיוניות ללמוד את התכונות הפיסיקליות של גרעין ב, תאים בודדים חיים נתון ההפרעות מכני גלובלי או מקומי. מדידת דפורמציות גרעיני הנגרמת בעקבות יישום מיושם דווקא זן המצע התשואות מידע חשוב על deformability של הגרעין ומאפשר השוואה כמותית בין מוטציות שונות או שורות תאים לקוי של חלבונים ספציפיים מעטפת הגרעין. זן מקומי יישום cytoskeletal עם microneedle משמש כדי להשלים את זה assay והוא יכול להניב מידע נוסף על העברת כוח תאיים בין הגרעין לבין cytoskeleton. לימוד המכניקה הגרעין בתאים חיים שלמים משמר את הארכיטקטורה תאיים רגיל ונמנע חפצים פוטנציאליים שיכולים להתעורר בעת עבודה עם גרעינים מבודדים. יתר על כן, זן יישום המצע מציג מודל טוב הלחץ הפיזיולוגי מנוסים על ידי תאים בשריר או ברקמות אחרות (למשל, כלי הדם לתאי שריר חלק חשוף זן כלי שיט). לבסוף, כאשר כלים אלה פותחו בעיקר כדי ללמוד מכניקה גרעיני, הם יכולים להיות מיושם גם לחקור את תפקודם של חלבונים cytoskeletal והאיתות mechanotransduction.
Protocol
1. זן התשתית ליישום
מדידת המתח הגרעיני מנורמל כולל הכנת מאכלים עם זן, ממברנות סיליקון אלסטי שקוף כמו משטח תרבית תאים, התאים ציפוי על המנות, ורכישת תמונות של התאים לפני, במהלך ולאחר יישום (uniaxial או biaxial) זן.
הכנת מנות קרום סיליקון היצמדות של תאים
- כל צלחת זן מורכב צלחת מחוייט פלסטיק ללא תחתית בקוטר של 3 "פלסטיק O-Ring לקיים קרום סיליקון, המשמש מצע תרבית תאים. להכנת המנות זן, מלחציים 4" x 4 "חתיכת קרום סיליקון בין O-Ring ואת צלחת. בזהירות לחתוך את הממברנה עודף, לשטוף עם מים deionized ו החיטוי את הכלים זן.
- סמן את נקודת התייחסות במרכז התחתון של הקרום (מבחוץ) לפני הציפוי ממברנות סיליקון עם מולקולות תאי מטריקס (למשל, פיברונקטין). ציון דרך זה יעזור לזהות את התאים אותו במהלך הניסויים זן. (אופציונאלי: עבור יישום זן uniaxial, שני פסים מקבילים של נייר דבק מוחלים סביב נקודת התייחסות להגביל דפורמציה של קרום במימד אחד).
- כדי לספק מצורף תא מעיל אופטימליים, ממברנות סיליקון עם פיברונקטין מיקרוגרם / מ"ל 3 מדולל 10 מ"ל PBS או חלבונים מתאים תאי מטריקס. מכסים את הצלחת זן עם צלחת הפוכה קלקר 10 ס"מ, ו דגירה את הכלים מעל בלילה 4 ° C.
- למחרת, לשטוף את הקרומים פעם עם בופר פוספט (PBS) כדי להסיר עודפי חלבון. מלאו צלחת עם 10 מ"ל של מדיום הגידול (השתנה Dulbecco של הנשרים בינוני (גלוקוז גבוהות) בתוספת סרום 10% שור עוברית 1% פניצילין / סטרפטומיצין) ומניחים בצד.
- עכבר fibroblasts עובריים הם trypsinized עם טריפסין 0.05% ו seeded במדיום הגידול בנקודת המפגש כ -30% על גבי צלחת ממברנה מצופה סיליקון דגירה של 24-48 שעות בתנאים תרבות נורמליים.
זן תשתית ניסויים
- הגדרת את המיקרוסקופ לניסויים. הניסויים מתבצעים על מיקרוסקופ הפוכה עם מצלמה דיגיטלית מתאים מיקרוסקופ פלואורסצנטי, לעומת שלב או DIC, באמצעות המטרה 60x ותמונה המתאים רכישת התוכנה (למשל, IPLab או Metamorph). מיקרוסקופ זקוף אינו מתאים עבור יישום זה. המכשיר מאמץ מורכב צלחת הבסיס שמתאים לבמה מיקרוסקופ ומחזיק Platen גלילי מרכזי המשמש ליישם להתאמץ כדי הקטע המרכזי של קרום סיליקון, צלחת מטלטלין שמכיל את צלחת זן וזה יכול להחליק למעלה ולמטה על four הדרכה סיכות, וכן צלחת של 5 ק"ג במשקל להחיל עומס.
- על מנת להמחיש גרעינים, דגירה התאים בצלחת את המתח עם 1 מיקרוגרם / מ"ל של Hoechst 33,342 עבור 15 דקות בשעה 37 ° C. לשאוב את המדיום ולהחליף עם 15 פנול אדום בינוני מ"ל צמיחה בחינם (השתנה פנול אדום חינם של Dulbecco הנשרים בינוני (גלוקוז גבוהות) עם 25 Hepes מ"מ, בתוספת סרום 10% שור עוברית 1% פניצילין / סטרפטומיצין). בורג את המנה זן לתוך צלחת בעל צלחת. בזהירות למרוח משחה (804 Braycote גריז אבק) כדי למתחם של החלק התחתון של קרום סיליקון כדי להבטיח גלישה של הממברנה לאורך Platen המרכזית. הקפד לשמור את החלק המרכזי של הממברנה ברור.
- מניחים את צלחת הבסיס לבמה מיקרוסקופ. בעל הר צלחת צלחת בזהירות על צלחת הבסיס. להבטיח כי במצב מנוחה הראשוני, קרום סיליקון המנה זן רופף נשענת על Platen המרכזי.
- ראשית, להתמקד התחתון של קרום סיליקון למצוא את הנקודה המרכזית התייחסות שחור. נקודה ישמש כנקודת ההתחלה עבור כל הרכישות התמונה מסייע באיתור התאים אותו במהלך ואחרי המתיחה. אנו משתמשים תוכנית אישית בכתב הדמיה אוטומטית לחנות עמדות של תאים להעביר תאים אלה במהלך הניסוי, אבל זה יכול גם להיות מושגת באופן ידני.
- החל מ נקודה, לשנות את הפוקוס כדי להמחיש את התאים העליונה של קרום סיליקון. אתר טוב התפשטות תאים עם גרעינים במיקום מרכזי ולרכוש ניגוד שלב ותמונה הקרינה של Hoechst גרעיני הכתם. התמונה לעומת שלב צריך להתמקד מתאר את התא הממברנה סיליקון, בעוד תמונות הקרינה צריכה להתמקד במישור המרכזי של הגרעין.
- לאחר רכישת תמונות של 5-15 תאים, לעבור בחזרה נקודה מרכזית. לאט לאט ליישם את משקל המנה מתח, וכתוצאה מכך יישום זן אחיד במרכז המנה. מאמץ מירבי המצע להחיל מוגבל על ידי מפרידי ניילון דגש על הפינים היישור האנכי (סיכות הדרכה).
- פוקוס על החלק התחתון של קרום סיליקון ולאתר את נקודות ההתייחסות שוב. החל מנקודה, מיקום מחדש של תאים זהים שוב לרכוש בניגוד שלב ותמונה הקרינה של תאים גרעיני תחת עומס מלא, מנסה להתאים מקרוב את המטוסים המוקד של התמונות הראשונית. תהליך זה לא יעלה על 10 דקות כדי למנוע פעיל שיפוץ והתאמה של התא למצע מתוח.
- אחרי כל התמונות המקביל נרכשו, להזיז את הבמה מיקרוסקופ בחזרה לנקודת ההתחלה. הסר בזהירות את משקל מהצלחת בעל צלחת ולאפשר קרום סיליקון להירגע. אם יש צורך, בעדינות את המנה המתח עד שהוא בעמדה הראשונית. ואז לרכוש בניגוד שלב ותמונות הקרינה של הפוסט זן תאים כמתואר לעיל לתמונות זן.
אנליזה
- תמונות של תאים גרעינים שכותרתו fluorescently לפני, במהלך ולאחר יישום זן מנותחים כדי לחשב את המתח הגרעיני מנורמל. במעבדה שלנו, אנו משתמשים תסריט אישית בכתב MATLAB לצורך ניתוח, אך מספר חלופות זמינות. הניתוח מתבצע בשלושה שלבים.
- ראשית, כדי לחשב את המתח המצע מיושם, עמדות של 3 עד 6 נקודות בקרה הממוקם על קרום מותאמות באופן ידני בין המקביל מראש, מלא, ופוסט זן תמונות. תוכנית MATLAB אז מחשב את המתח בקרום מיושם על ידי השוואת עמדות תואמות נקודות שליטה בין התמונות מראש זן מלא מתח וגם את המתח השיורי בין זן מראש ואת הפוסט זן תמונות. במקביל, נקודות הביקורת משמשים לרשום את זוגות התמונה, אשר יסייע לזהות תאים פגומים או ניתוק (ראה איור 1).
- בשלב השני, גרעינים נבחרים באופן ידני באמצעות תוכנית נפרדת MATLAB המחשבת זן גרעיני גרעין בנפרד על ידי התאמת גודל או גרעיני או סמנים intranuclear בין המקביל מראש, מלא, ופוסט זן תמונות ניאון. כדי להסביר וריאציות קטנות מתח הקרום מיושם בין ניסויים שונים, אנו מביעים את התוצאות מסננים גרעיני מנורמל, מוגדר כיחס בין המתח המושרה גרעיני למתח הקרום מיושם כי מחושבת עבור כל גרעין. סקריפטים MATLAB זמינים במעבדה Lammerding על פי דרישה.
- לבסוף, הגרעין כל תוקף, למעט מדידות של תאים לנתק או להינזק במהלך יישום זן (איור 1).
2. Microneedle assay מניפולציה
הכנה של מנות, תאים חסיד, ו microneedles
- דגירה 35 מ"מ זכוכית בתחתית תא הכלים תרבות עם ריכוז נמוך של פיברונקטין (0.5ug/ml) ב מלוחים שנאגרו של האנק מלח (HBSS) או חלבונים מתאים תאי מטריקס עבור 2 שעות 37 ° C. לשטוף כלים עם שתי פעמים HBSS ומוסיפים 2 מ"ל של מדיום הגידול על צלחת לפני שתמשיך לשלב הבא.
- עכבר fibroblasts עובריים הם trypsinized עם טריפסין 0.05% ו seeded בינוני 2 מ"ל צמיחה seeded ב 7.5 x 10 4 תאים / מ"ל על גבי פיברונקטין מצופה מנות תחתית הכוס. המקום התאים בחזרה חממה לילה. המקום התאים בחזרה חממה לילה. אחד צריך לייעל את מספר התאים כדי להשיג אחד, חסיד, הלא ומחוברות תאים סוגי תאים אחרים.
- משוך את microneedles, עשוי בורוסיליקט נימים, עד קצה בקטרים של כ 1-3 מיקרומטר עם מסחרי פיפטה חולץ (לדוגמא, החברה סאטר Instrument).
Microneedle הניסוי מניפולציה
- למחרת, דגירה בתאים עם כתם MitoTracker המיטוכונדריה (600 מיקרומטר; Invitrogen) ו Hoechst 33342 גרעיני כתם (1 מיקרוגרם / מ"ל) להוסיף צמיחה בינוני למשך 30 דקות ב 37 מעלות צלזיוס חממה.
- לשטוף את התאים פעם אחת HBSS במשך 5 דקות בטמפרטורת החדר ולאחר מכן להוסיף פנול אדום בינוני צמיחה חינם לתאי הדמיה.
- רוכשת תמונה אחת של תא יחיד ללא microneedle מוכנס לתוך cytoskeleton בניגוד שלב, תמונה אחת של פלורסנט התמונה Hoechst 33342 זרחני כתם אחד של המיטוכונדריה כתם, עם מטרה 60x (0.70 NA, תוכנית, Achromat) על הפוך מיקרוסקופ עם מצלמה תשלום מצמידים מכשיר דיגיטלי.
- שימוש micromanipulator (למשל, InjectMan NI 2, Eppendorf), בזהירות להכניס את microneedle לתוך הציטופלסמה של תא מרחק קבוע (בדרך כלל 5 מיקרומטר) הרחק בפריפריה גרעיני לקחת אחד לעומת השלב תמונה, תמונה אחת של פלורסנט Hoechst 33342 כתם ותמונה אחת הניאון של הכתם המיטוכונדריה. עבור יישום זה, זה עוזר לשלוט micromanipulator דרך מחשב, למשל, Windows HyperTerminal, כדי להשיג נהלים המיקרומניפולציה עקבי.
- הזז את microneedle, מרחק מסוים (בדרך כלל 10 או 20 מיקרומטר) כלפי הפריפריה התא 1 מיקרומטר / sec ובמקביל איסוף הקרינה ואת השלב תמונות לעומת כל 10שניות. כפי microneedle נע למרחק מסוים כלפי הפריפריה התא. עם הפרמטרים נבחר, כמו microneedle נע למרחק מסוים כלפי הפריפריה התא, זה יתאים 2-3 מסגרות במהלך תהליך מניפולציה.
- לבסוף לרכוש תמונות נוספות אחרי microneedle יוסר cytoskeleton.
אנליזה
- מפות עקירה מחושבים באמצעות סקריפט מותאם אישית בכתב MATLAB מבוסס על תכונות שכותרתו fluorescently מעקב של הגרעין לבין הציטופלסמה. (התסריט MATLAB זמין מהמעבדה Lammerding לפי בקשה). התוכנית משתמשת באלגוריתם מנורמל בין קורלציה בין אזורים תמונה קטנה (כ 10 מיקרומטר x 10 מיקרומטר בגודל במרווחים 5 מיקרומטר בנפרד) בתוך מסגרות תמונה הבאים. עבור כל אזור מרכז, תזוזה ב-x ו-y כיוונים מחושבים כמו המעבר בין המיקום המקורי ואת המיקום זיהו לאחרונה ומוצג כפי וקטור תזוזה ומאוחסנים גם ערכים מספריים. מתוך מפות עקירה, התקות הממוצע בתוך אזורים מוגדרים מראש יכול להיות מחושב. שים לב התקות cytoskeletal מבוססים על ערוץ הקרינה עבור סמנים cytoskeletal (למשל, MitoTracker המיטוכונדריה כתם), בעוד התקות גרעיני מחושבים מערוץ הקרינה המתאים האות Hoechst 33342. עבור היישום שלנו, אנו בוחנים באופן שגרתי את האזורים הבאים: (i) זן cytoskeletal באתר זן הבקשה, דהיינו, הכניסה לאתר microneedle (ii) המתח הגרעיני באזור בתוך גרעין כלפי האתר את היישום זן (iii) גרעיני המתח באזור גרעיני מהמקום הבקשה, וכן (iv) זן cytoskeletal באזור cytoplasmic ברחבי הגרעין. בנוסף, אפשר גם למדוד ישירות התארכות גרעינית בניגוד שלב או Hoechst 33342 רצפים הקרינה התמונה. במקרה זה, חל זן גרעיני הוא מחושב על ידי חלוקת התארכות גרעיני (ΔL = L - L 0) על ידי אורך הראשוני, L 0, כאשר L הוא אורך סופי של גרעין בסוף יישום זן ו-L 0 הוא אורך הראשונית של הגרעין. עבור תאים עם צימוד Nucleo-cytoskeletal שלם, גרעין יהיה להאריך כלפי האתר את היישום זן. לעומת זאת, בתאים שבהם Nucleo-cytoskeletal צימוד מופרת, כלומר הכוחות מועברים בצורה פחות יעילה בין cytoskeleton לבין גרעין, גרעין צפויה להאריך באופן משמעותי פחות בכיוון של האתר את היישום זן. לפיכך, ירידה דפורמציות גרעיני בתגובה לבקשה זן cytoskeletal לרמוז שיחררה את סוגר (חלקית) בין הגרעין לבין cytoskeleton.
3. נציג התוצאות:
זן התשתית ליישום
רכשנו תמונות לפני, במהלך ולאחר יישום להתאמץ כדי fibroblasts העכבר עובריים lamin הטרוזיגוטיים ו הומוזיגוטים A / C-לקוי (Lmna + / - ו Lmna - / -), ו - wild-type (Lmna + / +) בעכברים, ולאחר מכן שחושב את המתח הגרעיני מנורמל עבור כל תא. לאחר ניתוח, גרעינים הם תוקף תאים ניזוק או לסגת במהלך יישום זן אינם נכללים בניתוח. איור 1 א מציג גרעינים של שלושה תאים תקפים, ואילו 1B איור המתאר תאים צריכים להיות מחוץ ניתוח. נתונים מנורמל זן גרעיני אספו לפחות משלושה ניסויים עצמאיים (שכל אחת מהן מכילה מדידות גרעינים ~ 50-10) והשוו עם תאים אחרים או קבוצות הטיפול על ידי ניתוח סטטיסטי. הגברת המתח הגרעיני מנורמל מציין קשיחות גרעיני מופחת, כפי שניתן לראות תאים עם ביטוי מופחת של חלבונים מעטפת הגרעין lamin A / C (איור 2).
Microneedle assay מניפולציה
עבור assay המניפולציה microneedle, אנחנו צילמו התקות גרעיני cytoskeletal במהלך יישום מקומי זן cytoskeletal. תאים ניזוק או מנותקים אינם נכללים בניתוח. לניתוח, אנחנו מודדים את גודל התנועות גרעיני cytoskeletal כלפי האתר כוח היישום, תאים בודדים חסיד. לדוגמה, באיור 3, אנו עוקבים אחר המיטוכונדריה (סמן cytoskeleton) התקות לפני ואחרי מאמץ cytoskeletal ואז העלילה התקות כמו וקטורים. כל וקטור מייצג את העקירה כפי שחושב משמרת בין המיקום המקורי ואת המיקום זיהו לאחרונה. אזורים בעוצמה נמוכה תמונה או מרקם לא מספיק (למשל, באזורים מחוץ לתא) אינם נכללים בניתוח. התקות cytoskeletal ואת גרעיני לכמת אז במרחקים הגדלת מאתר את היישום זן (איור 4, באזורים המתאימים בו צבעוניים באזורים לבחורמשפחת איקס ב הבלעה). ב fibroblasts העכבר עובריים עם צימוד Nucleo-cytoskeletal שלם, הכוחות מועברים באמצעות תאים כולו, וכתוצאה מכך דפורמציות גרעיני cytoskeletal המושרה כי לאט לפזר מהמקום זן יישום (איור 4). לעומת זאת, fibroblasts עם צימוד Nucleo-cytoskeletal מופרעים (או ארגון cytoskeletal שינו) להציג התקות מקומי סמוך לאתר את היישום, כפי שמוצג באיור 4 ורק דפורמציות המושרה קצת יותר רחוקה. זן להשוואה יישום cytoskeletal באתר הכניסה microneedle (תיבת כתום) הוא ציין הן fibroblasts שליטה (mCherry לבד) ו fibroblasts עם צימוד Nucleo-cytoskeletal שיבשו (DN קאש). עם זאת, התקות גרעיני cytoskeletal המושרה (כחול, צהוב, אדום תיבות) על אזורים אחרים היה קטן משמעותית את fibroblasts עם צימוד Nucleo-cytoskeleton שיבשו (DN קאש) מאשר בתאים שליטה (mCherry לבד) (איור 4). לפיכך, ירידה התקות cytoskeletal גרעינית מהמקום יישום זן, עולה כי העברת הכוח בין cytoskeleton לבין הגרעין היה מוטרד.
חשוב לציין, יש לנו תוקף גם כי המיטוכונדריה הם סמן cytoskeletal מתאים, על ידי ביצוע מניפולציה על microneedle fibroblasts העכבר עובריים transfected עם GFP או mCherry אקטין GFP-vimentin ו שכותרתו fluorescently עם Mitotracker ירוק או אדום. מפות עקירה Cytoskeletal חושבו באופן עצמאי אות הניאון של המיטוכונדריה לבין cytoskeleton אקטין או vimentin. עקירה מוחלטת הממוצעת חושבה על ארבעה אזורים נפרדים cytoskeletal במרחקים הגדלת מהמקום יישום זן. ערכי השיפוע ו R בריבוע חושבו מתוך רגרסיה ליניארית בין המדידות המתקבלות המיטוכונדריה מ אקטין או vimentin, בהתאמה. עבור אקטין, המדרון היה 0.99 ואת הערך R 2 היה 0.986; עבור vimentin, המדרון היה 1.04 והערך R2 היה 0.971, המאשר כי התקות המיטוכונדריה לשמש אינדיקטורים אמין דפורמציות cytoskeletal.
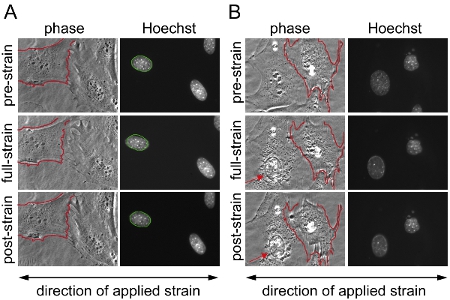
באיור 1. זן התשתית ליישום על fibroblasts העכבר עובריים (MEFs). Fibroblasts עכבר עובריים פני שני אזורים שונים על הממברנה סיליקון היו צילמו עם ניגודיות פאזה מיקרוסקופ פלואורסצנטי לפני, במהלך ולאחר יישום של זן uniaxial 20%. (א) דוגמה של ניסוי מוצלח עם גרעינים תקף מן התאים ששרדו את היישום זן ללא נזק או ניתוק (ב) דוגמה של תאים לסגת / מנותקת חלקית במהלך יישום זן; תוצאות מתאי המתואר (ב) לא ייכללו מניתוח. ב (ב), התא בצד שמאל מראה סימנים של נזק cytoskeletal וקריסה גרעיני (חץ), ואילו התא בצד ימין מתנתק חלקית חזר בו במהלך יישום זן. זו יכולה להיות אינדיקציה יישום מאמץ מופרז. לשם השוואה טובה יותר, ב (א) ו - (ב ') את הגבול של אחד קרום התא unstretched המתואר אדום על גבי באותו תא במהלך ולאחר יישום זן. ב (א) הגבול של גרעין unstretched המתואר ירוק על גבי הגרעין אותו במהלך ולאחר יישום זן.
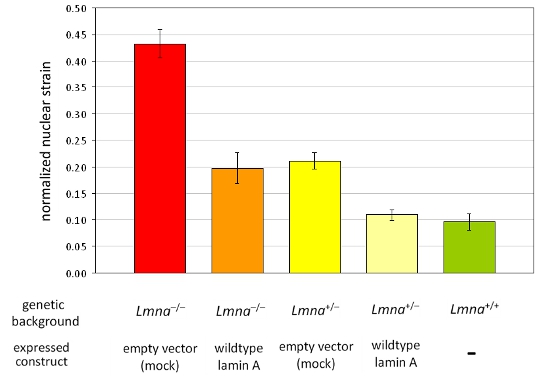
איור 2. ניתוח של מתח גרעיני מנורמל בהרכב של שורות תאים שונות MEF MEFs של Lmna -. / - ו Lmna + / - הרקע הגנטי ectopically להביע או וקטור ריק או wild-type lamin נותחו. בהשוואה MEFs של wild-type להמלטה (Lmna / + +), אובדן lamin A / C התוצאות ביטוי קשיחות גרעיני ירד כי ניתן לשחזר באופן מלא על ידי חידוש של wild-type lamin A. יש לציין, מופחת קשיחות גרעיני משתקף ערכים מוגברת של מתח גרעיני מנורמל. ברים שגיאה מייצגים סטיות התקן.

איור 3. Assay מניפולציה Microneedle למדוד הולכה כוח תאיים. שלב ניגודיות (A, B) ו פלואורסצנטי (C, D) תמונות של פיברובלסטים שכותרתה עם גרעיני כתם (כחול) MitoTracker המיטוכונדריה כתם (ירוק). Microneedle היה מוכנס לתוך cytoskeleton במרחק מוגדר מהגרעין (A ו-C) ועבר לאחר מכן כלפי הפריפריה תא (B, D). התקות Cytoskeletal גרעינית היו לכמת ידי גרעין שכותרתו fluorescently מעקב המיטוכונדריה באמצעות הזמנה בכתב צולבות מתאם אלגוריתם. (ה) המפה תזוזה של cytoskeletal הסופי (ירוק) דפורמציות שחושב מהסדרה תמונה הקרינה, אורך החץ הוא מוגדל על ידי 2x עבור visibi טובlity. סולם ברים, 10 מיקרומטר.
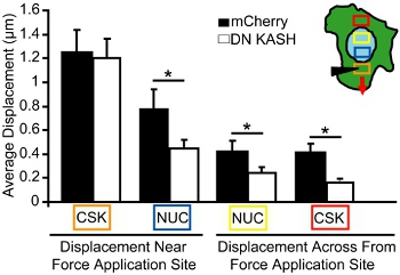
איור 4. ניתוח של העברת כוח תאיים במהלך מניפולציה microneedle. מושרה התקות cytoskeletal גרעינית במהלך מניפולציה microneedle, נמדדת בתחומים המתאימים את תיבות צבעוניות (הבלעה ב). תיבת תפוז הוא האתר הבקשה זן. למרות הבקשה זן דומה cytoskeleton (תיבת כתום), הנגרמת התקות גרעיני cytoskeletal (כחול, צהוב, אדום תיבות) היה קטן משמעותית את fibroblasts העכבר עובריים כי עם שיבשו Nucleo-cytoskeletal צימוד (DN קאש) לעומת הביקורת ( mCherry לבד) תאים.
Access restricted. Please log in or start a trial to view this content.
Discussion
זן תשתית assay
יישום מסננים שימש בהצלחה על ידינו וקבוצות אחרות ללמוד דפורמציות גרעיני המושרה בתאים נתון ללחץ מכני לחקור את התרומה של חלבונים ספציפיים מעטפת הגרעין כדי נוקשות גרעיני. 4-8 היתרון של שיטה זו היא כי בדיקות תכונות מכנ...
Access restricted. Please log in or start a trial to view this content.
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
עבודה זו נתמכה על ידי מכוני הבריאות הלאומיים (R01 ו R01 HL082792 NS059348) ואת בריגהם לב וכלי דם החולים לנשים מנהיגות פרס הקבוצה.
Access restricted. Please log in or start a trial to view this content.
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
| פיברונקטין | Millipore | FC010 | |
| MitoTracker אדום וירוק FM FM | Invitrogen | M22425 ו - M-7514 | |
| Hoechst 33342 | Invitrogen | H3570 | |
| האנק של שנאגרו מלח מלוחים | Invitrogen | 14185 | |
| חינם פנול, DMEM | Invitrogen | 21063 | |
| בסרום שור עוברית | Aleken הביולוגיים | FBSS500 | |
| פניצילין / סטרפטומיצין | סיגמא | P0781-100 מ"ל | |
| זכוכית בורוסיליקט עם נימה | סאטר Instrument | BF100-78-10 | |
| גלוס / יריעות גלוס שאינם מחוזקים סיליקון, 0.005 " | התמחות ייצור בע"מ | ||
| פוספט של Dulbecco בופר | Invitrogen | 14200 | |
| 35 מ"מ תחתית זכוכית תרבות מנות (FluoroDish) | העולם Precision מכשירים, INC | FD35-100 | |
| Braycote 804 אבק גריז | והנשמה אספקה | 05133A-AB |
References
- Friedl, P., Wolf, K., Lammerding, J. Nuclear mechanics during cell migration. Curr Opin Cell Biol. 23, 55-64 (2011).
- Mejat, A., Misteli, T. LINC complexes in health and disease. Nucleus. 1, 40-52 (2010).
- Worman, H. J., Fong, L. G., Muchir, A., Young, S. G. Laminopathies and the long strange trip from basic cell biology to therapy. J Clin Invest. 119, 1825-1836 (2009).
- Caille, N., Tardy, Y., Meister, J. J. Assessment of strain field in endothelial cells subjected to uniaxial deformation of their substrate. Ann Biomed Eng. 26, 409-416 (1998).
- Lammerding, J. Lamins A and C but not lamin B1 regulate nuclear mechanics. J Biol Chem. 281, 25768-25780 (2006).
- Lammerding, J. Abnormal nuclear shape and impaired mechanotransduction in emerin-deficient cells. J Cell Biol. 170, 781-791 (2005).
- Lammerding, J. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Verstraeten, V. L., Ji, J. Y., Cummings, K. S., Lee, R. T., Lammerding, J. Increased mechanosensitivity and nuclear stiffness in Hutchinson-Gilford progeria cells: effects of farnesyltransferase inhibitors. Aging Cell. 7, 383-393 (2008).
- Brooks, S. V., Zerba, E., Faulkner, J. A. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J Physiol. 488, 459-469 (1995).
- Maniotis, A. J., Chen, C. S., Ingber, D. E. Demonstration of mechanical connections between integrins, cytoskeletal filaments, and nucleoplasm that stabilize nuclear structure. Proc Natl Acad Sci. 94, 849-854 (1997).
Access restricted. Please log in or start a trial to view this content.
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved