Для просмотра этого контента требуется подписка на Jove Войдите в систему или начните бесплатную пробную версию.
Method Article
Биофизические Анализы для исследования механических свойств клеточного ядра Interphase: Субстрат приложений Процедить и микроиглы Манипуляция
В этой статье
Резюме
Приведем два независимых, микроскоп-инструменты для измерения индуцированных ядерных и цитоскелета деформации в отдельных живых прилипшие клетки в ответ на глобальные и локализованной деформации приложения. Эти методы используются для определения ядерных жесткости (то есть, деформируемость) и зонд внутриклеточной передачи силы между ядром и цитоскелета.
Аннотация
In most eukaryotic cells, the nucleus is the largest organelle and is typically 2 to 10 times stiffer than the surrounding cytoskeleton; consequently, the physical properties of the nucleus contribute significantly to the overall biomechanical behavior of cells under physiological and pathological conditions. For example, in migrating neutrophils and invading cancer cells, nuclear stiffness can pose a major obstacle during extravasation or passage through narrow spaces within tissues.1 On the other hand, the nucleus of cells in mechanically active tissue such as muscle requires sufficient structural support to withstand repetitive mechanical stress. Importantly, the nucleus is tightly integrated into the cellular architecture; it is physically connected to the surrounding cytoskeleton, which is a critical requirement for the intracellular movement and positioning of the nucleus, for example, in polarized cells, synaptic nuclei at neuromuscular junctions, or in migrating cells.2 Not surprisingly, mutations in nuclear envelope proteins such as lamins and nesprins, which play a critical role in determining nuclear stiffness and nucleo-cytoskeletal coupling, have been shown recently to result in a number of human diseases, including Emery-Dreifuss muscular dystrophy, limb-girdle muscular dystrophy, and dilated cardiomyopathy.3 To investigate the biophysical function of diverse nuclear envelope proteins and the effect of specific mutations, we have developed experimental methods to study the physical properties of the nucleus in single, living cells subjected to global or localized mechanical perturbation. Measuring induced nuclear deformations in response to precisely applied substrate strain application yields important information on the deformability of the nucleus and allows quantitative comparison between different mutations or cell lines deficient for specific nuclear envelope proteins. Localized cytoskeletal strain application with a microneedle is used to complement this assay and can yield additional information on intracellular force transmission between the nucleus and the cytoskeleton. Studying nuclear mechanics in intact living cells preserves the normal intracellular architecture and avoids potential artifacts that can arise when working with isolated nuclei. Furthermore, substrate strain application presents a good model for the physiological stress experienced by cells in muscle or other tissues (e.g., vascular smooth muscle cells exposed to vessel strain). Lastly, while these tools have been developed primarily to study nuclear mechanics, they can also be applied to investigate the function of cytoskeletal proteins and mechanotransduction signaling.
протокол
1. Субстрат применение штамма
Измерения нормированных ядерной деформации включает в себя подготовку деформации блюда с прозрачной, эластичной мембраны силиконовым как на поверхности клеток культуры, покрытие клеток на блюда, и получения изображения клеток до, во время и после (одноосное или двухосное) деформации приложения.
Подготовка силиконовая мембрана блюд и соблюдение клеток
- Каждый штамм блюдо состоит из заказных бездонную пластиковой посуды с диаметром 3 "и пластиковые уплотнительное кольцо провести силиконовой оболочкой, которая служит в качестве подложки клеточной культуры. Для приготовления блюд напряжение, зажим 4" х 4 "кусок силиконовая мембрана между кольцом и блюдом. Аккуратно срежьте избыточный мембраны, промыть деионизированной воды, и автоклав штамм блюд.
- Марк точкой отсчета в центре нижней части мембраны (снаружи) перед нанесением силиконовой мембраны с внеклеточной матрице молекулы (например, фибронектин). Это историческое поможет выявить тех же клеток во время экспериментов напряжение. (Дополнительно: Для одноосных приложением напряжения, двумя параллельными полосами скотча применяются вокруг точки отсчета для ограничения деформации мембраны в одном измерении.)
- Для обеспечения оптимального вложения клетку, пальто силиконовых мембран с 3 мкг / мл фибронектина разводят в 10 мл PBS или любым подходящим белкам внеклеточного матрикса. Обложка штамм блюдо с перевернутым блюдом полистирола 10 см, и инкубировать блюда в течение ночи при 4 ° C.
- На следующий день промыть мембран раз фосфатным буферным солевым раствором (PBS), чтобы удалить избыток белка. Заполните блюдо с 10 мл ростовой среды (Дульбеко изменения орлы средний (высокий уровень глюкозы) с добавлением 10% эмбриональной телячьей сыворотки и 1% пенициллина / стрептомицина) и отложить в сторону.
- Мышь эмбриональные фибробласты трипсином с 0,05% трипсина и высевают в питательную среду примерно в 30% слияния на покрытие блюдо мембраны силиконовым и инкубировать в течение 24 - 48 часов при нормальных условиях культуры.
Эксперименты Субстрат напряжение
- Настройка микроскопа для экспериментов. Эксперименты проводились на инвертированный микроскоп с цифровой камерой подходят для флуоресцентной микроскопии, фазового контраста и ДИК, используя 60x объективным и соответствующим программным обеспечением захвата изображений (например, IPLab или Метаморф). Прямой микроскоп не подходит для этого приложения. Напряжение устройство состоит из опорной плиты, которая соответствует на столик микроскопа и занимает центральную цилиндрическую валика, который служит применение штамма к центральной части силиконовая мембрана, подвижной пластины, которая содержит штамм блюдо и что может скользить вверх и вниз на четыре руководством булавки, а также 5-фунт веса пластины применять нагрузки.
- Для визуализации ядер, инкубировать клетки штамма блюдо с 1 мкг / мл Hoechst 33342 в течение 15 мин при 37 ° C. Аспирируйте от средних и заменить 15 мл фенола-красный среде без роста (изменения фенол-красный свободной Дульбеко орлы средний (высокий уровень глюкозы) с 25 Hepes мМ, с добавлением 10% эмбриональной телячьей сыворотки и 1% пенициллин / стрептомицин). Винт штамм блюдо в пластину держателя блюдо. Аккуратно нанесите смазку (Braycote 804 Вакуумная смазка), чтобы по периметру нижней части силиконовая мембрана для обеспечения скольжения мембраны вдоль центрального валика. Удостоверьтесь, чтобы держать центральную часть мембраны ясно.
- Место опорной плиты на столик микроскопа. Горы блюдо держателя пластины тщательно на опорной плите. Убедитесь, что в начальном положении покоя, силиконовая мембрана штамма блюдо свободно лежит на центральном валике.
- Во-первых, сосредоточить внимание на нижнюю часть силиконовой оболочки и найти центральную черную точку отсчета. Точка будет служить отправной точкой для всех изображений приобретений и помогает в поиске тех же клеток во время и после растяжения. Мы используем специально написанный автоматизированная программа визуализации для хранения позиции клетки и перенести эти клетки во время эксперимента, но это также может быть достигнуто вручную.
- Начиная с точки, настроить фокус для визуализации клеток и начало силиконовая мембрана. Найдите и распространение клеток с ядрами в центре города и приобрести фазового контраста и флуоресценции образ ядерной Hoechst пятно. Изображение фазового контраста следует сосредоточиться на контур ячейки и силиконовая мембрана, а флуоресцентные изображения должны быть сосредоточены на центральной плоскости ядра.
- После получения изображения от 5 до 15 клеток, вернуться в центральную точку. Медленно применять вес штамм блюдо, в результате единообразного применения напряжение в центре блюда. Максимальное напряжение подложки применяется ограничено нейлона распорки размещены на вертикальных контактов выравнивания (руководство контакта).
- Фокус на дне силиконовой оболочки и найти ссылки точкой снова. Начиная сточку, переместить же клетки и снова приобретают фазового контраста и флуоресценции образ клеток и ядер при полной деформации, пытаясь точно соответствовать фокальных плоскостях исходные изображения. Этот процесс не должен превышать 10 минут, чтобы избежать активной модернизации и адаптации клетки к напряженной подложки.
- После того как все соответствующие образы были приобретены, перемещать столик микроскопа обратно в исходную точку. Осторожно снимите весом от пластины держателя блюдо и дать силиконовая мембрана, чтобы расслабиться. Если необходимо, слегка надавите на напряжение блюдо, пока он находится в исходное положение. Затем приобрести фазового контраста и флуоресценции изображения после деформации клетки, как описано выше для деформации изображения.
Анализ
- Изображения клеток и флуоресцентно меченых ядер до, во время и после деформации приложения анализируются для вычисления нормированного ядерной деформации. В нашей лаборатории мы используем специально написанный сценарий MATLAB для анализа, но несколько альтернативных вариантов. Анализ проводится в три этапа.
- Во-первых, для расчета применяется субстрат штамма, позиции от 3 до 6 контрольных точек, расположенных на мембране вручную соответствие между соответствующими заранее, полный, и после деформации изображения. Программа MATLAB вычисляет применяются мембраны напряжение, сравнивая позиции соответствующих контрольных точек между предварительной деформации и полной деформации изображения, а также остаточных деформаций между предварительной деформации и после деформации изображения. В то же время, контрольные точки используются для регистрации изображения пары, которая поможет обнаружить повреждения или отключения ячейки (см. рисунок 1).
- На втором этапе, ядра вручную выбирается с помощью отдельной программы MATLAB, которая вычисляет ядерной деформации для каждого ядра, соответствующий одному ядерному размера или внутриядерных маркеров между соответствующими предварительно, полное-и пост-деформированного флуоресцентные изображения. Для учета малых изменений в прикладных мембраны напряжение между различными экспериментами, мы выражаем результаты Нормализованные ядерной деформации, определяемый как отношение индуцированного ядерной напрягаться, чтобы применять мембраны штамм, который рассчитывается для каждого ядра. MATLAB скриптов можно получить Lammerding лаборатории по запросу.
- Наконец, каждое ядро будет проверена, за исключением измерений из клеток, которые отсоединить или повреждены в процессе деформации приложений (рис. 1).
2. Микроиглы манипуляции анализа
Подготовка посуды, прилипшие клетки, и микроигл
- Инкубируйте 35 мм со стеклянным дном блюда культуре клеток с низкой концентрацией фибронектина (0.5ug/ml) в буферном солевом растворе соли Хэнка (HBSS) или любого подходящего белкам внеклеточного матрикса в течение 2 часов при температуре 37 ° C. Мыть посуду с HBSS в два раза и добавить 2 мл ростовой среды, чтобы блюдо прежде чем перейти к следующему шагу.
- Мышь эмбриональные фибробласты трипсином с 0,05% трипсина и посеяны в 2 мл ростовой среды посеяны на уровне 7,5 х 10 4 клеток / мл на фибронектин покрытием блюда стеклянным дном. Место клетки обратно в инкубаторе в течение ночи. Место клетки обратно в инкубаторе в течение ночи. Надо оптимизировать количество клеток для получения единого приверженца, не сливающийся клетки других типов клеток.
- Вытяните микроигл, изготовленные из боросиликатного капилляров, чтобы склонить чашу диаметром приблизительно от 1 до 3 мкм с коммерческой пипетки съемник (например, Саттер Instrument Company).
Микроиглы манипуляции эксперимент
- На следующий день, инкубировать клетки с MitoTracker митохондриальной пятна (600 мкм; Invitrogen) и Hoechst 33342 ядерных пятно (1 мкг / мл) добавляют к питательной среде в течение 30 минут при 37 ° C инкубатора.
- Вымойте клетки один раз в HBSS в течение 5 минут при комнатной температуре, а затем добавить фенол-красный среде без роста клеток для обработки изображений.
- Приобретайте одно изображение из одной клетки без микроиглы вставляется в цитоскелета в фазового контраста, один флуоресцентное изображение Hoechst 33342 пятно и одно флуоресцентное изображение митохондриальной пятно, с целью 60x (0,70 Н.А., план-ахромат) на перевернутый микроскоп с цифровой прибор с зарядовой связью камеры.
- Использование микроманипулятора (например, Н. И. InjectMan 2, Eppendorf), аккуратно вставьте микроиглы в цитоплазму ячейки фиксированном расстоянии (обычно 5 мкм) от периферии ядра и возьмите одну фазового контраста изображения, один флуоресцентное изображение Hoechst 33342 пятна и одно флуоресцентное изображение митохондриальной пятно. Для этого приложения, оно помогает контролировать микроманипулятора через компьютер, например, Windows HyperTerminal, для достижения согласованных процедур микроманипуляция.
- Перемещение микроиглы, определенном расстоянии (обычно 10 или 20 мкм) к периферии клетки на 1 мкм / сек одновременно сбора флуоресценции и фазового контраста изображения каждые 10секунд. Как микроиглы переходит на определенное расстояние к периферии клетки. С выбранными параметрами, как микроиглы переходит на определенное расстояние к периферии клетки, это будет соответствовать 2-3 кадров при манипуляции процессом.
- Наконец приобретения дополнительных изображений после микроиглы удаляется из цитоскелета.
Анализ
- Перемещение карты, рассчитываются с использованием специально написанный MATLAB сценарий, основанный на отслеживании флуоресцентно меченных особенностей ядра и цитоплазмы. (Сценарий MATLAB можно получить Lammerding лаборатории по запросу). Программа использует нормированную кросс-корреляцию между алгоритмом небольших областях изображения (приблизительно 10 мкм х 10 мкм и 5 мкм, расположенных друг от друга) в последующих кадрах изображения. Для каждого областного центра, перемещение в х-и у-направлениях вычисляются как сдвиг между прежнее место и вновь выявленных положение и отображается в виде вектора смещения, а также хранятся в виде числовых значений. С карты смещения, средний перемещений в заранее регионах могут быть вычислены. Обратите внимание, что цитоскелета перемещений на основе флуоресценции канал для цитоскелета маркеров (например, митохондриальная MitoTracker пятно), в то время ядерных смещений вычисляются из флуоресценции канал соответствующего Hoechst 33342 сигнал. Для нашего приложения мы регулярно рассматривать следующие регионы: (я) цитоскелета налегать на сайте штамм приложения, то есть, микроиглы месте введения, (II) ядерных напряжение в области внутри ядра по отношению к веб-приложением, штамма; (III) ядерные напряжение в ядерной области от веб-приложение, и (IV) цитоскелета напряжение в цитоплазматических региона через ядро. Кроме того, можно также непосредственно измерять ядерной удлинение от фазового контраста или Hoechst 33342 флуоресценции последовательности изображений. В этом случае, прикладная ядерная напряжение рассчитывается путем деления ядерных удлинение (ΔL = L - L 0), начальная длина, L 0, где L является конечной длины ядра в конце приложения напряжения и L 0, начальная длина ядра. Для ячеек с нетронутыми нуклео-цитоскелета связи, ядро будет удлиненная к веб-приложением, процедить. Напротив, в клетках, в которых нуклео-цитоскелета связь нарушается, то есть силы передаются менее эффективно, между цитоскелета и ядра, ядра, как ожидается, значительно меньше, удлиненные в направлении веб-приложением, процедить. Таким образом, снижение ядерных деформаций в ответ на применение цитоскелета штамм подразумевают (частично) развязки между ядром и цитоскелета.
3. Представитель результаты:
Субстрат применение штамма
Мы приобрели изображения до, во время и после деформации приложение мышиных эмбриональных фибробластов от гетерозиготных и гомозиготных ламина A / C-дефицитных (LMNA + / - и LMNA - / -), и дикого типа (LMNA + / +) мыши, а затем вычисляются нормированные ядерной деформации для каждой ячейки. После анализа, ядер, проверяются и клетки, которые повреждены или убрать напряжение во время применения исключены из анализа. Рисунок 1А изображает ядер из трех ячеек, которые являются действительными, в то время как рис 1В изображает клетки, которые должны быть исключены из анализа. Нормализованная ядерным данным штаммом объединяются, по крайней мере трех независимых экспериментов (каждая из которых содержит измерений от ~ 5-10 ядер) и по сравнению с другими ячейки или группы лечения путем статистического анализа. Увеличение нормированного ядерной штамм указывает снижение ядерной жесткость, как видно из клетки с уменьшенным выражением ядерных белков конверте ламин А / С (рис. 2).
Микроиглы манипуляции анализа
Для микроиглы анализ манипуляции, мы отображаемого ядерной и цитоскелета перемещений во время локализованных цитоскелета приложения напряжения. Клетки, которые повреждены или отдельные исключены из анализа. Для анализа, мы измеряем величину ядерной и цитоскелета движение к сайт приложения сил в одно-, прилипшие клетки. Например, на рисунке 3, мы отслеживаем митохондриальной (маркер для цитоскелета) смещения до и после цитоскелета, процедить и затем построить смещения как векторы. Каждый вектор представляет смещение вычисляется как сдвиг между прежнее место и вновь выявленных позиции. Регионы с низкой интенсивностью изображения или недостаточной текстуры (например, в регионах за пределами клетки), исключены из анализа. Цитоскелета и ядерной смещения затем количественно в некоторых районах на все большие расстояния от места приложения напряжения (рис. 4, области, соответствующие цветные боXES на вставке). В мышиных эмбриональных фибробластов с неповрежденными нуклео-цитоскелета связи, силы передаются через все клетки, в результате индуцированных ядерных и цитоскелета деформации, медленно рассеивается от места штамм приложений (рис. 4). В отличие от фибробластов с нарушенным нуклео-цитоскелета связи (или изменены цитоскелета организации) отображения локализованных перемещений возле веб-приложение, как показано на рисунке 4, и только немного индуцированной деформации дальше. Сопоставимые цитоскелета применение деформации при микроиглы месте введения (Orange Box) наблюдается как для контроля фибробластов (mCherry в одиночку) и фибробластов с нарушена нуклео-цитоскелета связи (DN KASH). Тем не менее, индуцированных ядерных и цитоскелета смещения (синий, желтый и красный коробок) в других регионах были значительно меньше фибробластов с нарушенной нуклео-цитоскелета связи (DN KASH), чем в контрольных клетках (mCherry только) (рис. 4). Таким образом, снижение цитоскелета и ядерной смещения от места приложения напряжения, показывает, что силы, передаваемые между цитоскелета и ядра был нарушен.
Важно отметить, что мы также подтверждено, что митохондрии являются подходящими цитоскелета маркер, путем проведения микроиглы манипуляции на мышиных эмбриональных фибробластов, трансфицированных GFP-или mCherry актина и GFP-виментин и флуоресцентно меченные Mitotracker зеленый или красный. Цитоскелета карт смещения рассчитывались независимо от флуоресцентного сигнала из митохондрий и актин или виментин цитоскелета. Среднее абсолютное смещение были вычислены для четырех различных регионах цитоскелета на все большие расстояния от места приложения напряжения. Склона и R-квадрат значения были вычислены с линейной регрессии между измерений, полученных из митохондрий и от актина или виментин, соответственно. Для актин, склон был 0,99 и R 2 значение было 0,986; для виментин, склон был 1,04 и R2 значение было 0,971, подтвердив, что митохондриальная перемещений служить надежными показателями для цитоскелета деформаций.
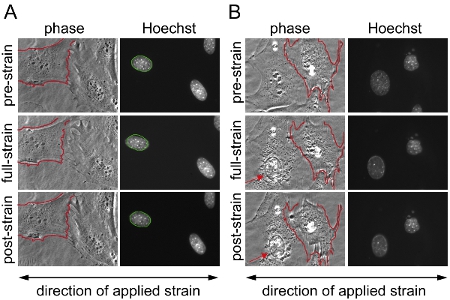
Рисунок 1. Субстрат штамм приложения на мышиных эмбриональных фибробластов (MEFs). Мышиных эмбриональных фибробластов в течение двух различных областях на мембране кремния, полученную с использованием фазового контраста и флуоресцентной микроскопии до, во время и после применения 20% одноосной деформации. () Пример успешного эксперимента с действительными ядрами из клеток, которые выжили штамм приложений без каких-либо повреждений или отряд и (Б) пример клетки, убрать / частично отдельный штамм во время применения; результаты из клеток изображены на (B) исключены из анализа. В (Б), клетка с левой стороны показывает признаки повреждения цитоскелета и ядерной коллапс (стрелка), а клетка с правой стороны отделяет отчасти и втягивается во время штамм приложения. Это может быть признаком чрезмерного приложения напряжения. Для лучшего сравнения, в (А) и (Б) границы одного из нерастянутое клеточных мембран изложена в красный и накладывается на одну камеру во время и после деформации приложения. В (А) границы нерастянутое ядра, изложенные в зеленый и накладывается на того же ядра во время и после деформации приложения.
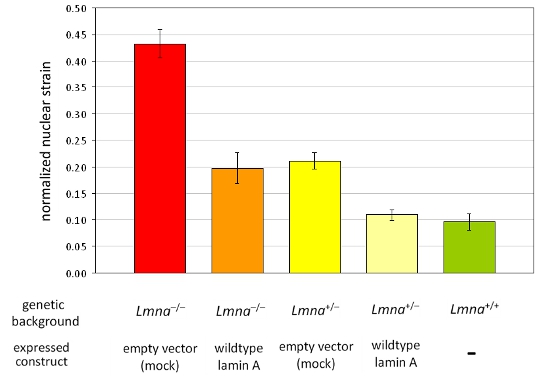
Рисунок 2. Анализ нормированных ядерной деформации в панели различных линий клеток MEF MEFs из LMNA -. / - И LMNA + / - генетический фон эктопически выражения либо пустой вектор или дикого типа ламин были проанализированы. По сравнению с MEFs от дикого типа однопометников (LMNA + / +), потеря ламина A / C выражения приводит к снижению ядерной жесткости, которые могут быть полностью восстановлена по реинтродукции дикого типа ламин А. Следует отметить, что снижение ядерной жесткость отражается повышенные значения нормированных ядерной деформации. Погрешности представляют собой стандартные ошибки.

Рисунок 3. Микроиглы анализа манипуляций для измерения внутриклеточной передачи силы. Фазового контраста (A, B) и флуоресценции (C, D) изображения фибробластов помечены ядерной пятно (синий) и MitoTracker митохондриальной пятна (зеленый). Микроиглы был вставлен в цитоскелета на определенном расстоянии от ядра (А и С), а затем двинулся к периферии клетки (B, D). Цитоскелета и ядерной перемещения были количественно путем отслеживания флуоресцентно-меченные ядра и митохондрий с помощью пользовательского написанный кросс-корреляции алгоритма. (Е) Водоизмещение карта окончательного цитоскелета (зеленый) деформации вычисляются по флуоресценции серии изображений; стрелки длина увеличивается в 2 раза для лучшего visibility. Шкала баров, 10 мкм.
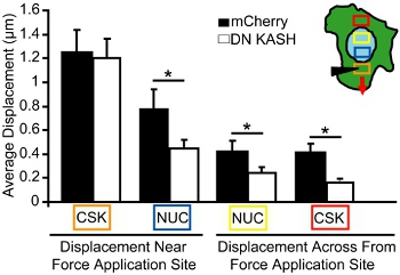
Рисунок 4. Анализ внутриклеточной передачи силы во время микроиглы манипуляции. Индуцированные цитоскелета и ядерной перемещений во время микроиглы манипуляции, измеряется в областях, соответствующих цветные квадраты (вставка на). Orange Box является местом штамм приложения. Несмотря на аналогичные приложения напряжения в цитоскелета (Orange Box), индуцированное ядерной и цитоскелета смещения (синий, желтый и красный коробок) были значительно меньше, в мышиных эмбриональных фибробластов, что с нарушена нуклео-цитоскелета связи (DN KASH) по сравнению с контролем ( mCherry в одиночку) клеток.
Access restricted. Please log in or start a trial to view this content.
Обсуждение
Анализ основания напряжение
Штамм заявка была успешно использована нами и другими группами для изучения индуцированных ядерных деформаций в клетках подвергаются механическим нагрузкам и исследовать вклад белков ядерного конверт ядерной жесткости. 4-8 преимущест?...
Access restricted. Please log in or start a trial to view this content.
Раскрытие информации
Нет конфликта интересов объявлены.
Благодарности
Работа выполнена при поддержке Национального института здоровья (R01 и R01 HL082792 NS059348) и Бригам и женской больницы сердечно-сосудистой премии группы лидерства.
Access restricted. Please log in or start a trial to view this content.
Материалы
| Name | Company | Catalog Number | Comments |
| Название реагента | Компания | Номер в каталоге | |
| Фибронектин | Millipore | FC010 | |
| MitoTracker Красный и зеленый FM FM | Invitrogen | M22425 и М-7514 | |
| Hoechst 33342 | Invitrogen | H3570 | |
| Буферизацией соли Хэнка Saline | Invitrogen | 14185 | |
| Фенол бесплатно, DMEM | Invitrogen | 21063 | |
| Фетальной телячьей сыворотки | Aleken биологические препараты | FBSS500 | |
| Пенициллин / стрептомицин | Сигма | P0781-100мл | |
| Боросиликатного стекла с нитью | Саттер Инструмент | BF100-78-10 | |
| Блеск / Блеск неармированного силиконовой пленки, 0,005 " | Специальность Производство ООО | ||
| Фосфат Дульбеко солевой буфер | Invitrogen | 14200 | |
| 35 мм со стеклянным дном культуры блюд (FluoroDish) | Всемирный точных приборов, INC | FD35-100 | |
| Braycote 804 Вакуумная смазка | Спи поставок | 05133A-AB |
Ссылки
- Friedl, P., Wolf, K., Lammerding, J. Nuclear mechanics during cell migration. Curr Opin Cell Biol. 23, 55-64 (2011).
- Mejat, A., Misteli, T. LINC complexes in health and disease. Nucleus. 1, 40-52 (2010).
- Worman, H. J., Fong, L. G., Muchir, A., Young, S. G. Laminopathies and the long strange trip from basic cell biology to therapy. J Clin Invest. 119, 1825-1836 (2009).
- Caille, N., Tardy, Y., Meister, J. J. Assessment of strain field in endothelial cells subjected to uniaxial deformation of their substrate. Ann Biomed Eng. 26, 409-416 (1998).
- Lammerding, J. Lamins A and C but not lamin B1 regulate nuclear mechanics. J Biol Chem. 281, 25768-25780 (2006).
- Lammerding, J. Abnormal nuclear shape and impaired mechanotransduction in emerin-deficient cells. J Cell Biol. 170, 781-791 (2005).
- Lammerding, J. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Verstraeten, V. L., Ji, J. Y., Cummings, K. S., Lee, R. T., Lammerding, J. Increased mechanosensitivity and nuclear stiffness in Hutchinson-Gilford progeria cells: effects of farnesyltransferase inhibitors. Aging Cell. 7, 383-393 (2008).
- Brooks, S. V., Zerba, E., Faulkner, J. A. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J Physiol. 488, 459-469 (1995).
- Maniotis, A. J., Chen, C. S., Ingber, D. E. Demonstration of mechanical connections between integrins, cytoskeletal filaments, and nucleoplasm that stabilize nuclear structure. Proc Natl Acad Sci. 94, 849-854 (1997).
Access restricted. Please log in or start a trial to view this content.
Перепечатки и разрешения
Запросить разрешение на использование текста или рисунков этого JoVE статьи
Запросить разрешениеThis article has been published
Video Coming Soon
Авторские права © 2025 MyJoVE Corporation. Все права защищены