このコンテンツを視聴するには、JoVE 購読が必要です。 サインイン又は無料トライアルを申し込む。
Method Article
相間細胞核の力学特性を探査する生物物理学的なアッセイ:基板の歪みのアプリケーションおよびマイクロニードル操作
要約
我々は、グローバルまたはローカライズされたひずみ申込みに応じて、単一の、生きている付着細胞で誘導核と細胞骨格の変形を測定するために二つの独立した、顕微鏡ベースのツールを紹介。これらの技術は、核の剛性を(すなわち、変形能)を決定すると、核と細胞骨格との間の細胞内力伝達を調べるために使用されます。
要約
ほとんどの真核細胞で、核は最大の細胞小器官であり、通常は周囲の細胞骨格の2〜10倍頑丈です。その結果、核の物理的性質は、生理学的および病理学的条件下で細胞全体の力学的挙動に大きく貢献する。例えば、好中球を移行し、がん細胞を侵入で、核の剛性は、組織内の狭いスペースを介して血管外漏出や通過時に大きな障害をもたらすことができる。1は、一方で、筋肉がするのに十分な構造的なサポートを必要とするような機械的にアクティブな組織中の細胞の核反復的な機械的ストレスに耐える。重要なのは、核がしっかりと細胞のアーキテクチャに統合され、それが物理的に偏光細胞、神経筋接合部シナプスの原子核で、例えば細胞内の運動と核の位置決めのための重要な要件、つまり、周囲の細胞骨格に接続されている、または細胞の移行の2当然のことながら、核の剛性とnucleo -細胞骨格結合を決定する上で重要な役割を果たすなどlaminsやnesprinsとして核膜タンパク質、、の変異を含む、ヒトの疾患の数に起因する最近示されているエメリー-ドレフュス型筋ジストロフィー、肢帯型筋ジストロフィー、および拡張型心筋症3多様な核膜タンパク質と特異的変異の影響の生物物理学的機能を調べるためには、我々は、単一の、生きた細胞で核の物理的性質を研究するための実験方法を開発しているグローバルまたはローカライズされた機械的な摂動を受ける。正確に適用される基板の歪みのアプリケーションへの応答で誘導される核の変形を測定することは、核の変形能に関する重要な情報を得られますし、別の変異や、特定の核膜タンパク質の欠損細胞株の間に定量的な比較を可能にします。マイクロニードルとローカライズされた細胞骨格の歪みアプリケーションは、このアッセイを補完するために使用され、核と細胞骨格との間の細胞内力伝達に関する追加情報を得ることができる。無傷の生細胞で核の力学を研究することは正常な細胞内のアーキテクチャを維持し、単離核での作業中に発生する可能性がある潜在的なアーティファクトを回避します。さらに、基板の歪みアプリケーションは、筋肉や他の組織の細胞(例えば、血管平滑筋細胞が血管緊張にさらされる)が経験する生理的ストレスのためのよいモデルを提示する。これらのツールは主に核の力学を研究するために開発されているが最後に、、彼らはまた、細胞骨格タンパク質とメカノシグナリングの機能を調査するために適用することができます。
プロトコル
1。基板の歪みアプリケーション
正規化された核のひずみの測定は、皿の上に細胞を播き、および(一軸または二軸)ひずみのアプリケーション作業中および作業後は、前のセルの画像を取得、細胞培養の表面のような透明な、弾性シリコン膜と歪の料理の準備が含まれています。
シリコン膜の料理と細胞の付着の調製
- 各菌株の料理は、3の直径を持つカスタムメイドの底なしのプラスチック皿で構成されています"と細胞培養の基質として機能するシリコン膜を、保持するためにO -リングプラスチック。ひずみの料理の準備は、4クランプ"xを4"O -リングと皿の間にシリコン膜の部分は。慎重に脱イオン水ですすぎ、過剰な膜を切り取る、とひずみの料理をオートクレーブ。
- 細胞外マトリックス分子(例えば、フィブロネクチン)とシリコン膜は、コーティングの前にメンブレンの中央下部(外側)の基準点をマーク。このランドマークは、ひずみの実験中の同じ細胞を識別するのに役立ちます。 (オプション:一軸性歪みのアプリケーションでは、スコッチテープの2つの平行ストライプは、一次元の膜の変形を制限する基準点の周囲に適用されます。)
- 10ミリリットルのPBSまたは任意の適切な細胞外マトリックスタンパク質で希釈した3μg/ mlのフィブロネクチンとの最適な細胞の付着、コートシリコン膜を提供する。反転10cmのポリスチレンディッシュとひずみの料理をカバーし、4℃一晩の料理をインキュベート℃に
- リン酸が過剰なタンパク質を除去するために緩衝生理食塩水(PBS)で次の日に、一回膜をすすいでください。増殖培地10mlの(ダルベッコ変法イーグル培地(高グルコース)は10%ウシ胎児血清および1%ペニシリン/ストレプトマイシンを添加した)で皿を記入し、脇に置きます。
- 通常の培養条件下で48時間 - マウス胚線維芽細胞は、24のコーティングされたシリコン膜の料理とインキュベート上に約30%コンフルエントに増殖培地に0.05%トリプシンおよびシードでトリプシン処理されています。
基板の歪みの実験
- 実験用の顕微鏡を設定する。実験は60倍の客観的かつ適切な画像収集ソフトウエア(例えば、IPLabまたはMetamorph)を使用して、蛍光顕微鏡、位相コントラストやDICに適したデジタルカメラで倒立顕微鏡上で実行されます。正立顕微鏡には、このアプリケーションには適していません。歪みのデバイスは、顕微鏡のステージに収まるベースプレートで構成され、中央の円筒状のシリコン膜、歪みの皿を保持する可動板の中央部にひずみを適用するために提供するプラテンと、それは上を上下にスライドすることができますを取得していますfour指導ピンだけでなく、負荷を適用するには、5ポンドの重量のプレート。
- 核を可視化するために、37℃で15分間ヘキスト33342の1μg/ mlの株皿で細胞をインキュベート℃に培地をオフに吸引し、15ミリリットルフェノールレッドフリー増殖培地(10%ウシ胎児血清および1%ペニシリン/ストレプトマイシンを添加したフェノールレッドフリーダルベッコ改変イーグル培地(高グルコース)、25mMのHEPESを、)と交換してください。皿ホルダープレートにひずみ皿ネジ。慎重に中央プラテンに沿って膜のグライダーを保証するためにシリコン膜の底部の周囲にグリース(Braycote 804真空グリース)を適用する。膜の中央部を明確にすることを確認してください。
- 顕微鏡のステージ上にベースプレートを置きます。ベースプレート上に慎重に皿ホルダープレートをマウントします。初期の安静時の位置で、ひずみの皿のシリコン膜が緩く、中央プラテンの上に物を置かないことを保証する。
- 最初に、シリコン膜の底部に集中し、中央の黒の基準点を見つける。ドットは、ストレッチの実行中と実行後、同じセルの位置を目ですべての画像の取得とエイズのための出発点として機能します。我々は、細胞の位置を格納し、実験中にこれらの細胞を再配置するためにカスタムで作成された自動化されたイメージングプログラムを使用しますが、これも手動で達成することができます。
- ドットから始まる、細胞とシリコン膜の上部を可視化にフォーカスを調整します。中心部に位置する原子核とよく拡散セルを見つけて、位相コントラストと核染色法ヘキストの蛍光画像を取得。蛍光画像は、核の中心面に焦点を当てるべきである一方、位相コントラスト画像は、細胞の輪郭とシリコン膜に焦点を当てる必要があります。
- 5〜15細胞の画像を取得した後、中央のドットに戻ります。ゆっくりと皿の中央に均一なひずみのアプリケーションで、その結果、ひずみの皿に重みを適用します。最大適用される基板の歪みは、垂直方向の位置合わせピン(ガイダンスピン)に置かれたナイロンスペーサーによって制限されます。
- シリコン膜の底部に着目し、再び基準点を見つけます。から開始ドットは、同じセルを移動すると再び密接に最初の画像の焦点面を一致させようと、位相コントラストと完全な負担がかかっている細胞および核の蛍光画像を取得する。このプロセスは緊張した基板にセルのアクティブなリモデリングと適応を避けるために10分を超えないようにしてください。
- 対応するすべての画像が取得された後、出発点に戻って顕微鏡ステージを移動する。慎重に皿ホルダープレートから重量を削除し、シリコン膜は、リラックスすることができます。必要な場合は、最初の位置になるまで、ゆっくりとひずみの皿を押し上げます。ひずみイメージに上記のような、位相コントラストとポスト株の細胞の蛍光画像を取得。
分析
- 前細胞と蛍光標識した核の画像、中、および歪みのアプリケーションの後に正規化された核のひずみを計算するために分析されます。当研究室では、我々は分析のためにカスタムで作成されたMATLABのスクリプトを使用しますが、いくつかの代替オプションが利用可能です。分析は3つのステップで実行されます。
- 最初に、適用される基板の歪みを計算するために、膜上にある3から6の制御点の位置は、手動で対応するプリ、フル、および後のひずみの画像間で照合されます。 MATLABのプログラムは、事前にひずみともフル歪画像と事前ひずみとポストひずみ画像間の残留歪みの間に制御点を一致させる位置を比較することにより適用される膜のひずみを計算します。同時に、制御点が(図1を参照)損傷またはデタッチする細胞を検出するための手助けとなる、画像のペアを登録するために使用されています。
- 第二段階では、核を手動で核のサイズや対応するプリ、フル、および後のひずみ蛍光画像間の核内のマーカーのいずれかを照合することによって、個々の原子核の核ひずみを計算する別のMATLABプログラムを使用して選択します。異なる実験間で適用される膜のひずみの小さな変動を考慮するには、我々はそれぞれの核に対して計算され適用される膜のひずみへの誘導核歪みの比として定義される正規化された核ひずみ 、などの結果を表現する。 MATLABのスクリプトは、要求に応じてLammerding研究室から入手できます。
- 最後に、それぞれの核は、デタッチまたはひずみのアプリケーション(図1)中に破損の細胞から測定値を除く、検証されます。
2。マイクロニードルの操作アッセイ
料理、接着細胞、およびマイクロニードルの作製
- 37ハンクのバッファ塩の生理食塩水でフィブロネクチンの低濃度(0.5ug/ml)(HBSS)または2時間の任意の適切な細胞外マトリックスタンパク質35 mmガラスボトムの細胞培養皿をインキュベート℃にHBSSで2回皿を洗い、次の手順に進む前に皿に増殖培地2 mlを加える。
- マウス胚性線維芽細胞は、フィブロネクチンでコーティングされたガラスボトムディッシュに7.5 × 10 4細胞/ mlで播種した2 mlの増殖培地に0.05%トリプシンおよびシードでトリプシン処理されています。一晩バックインキュベーターで場所細胞。一晩バックインキュベーターで場所細胞。一つは、他の細胞型の単一の、接着性、非コンフルエントの細胞を得るために細胞の数を最適化する必要があります。
- 商業用ピペットプラー(例えば、サッターインストゥルメント社)で約1〜3μmの直径を傾けて、ホウケイ酸毛細血管製のマイクロニードルを、引き出します。
マイクロニードルの操作実験
- 翌日、MitoTrackerにより細胞をインキュベートするミトコンドリア染色(600μM、Invitrogen社)とヘキスト33342核染色(1μg/ mL)を37℃インキュベーターで30分間、増殖培地に添加。
- 室温で5分間、HBSSで細胞を一度洗浄しイメージングするための細胞にフェノールレッドフリー増殖培地を加える。
- 位相コントラストの細胞骨格に挿入されたマイクロニードルなく、単一のセルの1つのイメージを取得、ミトコンドリアのヘキスト33342染色及びつの蛍光画像の一蛍光画像は、逆に60倍の目標(0.70 NA、プラン-アクロマート)で、染色デジタルCCDカメラと顕微鏡。
- マイクロマニピュレータ(例えば、InjectMan NI 2、エッペンドルフ)を使用して、慎重にセル離れて核周縁部から一定の距離(通常は5ミクロン)の細胞質中にマイクロニードルを挿入し、一つの相コントラスト画像、ヘキスト33342のいずれかの蛍光画像を取る染色とミトコンドリア染色の一つ蛍光画像。このアプリケーションでは、それは一貫性のあるマイクロマニピュレーションの手順を達成するために、コンピュータを介して、例えば、Windowsのハイパーターミナルを、マイクロマニピュレータを制御するのに役立ちます。
- 同時に蛍光および位相コントラスト画像を収集しながら、10はマイクロニードルが1μm/秒でのセルの周囲に向かって特定の距離を(通常は10または20μm)を移動する秒。マイクロニードルは、セルの周囲に向かって特定の距離に移動しているとして。選択したパラメータで、マイクロニードルは、セルの周囲に向かって特定の距離に動いているとして、これは操作の処理中に2〜3フレームに対応します。
- マイクロニードルが細胞骨格から削除された後に最後に追加の画像を取得。
分析
- ディスプレイスメントマップは、核と細胞質のトラッキング蛍光標識の機能に基づいて、カスタムで作成されたMATLABのスクリプトを使用して計算されます。 (MATLABのスクリプトは、要求に応じてLammerding研究室から入手可能です)。プログラムは、後続の画像フレームの小さな画像領域(Xサイズで10μmと間隔5μmの間隔は約10μm)の間に正規化相互相関アルゴリズムを使用しています。各地域センターのための、の変位x軸とy軸方向は元の場所と新たに同定された位置の間のシフトとして計算し、変位ベクトルとして表示しても数値として格納されます。ディスプレイスメントマップから、あらかじめ定義された領域内の平均的な変位を計算することができます。核の変位はヘキスト33342信号に対応する蛍光チャネルから計算される間、細胞骨格の変位は、細胞骨格マーカー(例えば、MitoTrackerによりミトコンドリア染色)のための蛍光チャネルに基づいていることに注意してください。私たちのアプリケーションでは、我々は日常的に次の地域調べる:;ひずみアプリケーションのサイトに向かって核の内側の領域で(ⅱ)核ひずみ、ひずみのアプリケーションのサイトで(i)の細胞骨格の歪み、すなわち、マイクロニードル挿入部位を(iii)の核アプリケーションのサイトから離れ、核領域でのひずみ、および核間の細胞質領域の(ⅳ)細胞骨格歪み。さらに、人はまた、直接位相コントラストまたはヘキスト33342蛍光画像シーケンスから核伸長を測定することができます。この場合、核の株は核の伸長(ΔL= L - L 0)で割って算出され適用さLは、ひずみのアプリケーションの終了時に核の最終的な長さであり、L 0は最初の長さ、L 0、で核の初期の長さ。無傷nucleo -細胞骨格結合をもつ細胞は、核がひずみのアプリケーションのサイトに向かって伸長されます。対照的に、細胞内でnucleo -細胞骨格結合が破壊された、すなわち、力が細胞骨格と核の間に小さい効率的に送信される、核は、ひずみのアプリケーションのサイトの方向で有意に少なかった伸長が期待される。このように、核と細胞骨格の間に(部分的)脱共役を意味する細胞骨格の歪みアプリケーションに応答して核の変形を減少させた。
3。代表的な結果:
基板の歪みアプリケーション
我々は中に、前に画像を取得し、ヘテロ接合とホモ接合ラミンからマウス胚線維芽細胞へのひずみ印加後の/ C欠損(LMNA + / -とLMNA - / - )、その後、および野生型(LMNA + / +)マウスと各セルのための正規化された核のひずみを計算した。分析した後、核が検証され、ひずみの適用中に破損または撤回する細胞を解析から除外されます。図1Bは、分析から除外されるべきセルを描いているのに対し、図1Aは、有効な3つの細胞の核を示しています。正規化された核菌株のデータは、少なくとも3つの独立した実験(それぞれが5〜10核から測定値を含む)からプールし、統計解析によって他の細胞や治療群と比較されます。の増加、正規化、核菌株は、/ C(図2)ラミン核膜タンパク質の発現低下と細胞に見られる減少核剛性を、示している。
マイクロニードルの操作アッセイ
マイクロニードル操作アッセイのために、我々は、ローカライズされた細胞骨格の歪みアプリケーションの間に、核と細胞骨格の変位をイメージ。破損または切り離さ細胞を解析から除外されます。分析のために、我々は、単一の、付着細胞の力の適用部位に向かって核と細胞骨格の動きの大きさを測定する。例えば、図3に、我々は細胞骨格の歪みの前と後のミトコンドリア(細胞骨格のマーカー)変位を追跡し、ベクトルのような変位をプロットする。各ベクトルは、元の場所と新たに同定された位置との間のシフトとして計算された変位を表しています。低画像強度または不十分なテクスチャ(例えば、細胞外領域)を持つ領域は解析から除外されます。細胞骨格と核の変位は、ひずみのアプリケーションのサイトからの増加の距離(図4、色付きのBOに対応する領域でのselectの分野で定量化されています挿入図にXES)。無傷nucleo -細胞骨格結合を持つマウス胚線維芽細胞では、力が徐々に歪みのアプリケーションのサイト(図4)から放散誘発核と細胞骨格の変形で、その結果、全体の細胞を介して送信されます。対照的に、乱れたnucleo -細胞骨格結合(または変更された細胞骨格組織)による線維芽細胞は、図4に示すように、適用部位の近くにローカライズされた変位、遠くの少しだけ誘発された変形を表示します。マイクロニードル挿入部位(オレンジボックス)で同等の細胞骨格の歪みアプリケーションは、コントロールの線維芽細胞(mCherryアローン)と中断nucleo -細胞骨格結合(DNカッシュ)と線維芽細胞の両方で観察される。しかし、他の地域で誘発される核と細胞骨格変位は(、青、黄色、そして赤のボックス)コントロール細胞(mCherry単独)(図4)に比べて破壊さnucleo -細胞骨格の結合(DNカッシュ)と線維芽細胞で有意に小さかった。このように、離れて歪みのアプリケーションのサイトから細胞骨格と核の変位の減少は、細胞骨格と核の間の力の伝達が乱されたことを示します。
重要なことは、我々はまた、GFP -またはmCherryアクチンとGFP -ビメンチンをトランスフェクションし、蛍光MitoTrackerにより緑や赤で標識したマウス胚線維芽細胞にマイクロニードル操作を行うことにより、ミトコンドリアは、適切な細胞骨格マーカーであることが検証されている。細胞骨格ディスプレイスメントマップは、ミトコンドリアとアクチンやビメンチン細胞骨格の蛍光信号から独立して計算した。平均絶対変位は、ひずみのアプリケーションのサイトからの距離を離れて増加で4つの異なる細胞骨格の領域について計算した。傾きとR - 2乗値は、ミトコンドリアからそれぞれアクチンやビメンチン、から得られた測定値との間の線形回帰から計算された。アクチンの場合、傾きは0.99であり、R 2値は0.986であった。ビメンチンのために、傾きは1.04とR2の値は、ミトコンドリアの変位は細胞骨格の変形のための信頼できる指標となることを確認し、0.971であった。
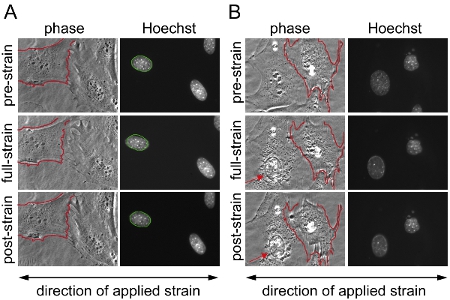
図1。マウス胚性繊維芽細胞(MEF)上に基板のひずみアプリケーション。シリコン膜上に、次の2つの分野に広がって、マウス胚線維芽細胞を20%一軸性歪みのアプリケーション作業中および作業後は、位相コントラスト、蛍光顕微鏡で画像化した。有効ないかなる損害または剥離することなく歪みのアプリケーションを生き残った細胞からの核と部分的に歪のアプリケーション中に切り離さ/撤回細胞の(B)の例で成功した実験の(A)の例、(B)は除外されるに示されている細胞からの結果分析から。右側のセルは、ひずみの適用中に部分的に本体に収納切り離している間に(B)、左側のセルは、細胞骨格損傷及び核崩壊(矢印)の兆候を示しています。これは、過度のひずみアプリケーションを示している可能性があります。より良い比較のために、で(A)と(B)未延伸の細胞膜の一つの境界線が赤で概説し、歪みのアプリケーションの実行中および終了後は、同じセルに重ねて表示される。 (A)未延伸の核の境界線が緑に概説し、歪みのアプリケーションの実行中および終了後は、同じ核に重畳される。における
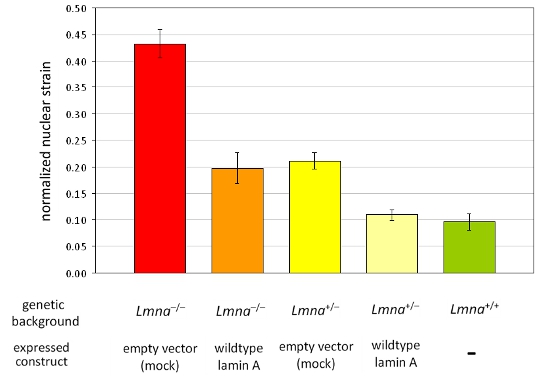
図2。別のMEF細胞株のパネルで正規化された核株の分析 LMNAのMEFの- 。/ -とLMNA + / -異所性には空のベクトルまたは分析された野生型ラミンを表現する遺伝的背景。が反映されている野生型の同腹子(LMNA + / +)、ラミンの損失からのMEFと比較して、完全に野生型ラミンAの再導入によって復元することができます減少核剛性/ Cの式の結果は注目すべきことに、核の剛性を減少させた正規化された核株の上昇値。エラーバーは標準誤差を表しています。

図3。細胞内力伝達を測定するためのマイクロニードル操作アッセイ。位相コントラスト(、B)および蛍光(C、D)核染色(青色)で標識された線維芽細胞の画像とミトコンドリア染色(緑)MitoTrackerにより。マイクロニードルは、核(AおよびC)から定義された距離で、細胞骨格に挿入し、続いて細胞の周囲(B、D)に向かって移動されました。細胞骨格と核の変位は、カスタムで作成された相互相関アルゴリズムを用いて蛍光標識した核とミトコンドリアを追跡することによって定量した。 (E)蛍光画像系列から計算された最終的な細胞骨格(緑)変形の変位マップを、矢印の長さは、よりよいvisibiのために2倍で増幅されlity。スケールバーは、10μmである。
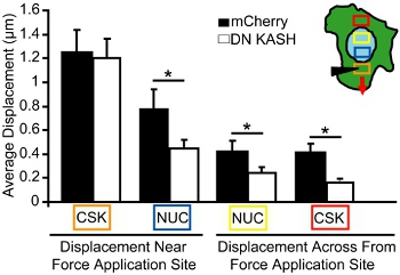
図4。マイクロニードル操作中に細胞内力伝達の解析は。カラーボックスに対応する領域(内のイラスト)で測定、マイクロニードル操作中に細胞骨格や核の変位を誘発した。オレンジ色のボックスは、ひずみのアプリケーションのサイトです。細胞骨格の類似したひずみのアプリケーション(オレンジボックス)にもかかわらず、誘発される核と細胞骨格の変位(黄色、青、そして赤のボックス)は、対照と比較して中断nucleo -細胞骨格結合(DNカッシュ)(あることがマウス胚線維芽細胞で有意に小さかったmCherryアローン)細胞。
Access restricted. Please log in or start a trial to view this content.
ディスカッション
基板のひずみ分析
歪みのアプリケーションが正常に機械的応力を受けた細胞で誘導される核の変形を研究するために、核剛性に固有の核膜タンパク質の寄与を調査するために私達と他のグループによって使用されています。4-8この手法の利点は、プローブの機械的特性をすることです。彼らの正常な細胞と細胞骨格の環境で核を生きるのと、そのような契約筋肉や?...
Access restricted. Please log in or start a trial to view this content.
開示事項
利害の衝突は宣言されません。
謝辞
この作品は、健康(R01 HL082792とR01 NS059348)とブリガムアンドウィメンズ病院循環器リーダーシップグループ賞の国立研究所によってサポートされていました。
Access restricted. Please log in or start a trial to view this content.
資料
| Name | Company | Catalog Number | Comments |
| 試薬の名前 | 会社 | カタログ番号 | |
| フィブロネクチン | ミリポア | FC010 | |
| MitoTrackerにより赤FMとグリーンFM | インビトロジェン | M22425およびM - 7514 | |
| ヘキスト33342 | インビトロジェン | H3570 | |
| ハンクのバッファ塩の生理食塩水 | インビトロジェン | 14185 | |
| フェノールフリー、DMEM | インビトロジェン | 21063 | |
| ウシ胎仔血清 | Alekenバイオ | FBSS500 | |
| ペニシリン/ストレプトマイシン | シグマ | P0781 - 100ML | |
| フィラメントとホウケイ酸ガラス | サッターインストゥルメント | BF100 - 78から10 | |
| "グロス/グロス非強化シリコンシートを、0.005 | 専門製造株式会社 | ||
| ダルベッコのリン酸緩衝生理食塩水 | インビトロジェン | 14200 | |
| 35ミリメートルのガラス底の培養皿(FluoroDish) | 世界精密機器、INC | FD35 - 100 | |
| Braycote 804真空グリース | SPI用品 | 05133A - AB |
参考文献
- Friedl, P., Wolf, K., Lammerding, J. Nuclear mechanics during cell migration. Curr Opin Cell Biol. 23, 55-64 (2011).
- Mejat, A., Misteli, T. LINC complexes in health and disease. Nucleus. 1, 40-52 (2010).
- Worman, H. J., Fong, L. G., Muchir, A., Young, S. G. Laminopathies and the long strange trip from basic cell biology to therapy. J Clin Invest. 119, 1825-1836 (2009).
- Caille, N., Tardy, Y., Meister, J. J. Assessment of strain field in endothelial cells subjected to uniaxial deformation of their substrate. Ann Biomed Eng. 26, 409-416 (1998).
- Lammerding, J. Lamins A and C but not lamin B1 regulate nuclear mechanics. J Biol Chem. 281, 25768-25780 (2006).
- Lammerding, J. Abnormal nuclear shape and impaired mechanotransduction in emerin-deficient cells. J Cell Biol. 170, 781-791 (2005).
- Lammerding, J. Lamin A/C deficiency causes defective nuclear mechanics and mechanotransduction. J Clin Invest. 113, 370-378 (2004).
- Verstraeten, V. L., Ji, J. Y., Cummings, K. S., Lee, R. T., Lammerding, J. Increased mechanosensitivity and nuclear stiffness in Hutchinson-Gilford progeria cells: effects of farnesyltransferase inhibitors. Aging Cell. 7, 383-393 (2008).
- Brooks, S. V., Zerba, E., Faulkner, J. A. Injury to muscle fibres after single stretches of passive and maximally stimulated muscles in mice. J Physiol. 488, 459-469 (1995).
- Maniotis, A. J., Chen, C. S., Ingber, D. E. Demonstration of mechanical connections between integrins, cytoskeletal filaments, and nucleoplasm that stabilize nuclear structure. Proc Natl Acad Sci. 94, 849-854 (1997).
Access restricted. Please log in or start a trial to view this content.
転載および許可
このJoVE論文のテキスト又は図を再利用するための許可を申請します
許可を申請さらに記事を探す
This article has been published
Video Coming Soon
Copyright © 2023 MyJoVE Corporation. All rights reserved