Method Article
RNA בידוד Pseudomonas aeruginosa מיישבים את מערכת העיכול Murine
In This Article
Summary
שיטה אמינה הבידוד של RNA Pseudomonas aeruginosa התאושש cecums Murine מתואר. RNA התאושש היא בכמות ובאיכות מספקת עבור qPCR הבאים, פרופיל שעתוק, ו-RNA ניסויים Seq. טכניקה זו ניתן להתאים עבור בידוד RNA של חיידקים במעיים אחרים.
Abstract
Pseudomonas (רש"פ) aeruginosa זיהומים לגרום תחלואה ותמותה משמעותי ב מארחים בעלי מערכת חיסונית חלשה, כגון חולים עם לוקמיה, פצעים חמורים לשרוף, או השתלות איברים 1. אצל חולים בעלי סיכון גבוה ב לפיתוח זיהומים הרשות הדם, מערכת העיכול (GI) הינו המאגר העיקרי של קולוניזציה 2, אבל המנגנונים שבאמצעותם מעברים הרשות מן חיידק colonizing אסימפטומטיים עד פולשנית, וקטלני לעיתים קרובות, הפתוגן אינם ברורים. בעבר, ביצענו ניסויים פרופיל vivo שעתוק על ידי הרשות מחלים mRNA מתאי חיידקים המתגוררים cecums של קולוניזציה עכברים 3 על מנת לזהות שינויים בביטוי גנים חיידקיים במהלך שינויים מצב החיסון של המארח.
בדומה לכל ניסוי פרופיל שעתוק, הצעד שער הגבלת היא בבידוד של כמויות מספיקות של mRNA באיכות גבוהה. לאור שפע של אנזימים, פסולת, שאריות מזון, חומר חלקיקי במערכת העיכול, האתגר של בידוד RNA הוא מרתיע. כאן, אנו מציגים שיטה בידוד אמין לשחזור של RNA חיידקי התאושש העיכול Murine. שיטה זו מנצלת מודל ומבוססת Murine של קולוניזציה GI הרשות נויטרופניה-Induced הפצת 4. קולוניזציה GI פעם עם הרשות הפלסטינית הוא אישר, עכברים הם מורדמים תוכן ו cecal הם התאושש פלאש קפוא. RNA מופק אז באמצעות שילוב של הפרעה מכנית, רותחים, פנול / כלורופורם עקירות, טיפול DNase ו כרומטוגרפיה זיקה. כמות וטוהר יאושרו על ידי לספקטרופוטומטריה (טכנולוגיות Nanodrop) ו bioanalyzer (Agilent Technologies) (איור 1). שיטה זו של בידוד חיידקים במערכת העיכול RNA יכול בקלות להיות מותאם חיידקים ופטריות אחרות.
Protocol
1. דגם Murine של פ GI aeruginosa להתיישבות והפצת
- עכברים C3H/HeN (6-8 wks הישן, נקבה, הרלן) מטופלים עם אנטיביוטיקה דרך הפה כדי לרוקן צומח commensal ולאחר מכן מונו יישבו עם הרשות הפלסטינית כפי שתואר לעיל 4.
2. מסיק Murine תוכן לומינל Cecal
- לטבול מרגמה לנקות נירוסטה לתוך אמבט חנקן נוזלי.
- להרדים עכברים בחנק פחמן דו חמצני.
- עכבר פגר מאובטחת על לוח קלקר ומקלחת עם אתנול 95%. לעשות חתך אורכי קו האמצע דרך העור מעצם החזה ועד חיץ הנקבים. לשקף את העור הצפק לחשוף את חלל הבטן.
- לכרות cecum כולו. החזק את cecum עם מלקחיים מעל המכתש נירוסטה. Snip בשני הקצוות של cecum עם מספריים לנתיחה.
- הכנס קצה פיפטה P1000 מלא מ"ל 1 של חיץ flushate cecal (10 mM TrisHCl, 1 mM EDTA ו - 200 mM NaCl) 5 אל הקצה הפרוקסימלי של cecum. פלאש החיץ flushate cecal ותכנים luminal cecal אל תוך המדוכה נירוסטה. 1 מ"ל של חיץ flushate cecal יהיה מספיק הסמקה כל תוכן cecal. Cecal תוכן flushate יהיה להקפיא מיד לבוא במגע עם מרגמה.
- טוחנים את תוכן flushate cecal עם העלי סטרילית.
- הקרקע מקום קפוא תוכן luminal cecal לתוך צינור פוליפרופילן 50 מ"ל חרוטי שקוע באמבט קרח / אתנול יבש.
- חזור על שלבים 2.2 עד 2.7 עבור כל עכבר נוסף.
- חנות ב -80 ° C.
3. בידוד חיידקי RNA
- נפח חם 1 (בהתבסס על נפח סופי של שני תוכן luminal cecal, כ 3 מ"ל) של חומצת פנול / כלורופורם (05:01, v / v) הנכלל שפופרת 50 מ"ל Oak Ridge צנטריפוגה עם כובע מאובטחת parafilm ב 65 ° C אמבט מים.
- מרתיחים 0.5 נפח המאגר תמוגה (2% SDS, 16 mM EDTA ו - 200 mM NaCl) 6 הכלולים צינור פוליפרופילן 50 מ"ל חרוטי במשך 5 דקות.
- הוסף חוצץ תמוגה רותחים לתכנים luminal cecal. Homogenize. מרתיחים במשך 5 דקות עם vortexing תקופתיות.
- מוסיפים את 100 ° C תוכן cecal / מדגם תמוגה על חומצה 65 מעלות צלזיוס פנול / כלורופורם את הצינור צנטריפוגות רידג'. חותם כובע עם parafilm.
- לדגור על 65 מעלות צלזיוס למשך 10 דקות עם vortexing תקופתיים (כל 2 דקות).
- צנטריפוגה מדגם ב g 2500 ב · 4 במשך 15 דקות.
- בזהירות העברת השלב מימית (הימנעות מכל של הממשק לבן) כדי צנטריפוגה רידג' Oak טרי 50 מ"ל. היקף השלב מימית תהיה כ -50% מהנפח הכולל של תוכן cecal, חיץ תמוגה, וחומצה פנול / כלורופורם. הוסף נפח שווה של חומצת פנול / כלורופורם.
- חותם כובע עם parafilm ומערבבים היטב על ידי vortexing במהירות גבוהה.
- צנטריפוגה מדגם ב g 2500 ב · 4 במשך 15 דקות.
- חזור על שלבים 3.7-3.9 עד אין ממשק לבן גלוי בין שלבי מימית ואורגנית.
- בזהירות כדי להעביר את השלב מימית צנטריפוגה רידג' Oak טרי 50 מ"ל. הוסף נפח שווה של כלורופורם / isoamyl אלכוהול (24:1, v / v).
- חותם כובע ומערבבים היטב על ידי vortexing.
- צנטריפוגה מדגם ב g 2500 ב · 4 במשך 15 דקות. הסר השלב מימית (נפח יעמוד על כ 50% מנפח את התגובה בסה"כ) כדי שפופרת 15 מ"ל פוליפרופילן חרוטי ולהוסיף נפח שווה של isopropanol.
- דגירה ב -20 ° לפחות 2 שעות או למשך הלילה.
- צנטריפוגה מדגם ב g 2500 · 4 ב 45 דקות. ג'ל כמו גלולה יהוו בחלק התחתון של הצינור. הסר supernatant.
- שטפו את הכדור עם 1 מ"ל של אתנול קר כקרח 70%. וורטקס. צנטריפוגה מדגם ב ב ז ב 10,000 · 4 במשך 5 דקות.
- הסר את supernatant ו להפוך את הצינור כדי לאפשר יבש גלולה בטמפרטורת החדר למשך 10 דקות.
- Resuspend גלולה רנ"א 200 μl מים RNase חינם.
4. DNase טיפול (Turbo-DNA חינם, Applied Biosystems)
- הוסף 20 μl של חיץ 10X DNase טורבו 2 μl טורבו DNase ומערבבים בעדינות.
- לדגור על ° 37 במשך 20 דקות.
- הוסף 20 μl של מגיב DNase resuspended איון ומערבבים היטב.
- דגירה 5 דקות בטמפרטורת החדר, ערבוב מדי פעם.
- צנטריפוגה ב g 10,000 בטמפרטורת החדר למשך 1.5 דקות ולהעביר את supernatant לצינור microfuge חדש.
- הוסף כרך אחד של חומצה (4 מעלות) קר פנול / כלורופורם ומערבבים היטב על ידי vortexing דקה 1.
- צנטריפוגה ב g 12,500 בטמפרטורת החדר למשך 2 דקות.
- מעבירים את השלב מימית לצינור חדשה ולהוסיף 1 נפח של כלורופורם / isoamyl אלכוהול (49:1 v / v), מערבולת.
- צנטריפוגה ב g 12,500 בטמפרטורת החדר למשך 2 דקות.
- מעבירים את השלב מימית (כ 50% מנפח את התגובה סה"כ) לצינור חדש.
- הוסף נפח של 0.1 נתרן אצטט 3M, ו-pH 5.52.5 כרכים של אתנול קר כקרח 100%. וורטקס.
- דגירה ב -20 ° לפחות 2 שעות או ב -80 ° במשך 30 דקות.
- צנטריפוגה ב g 12,000 במשך 30 דקות ב 4 מעלות
- הסר supernatant.
- שטפו את הכדור עם 1 מ"ל של אתנול קר כקרח 70% על ידי centrifuging במשך 5 דקות ב g 10,000 ב · 4.
- הסר את supernatant יבשה ואוויר במשך 10 דקות.
- Resuspend גלולה ב 100 μl מים RNase חינם. במאי צריך לשים באמבט מים 65 ° עד resuspend ו לפזר את גלולה.
- כדי לבדוק את היעילות של הטיפול DNase, בתגובה RT-PCR תקן הגברה של חלבון ריבוזומלי (או גן התייחסות אחרת) יכול להתבצע עבור דגימות מטופלים ולא מטופלים, תוך שימוש לא שולטת RT.
5. RNA שלב ניקוי (Qiagen, RNeasy Kit)
- עיינו בדפי 56-57 של Qiagen RNeasy מיני מדריך (4 th Edition, אפריל 2006). פעל כפי שצוין.
6. נציג תוצאות
הסכום הכולל של RNA חיידקי התאושש באמצעות פרוטוקול זה הוא כ 2-3 מיקרוגרם משני cecums. RNA התאושש היא בכמות ובאיכות מספקת עבור qPCR הבאים, פרופיל שעתוק, ו-RNA ניסויים Seq. טוהר RNA נבחנת באופן שוטף על ידי מדידת יחס 260nm/280nm 7 המדגם, אך שיטה זו אינה מספקת מידע על תקינות RNA. Bioanalyzer Agilent היא פלטפורמה מיקרופלואידיקה מבוסס על כימות, אומדת ובקרת איכות של DNA, RNA, חלבונים בתאים וכן מנצל מטרי שלמות המכונה RNA מספר Integrity RNA (רין) 8. RNA חילוץ עם פרוטוקול זה מייצר 260/280 יחסי החל 1.7-2.0 וערכים רין ≥ 7.0. דוגמה לניתוח Agilent Bioanalyzer של RNA חיידקי התאושש על ידי פרוטוקול זה מוצג באיור 1.
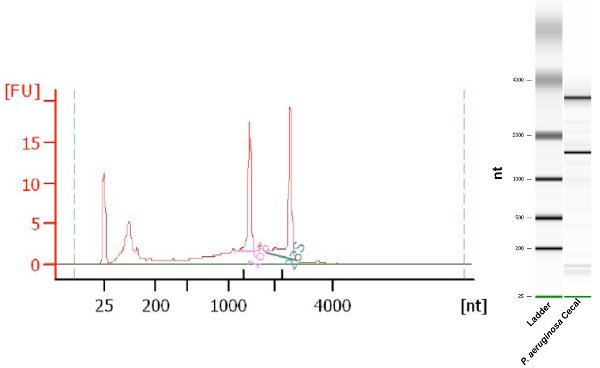
באיור 1. Agilent Bioanalyzer electropherogram וג'ל כמו התמונה של מסך מדגם Pseudomonas aeruginosa RNA בודד התאושש תוכן cecal Murine. רין 8.0.
Discussion
שיטת מיצוי RNA המתואר כאן מאפשר התאוששות של כמויות מספיקות של באיכות גבוהה הכולל Pseudomonas aeruginosa RNA שנקטפו מן העיכול Murine. שיטה זו אינה מוגבלת פ aeruginosa ועלול להיות מיושם על חיידקים אחרים. ההתאוששות של אורגניזמים מספיק חיידקים מהמעי ישתנו באופן משמעותי מן אורגניזם לאורגניזם. במודל Murine שלנו, פ aeruginosa בדרך כלל colonizes מערכת העיכול Murine ברמות בין 5 x אוקטובר 07-05 x 10 8 CFU / g צואה 4. מאז התאושש תוכן cecal הם בערך 0.5 גרם, מספר משוער של פ aeruginosa התאושש משני cecums הוא בין 5 x 07-05 אוקטובר CFU x 8 10. אם מיקרואורגניזמים אחרים נמצאים בשימוש, יהיה זה נבון כדי לוודא רמות קולוניזציה GI ואז לחשב את מספר cecums צריך לשחזר את מספר ממוקד של CFU. חשוב גם לציין כי בעת שימוש במודל זה Murine בפרט, עכברים שטופלו באנטיביוטיקה לא נגוע הרשות אין כמויות מדידים של RNA שבודד תוכן cecal שלהם.
מודל Murine שלנו הקולוניזציה Pseudomonas aeruginosa העיכול ומנסה לחקות את הפצת בפתוגנזה של פ בקטרמיה ב סרטן בתאי גזע להשתלה בחולים aeruginosa. באוכלוסיית חולים זו, commensal צומח תיגמר לעתים קרובות משני לטיפול אנטיביוטי או כימותרפיות (למשל דלדול אנטיביוטי של GI commensal הצומח) וכתוצאה מכך צמיחת יתר של חיידקים פתוגניים (למשל מונו בשיתוף עם aeruginosa פ ') ולאחר מכן הפצתו הבאים לאחר דיכוי המערכת החיסונית. היתרונות והמגבלות של מודל זה Murine כבר התייחס בעבר 4. מטרת המחקר הנוכחי היא לספק מתודולוגיה לבידוד מוחלט RNA של חיידקים מן במערכת העיכול. פרוטוקול זה יכול בקלות להיות מותאם Murine מודלים אחרים ללמוד היבטים אחרים של חיידקים בפתוגנזה של מערכת העיכול (כלומר commensal אינטראקציות הצומח, אפקטים על חיידקי מחלת מעי דלקתית, וכו ').
אחד היתרונות של שיטה זו היא שילוב של צעדים תמוגה מרובים כולל הקפאה / הפשרה, שיבוש מכני (כתישה עם homogenization, מרגמה / העלי), רותחים, תמוגה כימיים (למשל SDS). למרות ריבוי הצעדים תמוגה, כמה מיקרואורגניזמים (בעיקר חיידקים גראם חיוביים ופטריות / שמרים) עשויים לדרוש הפרעה מכנית נוספים. לאחר חם תמוגה / חומצת פנול, כלורופורם הדגירה (שלב 3.5), תוספת של חרוזים (0.1 מ"מ עבור חיידקים ו / או 0.5-0.7 מ"מ עבור שמרים), צעד הבאים חרוז פועם צריך להספיק כדי lyse האורגניזמים 9, 10.
בהתחשב באופי המורכב של חומרים התאושש מן cecum Murine, חזר קר acid-phenol/chloroform עקירות (שלב 3.7-3.9) נדרשים לחלוטין על מנת להשיג איכות RNA מקובל והיושרה לתגובות במורד נוספת. בין 3-5 קר acid-phenol/chloroform עקירות ייתכן שתידרש לפני הלבן ממשק בין שלבי מימית ואורגנית מסולק. לבסוף, שילוב של הטיפול הן DNase (שלב 4) ו פרוטוקול ניקוי RNeasy (שלב 5) חיוניים הסרת DNA זיהום קטנים שאינם mRNA (5s וגם tRNA). כאמור, ה-RNA התאושש על ידי שימוש בפרוטוקול זה היא בכמות ובאיכות מספקת עבור פרופיל שעתוק הבאים 3, qPCR (לא פורסם), ו-RNA Seq (לא פורסם) ניסויים.
Disclosures
אין ניגודי אינטרסים הכריז.
Acknowledgements
עבודה זו מומנה על ידי המכון הלאומי לבריאות מענקים AI62983 (AYK), AI22535 (GPB).
Materials
| Name | Company | Catalog Number | Comments |
| שם מגיב | חברה | מספר קטלוגי | |
|---|---|---|---|
| מכתש ועלי | דיג | 12-947-1 | |
| Homogenizer | אומני | TM-125 | |
| Oak Ridge צינורות צנטריפוגה (50 מ"ל) | Nalgene | 3119-0050 | |
| חומצה פנול / כלורופורם | Ambion | AM9720 | |
| כלורופורם | סיגמא אולדריץ | C2432 | |
| Isoamyl אלכוהול | סיגמא אולדריץ | W205702 | |
| Isopropanol | סיגמא אולדריץ | 190764 | |
| Diethyl pyrocarbonate (DEPC) | סיגמא אולדריץ | 40718 | |
| DNase | Ambion | AM2238 | |
| RNeasy Kit | Qiagen | 74104 | |
| 3M נתרן אצטט | Ambion | AM9740 | |
| 100% אתנול | סיגמא אולדריץ | E7023 |
References
- Bodey, G. P., Bolivar, R., Fainstein, V., Jadeja, L. Infections caused by Pseudomonas aeruginosa. Rev Infect Dis. 5, 279-279 (1983).
- Bertrand, X. Endemicity, molecular diversity and colonisation routes of Pseudomonas aeruginosa in intensive care units. Intensive Care Med. 27, 1263-1268 (2001).
- Koh, A. Y. Utility of in vivo transcription profiling for identifying Pseudomonas aeruginosa genes needed for gastrointestinal colonization and dissemination. PLoS One. 5, e15131-e15131 (2010).
- Koh, A. Y., Priebe, G. P., Pier, G. B. Virulence of Pseudomonas aeruginosa in a murine model of gastrointestinal colonization and dissemination in neutropenia. Infect Immun. 73, 2262-2272 (2005).
- Alexander, R. J., Raicht, R. F. Purification of total RNA from human stool samples. Dig Dis Sci. 43, 2652-2658 (1998).
- Fitzsimons, N. A., Akkermans, A. D., de Vos, W. M., Vaughan, E. E. Bacterial gene expression detected in human faeces by reverse transcription-PCR. J Microbiol Methods. 55, 133-140 (2003).
- Manchester, K. L. Use of UV methods for measurement of protein and nucleic acid concentrations. Biotechniques. 20, 968-970 (1996).
- Schroeder, A. The RIN: an RNA integrity number for assigning integrity values to RNA measurements. BMC Mol Biol. 7, 3-3 (2006).
- Turnbaugh, P. J. A core gut microbiome in obese and lean twins. Nature. 457, 480-484 (2009).
Reprints and Permissions
Request permission to reuse the text or figures of this JoVE article
Request PermissionExplore More Articles
This article has been published
Video Coming Soon
Copyright © 2025 MyJoVE Corporation. All rights reserved